ショウジョウバエの眼における細胞種に特異的なロドプシンの発現は重複的な制御ループにより厳密に規定される
中越英樹1・Claude Desplan2
(1岡山大学大学院自然科学研究科 バイオサイエンス専攻分子遺伝学分野,2米国New York大学,Department of Biology)
email:中越英樹
DOI: 10.7875/first.author.2011.101
Interlocked feedforward loops control cell-type-specific rhodopsin expression in the Drosophila eye.
Robert J. Johnston Jr., Yoshiaki Otake, Pranidhi Sood, Nina Vogt, Rudy Behnia, Daniel Vasiliauskas, Elizabeth McDonald, Baotong Xie, Sebastian Koenig, Reinhard Wolf, Tiffany Cook, Brian Gebelein, Edo Kussell, Hideki Nakagoshi, Claude Desplan
Cell, 145, 956-968 (2011)
ショウジョウバエの個眼には異なる機能をもつサブタイプが存在する.転写抑制因子Dveはロドプシンの発現制御(サブタイプの決定)において中心的な役割をはたす.OtdとDveにより構成される発現制御ループは眼の全域にわたるロドプシンの発現抑制にかかわる.内側光受容細胞では別の発現制御ループによりDveによる発現抑制が解除され,細胞種に特異的なロドプシンの発現が誘導される.このようなDveを共通タンパク質とする重複的な制御ループに細胞種あるいは領域に特異的なタンパク質がくわわることで,Dveの発現レベルや転写抑制活性が微調整されて新たな細胞種が規定されている.今回,明らかになった重複的な制御ループは,細胞種の特異化を行うための一般的な制御機構モデルになりうると考えられる.
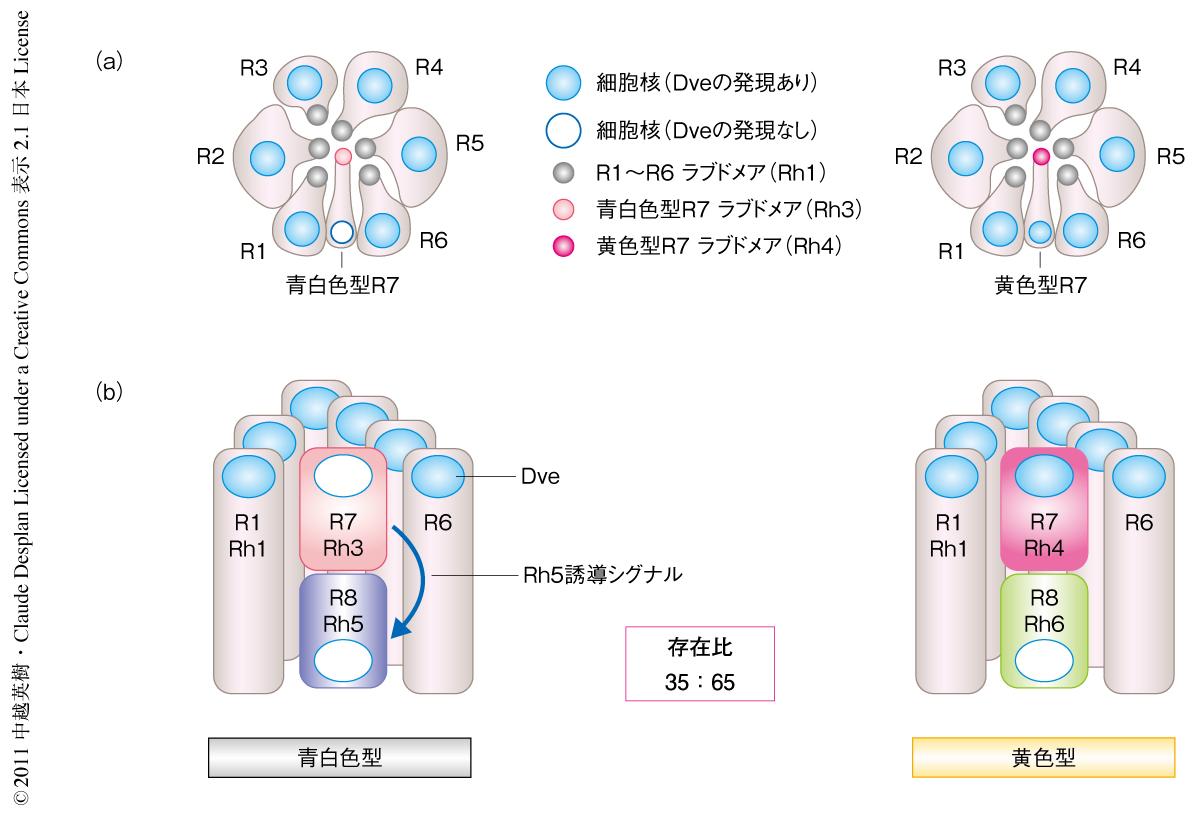
ショウジョウバエの複眼は約800個の個眼から構成され,それぞれの個眼には8個の光受容細胞(R1~R8)が存在する.それぞれの光受容細胞の頂端側には光を受容するロドプシンの集積した構造体(ラブドメア,感桿分体)が規則的に配置している.ラブドメアを外側に配置する細胞を外側光受容細胞(R1~R6),内側にラブドメアを配置している細胞を内側光受容細胞(R7,R8)とよぶ(図1a).外側光受容細胞はロドプシン1を発現することで物体の認識にかかわっており,脊椎動物の桿体に対応する.一方,内側光受容細胞は吸収波長の異なるロドプシン3~ロドプシン6のいずれかを発現することで色の認識にかかわっており,脊椎動物の錐体に対応する.ロドプシン3およびロドプシン4は紫外光感受性であり,ロドプシン5は青色光感受性,ロドプシン6は緑色光感受性である.内側光受容細胞の発現するロドプシンのパターンにより,大部分の個眼は2つのサブタイプ,すなわち,ロドプシン3とロドプシン5をもつ青白色型と,ロドプシン4とロドプシン6をもつ黄色型とに分類される(図1b).この2つのタイプの個眼はランダムな配置でありながらつねに一定の比率(青白色型と黄色型とは35:65)で複眼に分布している.また,複眼の背側辺縁部(dorsal rim area:DRA)には偏光の認識を行うために特殊化したロドプシン3のみをもつDRA型の個眼が配列している1).
K50型ホメオドメインをもつ転写制御因子Defective proventriculus(Dve)はさまざまな組織で発現し遺伝子発現の抑制に関与する2-4).成虫の個眼の光受容細胞においては外側光受容細胞および黄色型R7細胞においてDveが発現している(図1).dve変異をもつ複眼では外側光受容細胞におけるロドプシン1の発現および黄色型R7細胞におけるロドプシン4の発現は変化しなかったが,すべてのR7細胞においてロドプシン3が発現するようになり,黄色型R7細胞ではロドプシン3とロドプシン4が共発現していた.つまり,Dveの機能は黄色型R7細胞においてロドプシン3の発現を抑制することであった.さらに,dve変異をもつ複眼では内側光受容細胞の発現するロドプシン3,ロドプシン5,ロドプシン6が外側光受容細胞においてランダムなパターンで異所発現していた.つまり,外側光受容細胞におけるDveの機能は内側光受容細胞の発現するロドプシンの発現を抑制することであった.これら内側光受容細胞において発現するロドプシン遺伝子の上流制御領域にはK50型ホメオドメイン結合配列TAATCCが存在し,Dveによるロドプシン3,ロドプシン5,ロドプシン6の発現抑制はこの配列への結合に依存していることが明らかになった.
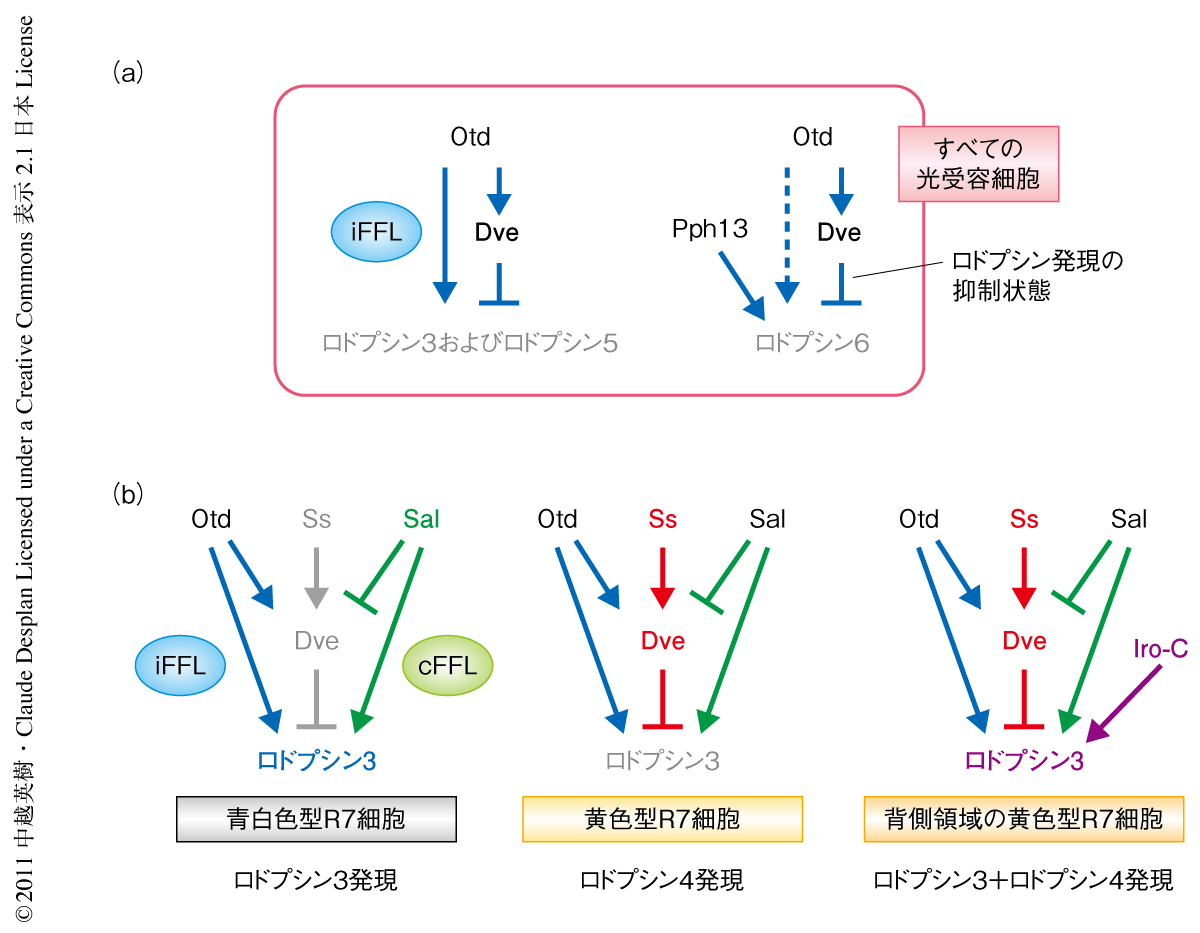
K50型ホメオドメインをもつ転写因子Orthodenticle(Otd)はすべての光受容細胞で発現する.しかし,otd変異をもつ複眼は複雑な表現型を示し,青白色型の個眼におけるロドプシン3およびロドプシン5の発現消失,また,外側光受容細胞におけるロドプシン6の異所発現が報告されている5).また,ロドプシン3遺伝子およびロドプシン5遺伝子の上流制御領域に存在するK50型ホメオドメイン結合配列はOtdによる転写活性化に必要であった.つまり,Dveによるロドプシン3およびロドプシン5の発現抑制は,DveとOtdとがK50型ホメオドメイン結合配列に対し競合することによる阻害効果として理解することができた.実際に,DNA結合実験や培養細胞を用いたトランスフェクション実験により,このK50型ホメオドメイン結合配列への競合が確認された.そこでOtdとDveの関係性を調べてみると,Dveの発現にはOtdの活性が細胞自律的に必要であることがわかった.これらの結果から,Otdはロドプシン3およびロドプシン5の発現に必要であると同時に,ロドプシン3およびロドプシン5の抑制タンパク質であるDveを誘導するという,“矛盾した”発現制御ループ6)(incoherent feedforward loop:iFFL)を形成していることがわかった(図2a).
otd変異をもつ複眼では外側光受容細胞においてロドプシン6が異所発現した.この表現型はdve変異をもつ複眼と同じであったため,Otdにより誘導されたDveがロドプシン6の発現を抑制するという直線的な制御経路により説明は可能であった.しかしながら,トランスフェクション実験においてOtdはロドプシン6遺伝子のプロモーターからの転写をK50型ホメオドメイン結合配列に依存的に活性化した.つまり,ロドプシン3およびロドプシン5と同様の“矛盾した”発現制御ループ(iFFL)が存在することにくわえて,ロドプシン6の発現誘導を担う別の転写因子の存在が予想された.実際に,すべての光受容細胞で発現する転写因子Pph13によりK50型ホメオドメイン結合配列に非依存的に活性化されたロドプシン6遺伝子のプロモーターからの転写が,Dveにより抑制されることが確認された(図2a).
内側光受容細胞の運命は転写因子Spalt(Sal)により規定される.sal変異をもつ複眼では内側光受容細胞に特異的なロドプシンの発現が消失しすべての光受容細胞がロドプシン1を発現する7).SalとDveの発現パターンは黄色型R7細胞を除き相補的であり,Dveには内側光受容細胞の発現するロドプシン3,ロドプシン5,ロドプシン6を抑制する活性のあることから,SalがDveの発現を抑制する可能性を検証した.蛹期中期のsal変異をもつ複眼原基では青白色型R7細胞やR8細胞を含むすべての光受容細胞においてDveが発現していた.さらに,外側光受容細胞においてSalの強制発現を行うとDveの発現が抑制されたことから,SalによりDveの発現が抑制されることが明らかになった(図2b).
dve変異をもつ複眼の外側光受容細胞においてSalの強制発現を行うと外側光受容細胞におけるロドプシン3の異所発現の頻度が著しく上昇し,sal dve二重変異をもつ複眼ではロドプシン3を発現しないR7細胞が出現した.これらの実験結果から,Salはロドプシン3の抑制タンパク質であるDveの発現を抑制するとともに,ロドプシン3の発現誘導にも必要であり,“理にかなった”発現制御ループ6)(coherent feedforward loop:cFFL)を形成していることがわかった(図2b).青白色型R7細胞ではSalによりDveの発現が抑制されるため,Otd-Dve-ロドプシン3の“矛盾した”発現制御ループ(iFFL)のうちOtdによるRh3の発現誘導活性のみが機能し,Sal-Dve-ロドプシン3の“理にかなった”発現制御ループ(cFFL)とともにロドプシン3の発現が誘導されるものと考えられた.
転写因子Spineless(Ss)は黄色型R7細胞の運命決定を行うため8),黄色型R7細胞におけるDveの発現はSsの活性により誘導されていることが予想された.実際に,ss変異をもつR7細胞ではDveの発現が消失し,Ssの強制発現によりすべてのR7細胞にDveの発現が誘導された.黄色型R7細胞におけるDveの発現レベルは外側光受容細胞よりもかなり低く,この発現レベルの差はSalの発現の有無により説明できた.内側光受容細胞ではSalによりDveの発現が抑制されるが,黄色型R7細胞ではこの抑制に打ち勝つだけのSsの活性(図2b)によりDveの発現が誘導されるため,Salを発現しない外側光受容細胞よりもDveの発現レベルが低下してしまうのであろう.このような重複的な制御ループによりDveの発現レベルが厳密に制御されることは,あとで述べるように,個眼のサブタイプの決定において非常に重要な意味をもつと思われた.
それぞれの光受容細胞は1種類のロドプシンのみを発現するが,複眼の背側1/3に相当する領域の黄色型R7細胞は例外的にロドプシン3とロドプシン4とを共発現する9).この共発現は背側決定タンパク質複合体であるIroquois複合体(Iro-C)のはたらきによるが,黄色型R7細胞におけるロドプシン3とロドプシン4の共発現はdve変異をもつ複眼の表現型と同じであった.そこで,Iro-CによりDveの発現が抑制される可能性を検討してみたが,背側領域の黄色型R7細胞においてDveの発現レベルが顕著に低いことはなかった.さきに述べたように,黄色型R7細胞におけるDveの発現レベルは外側光受容細胞と比べるとかなり低いものの,ロドプシン3の発現を抑制するには十分であった.Iro-Cが背側領域の黄色型R7細胞においてロドプシン3を誘導できる条件として,黄色型R7細胞におけるDveの発現が低レベルである,あるいは,Dveのロドプシン3の抑制活性がなんらかの機構により不活性化されている,という2つの可能性が考えられた.Dveの強制発現実験の結果,Iro-Cが存在しても十分量のDveがあれば背側でも腹側でもロドプシン3の発現を抑制することができた.つまり,黄色型R7細胞におけるDveの低いレベルの発現状態においてのみ,Iro-Cが背側領域の黄色型R7細胞にロドプシン3とロドプシン4の共発現を誘導できることが明らかになった(図2b).このような異なるロドプシンの共発現は複眼の背側領域において紫外光感受性の波長域を広げることになり,それにより太陽光の方向をより正確に感知できるようになるものと考えられた.
今回,明らかになった重複的な制御ループは,すべての光受容細胞でさまざまなロドプシンを発現誘導の可能な状態にしておき転写抑制因子Dveがその状態を抑制するという“矛盾した”制御ループ(iFFL)が基本型になっていた.このような系はむだが多いようにも思えるが,進化の過程で遺伝子発現パターンを急激に変化させるにはむしろ効率的であるともいえる.また,転写抑制因子による抑制を解除する“理にかなった”制御ループ(cFFL)が追加され,抑制効果を打ち消すような転写因子SsおよびIro-Cの獲得により新しい個眼のサブタイプを規定できるなど,遺伝子発現を切り替える系としてもきわめて精妙な制御ができる.
興味深いことに,Dveを中心とした重複的な制御ループは頭部の形成過程においても高度に保存されている10).このような重複的な制御ループは細胞種の特異化を行う過程において一般的な制御機構として使われている可能性が示唆される.
略歴:1991年 東京理科大学大学院薬学研究科博士後期課程 修了,同年 理化学研究所 基礎科学特別研究員,1992年 国立精神・神経センター神経研究所 特別研究員,1999年 東京工業大学フロンティア創造共同研究センター 研究員を経て,同年 岡山大学理学部 助教授(現 大学院自然科学研究科 准教授).
研究テーマ:消化管細胞や神経細胞の機能分化の制御機構.
研究室URL:http://www.biol.okayama-u.ac.jp/nakagoshi/kinou.html
Claude Desplan
米国New York大学 教授.
© 2011 中越英樹・Claude Desplan Licensed under CC 表示 2.1 日本
(1岡山大学大学院自然科学研究科 バイオサイエンス専攻分子遺伝学分野,2米国New York大学,Department of Biology)
email:中越英樹
DOI: 10.7875/first.author.2011.101
Interlocked feedforward loops control cell-type-specific rhodopsin expression in the Drosophila eye.
Robert J. Johnston Jr., Yoshiaki Otake, Pranidhi Sood, Nina Vogt, Rudy Behnia, Daniel Vasiliauskas, Elizabeth McDonald, Baotong Xie, Sebastian Koenig, Reinhard Wolf, Tiffany Cook, Brian Gebelein, Edo Kussell, Hideki Nakagoshi, Claude Desplan
Cell, 145, 956-968 (2011)
要 約
ショウジョウバエの個眼には異なる機能をもつサブタイプが存在する.転写抑制因子Dveはロドプシンの発現制御(サブタイプの決定)において中心的な役割をはたす.OtdとDveにより構成される発現制御ループは眼の全域にわたるロドプシンの発現抑制にかかわる.内側光受容細胞では別の発現制御ループによりDveによる発現抑制が解除され,細胞種に特異的なロドプシンの発現が誘導される.このようなDveを共通タンパク質とする重複的な制御ループに細胞種あるいは領域に特異的なタンパク質がくわわることで,Dveの発現レベルや転写抑制活性が微調整されて新たな細胞種が規定されている.今回,明らかになった重複的な制御ループは,細胞種の特異化を行うための一般的な制御機構モデルになりうると考えられる.
はじめに
ショウジョウバエの複眼は約800個の個眼から構成され,それぞれの個眼には8個の光受容細胞(R1~R8)が存在する.それぞれの光受容細胞の頂端側には光を受容するロドプシンの集積した構造体(ラブドメア,感桿分体)が規則的に配置している.ラブドメアを外側に配置する細胞を外側光受容細胞(R1~R6),内側にラブドメアを配置している細胞を内側光受容細胞(R7,R8)とよぶ(図1a).外側光受容細胞はロドプシン1を発現することで物体の認識にかかわっており,脊椎動物の桿体に対応する.一方,内側光受容細胞は吸収波長の異なるロドプシン3~ロドプシン6のいずれかを発現することで色の認識にかかわっており,脊椎動物の錐体に対応する.ロドプシン3およびロドプシン4は紫外光感受性であり,ロドプシン5は青色光感受性,ロドプシン6は緑色光感受性である.内側光受容細胞の発現するロドプシンのパターンにより,大部分の個眼は2つのサブタイプ,すなわち,ロドプシン3とロドプシン5をもつ青白色型と,ロドプシン4とロドプシン6をもつ黄色型とに分類される(図1b).この2つのタイプの個眼はランダムな配置でありながらつねに一定の比率(青白色型と黄色型とは35:65)で複眼に分布している.また,複眼の背側辺縁部(dorsal rim area:DRA)には偏光の認識を行うために特殊化したロドプシン3のみをもつDRA型の個眼が配列している1).
1.内側光受容細胞において発現するロドプシンを抑制する転写抑制因子Dve
K50型ホメオドメインをもつ転写制御因子Defective proventriculus(Dve)はさまざまな組織で発現し遺伝子発現の抑制に関与する2-4).成虫の個眼の光受容細胞においては外側光受容細胞および黄色型R7細胞においてDveが発現している(図1).dve変異をもつ複眼では外側光受容細胞におけるロドプシン1の発現および黄色型R7細胞におけるロドプシン4の発現は変化しなかったが,すべてのR7細胞においてロドプシン3が発現するようになり,黄色型R7細胞ではロドプシン3とロドプシン4が共発現していた.つまり,Dveの機能は黄色型R7細胞においてロドプシン3の発現を抑制することであった.さらに,dve変異をもつ複眼では内側光受容細胞の発現するロドプシン3,ロドプシン5,ロドプシン6が外側光受容細胞においてランダムなパターンで異所発現していた.つまり,外側光受容細胞におけるDveの機能は内側光受容細胞の発現するロドプシンの発現を抑制することであった.これら内側光受容細胞において発現するロドプシン遺伝子の上流制御領域にはK50型ホメオドメイン結合配列TAATCCが存在し,Dveによるロドプシン3,ロドプシン5,ロドプシン6の発現抑制はこの配列への結合に依存していることが明らかになった.
2.転写因子OtdとDveによる発現制御ループ
K50型ホメオドメインをもつ転写因子Orthodenticle(Otd)はすべての光受容細胞で発現する.しかし,otd変異をもつ複眼は複雑な表現型を示し,青白色型の個眼におけるロドプシン3およびロドプシン5の発現消失,また,外側光受容細胞におけるロドプシン6の異所発現が報告されている5).また,ロドプシン3遺伝子およびロドプシン5遺伝子の上流制御領域に存在するK50型ホメオドメイン結合配列はOtdによる転写活性化に必要であった.つまり,Dveによるロドプシン3およびロドプシン5の発現抑制は,DveとOtdとがK50型ホメオドメイン結合配列に対し競合することによる阻害効果として理解することができた.実際に,DNA結合実験や培養細胞を用いたトランスフェクション実験により,このK50型ホメオドメイン結合配列への競合が確認された.そこでOtdとDveの関係性を調べてみると,Dveの発現にはOtdの活性が細胞自律的に必要であることがわかった.これらの結果から,Otdはロドプシン3およびロドプシン5の発現に必要であると同時に,ロドプシン3およびロドプシン5の抑制タンパク質であるDveを誘導するという,“矛盾した”発現制御ループ6)(incoherent feedforward loop:iFFL)を形成していることがわかった(図2a).
otd変異をもつ複眼では外側光受容細胞においてロドプシン6が異所発現した.この表現型はdve変異をもつ複眼と同じであったため,Otdにより誘導されたDveがロドプシン6の発現を抑制するという直線的な制御経路により説明は可能であった.しかしながら,トランスフェクション実験においてOtdはロドプシン6遺伝子のプロモーターからの転写をK50型ホメオドメイン結合配列に依存的に活性化した.つまり,ロドプシン3およびロドプシン5と同様の“矛盾した”発現制御ループ(iFFL)が存在することにくわえて,ロドプシン6の発現誘導を担う別の転写因子の存在が予想された.実際に,すべての光受容細胞で発現する転写因子Pph13によりK50型ホメオドメイン結合配列に非依存的に活性化されたロドプシン6遺伝子のプロモーターからの転写が,Dveにより抑制されることが確認された(図2a).
3.転写因子SalとDveによる発現制御ループ
内側光受容細胞の運命は転写因子Spalt(Sal)により規定される.sal変異をもつ複眼では内側光受容細胞に特異的なロドプシンの発現が消失しすべての光受容細胞がロドプシン1を発現する7).SalとDveの発現パターンは黄色型R7細胞を除き相補的であり,Dveには内側光受容細胞の発現するロドプシン3,ロドプシン5,ロドプシン6を抑制する活性のあることから,SalがDveの発現を抑制する可能性を検証した.蛹期中期のsal変異をもつ複眼原基では青白色型R7細胞やR8細胞を含むすべての光受容細胞においてDveが発現していた.さらに,外側光受容細胞においてSalの強制発現を行うとDveの発現が抑制されたことから,SalによりDveの発現が抑制されることが明らかになった(図2b).
dve変異をもつ複眼の外側光受容細胞においてSalの強制発現を行うと外側光受容細胞におけるロドプシン3の異所発現の頻度が著しく上昇し,sal dve二重変異をもつ複眼ではロドプシン3を発現しないR7細胞が出現した.これらの実験結果から,Salはロドプシン3の抑制タンパク質であるDveの発現を抑制するとともに,ロドプシン3の発現誘導にも必要であり,“理にかなった”発現制御ループ6)(coherent feedforward loop:cFFL)を形成していることがわかった(図2b).青白色型R7細胞ではSalによりDveの発現が抑制されるため,Otd-Dve-ロドプシン3の“矛盾した”発現制御ループ(iFFL)のうちOtdによるRh3の発現誘導活性のみが機能し,Sal-Dve-ロドプシン3の“理にかなった”発現制御ループ(cFFL)とともにロドプシン3の発現が誘導されるものと考えられた.
4.黄色型R7細胞の決定タンパク質Ssによる制御機構
転写因子Spineless(Ss)は黄色型R7細胞の運命決定を行うため8),黄色型R7細胞におけるDveの発現はSsの活性により誘導されていることが予想された.実際に,ss変異をもつR7細胞ではDveの発現が消失し,Ssの強制発現によりすべてのR7細胞にDveの発現が誘導された.黄色型R7細胞におけるDveの発現レベルは外側光受容細胞よりもかなり低く,この発現レベルの差はSalの発現の有無により説明できた.内側光受容細胞ではSalによりDveの発現が抑制されるが,黄色型R7細胞ではこの抑制に打ち勝つだけのSsの活性(図2b)によりDveの発現が誘導されるため,Salを発現しない外側光受容細胞よりもDveの発現レベルが低下してしまうのであろう.このような重複的な制御ループによりDveの発現レベルが厳密に制御されることは,あとで述べるように,個眼のサブタイプの決定において非常に重要な意味をもつと思われた.
5.背側決定タンパク質複合体Iro-Cにより誘導されるロドプシンの共発現
それぞれの光受容細胞は1種類のロドプシンのみを発現するが,複眼の背側1/3に相当する領域の黄色型R7細胞は例外的にロドプシン3とロドプシン4とを共発現する9).この共発現は背側決定タンパク質複合体であるIroquois複合体(Iro-C)のはたらきによるが,黄色型R7細胞におけるロドプシン3とロドプシン4の共発現はdve変異をもつ複眼の表現型と同じであった.そこで,Iro-CによりDveの発現が抑制される可能性を検討してみたが,背側領域の黄色型R7細胞においてDveの発現レベルが顕著に低いことはなかった.さきに述べたように,黄色型R7細胞におけるDveの発現レベルは外側光受容細胞と比べるとかなり低いものの,ロドプシン3の発現を抑制するには十分であった.Iro-Cが背側領域の黄色型R7細胞においてロドプシン3を誘導できる条件として,黄色型R7細胞におけるDveの発現が低レベルである,あるいは,Dveのロドプシン3の抑制活性がなんらかの機構により不活性化されている,という2つの可能性が考えられた.Dveの強制発現実験の結果,Iro-Cが存在しても十分量のDveがあれば背側でも腹側でもロドプシン3の発現を抑制することができた.つまり,黄色型R7細胞におけるDveの低いレベルの発現状態においてのみ,Iro-Cが背側領域の黄色型R7細胞にロドプシン3とロドプシン4の共発現を誘導できることが明らかになった(図2b).このような異なるロドプシンの共発現は複眼の背側領域において紫外光感受性の波長域を広げることになり,それにより太陽光の方向をより正確に感知できるようになるものと考えられた.
おわりに
今回,明らかになった重複的な制御ループは,すべての光受容細胞でさまざまなロドプシンを発現誘導の可能な状態にしておき転写抑制因子Dveがその状態を抑制するという“矛盾した”制御ループ(iFFL)が基本型になっていた.このような系はむだが多いようにも思えるが,進化の過程で遺伝子発現パターンを急激に変化させるにはむしろ効率的であるともいえる.また,転写抑制因子による抑制を解除する“理にかなった”制御ループ(cFFL)が追加され,抑制効果を打ち消すような転写因子SsおよびIro-Cの獲得により新しい個眼のサブタイプを規定できるなど,遺伝子発現を切り替える系としてもきわめて精妙な制御ができる.
興味深いことに,Dveを中心とした重複的な制御ループは頭部の形成過程においても高度に保存されている10).このような重複的な制御ループは細胞種の特異化を行う過程において一般的な制御機構として使われている可能性が示唆される.
文 献
- Morante, J., Desplan, C. & Celik, A.: Generating patterned arrays of photoreceptors. Curr. Opin. Genet. Dev., 17, 314-319 (2007)[PubMed]
- Nakagoshi, H., Hoshi, M., Nabeshima, Y. et al.: A novel homeobox gene mediates the Dpp signal to establish functional specificity within target cells. Genes Dev., 12, 2724-2734 (1998)[PubMed]
- Nakagoshi, H., Shirai, T., Nabeshima, Y. et al.: Refinement of wingless expression by a Wingless- and Notch-responsive homeodomain protein, Defective proventriculus. Dev. Biol., 249, 44-56 (2002)[PubMed]
- Shirai, T., Yorimitsu, T., Kiritooshi, N. et al.: Notch signaling relieves the joint-suppressive activity of Defective proventriculus in the Drosophila leg. Dev. Biol., 312, 147-156 (2007)[PubMed]
- Tahayato, A., Sonneville, R., Pichaud, F. et al.: Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev. Cell, 5, 391-402 (2003)[PubMed]
- Alon, U.: Network motifs: theory and experimental approaches. Nat. Rev. Genet., 8, 450-461 (2007)[PubMed]
- Mollereau, B., Dominguez, M., Webel, R. et al.: Two-step process for photoreceptor formation in Drosophila. Nature, 412, 911-913 (2001)[PubMed]
- Wernet, M. F., Mazzoni, E. O., Celik, A. et al.: Stochastic spineless expression creates the retinal mosaic for colour vision. Nature, 440, 174-180 (2006)[PubMed]
- Mazzoni, E. O., Celik, A., Wernet, M. F. et al.: Iroquois complex genes induce co-expression of rhodopsins in Drosophila. PLoS Biol., 6, e97 (2008)[PubMed]
- Yorimitsu, T., Kiritooshi, N. & Nakagoshi, H.: Defective proventriculus specifies the ocellar region in the Drosophila head. Dev. Biol., 356, 598-607 (2011)[PubMed]
著者プロフィール
略歴:1991年 東京理科大学大学院薬学研究科博士後期課程 修了,同年 理化学研究所 基礎科学特別研究員,1992年 国立精神・神経センター神経研究所 特別研究員,1999年 東京工業大学フロンティア創造共同研究センター 研究員を経て,同年 岡山大学理学部 助教授(現 大学院自然科学研究科 准教授).
研究テーマ:消化管細胞や神経細胞の機能分化の制御機構.
研究室URL:http://www.biol.okayama-u.ac.jp/nakagoshi/kinou.html
Claude Desplan
米国New York大学 教授.
© 2011 中越英樹・Claude Desplan Licensed under CC 表示 2.1 日本