コンデンシンとヒストンH2Aとの相互作用が分裂期の染色体を形成する
多田健志・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:多田健志
DOI: 10.7875/first.author.2011.097
Condensin association with histone H2A shapes mitotic chromosomes.
Kenji Tada, Hiroaki Susumu, Takeshi Sakuno, Yoshinori Watanabe
Nature, 474, 477-483 (2011)
遺伝情報を担う染色体は細胞周期にともないその形態を変化させる.活発に転写が行われている間期の不定形なゆるんだ染色体は,分裂期に進行すると高度に折りたたまれた棒状の凝縮した構造をとる.この分裂期における染色体の凝縮にかかわる因子として,生物種をこえて高度に保存されたコンデンシン複合体が知られている.しかし,コンデンシンの染色体への局在の分子機構については不明な点も多かった.今回,筆者らは,動原体領域にとくに濃縮したコンデンシンの局在が,動原体タンパク質Pcs1-Mde4複合体に依存していることを明らかにした.また,動原体のみならず染色体の全体におけるコンデンシンの局在には,染色体DNAに均一に結合しているヒストン複合体のひとつであるヒストンH2Aとの相互作用が重要であることが明らかになった.一方,生物種をこえて保存された分裂期キナーゼAurora Bもコンデンシンの染色体への局在を制御していることが示唆されていたが,そのリン酸化の標的は不明であった.この研究により,コンデンシンがAurora Bのリン酸化の標的であり,このリン酸化に依存してヒストンH2Aとの相互作用は促進されることが明らかになった.
分裂期における染色体の凝縮はかぎられた空間において染色体の分配を遂行するうえで必須の現象であると考えられる.この分裂期における染色体の凝縮にはコンデンシンとよばれるタンパク質複合体の寄与していることが知られている.実際,コンデンシンの機能を阻害すると分裂期における染色体の構造形成や染色体腕部の分離に異常を生じることが報告されている1).また,細胞内においてコンデンシンの機能を阻害するとセントロメア領域の構造的な安定性や動原体の機能にも異常を生じることより,コンデンシンはセントロメア領域においても重要な機能をはたしていることが示唆されていた2,3).コンデンシンがその機能を発揮するためには染色体に局在することが必須であると考えられる.しかし,コンデンシンの染色体への局在の分子機構については不明な点も多い.その分子機構を探るため,まず,染色体腕部とセントロメア領域におけるコンデンシンの機能を分離することを試みた.
まず,分裂酵母を用いて動原体領域におけるコンデンシンの機能を探ることを試みた.コンデンシンのサブユニットのひとつに配列特異的なTEVプロテアーゼの認識配列を挿入しておき,TEVプロテアーゼを動原体にのみ局在させることでこの領域のコンデンシンを特異的に不活性化した.その結果,動原体領域のクロマチン構造がゆるむとともに,スピンドル微小管と動原体との結合に異常がみられた.このことより,コンデンシンが動原体領域のクロマチンを凝縮させてコンパクトにし,動原体がスピンドル微小管から異常なとらえられ方をするのを防いでいることが示唆された.
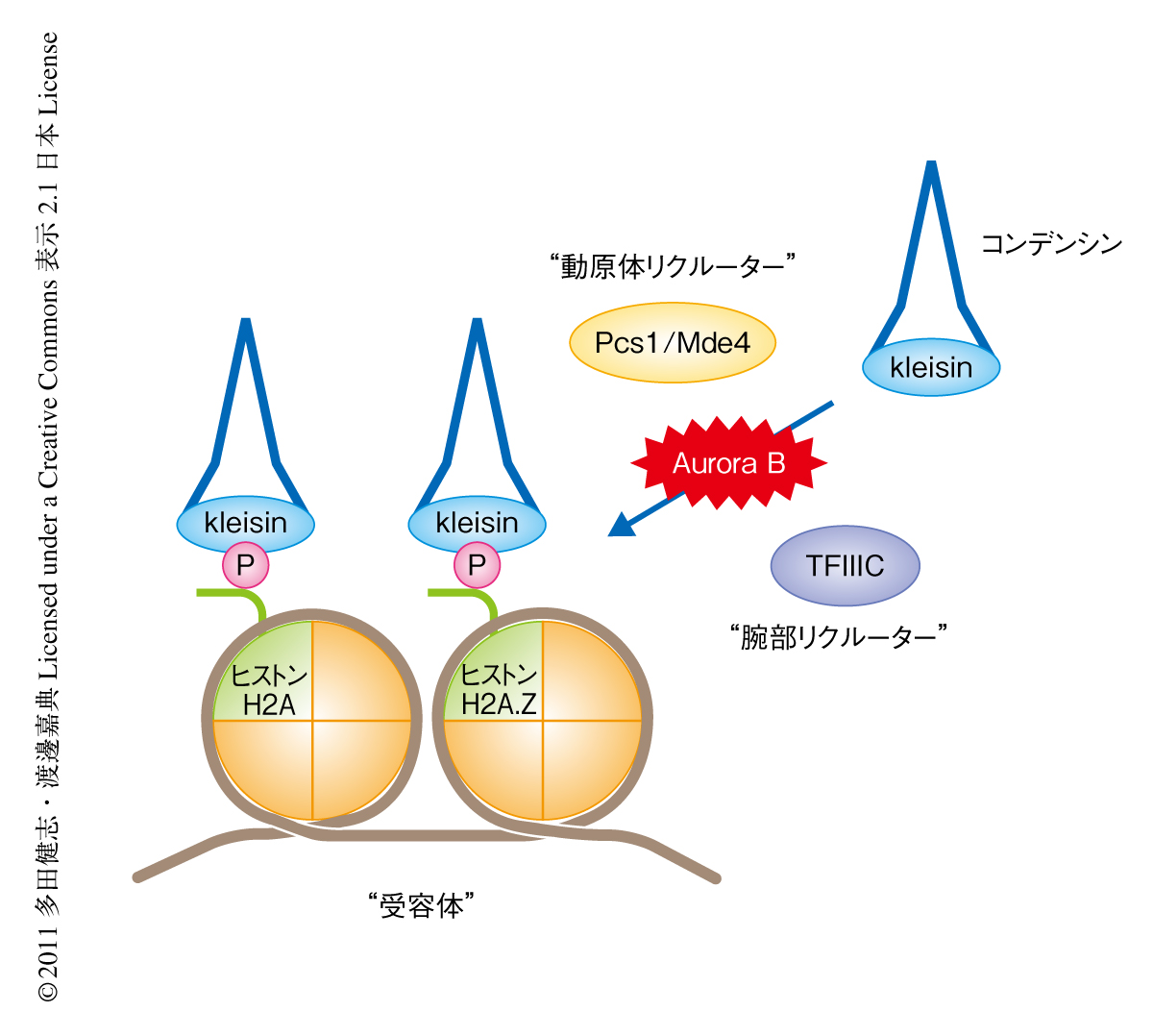
類似の機能は動原体タンパク質Pcs1-Mde4複合体でも報告されていた4).そこで,コンデンシンとPcs1-Mde4複合体との関係を調べた.その結果,pcs1遺伝子破壊株では動原体領域におけるコンデンシンの局在が低下していることが明らかになった.重要なことに,pcs1遺伝子破壊株における染色体の分配異常の表現型は動原体領域にコンデンシンを強制的に局在させることで抑圧された.以上の結果より,Pcs1-Mde4複合体の下流においてコンデンシンが実行因子として動原体領域のクロマチンを凝縮させ,スピンドル微小管と動原体との正確な結合を保障していることが示唆された.また,これまでの知見から,染色体腕部におけるコンデンシンの局在はRNAポリメラーゼIIIの転写因子TFIIICに依存しているとされている5).これらをあわせて,染色体におけるコンデンシンの局在は動原体領域と染色体腕部において異なるリクルーター(それぞれ,Pcs1-Mde4複合体とTFIIIC)により制御されていることが明らかになった(図1).
生物種をこえて保存された分裂期キナーゼAurora Bもコンデンシンの染色体への局在を制御していることが多くの生物種で示唆されていたが3,6,7),その分子機構はこれまでのところ明らかにされていない.とくに,コンデンシンの染色体への局在に関するAurora Bの基質の同定は重要な課題であった.Aurora Bの活性を阻害した際のコンデンシンの局在を検討すると,染色体の全体にわたりその局在の低下していることが明らかになった.そのため,Aurora Bは領域に特異的なリクルーターではなく,コンデンシンそのものを制御している可能性が考えられた.そこで,コンデンシンのサブユニットすべてをin vitroにおいてAurora Bによりリン酸化した.その結果,コンデンシンのkleisinサブユニット(分裂酵母ではCnd2)がAurora Bのよい基質であることが明らかになった.
つぎに,このAurora BによるCnd2のリン酸化の生理的な意義を探るため,リン酸化部位のセリン残基をアラニン残基で置換した非リン酸化型変異株を作製した.この変異株はコンデンシンの変異株に特徴的な染色体の分離異常を示し,コンデンシンの機能の低下していることが明らかになった.また,この非リン酸化型変異タンパク質はAurora Bの活性を阻害した場合と同様に染色体の全体にわたりその局在が低下していた.さらに重要なことに,リン酸化部位のセリン残基をグルタミン酸残基で置換したリン酸化模倣型変異はAurora Bの活性低下による生育阻害を抑圧した.これらのことより,コンデンシンは生体内におけるAurora Bのもっとも重要な基質のひとつであることが明らかになった.なお,これらの結果は,同じ時期に別のグループからも報告された8).
Aurora Bによるコンデンシンの局在制御はヒト培養細胞においても示唆されている.そこで,さきに述べたAurora Bによるコンデンシンkleisinサブユニットのリン酸化がヒトでも保存されているかどうかを検討した.ヒトを含む高等真核生物には2種類のコンデンシン(コンデンシンIとコンデンシンII)の存在することが知られている9).それらのkleisinサブユニット(それぞれ,CAP-HとCAP-H2)についてin vitroにおいてAurora Bによりリン酸化した.その結果,分裂酵母のコンデンシンにより相同性の高いコンデンシンIのkleisinサブユニットCAP-HがAurora Bのよい基質であることが明らかになった.また,CAP-Hの非リン酸化型変異タンパク質はAurora Bの活性を阻害した場合と同様に染色体への局在が低下していた.以上より,Aurora Bによるコンデンシンkleisinサブユニットのリン酸化,および,そのリン酸化によるコンデンシンの染色体への局在の制御は生物種をこえて保存されたものであることが示唆された.
では,Aurora Bによるコンデンシンkleisinサブユニットのリン酸化はコンデンシンの機能においてどのように重要なのだろうか? ひとつの可能性として,染色体に広く存在するなにかしらのクロマチン因子との相互作用を制御していることが考えられた.そのような因子を探索する目的で分裂期に同調したヒト培養細胞を用いてコンデンシンの免疫沈降実験を行った.その結果,コンデンシンの免疫沈降産物にヒストンの含まれることが明らかになった.また,in vitroでの結合実験によりコンデンシンとヒストンとの相互作用をさらに検討した結果,コンデンシンkleisinサブユニットはヒストンH2AおよびそのバリアントであるヒストンH2A.Zと特異的に相互作用することが明らかになった.また,重要なことに,この相互作用はコンデンシンkleisinサブユニットをAurora Bでリン酸化した際に促進された.
さらに,コンデンシンとの相互作用に重要なヒストンH2Aの領域を検索したところ,N末端のテール領域を欠いたものではコンデンシンとの相互作用が失われ,この領域が相互作用に重要であることが明らかになった.さらに,ヒストンH2AのN末端テール領域に存在する塩基性残基(そのなかでもとくに,18番目のアルギニン残基)がコンデンシンとの相互作用に重要であった.
コンデンシンとヒストンH2AおよびヒストンH2A.Zとの相互作用の生理的な意義を探るため遺伝学的な解析の容易な分裂酵母を用いた.分裂酵母の染色体に存在する2つのヒストンH2Aの遺伝子をin vitroでの結合実験でコンデンシンとの相互作用が低下する変異型アリルで置換した変異株(18番目のアルギニン残基をアラニン残基で置換)を作製した.この変異株をヒストンH2A.Zの発現抑制変異と組み合わせると,コンデンシンの変異株に特徴的な染色体の分離異常がみられた.また,このヒストンH2Aの変異株およびヒストンH2A.Zの発現抑制変異株では,染色体の全体にわたりコンデンシンの局在が低下していた.さらに,これら2つの変異の二重変異株においてコンデンシンの局在の低下がもっとも顕著であった.以上の結果より,ヒストンH2AおよびヒストンH2A.Zが重複的に染色体におけるコンデンシン受容体として機能していることが示唆された(図1).また,ヒト培養細胞を用いてヒストンH2A.ZをRNAi法によりノックダウンすると染色体におけるコンデンシンの局在の低下がみられたことより,この分子機構が生物種をこえて保存されていることが示唆された.
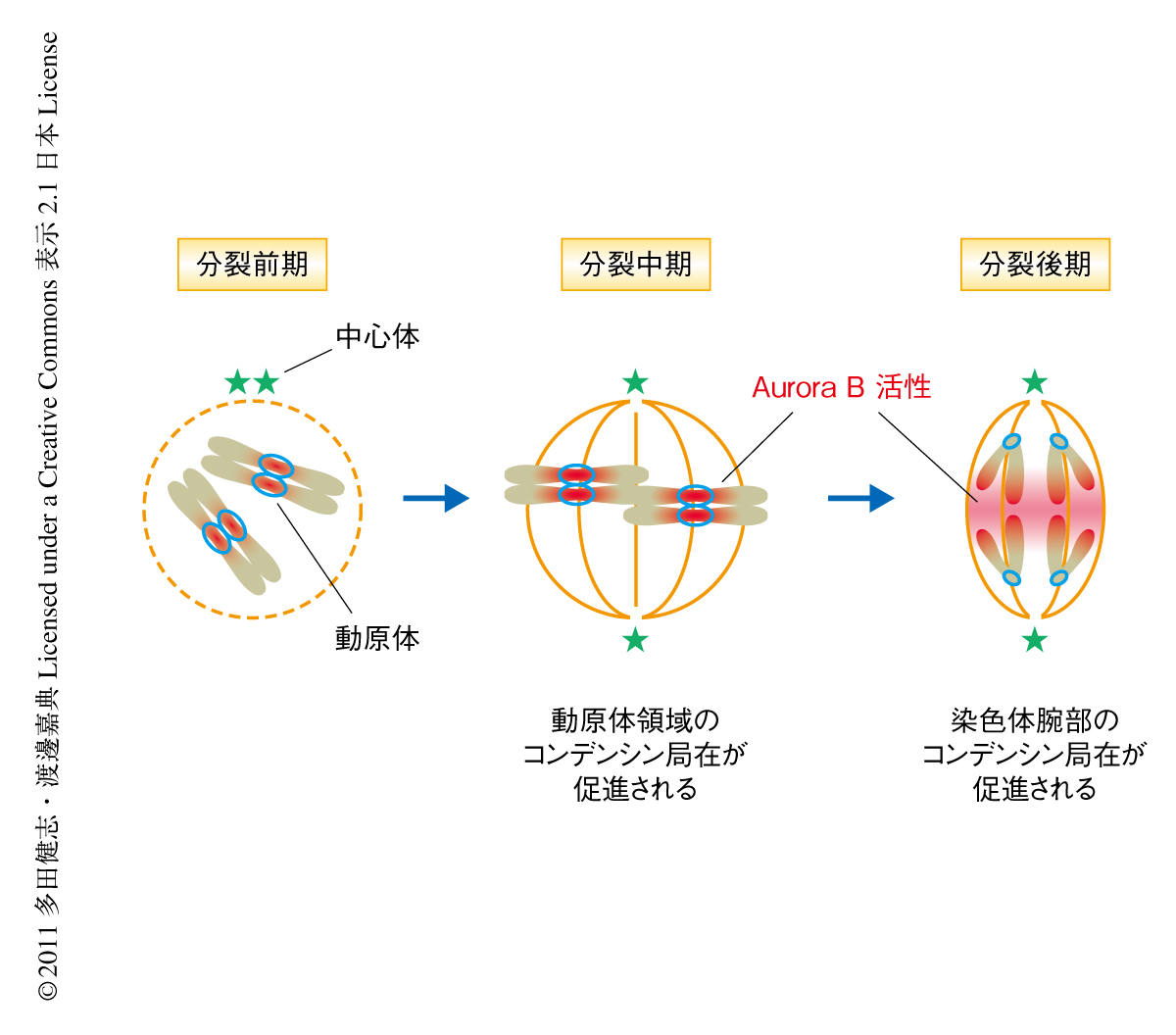
ここまで,コンデンシンの染色体への局在にはAurora Bによるコンデンシンのリン酸化が重要であることが明らかになった.ここで,Aurora Bは分裂中期まではセントロメア領域に局在し,分裂後期に進行するとスピンドル中央部にその局在を移しスピンドル中央部を中心としたAurora Bキナーゼ活性の勾配を形成することが知られている10,11).そのため,Aurora Bは分裂中期までは動原体領域におけるコンデンシンの局在を促進してスピンドル微小管と動原体との正確な結合を保障し,分裂後期にはスピンドル中央領域に位置する染色体腕部におけるコンデンシンの局在を促進して腕部の分離を助けていることが考えられた(図2).実際に分裂酵母の場合,染色体腕部におけるコンデンシンの局在は,よりAurora Bの活性にさらされる分裂後期において最大となっていた.また,ヒト培養細胞を用いた際も分裂後期においてAurora Bの活性の勾配に相関したコンデンシンの局在がみられた.これにより,Aurora Bキナーゼによる分裂期の染色体構造の時空間的な制御機構が明らかになった.
今回の研究により,分裂期の染色体のかたちを規定するコンデンシン複合体の局在機構の一端が明らかになった.まず,動原体領域と染色体腕部におけるコンデンシンの局在は,2つの異なるリクルーター(それぞれ,Pcs1-Mde4複合体とTFIIIC)により制御されていることが明らかになった.これに対し,Aurora Bによるリン酸化に依存したコンデンシンとヒストンH2AおよびヒストンH2A.Zとの相互作用は,領域によらないコンデンシンの染色体への局在の根幹をなすものであると考えられた.このように,コンデンシンの染色体への局在には少なくとも2つの階層における制御のあることが示唆された(図1).また,Aurora Bキナーゼは分裂期にその局在を変化させることが知られていたが,コンデンシンがその直接の基質となっていたことから,コンデンシンの染色体への局在も時空間的な制御をうけていることが明らかになった(図2).
略歴:東京大学大学院理学系研究科博士課程 在籍中.
研究テーマ:コンデンシン複合体の染色体への局在機構.
抱負:正確な染色体分配を遂行するために細胞の備えた分子機構の緻密さに驚かされながら研究を進めている.このような美しい染色体分配の分子機構を少しでも明らかにしていけたらと考えている.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2011 多田健志・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:多田健志
DOI: 10.7875/first.author.2011.097
Condensin association with histone H2A shapes mitotic chromosomes.
Kenji Tada, Hiroaki Susumu, Takeshi Sakuno, Yoshinori Watanabe
Nature, 474, 477-483 (2011)
要 約
遺伝情報を担う染色体は細胞周期にともないその形態を変化させる.活発に転写が行われている間期の不定形なゆるんだ染色体は,分裂期に進行すると高度に折りたたまれた棒状の凝縮した構造をとる.この分裂期における染色体の凝縮にかかわる因子として,生物種をこえて高度に保存されたコンデンシン複合体が知られている.しかし,コンデンシンの染色体への局在の分子機構については不明な点も多かった.今回,筆者らは,動原体領域にとくに濃縮したコンデンシンの局在が,動原体タンパク質Pcs1-Mde4複合体に依存していることを明らかにした.また,動原体のみならず染色体の全体におけるコンデンシンの局在には,染色体DNAに均一に結合しているヒストン複合体のひとつであるヒストンH2Aとの相互作用が重要であることが明らかになった.一方,生物種をこえて保存された分裂期キナーゼAurora Bもコンデンシンの染色体への局在を制御していることが示唆されていたが,そのリン酸化の標的は不明であった.この研究により,コンデンシンがAurora Bのリン酸化の標的であり,このリン酸化に依存してヒストンH2Aとの相互作用は促進されることが明らかになった.
はじめに
分裂期における染色体の凝縮はかぎられた空間において染色体の分配を遂行するうえで必須の現象であると考えられる.この分裂期における染色体の凝縮にはコンデンシンとよばれるタンパク質複合体の寄与していることが知られている.実際,コンデンシンの機能を阻害すると分裂期における染色体の構造形成や染色体腕部の分離に異常を生じることが報告されている1).また,細胞内においてコンデンシンの機能を阻害するとセントロメア領域の構造的な安定性や動原体の機能にも異常を生じることより,コンデンシンはセントロメア領域においても重要な機能をはたしていることが示唆されていた2,3).コンデンシンがその機能を発揮するためには染色体に局在することが必須であると考えられる.しかし,コンデンシンの染色体への局在の分子機構については不明な点も多い.その分子機構を探るため,まず,染色体腕部とセントロメア領域におけるコンデンシンの機能を分離することを試みた.
1.動原体領域へのコンデンシンの局在は動原体タンパク質Pcs1-Mde4複合体に依存している
まず,分裂酵母を用いて動原体領域におけるコンデンシンの機能を探ることを試みた.コンデンシンのサブユニットのひとつに配列特異的なTEVプロテアーゼの認識配列を挿入しておき,TEVプロテアーゼを動原体にのみ局在させることでこの領域のコンデンシンを特異的に不活性化した.その結果,動原体領域のクロマチン構造がゆるむとともに,スピンドル微小管と動原体との結合に異常がみられた.このことより,コンデンシンが動原体領域のクロマチンを凝縮させてコンパクトにし,動原体がスピンドル微小管から異常なとらえられ方をするのを防いでいることが示唆された.
類似の機能は動原体タンパク質Pcs1-Mde4複合体でも報告されていた4).そこで,コンデンシンとPcs1-Mde4複合体との関係を調べた.その結果,pcs1遺伝子破壊株では動原体領域におけるコンデンシンの局在が低下していることが明らかになった.重要なことに,pcs1遺伝子破壊株における染色体の分配異常の表現型は動原体領域にコンデンシンを強制的に局在させることで抑圧された.以上の結果より,Pcs1-Mde4複合体の下流においてコンデンシンが実行因子として動原体領域のクロマチンを凝縮させ,スピンドル微小管と動原体との正確な結合を保障していることが示唆された.また,これまでの知見から,染色体腕部におけるコンデンシンの局在はRNAポリメラーゼIIIの転写因子TFIIICに依存しているとされている5).これらをあわせて,染色体におけるコンデンシンの局在は動原体領域と染色体腕部において異なるリクルーター(それぞれ,Pcs1-Mde4複合体とTFIIIC)により制御されていることが明らかになった(図1).
2.分裂期キナーゼAurora Bはコンデンシンのkleisinサブユニットをリン酸化する
生物種をこえて保存された分裂期キナーゼAurora Bもコンデンシンの染色体への局在を制御していることが多くの生物種で示唆されていたが3,6,7),その分子機構はこれまでのところ明らかにされていない.とくに,コンデンシンの染色体への局在に関するAurora Bの基質の同定は重要な課題であった.Aurora Bの活性を阻害した際のコンデンシンの局在を検討すると,染色体の全体にわたりその局在の低下していることが明らかになった.そのため,Aurora Bは領域に特異的なリクルーターではなく,コンデンシンそのものを制御している可能性が考えられた.そこで,コンデンシンのサブユニットすべてをin vitroにおいてAurora Bによりリン酸化した.その結果,コンデンシンのkleisinサブユニット(分裂酵母ではCnd2)がAurora Bのよい基質であることが明らかになった.
つぎに,このAurora BによるCnd2のリン酸化の生理的な意義を探るため,リン酸化部位のセリン残基をアラニン残基で置換した非リン酸化型変異株を作製した.この変異株はコンデンシンの変異株に特徴的な染色体の分離異常を示し,コンデンシンの機能の低下していることが明らかになった.また,この非リン酸化型変異タンパク質はAurora Bの活性を阻害した場合と同様に染色体の全体にわたりその局在が低下していた.さらに重要なことに,リン酸化部位のセリン残基をグルタミン酸残基で置換したリン酸化模倣型変異はAurora Bの活性低下による生育阻害を抑圧した.これらのことより,コンデンシンは生体内におけるAurora Bのもっとも重要な基質のひとつであることが明らかになった.なお,これらの結果は,同じ時期に別のグループからも報告された8).
3.Aurora Bによるコンデンシンのリン酸化はヒト培養細胞においても保存されている
Aurora Bによるコンデンシンの局在制御はヒト培養細胞においても示唆されている.そこで,さきに述べたAurora Bによるコンデンシンkleisinサブユニットのリン酸化がヒトでも保存されているかどうかを検討した.ヒトを含む高等真核生物には2種類のコンデンシン(コンデンシンIとコンデンシンII)の存在することが知られている9).それらのkleisinサブユニット(それぞれ,CAP-HとCAP-H2)についてin vitroにおいてAurora Bによりリン酸化した.その結果,分裂酵母のコンデンシンにより相同性の高いコンデンシンIのkleisinサブユニットCAP-HがAurora Bのよい基質であることが明らかになった.また,CAP-Hの非リン酸化型変異タンパク質はAurora Bの活性を阻害した場合と同様に染色体への局在が低下していた.以上より,Aurora Bによるコンデンシンkleisinサブユニットのリン酸化,および,そのリン酸化によるコンデンシンの染色体への局在の制御は生物種をこえて保存されたものであることが示唆された.
4.Aurora Bによりリン酸化されたコンデンシンkleisinサブユニットはヒストンH2Aと相互作用する
では,Aurora Bによるコンデンシンkleisinサブユニットのリン酸化はコンデンシンの機能においてどのように重要なのだろうか? ひとつの可能性として,染色体に広く存在するなにかしらのクロマチン因子との相互作用を制御していることが考えられた.そのような因子を探索する目的で分裂期に同調したヒト培養細胞を用いてコンデンシンの免疫沈降実験を行った.その結果,コンデンシンの免疫沈降産物にヒストンの含まれることが明らかになった.また,in vitroでの結合実験によりコンデンシンとヒストンとの相互作用をさらに検討した結果,コンデンシンkleisinサブユニットはヒストンH2AおよびそのバリアントであるヒストンH2A.Zと特異的に相互作用することが明らかになった.また,重要なことに,この相互作用はコンデンシンkleisinサブユニットをAurora Bでリン酸化した際に促進された.
さらに,コンデンシンとの相互作用に重要なヒストンH2Aの領域を検索したところ,N末端のテール領域を欠いたものではコンデンシンとの相互作用が失われ,この領域が相互作用に重要であることが明らかになった.さらに,ヒストンH2AのN末端テール領域に存在する塩基性残基(そのなかでもとくに,18番目のアルギニン残基)がコンデンシンとの相互作用に重要であった.
5.ヒストンH2AおよびヒストンH2A.Zは染色体におけるコンデンシン受容体として機能する
コンデンシンとヒストンH2AおよびヒストンH2A.Zとの相互作用の生理的な意義を探るため遺伝学的な解析の容易な分裂酵母を用いた.分裂酵母の染色体に存在する2つのヒストンH2Aの遺伝子をin vitroでの結合実験でコンデンシンとの相互作用が低下する変異型アリルで置換した変異株(18番目のアルギニン残基をアラニン残基で置換)を作製した.この変異株をヒストンH2A.Zの発現抑制変異と組み合わせると,コンデンシンの変異株に特徴的な染色体の分離異常がみられた.また,このヒストンH2Aの変異株およびヒストンH2A.Zの発現抑制変異株では,染色体の全体にわたりコンデンシンの局在が低下していた.さらに,これら2つの変異の二重変異株においてコンデンシンの局在の低下がもっとも顕著であった.以上の結果より,ヒストンH2AおよびヒストンH2A.Zが重複的に染色体におけるコンデンシン受容体として機能していることが示唆された(図1).また,ヒト培養細胞を用いてヒストンH2A.ZをRNAi法によりノックダウンすると染色体におけるコンデンシンの局在の低下がみられたことより,この分子機構が生物種をこえて保存されていることが示唆された.
6.Aurora Bによるコンデンシンの局在の時空間的な制御
ここまで,コンデンシンの染色体への局在にはAurora Bによるコンデンシンのリン酸化が重要であることが明らかになった.ここで,Aurora Bは分裂中期まではセントロメア領域に局在し,分裂後期に進行するとスピンドル中央部にその局在を移しスピンドル中央部を中心としたAurora Bキナーゼ活性の勾配を形成することが知られている10,11).そのため,Aurora Bは分裂中期までは動原体領域におけるコンデンシンの局在を促進してスピンドル微小管と動原体との正確な結合を保障し,分裂後期にはスピンドル中央領域に位置する染色体腕部におけるコンデンシンの局在を促進して腕部の分離を助けていることが考えられた(図2).実際に分裂酵母の場合,染色体腕部におけるコンデンシンの局在は,よりAurora Bの活性にさらされる分裂後期において最大となっていた.また,ヒト培養細胞を用いた際も分裂後期においてAurora Bの活性の勾配に相関したコンデンシンの局在がみられた.これにより,Aurora Bキナーゼによる分裂期の染色体構造の時空間的な制御機構が明らかになった.
おわりに
今回の研究により,分裂期の染色体のかたちを規定するコンデンシン複合体の局在機構の一端が明らかになった.まず,動原体領域と染色体腕部におけるコンデンシンの局在は,2つの異なるリクルーター(それぞれ,Pcs1-Mde4複合体とTFIIIC)により制御されていることが明らかになった.これに対し,Aurora Bによるリン酸化に依存したコンデンシンとヒストンH2AおよびヒストンH2A.Zとの相互作用は,領域によらないコンデンシンの染色体への局在の根幹をなすものであると考えられた.このように,コンデンシンの染色体への局在には少なくとも2つの階層における制御のあることが示唆された(図1).また,Aurora Bキナーゼは分裂期にその局在を変化させることが知られていたが,コンデンシンがその直接の基質となっていたことから,コンデンシンの染色体への局在も時空間的な制御をうけていることが明らかになった(図2).
文 献
- Hirano, T.: Condensins: organizing and segregating the genome. Curr. Biol., 15, R265-275 (2005)[PubMed]
- Ribeiro, S. A., Gatlin, J. C., Dong, Y. et al.: Condensin regulates the stiffness of vertebrate centromeres. Mol. Biol. Cell, 20, 2371-2380 (2009)[PubMed]
- Nakazawa, N., Nakamura, T., Kokubu, A. et al.: Dissection of the essential steps for condensin accumulation at kinetochores and rDNAs during fission yeast mitosis. J. Cell Biol., 180, 1115-1131 (2008)[PubMed]
- Gregan, J., Riedel, C. G., Pidoux, A. L. et al.: The kinetochore proteins Pcs1 and Mde4 and heterochromatin are required to prevent merotelic orientation. Curr. Biol., 17, 1190-1200 (2007)[PubMed]
- Iwasaki, O., Tanaka, A., Tanizawa, H. et al.: Centromeric localization of dispersed Pol III genes in fission yeast. Mol. Biol. Cell, 21, 254-265 (2010)[PubMed]
- Lipp, J. J., Hirota, T., Poser, I. et al.: Aurora B controls the association of condensin I but not condensin II with mitotic chromosomes. J. Cell Sci., 120, 1245-1255 (2007)[PubMed]
- Giet, R. & Glover, D. M.: Drosophila aurora B kinase is required for histone H3 phosphorylation and condensin recruitment during chromosome condensation and to organize the central spindle during cytokinesis. J. Cell Biol., 152, 669-682 (2001)[PubMed]
- Nakazawa, N., Mehrotra, R., Ebe, M. et al.: Condensin phosphorylated by the Aurora-B-like kinase Ark1 is continuously required until telophase in a mode distinct from Top2. J. Cell Sci., 124, 1795-1807 (2011)[PubMed]
- Ono, T., Losada, A., Hirano, M. et al.: Differential contributions of condensin I and condensin II to mitotic chromosome architecture in vertebrate cells. Cell, 115, 109-121 (2003)[PubMed]
- Ruchaud, S., Carmena, M. & Earnshaw, W. C.: Chromosomal passengers: conducting cell division. Nat. Rev. Mol. Cell Biol., 8, 798-812 (2007)[PubMed]
- Fuller, B. G., Lampson, M. A., Foley, E. A. et al.: Midzone activation of aurora B in anaphase produces an intracellular phosphorylation gradient. Nature, 453, 1132-1136 (2008)[PubMed]
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 在籍中.
研究テーマ:コンデンシン複合体の染色体への局在機構.
抱負:正確な染色体分配を遂行するために細胞の備えた分子機構の緻密さに驚かされながら研究を進めている.このような美しい染色体分配の分子機構を少しでも明らかにしていけたらと考えている.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2011 多田健志・渡邊嘉典 Licensed under CC 表示 2.1 日本