細胞浸潤において基底膜の穴の大きさは厳密に制御されている
伊原伸治・David R. Sherwood
(米国Duke大学,Department of Biology)
email:伊原伸治
DOI: 10.7875/first.author.2011.090
Basement membrane sliding and targeted adhesion remodels tissue boundaries during uterine-vulval attachment in Caenorhabditis elegans.
Shinji Ihara, Elliott J. Hagedorn, Meghan A. Morrissey, Qiuyi Chi, Fumio Motegi, James M. Kramer, David R. Sherwood
Nature Cell Biology, 13, 641-651 (2011)
細胞浸潤や器官形成の際に基底膜に大きな穴が開くことが知られている.in vivoにおいて,この大きな穴がどのようにできるのかはまったくわかっていないが,おそらく,タンパク質分解酵素による基底膜の分解,もしくは,基底膜の合成低下により大きな穴ができるものと考えられてきた.筆者らは,線虫C. elegansの子宮および陰門の形成をモデルとして,この基底膜の穴の大きさがどのように制御されているのかを明らかにした.その結果,これまでの仮説とは大きく異なり,基底膜の分解は検出できるレベルではほとんど起こっておらず,基底膜が両方向に移動することで穴を大きくしていることが明らかになった.さらに,基底膜の境界部分にある細胞に基底膜との結合タンパク質であるインテグリンやVAB-19とよばれるタンパク質が局在化して,穴の大きさを制御していることが明らかになった.
発生の過程やがん細胞で観察される細胞浸潤は基底膜を介した細胞移動のことである.たとえば,がん細胞が基底膜を通過して間質組織などに浸潤したものを微小浸潤がんとよぶが,これは予後と強い相関のあることからも,細胞浸潤は医学や生物学における主要な研究テーマのひとつである.しかしながら,in vivoにおける細胞浸潤の実験モデルの確立は非常に困難である.その主たる理由は基底膜を人工的につくれないことである.基底膜は多細胞生物の共通構造であり数種類のタンパク質からなるシート状の構造をしている.線虫についてアンカー細胞の基底膜を介する浸潤モデルは近年になり確立されたin vivoにおける実験モデルであり,遺伝学や細胞生物学を組み合わせて解析できる有用なモデルである1,2).さらに,アンカー細胞の浸潤においては,がん細胞でも観察される浸潤突起が観察されることからも,がん細胞と同じような分子機構により浸潤を行っているものと考えられている3).
筆者らは,蛍光タンパク質と共焦点レーザー顕微鏡を組み合わせた解析を行い,これまでの予想とは大きく異なり,細胞浸潤における基底膜の穴の拡大において基底膜の分解はほとんど起こっていないことを明らかにした.
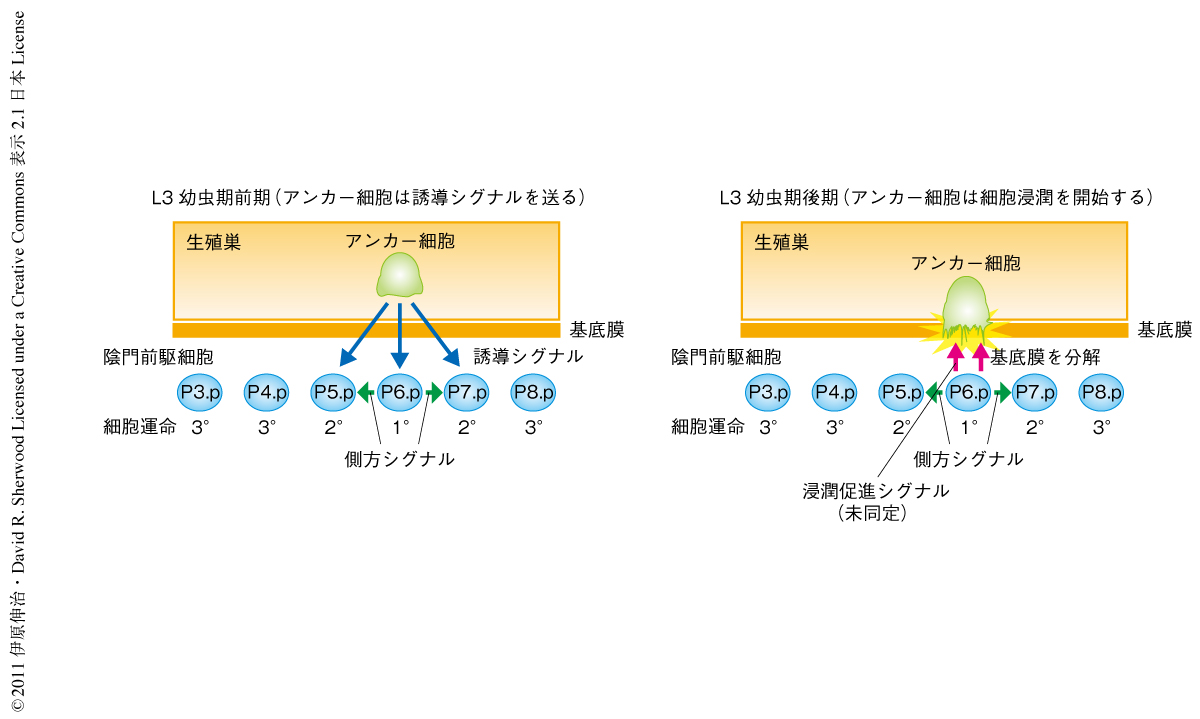
線虫の外部生殖器である陰門(vulva)は腹部の中央に一定の細胞分裂パターンをへて形成される.これは6個の陰門前駆細胞のなかの3つの細胞の子孫,計22個の細胞から構成される.アンカー細胞はこの陰門の形成の際に6個ある陰門前駆細胞(P3.p細胞からP8.p細胞)のうち,3個の細胞(P5.p細胞からP7.p細胞)にはたらきかけて誘導シグナルを送る(図1).誘導シグナルをもっとも強く受け取ったP6.p細胞は1°の運命に誘導され,陰門のE細胞およびF細胞をつくりだす.P6.p細胞は1°の運命に誘導されて側方シグナルを送り,P5.p細胞とP7.p細胞に発現しているNOTCH受容体を介し,これらの細胞が2°の運命になるよう誘導する.2°の運命をもつ細胞は陰門のA細胞,B細胞,C細胞,D細胞をつくりだし陰門を形成する.さらに,アンカー細胞は基底膜を介した細胞移動(浸潤)を行うが,この浸潤は子宮と陰門との適切な結合に必須である.
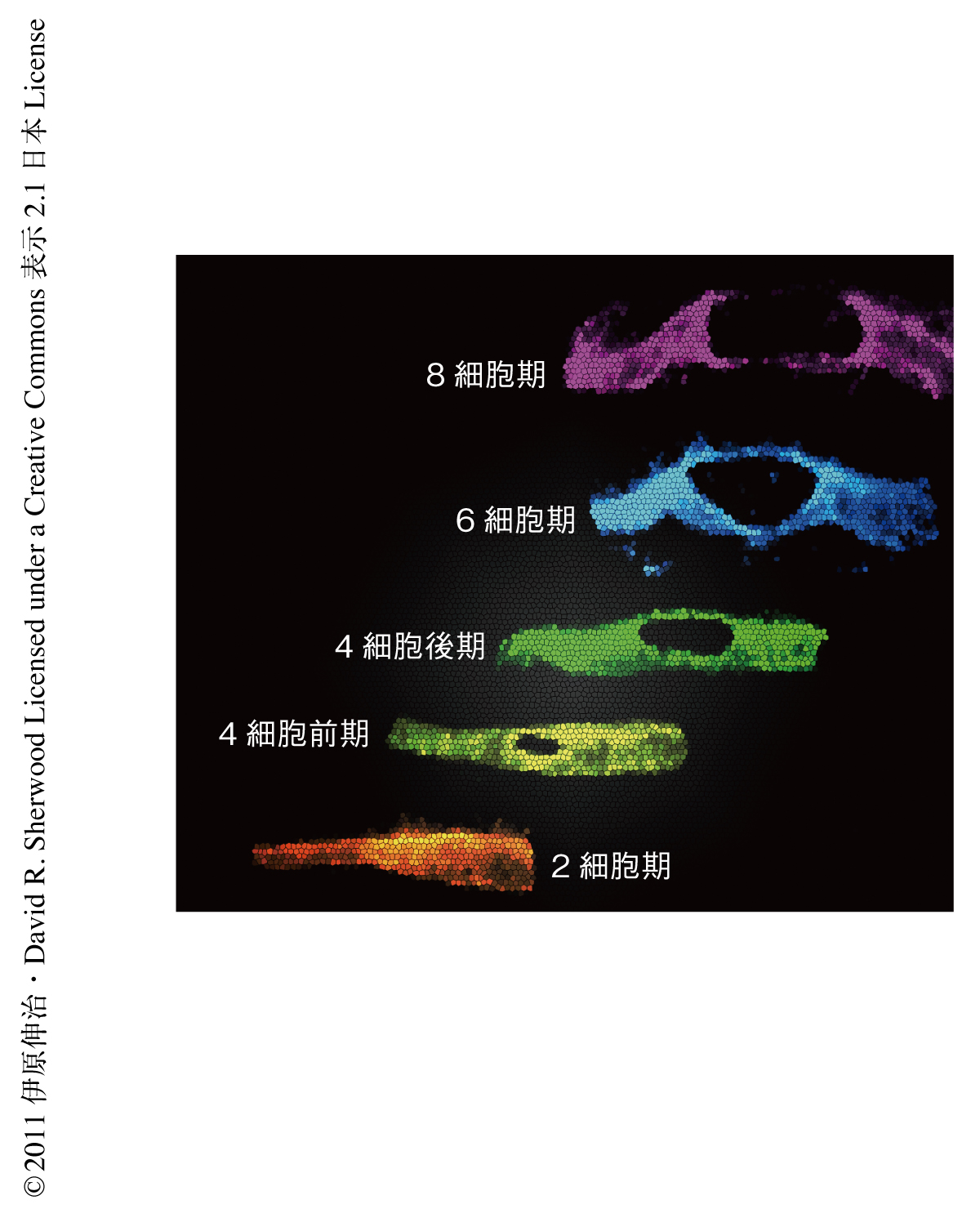
最初に,この過程の可視化に取り組んだ.基底膜の主要な構成成分であるラミニンに蛍光タンパク質GFPあるいはmCherryを結合させることで基底膜の可視化を行い,アンカー細胞に強く発現するプロモーターを用いホスホリパーゼCのPHドメインを発現させることでアンカー細胞の可視化に成功した4,5).この実験系を用いて,スピニングディスク型共焦点顕微鏡を利用して3次元構築を行い,基底膜にできた穴の大きさが発生の段階に完全に依存していることを明らかにした(図2).
細胞破壊実験と変異体により個々の細胞のはたらきを明らかにした.浸潤のまえにレーザー照射によりアンカー細胞を破壊して取り除くと,穴はまったく観察されなかった.しかし,いったん穴ができるとアンカー細胞を取り除いても穴の大きさはまったく正常であった.このことは,アンカー細胞は基底膜に穴をあけるためだけに必要であることを示していた.また,陰門前駆細胞が分裂しない変異体では穴の大きさは有意に小さいことが明らかになった.この実験結果は,穴を拡大させる役割は陰門前駆細胞がもつことを示していた.さらに,穴の大きさの制御機構は,陰門前駆細胞のほか,将来,子宮になる細胞にも存在することが明らかになった.
基底膜は培養細胞を用いても人工的に合成することができないので,その動態はほとんど明らかにされていない.線虫は簡単に生細胞イメージング法が使えるので,そのメリットを活かしてさまざまな基底膜の構成成分を可視化したが,これをさらに進展させ,光転換する蛍光タンパク質を利用することによりそのダイナミクスを追跡した.
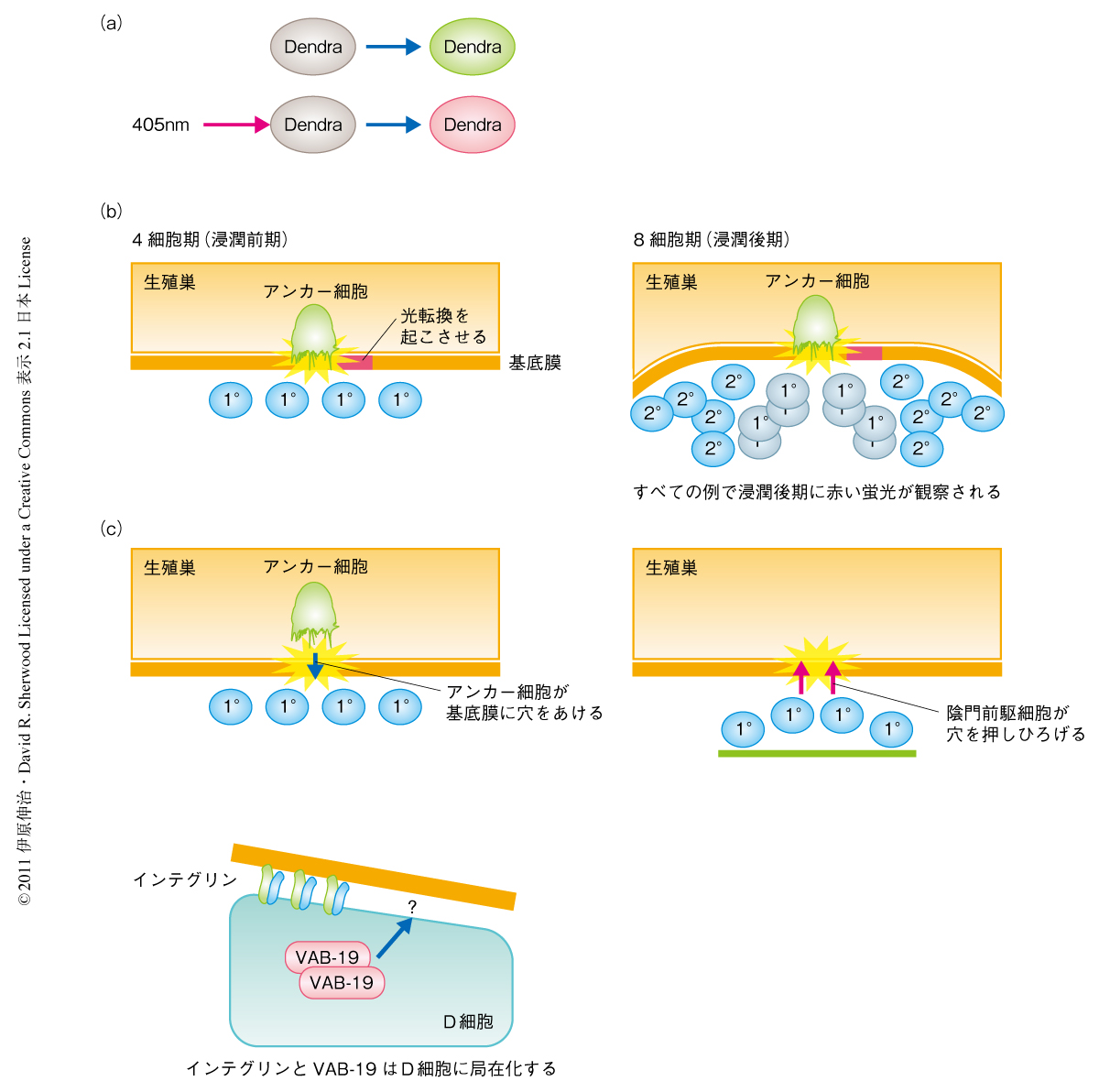
Dendraは2006年に報告された単量体からなる光転換型蛍光タンパク質である6).通常は緑色の蛍光を発するが,波長405 nmの光を照射すると赤色の蛍光を発するようになる(図3a).線虫における発現のためコドンを改変したDendra発現ベクターを用いて,基底膜の主要な構成成分であるラミニンの可視化に成功した.これを用いて穴の拡大の際の基底膜のダイナミクスを測定した結果,驚くべきことに,拡大の過程では基底膜の分解がほとんど起こらないことが明らかになった(図3b).さらに,ラミニン-GFP融合タンパク質を用いてFRAP(fluorescence recovery after photobleaching,光退色後の蛍光回復)を観察した結果,穴の境界の付近では基底膜の合成の顕著な低下は観察されなかった.この結果は,穴の拡大の過程において,基底膜の分解も合成低下も起こっていないことを示していた.以上の結果より,穴の拡大の過程では基底膜の移動により穴の拡大していることが明らかになった.
線虫の子宮と陰門の形成がうまくいかないときにはしばしばRUP(rupture vulva phenotype)とよばれる表現型が観察される.線虫の遺伝子データベースであるWormBaseを用いてRNAiによりRUP表現型を示す約300個の遺伝子を選択した.さらに,穴の大きさの制御機構を明らかにするため,そこから細胞外タンパク質あるいは膜結合型タンパク質をコードする遺伝子を選び出した.
基底膜にできる穴の境界線は8細胞期にはD細胞(陰門細胞)とよばれる細胞に移動する.選び出した遺伝子の変異体において8細胞期に穴の境界線がD細胞にあるかどうかを観察した.その結果,ラミニン結合型インテグリンのαサブユニットをコードするina-1遺伝子の変異体では低い頻度で穴の大きさが破綻(穴が拡大)していることを見い出した.インテグリンはαサブユニットとβサブユニットとでヘテロ二量体を形成するが,線虫にはβサブユニットはPAT-3の1種類しかない.生体におけるインテグリンの局在を明らかにするため,PAT-3にGFPを融合させINA-1と共発現させることで,INA-1-PAT-3ヘテロ二量体の生体における局在を解析した.その結果,インテグリンは穴の境界線の付近の細胞(D細胞)に局在化していることが明らかになった.また,D細胞にドミナントネガティブ型のインテグリンを発現させると穴の大きさの異常が観察され,この結果はインテグリンがD細胞において穴の大きさを制御していることを示していた.
さらに,哺乳類のがん抑制遺伝子として知られるkank遺伝子の相同遺伝子であるvab-19遺伝子の変異体でも,低い頻度で穴の大きさが破綻(穴が拡大)していることを見い出した.そして,VAB-19もインテグリンと同様にD細胞に局在化していることを明らかにした.遺伝学的な手法を用いて解析した結果,ina-1遺伝子とvab-19遺伝子は同一の経路には存在しないという結果が示唆されたが,VAB-19による制御機構は不明であった(図3c).以上の結果は,陰門前駆細胞ではインテグリンとVAB-19をそれぞれ経由する並行した2つの経路が基底膜の境界線の位置を決定していることを示していた.
基底膜は人工的には合成できないことから,その動態の解析はほとんど行われていない.今回,筆者らは,細胞浸潤において基底膜がどのように制御されているのか,その動態の解析を行った.この研究で用いた基底膜の可視化や蛍光タンパク質Dendraを用いた動態の解析などの技術は基底膜を理解するうえで必須になるものと考えている.さらに,驚くべきことに,基底膜の穴の拡大のときにはこれまでの予想とは異なり,基底膜の分解はほとんど起こらないことを見い出した.この研究によって明らかになった知見は,多細胞体の構築モデルを考察するにあたり興味深い知見となることを期待している.そして今後は,線虫のメリットを最大限に活かして,基底膜の穴の大きさの制御機構にさらにせまりたいと考えている.
略歴:2003年 大阪大学大学院医学系研究科博士課程 修了,2004年 理化学研究所 基礎科学特別研究員,2008年 米国Duke大学 研究員を経て,2010年より国立遺伝学研究所 助教.
研究テーマ:多細胞体構築の制御機構の解析(非対称分裂や細胞浸潤).
抱負:焦らず,慌てず,おもしろいことをおもしろく研究していく.
David R. Sherwood
米国Duke大学Assistant Professor.
研究室URL:http://web.me.com/dsherwoo/Sherwood_Lab/Welcome.html
© 2011 伊原伸治・David R. Sherwood Licensed under CC 表示 2.1 日本
(米国Duke大学,Department of Biology)
email:伊原伸治
DOI: 10.7875/first.author.2011.090
Basement membrane sliding and targeted adhesion remodels tissue boundaries during uterine-vulval attachment in Caenorhabditis elegans.
Shinji Ihara, Elliott J. Hagedorn, Meghan A. Morrissey, Qiuyi Chi, Fumio Motegi, James M. Kramer, David R. Sherwood
Nature Cell Biology, 13, 641-651 (2011)
要 約
細胞浸潤や器官形成の際に基底膜に大きな穴が開くことが知られている.in vivoにおいて,この大きな穴がどのようにできるのかはまったくわかっていないが,おそらく,タンパク質分解酵素による基底膜の分解,もしくは,基底膜の合成低下により大きな穴ができるものと考えられてきた.筆者らは,線虫C. elegansの子宮および陰門の形成をモデルとして,この基底膜の穴の大きさがどのように制御されているのかを明らかにした.その結果,これまでの仮説とは大きく異なり,基底膜の分解は検出できるレベルではほとんど起こっておらず,基底膜が両方向に移動することで穴を大きくしていることが明らかになった.さらに,基底膜の境界部分にある細胞に基底膜との結合タンパク質であるインテグリンやVAB-19とよばれるタンパク質が局在化して,穴の大きさを制御していることが明らかになった.
はじめに
発生の過程やがん細胞で観察される細胞浸潤は基底膜を介した細胞移動のことである.たとえば,がん細胞が基底膜を通過して間質組織などに浸潤したものを微小浸潤がんとよぶが,これは予後と強い相関のあることからも,細胞浸潤は医学や生物学における主要な研究テーマのひとつである.しかしながら,in vivoにおける細胞浸潤の実験モデルの確立は非常に困難である.その主たる理由は基底膜を人工的につくれないことである.基底膜は多細胞生物の共通構造であり数種類のタンパク質からなるシート状の構造をしている.線虫についてアンカー細胞の基底膜を介する浸潤モデルは近年になり確立されたin vivoにおける実験モデルであり,遺伝学や細胞生物学を組み合わせて解析できる有用なモデルである1,2).さらに,アンカー細胞の浸潤においては,がん細胞でも観察される浸潤突起が観察されることからも,がん細胞と同じような分子機構により浸潤を行っているものと考えられている3).
筆者らは,蛍光タンパク質と共焦点レーザー顕微鏡を組み合わせた解析を行い,これまでの予想とは大きく異なり,細胞浸潤における基底膜の穴の拡大において基底膜の分解はほとんど起こっていないことを明らかにした.
1.線虫における陰門の形成と細胞浸潤の可視化
線虫の外部生殖器である陰門(vulva)は腹部の中央に一定の細胞分裂パターンをへて形成される.これは6個の陰門前駆細胞のなかの3つの細胞の子孫,計22個の細胞から構成される.アンカー細胞はこの陰門の形成の際に6個ある陰門前駆細胞(P3.p細胞からP8.p細胞)のうち,3個の細胞(P5.p細胞からP7.p細胞)にはたらきかけて誘導シグナルを送る(図1).誘導シグナルをもっとも強く受け取ったP6.p細胞は1°の運命に誘導され,陰門のE細胞およびF細胞をつくりだす.P6.p細胞は1°の運命に誘導されて側方シグナルを送り,P5.p細胞とP7.p細胞に発現しているNOTCH受容体を介し,これらの細胞が2°の運命になるよう誘導する.2°の運命をもつ細胞は陰門のA細胞,B細胞,C細胞,D細胞をつくりだし陰門を形成する.さらに,アンカー細胞は基底膜を介した細胞移動(浸潤)を行うが,この浸潤は子宮と陰門との適切な結合に必須である.
最初に,この過程の可視化に取り組んだ.基底膜の主要な構成成分であるラミニンに蛍光タンパク質GFPあるいはmCherryを結合させることで基底膜の可視化を行い,アンカー細胞に強く発現するプロモーターを用いホスホリパーゼCのPHドメインを発現させることでアンカー細胞の可視化に成功した4,5).この実験系を用いて,スピニングディスク型共焦点顕微鏡を利用して3次元構築を行い,基底膜にできた穴の大きさが発生の段階に完全に依存していることを明らかにした(図2).
2.それぞれの細胞の役割は決まっている
細胞破壊実験と変異体により個々の細胞のはたらきを明らかにした.浸潤のまえにレーザー照射によりアンカー細胞を破壊して取り除くと,穴はまったく観察されなかった.しかし,いったん穴ができるとアンカー細胞を取り除いても穴の大きさはまったく正常であった.このことは,アンカー細胞は基底膜に穴をあけるためだけに必要であることを示していた.また,陰門前駆細胞が分裂しない変異体では穴の大きさは有意に小さいことが明らかになった.この実験結果は,穴を拡大させる役割は陰門前駆細胞がもつことを示していた.さらに,穴の大きさの制御機構は,陰門前駆細胞のほか,将来,子宮になる細胞にも存在することが明らかになった.
3.光転換型蛍光タンパク質Dendraの応用
基底膜は培養細胞を用いても人工的に合成することができないので,その動態はほとんど明らかにされていない.線虫は簡単に生細胞イメージング法が使えるので,そのメリットを活かしてさまざまな基底膜の構成成分を可視化したが,これをさらに進展させ,光転換する蛍光タンパク質を利用することによりそのダイナミクスを追跡した.
Dendraは2006年に報告された単量体からなる光転換型蛍光タンパク質である6).通常は緑色の蛍光を発するが,波長405 nmの光を照射すると赤色の蛍光を発するようになる(図3a).線虫における発現のためコドンを改変したDendra発現ベクターを用いて,基底膜の主要な構成成分であるラミニンの可視化に成功した.これを用いて穴の拡大の際の基底膜のダイナミクスを測定した結果,驚くべきことに,拡大の過程では基底膜の分解がほとんど起こらないことが明らかになった(図3b).さらに,ラミニン-GFP融合タンパク質を用いてFRAP(fluorescence recovery after photobleaching,光退色後の蛍光回復)を観察した結果,穴の境界の付近では基底膜の合成の顕著な低下は観察されなかった.この結果は,穴の拡大の過程において,基底膜の分解も合成低下も起こっていないことを示していた.以上の結果より,穴の拡大の過程では基底膜の移動により穴の拡大していることが明らかになった.
4.インテグリンとVAB-19が穴の大きさを決定している
線虫の子宮と陰門の形成がうまくいかないときにはしばしばRUP(rupture vulva phenotype)とよばれる表現型が観察される.線虫の遺伝子データベースであるWormBaseを用いてRNAiによりRUP表現型を示す約300個の遺伝子を選択した.さらに,穴の大きさの制御機構を明らかにするため,そこから細胞外タンパク質あるいは膜結合型タンパク質をコードする遺伝子を選び出した.
基底膜にできる穴の境界線は8細胞期にはD細胞(陰門細胞)とよばれる細胞に移動する.選び出した遺伝子の変異体において8細胞期に穴の境界線がD細胞にあるかどうかを観察した.その結果,ラミニン結合型インテグリンのαサブユニットをコードするina-1遺伝子の変異体では低い頻度で穴の大きさが破綻(穴が拡大)していることを見い出した.インテグリンはαサブユニットとβサブユニットとでヘテロ二量体を形成するが,線虫にはβサブユニットはPAT-3の1種類しかない.生体におけるインテグリンの局在を明らかにするため,PAT-3にGFPを融合させINA-1と共発現させることで,INA-1-PAT-3ヘテロ二量体の生体における局在を解析した.その結果,インテグリンは穴の境界線の付近の細胞(D細胞)に局在化していることが明らかになった.また,D細胞にドミナントネガティブ型のインテグリンを発現させると穴の大きさの異常が観察され,この結果はインテグリンがD細胞において穴の大きさを制御していることを示していた.
さらに,哺乳類のがん抑制遺伝子として知られるkank遺伝子の相同遺伝子であるvab-19遺伝子の変異体でも,低い頻度で穴の大きさが破綻(穴が拡大)していることを見い出した.そして,VAB-19もインテグリンと同様にD細胞に局在化していることを明らかにした.遺伝学的な手法を用いて解析した結果,ina-1遺伝子とvab-19遺伝子は同一の経路には存在しないという結果が示唆されたが,VAB-19による制御機構は不明であった(図3c).以上の結果は,陰門前駆細胞ではインテグリンとVAB-19をそれぞれ経由する並行した2つの経路が基底膜の境界線の位置を決定していることを示していた.
おわりに
基底膜は人工的には合成できないことから,その動態の解析はほとんど行われていない.今回,筆者らは,細胞浸潤において基底膜がどのように制御されているのか,その動態の解析を行った.この研究で用いた基底膜の可視化や蛍光タンパク質Dendraを用いた動態の解析などの技術は基底膜を理解するうえで必須になるものと考えている.さらに,驚くべきことに,基底膜の穴の拡大のときにはこれまでの予想とは異なり,基底膜の分解はほとんど起こらないことを見い出した.この研究によって明らかになった知見は,多細胞体の構築モデルを考察するにあたり興味深い知見となることを期待している.そして今後は,線虫のメリットを最大限に活かして,基底膜の穴の大きさの制御機構にさらにせまりたいと考えている.
文 献
- Sherwood, D. R. & Sternberg P. W.: Anchor cell invasion into the vulval epithelium in C. elegans. Dev. Cell, 5, 21-31 (2003)[PubMed]
- Sherwood, D. R., Butler, J. A., Kramer, J. M. et al.: FOS-1 promotes basement-membrane removal during anchor-cell invasion in C. elegans. Cell, 121, 951-962 (2005)[PubMed]
- Schoumacher, M., Louvard, D., Vignjevic, D. et al.: Cytoskeleton networks in basement membrane transmigration. Eur. J. Cell Biol., 90, 93-99 (2011)[PubMed]
- Ziel, J. W., Hagedorn, E. J., Audhya, A. et al.: UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11, 183-189 (2009)[PubMed]
- Hagedorn, E. J., Yashiro, H., Ziel, J. W. et al.: Integrin acts upstream of netrin signaling to regulate formation of the anchor cell's invasive membrane in C. elegans. Dev. Cell, 17, 187-198 (2009)[PubMed]
- Gurskaya, N. G., Verkhusha, V. V., Shcheglov, A. S. et al.: Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat. Biotechnol., 24, 461-465 (2006)[PubMed]
著者プロフィール
略歴:2003年 大阪大学大学院医学系研究科博士課程 修了,2004年 理化学研究所 基礎科学特別研究員,2008年 米国Duke大学 研究員を経て,2010年より国立遺伝学研究所 助教.
研究テーマ:多細胞体構築の制御機構の解析(非対称分裂や細胞浸潤).
抱負:焦らず,慌てず,おもしろいことをおもしろく研究していく.
David R. Sherwood
米国Duke大学Assistant Professor.
研究室URL:http://web.me.com/dsherwoo/Sherwood_Lab/Welcome.html
© 2011 伊原伸治・David R. Sherwood Licensed under CC 表示 2.1 日本