TGFβによるSmadに非依存性のTh17細胞の分化誘導は転写因子Eomesの抑制を介する
市山健司・吉村昭彦
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2011.089
Transcription factor Smad-independent T helper 17 cell induction by transforming-growth factor-β is mediated by suppression of eomesodermin.
Kenji Ichiyama, Takashi Sekiya, Naoko Inoue, Taiga Tamiya, Ikko Kashiwagi, Akihiro Kimura, Rimpei Morita, Go Muto, Takashi Shichita, Reiko Takahashi, Akihiko Yoshimura
Immunity, 34, 741-754 (2011)
Th17細胞は,近年,インターロイキン17を高産生する新たなエフェクターT細胞として報告され,自己免疫疾患や細菌感染防御などに重要な役割を担っていることが明らかになっている.ナイーブT細胞からTh17細胞への分化誘導にはインターロイキン6およびTGFβが必要であり,TGFβは転写因子Smadに非依存的に,Th17細胞のマスター遺伝子の産物であるRORγtの発現促進を介して,Th17細胞への分化を誘導することが知られている.しかしながら,TGFβがどのような分子機構によりRORγtの発現を誘導するのか,その詳細は不明であった.今回,筆者らは,T細胞に特異的にSmad2およびSmad3をノックアウトしたマウスを用いた解析から,転写因子EomesがTGFβにより,Smad経路を介さず,JNK-c-Jun経路を介して抑制されることを見い出した.さらに,EomesはそのTボックスドメインを介しRORγtおよびインターロイキン17Aの遺伝子プロモーターに直接に結合し,その転写活性を抑制することでTh17細胞の分化を負に制御することも明らかにした.この報告は,これまで知られていなかったTh17細胞の分化制御機構を示したものであり,自己免疫疾患に対する新規の治療法の開発のための基盤確立に大きく貢献する非常に意義のあるものと思われる.
免疫系の恒常性の維持には免疫の中枢とよばれるヘルパーT細胞が主要な役割をはたしている.ヘルパーT細胞は侵入した病原体の種類に応じてTh1細胞,Th2細胞,Th17細胞の3種類のいずれかのエフェクターT細胞に分化誘導され,その病原体の排除に最適な免疫応答を誘導する.これらヘルパーT細胞の分化および増幅はサイトカインの刺激により厳密に制御されており,また,その破綻がさまざまな疾患に直結する(図1).
インターロイキン17を高産生するTh17細胞は最近になり発見されたエフェクターT細胞で,関節炎リウマチや多発性硬化症,乾癬,炎症性腸疾患などの自己免疫疾患をひき起こす細胞として注目されている1,2).Th17細胞はTGFβ(transforming growth factor β,トランスフォーミング増殖因子β)およびインターロイキン6によりナイーブT細胞から分化誘導され,転写因子RORγtの遺伝子がそのマスター遺伝子として報告されている3).また,これまでの研究から,RORγtの発現はTGFβの刺激により誘導されることが明らかになっており,さらに,TGFβの主要な下流転写因子であるSmadをノックアウトしたT細胞においてもTGFβによりRORγtの発現が正常に誘導されることから,RORγtの発現誘導にはSmadに非依存的な分子機構が重要であることが示唆されている4,5).しかしながら,この分子機構が何であるかはこれまで不明であった.そこでこの研究では,T細胞に特異的に転写因子Smadをノックアウトしたマウスを作製し,TGFβによるSmadに非依存的なTh17細胞の分化制御機構の解明を試みた.
TGFβによりSmadに非依存的に制御されるタンパク質を同定するため,Smad2およびSmad3の両者をノックアウトしたT細胞を用いてマイクロアレイ解析を行った.その結果,これまで細胞傷害性T細胞(CD8陽性T細胞)の分化に重要であることが知られていた転写因子Eomesodermin(Eomes)の遺伝子がTGFβによりSmadに非依存性に転写抑制される遺伝子として同定された.ほかにもSmadに非依存的に転写が促進されたり抑制されたりする遺伝子は見い出されたが,Th17細胞の分化に影響する遺伝子はEomesの遺伝子のみであった.そこで,実際にEomesがTGFβによりSmadに非依存的に抑制されるかどうか確認したところ,Smad2およびSmad3をノックアウトしたT細胞においてTGFβを含む培養条件(Th17細胞の分化する条件)において,Eomesの発現はmRNAレベルおよびタンパク質レベルで顕著に減少した.このことから,EomesはT細胞においてTGFβによりSmadに非依存的に抑制されることが明らかになった.
T細胞においてSmad経路以外のどのようなシグナル伝達経路がEomesの発現を制御するのか検討を行った.TGFβにはSmad経路以外にいくつかのシグナル伝達経路が知られている6).そこで,それらの経路をそれぞれ阻害する阻害剤を用いてTGFβによるEomesの発現抑制に及ぼす影響を検討した結果,JNK阻害剤を用いた場合にTGFβによるEomesの発現抑制が解除されることを見い出した.また,JNK阻害剤の処理によりRORγtやインターロイキン17Aの発現も抑制された.そこで,JNKに焦点をしぼり,さらにレトロウイルスの系を用いたJNKの過剰発現実験およびshRNAを用いたノックダウン実験を行った.その結果,JNKを過剰発現したT細胞ではTGFβの非存在下でもEomesの発現が抑制され,RORγtおよびインターロイキン17Aの発現が増強した.一方,JNKをノックダウンしたT細胞ではEomesの発現が増強し,RORγtおよびインターロイキン17Aの発現は減少した.以上の結果から,TGFβはJNKを介してEomesの発現を抑制すること,また,JNK経路がTh17細胞への分化を正に制御することが示唆された.
JNKは転写因子c-Junを介して機能を発揮することが知られている.そこでつぎに,Eomesの発現に及ぼすc-Junの効果を検討した.その結果,c-JunはEomesの遺伝子プロモーターの活性を顕著に抑制し,また,活性化したT細胞におけるEomesの発現誘導をmRNAレベルおよびタンパク質レベルで強く抑制した.このことから,TGFβはJNK-c-Jun経路を介してEomesの発現を抑制することが明らかになった.
多発性硬化症のモデルマウスである実験的自己免疫性脳脊髄炎の病態にTh17細胞の関与することが知られている.そこで,JNK阻害剤の実験的自己免疫性脳脊髄炎に及ぼす効果を検討した.自己免疫性脳脊髄炎を誘導するため髄鞘構成糖タンパク質をマウスに免疫したのち,2日目から11日目まで,毎日0.5 mg/kgのJNK阻害剤をマウス腹腔内に投与した.その結果,JNK阻害剤は予想どおりTh17細胞の分化を抑制し,実験的自己免疫性脳脊髄炎の症状を著しく改善した.このことから,JNKは生体においてもTh17細胞の分化を制御していることが示唆された.
Th17細胞の分化に及ぼすEomesの影響を検討するため,レトロウイルスの系を用いてT細胞へのEomesの過剰発現実験を行った.その結果,Eomesの過剰発現によりRORγtおよびインターロイキン17Aの発現が抑制され,Th17細胞の分化が顕著に阻害された.また,逆にshRNAを用いT細胞においてEomesの発現をノックダウンしたところ,TGFβの非存在下でRORγtおよびインターロイキン17Aの発現は有意に増強した.したがって,EomesはTh17細胞の分化における負の制御タンパク質であり,TGFβはEomesの発現抑制を介してRORγtおよびインターロイキン17Aの発現を促進することでTh17細胞の分化を正に制御する可能性が示唆された.
Th17細胞の分化がインターフェロンγにより抑制されることは以前より知られている7).Eomesはインターフェロンγの産生に重要な役割を担っており,Eomesを発現した細胞はインターフェロンγ産生能を獲得する8).そこで,EomesによるTh17細胞の分化抑制がインターフェロンγの産生を介したものであるかどうか検討するため,インターフェロンγあるいはその主要な下流転写因子であるSTAT1をノックアウトしたマウスに由来するT細胞においてEomesの過剰発現実験を行った.その結果,インターフェロンγもしくはSTAT1をノックアウトしたT細胞においてもEomesはRORγtおよびインターロイキン17Aの発現をmRNAレベルおよびタンパク質レベルで顕著に抑制した.このことから,Eomesはインターフェロンγ-STAT1経路を介さずにTh17細胞の分化を抑制することが明らかになった.
EomesによるTh17細胞の分化抑制の詳細な分子機構を解明するため,EomesがRORγtおよびインターロイキン17Aの遺伝子プロモーターに及ぼす影響を検討した.その結果,EomesはRORγtおよびインターロイキン17Aの遺伝子プロモーターの近位領域に直接に結合し,その転写活性を濃度依存的に強く抑制することがわかった.一方,それぞれのプロモーターに存在するTボックス結合領域に変異を導入するとEomesによる転写活性抑制は完全に消失した.さらに,Tボックスドメインを欠失させたEomes変異体を作製したところ,それぞれのプロモーターへの結合が消失し,また,プロモーターの転写活性およびTh17細胞の分化を抑制することはできなくなった.以上の結果から,EomesはTボックスドメインを介してRORγtおよびインターロイキン17Aの遺伝子プロモーターのTボックス結合領域に直接に結合することで,転写活性を負に制御することが明らかになった.
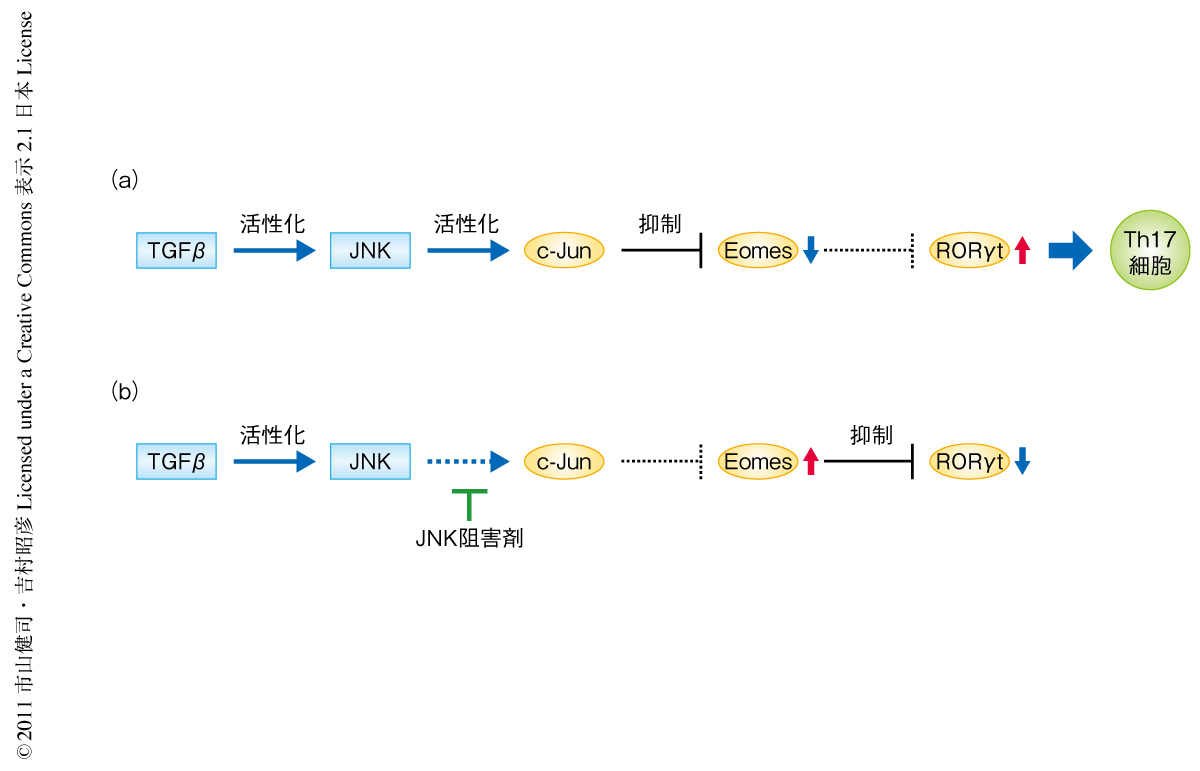
この研究により,TGFβ→JNK→c-Jun→Eomesの抑制→Th17細胞の分化誘導,というSmad経路に依存しない新規のTh17細胞の分化制御機構が明らかになった(図2).このことから,Eomesの発現やJNKの機能を調節することでさまざまな自己免疫疾患の制御が可能になると考えられる.しかしながら,EomesはRORγtの発現誘導を抑制する負の制御因子であり,RORγtを本当に誘導する本体はまだわかっていない.したがって,TGFβによるTh17細胞の分化誘導機構はまだその全容が解明されたわけではなく未知の部分が存在する.今後,さらなる解析が進み,TGFβによるTh17細胞の分化誘導機構の理解が深まることで,TGFβシグナルを標的とした自己免疫疾患などの新規の治療法の開発につながることが期待される.
略歴:2009年 九州大学大学院医学研究科博士課程 修了,同年 慶應義塾大学医学部 博士研究員を経て,2010年より米国Texas大学MD Anderson Cancer Center博士研究員.
研究テーマ:新規のTh17細胞の分化制御タンパク質の探索.
抱負:T細胞の研究を免疫疾患の新規な治療法の開発につなげたい.
吉村 昭彦(Akihiko Yoshimura)
慶応義塾大学医学部 教授.
研究室URL:http://new.immunoreg.jp/
© 2011 市山健司・吉村昭彦 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2011.089
Transcription factor Smad-independent T helper 17 cell induction by transforming-growth factor-β is mediated by suppression of eomesodermin.
Kenji Ichiyama, Takashi Sekiya, Naoko Inoue, Taiga Tamiya, Ikko Kashiwagi, Akihiro Kimura, Rimpei Morita, Go Muto, Takashi Shichita, Reiko Takahashi, Akihiko Yoshimura
Immunity, 34, 741-754 (2011)
要 約
Th17細胞は,近年,インターロイキン17を高産生する新たなエフェクターT細胞として報告され,自己免疫疾患や細菌感染防御などに重要な役割を担っていることが明らかになっている.ナイーブT細胞からTh17細胞への分化誘導にはインターロイキン6およびTGFβが必要であり,TGFβは転写因子Smadに非依存的に,Th17細胞のマスター遺伝子の産物であるRORγtの発現促進を介して,Th17細胞への分化を誘導することが知られている.しかしながら,TGFβがどのような分子機構によりRORγtの発現を誘導するのか,その詳細は不明であった.今回,筆者らは,T細胞に特異的にSmad2およびSmad3をノックアウトしたマウスを用いた解析から,転写因子EomesがTGFβにより,Smad経路を介さず,JNK-c-Jun経路を介して抑制されることを見い出した.さらに,EomesはそのTボックスドメインを介しRORγtおよびインターロイキン17Aの遺伝子プロモーターに直接に結合し,その転写活性を抑制することでTh17細胞の分化を負に制御することも明らかにした.この報告は,これまで知られていなかったTh17細胞の分化制御機構を示したものであり,自己免疫疾患に対する新規の治療法の開発のための基盤確立に大きく貢献する非常に意義のあるものと思われる.
はじめに
免疫系の恒常性の維持には免疫の中枢とよばれるヘルパーT細胞が主要な役割をはたしている.ヘルパーT細胞は侵入した病原体の種類に応じてTh1細胞,Th2細胞,Th17細胞の3種類のいずれかのエフェクターT細胞に分化誘導され,その病原体の排除に最適な免疫応答を誘導する.これらヘルパーT細胞の分化および増幅はサイトカインの刺激により厳密に制御されており,また,その破綻がさまざまな疾患に直結する(図1).
インターロイキン17を高産生するTh17細胞は最近になり発見されたエフェクターT細胞で,関節炎リウマチや多発性硬化症,乾癬,炎症性腸疾患などの自己免疫疾患をひき起こす細胞として注目されている1,2).Th17細胞はTGFβ(transforming growth factor β,トランスフォーミング増殖因子β)およびインターロイキン6によりナイーブT細胞から分化誘導され,転写因子RORγtの遺伝子がそのマスター遺伝子として報告されている3).また,これまでの研究から,RORγtの発現はTGFβの刺激により誘導されることが明らかになっており,さらに,TGFβの主要な下流転写因子であるSmadをノックアウトしたT細胞においてもTGFβによりRORγtの発現が正常に誘導されることから,RORγtの発現誘導にはSmadに非依存的な分子機構が重要であることが示唆されている4,5).しかしながら,この分子機構が何であるかはこれまで不明であった.そこでこの研究では,T細胞に特異的に転写因子Smadをノックアウトしたマウスを作製し,TGFβによるSmadに非依存的なTh17細胞の分化制御機構の解明を試みた.
1.転写因子EomesはTGFβによりSmadに非依存的に抑制される
TGFβによりSmadに非依存的に制御されるタンパク質を同定するため,Smad2およびSmad3の両者をノックアウトしたT細胞を用いてマイクロアレイ解析を行った.その結果,これまで細胞傷害性T細胞(CD8陽性T細胞)の分化に重要であることが知られていた転写因子Eomesodermin(Eomes)の遺伝子がTGFβによりSmadに非依存性に転写抑制される遺伝子として同定された.ほかにもSmadに非依存的に転写が促進されたり抑制されたりする遺伝子は見い出されたが,Th17細胞の分化に影響する遺伝子はEomesの遺伝子のみであった.そこで,実際にEomesがTGFβによりSmadに非依存的に抑制されるかどうか確認したところ,Smad2およびSmad3をノックアウトしたT細胞においてTGFβを含む培養条件(Th17細胞の分化する条件)において,Eomesの発現はmRNAレベルおよびタンパク質レベルで顕著に減少した.このことから,EomesはT細胞においてTGFβによりSmadに非依存的に抑制されることが明らかになった.
2.TGFβはJNK-c-Jun経路を介してEomesの発現を負に制御する
T細胞においてSmad経路以外のどのようなシグナル伝達経路がEomesの発現を制御するのか検討を行った.TGFβにはSmad経路以外にいくつかのシグナル伝達経路が知られている6).そこで,それらの経路をそれぞれ阻害する阻害剤を用いてTGFβによるEomesの発現抑制に及ぼす影響を検討した結果,JNK阻害剤を用いた場合にTGFβによるEomesの発現抑制が解除されることを見い出した.また,JNK阻害剤の処理によりRORγtやインターロイキン17Aの発現も抑制された.そこで,JNKに焦点をしぼり,さらにレトロウイルスの系を用いたJNKの過剰発現実験およびshRNAを用いたノックダウン実験を行った.その結果,JNKを過剰発現したT細胞ではTGFβの非存在下でもEomesの発現が抑制され,RORγtおよびインターロイキン17Aの発現が増強した.一方,JNKをノックダウンしたT細胞ではEomesの発現が増強し,RORγtおよびインターロイキン17Aの発現は減少した.以上の結果から,TGFβはJNKを介してEomesの発現を抑制すること,また,JNK経路がTh17細胞への分化を正に制御することが示唆された.
JNKは転写因子c-Junを介して機能を発揮することが知られている.そこでつぎに,Eomesの発現に及ぼすc-Junの効果を検討した.その結果,c-JunはEomesの遺伝子プロモーターの活性を顕著に抑制し,また,活性化したT細胞におけるEomesの発現誘導をmRNAレベルおよびタンパク質レベルで強く抑制した.このことから,TGFβはJNK-c-Jun経路を介してEomesの発現を抑制することが明らかになった.
3.JNK阻害剤は実験的自己免疫性脳脊髄炎の症状を改善する
多発性硬化症のモデルマウスである実験的自己免疫性脳脊髄炎の病態にTh17細胞の関与することが知られている.そこで,JNK阻害剤の実験的自己免疫性脳脊髄炎に及ぼす効果を検討した.自己免疫性脳脊髄炎を誘導するため髄鞘構成糖タンパク質をマウスに免疫したのち,2日目から11日目まで,毎日0.5 mg/kgのJNK阻害剤をマウス腹腔内に投与した.その結果,JNK阻害剤は予想どおりTh17細胞の分化を抑制し,実験的自己免疫性脳脊髄炎の症状を著しく改善した.このことから,JNKは生体においてもTh17細胞の分化を制御していることが示唆された.
4.EomesはTh17細胞の分化を負に制御する
Th17細胞の分化に及ぼすEomesの影響を検討するため,レトロウイルスの系を用いてT細胞へのEomesの過剰発現実験を行った.その結果,Eomesの過剰発現によりRORγtおよびインターロイキン17Aの発現が抑制され,Th17細胞の分化が顕著に阻害された.また,逆にshRNAを用いT細胞においてEomesの発現をノックダウンしたところ,TGFβの非存在下でRORγtおよびインターロイキン17Aの発現は有意に増強した.したがって,EomesはTh17細胞の分化における負の制御タンパク質であり,TGFβはEomesの発現抑制を介してRORγtおよびインターロイキン17Aの発現を促進することでTh17細胞の分化を正に制御する可能性が示唆された.
5.EomesによるTh17細胞の分化抑制はインターフェロンγ-STAT1経路を介さない
Th17細胞の分化がインターフェロンγにより抑制されることは以前より知られている7).Eomesはインターフェロンγの産生に重要な役割を担っており,Eomesを発現した細胞はインターフェロンγ産生能を獲得する8).そこで,EomesによるTh17細胞の分化抑制がインターフェロンγの産生を介したものであるかどうか検討するため,インターフェロンγあるいはその主要な下流転写因子であるSTAT1をノックアウトしたマウスに由来するT細胞においてEomesの過剰発現実験を行った.その結果,インターフェロンγもしくはSTAT1をノックアウトしたT細胞においてもEomesはRORγtおよびインターロイキン17Aの発現をmRNAレベルおよびタンパク質レベルで顕著に抑制した.このことから,Eomesはインターフェロンγ-STAT1経路を介さずにTh17細胞の分化を抑制することが明らかになった.
6.Eomesはプロモーターに直接に作用することでTh17細胞の分化を負に制御する
EomesによるTh17細胞の分化抑制の詳細な分子機構を解明するため,EomesがRORγtおよびインターロイキン17Aの遺伝子プロモーターに及ぼす影響を検討した.その結果,EomesはRORγtおよびインターロイキン17Aの遺伝子プロモーターの近位領域に直接に結合し,その転写活性を濃度依存的に強く抑制することがわかった.一方,それぞれのプロモーターに存在するTボックス結合領域に変異を導入するとEomesによる転写活性抑制は完全に消失した.さらに,Tボックスドメインを欠失させたEomes変異体を作製したところ,それぞれのプロモーターへの結合が消失し,また,プロモーターの転写活性およびTh17細胞の分化を抑制することはできなくなった.以上の結果から,EomesはTボックスドメインを介してRORγtおよびインターロイキン17Aの遺伝子プロモーターのTボックス結合領域に直接に結合することで,転写活性を負に制御することが明らかになった.
おわりに
この研究により,TGFβ→JNK→c-Jun→Eomesの抑制→Th17細胞の分化誘導,というSmad経路に依存しない新規のTh17細胞の分化制御機構が明らかになった(図2).このことから,Eomesの発現やJNKの機能を調節することでさまざまな自己免疫疾患の制御が可能になると考えられる.しかしながら,EomesはRORγtの発現誘導を抑制する負の制御因子であり,RORγtを本当に誘導する本体はまだわかっていない.したがって,TGFβによるTh17細胞の分化誘導機構はまだその全容が解明されたわけではなく未知の部分が存在する.今後,さらなる解析が進み,TGFβによるTh17細胞の分化誘導機構の理解が深まることで,TGFβシグナルを標的とした自己免疫疾患などの新規の治療法の開発につながることが期待される.
文 献
- Cua, D. J., Sherlock, J., Chen, Y. et al.: Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature, 421, 744-748 (2003)[PubMed]
- Park, H., Li, Z., Yang, X. O. et al.: A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat. Immunol., 6, 1133-1141 (2005)[PubMed]
- Ivanov, I. I., McKenzie, B. S., Zhou, L. et al.: The orphan nuclear receptor RORγt directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell, 126, 1121-1133 (2006)[PubMed]
- Yang, X. O., Nurieva, R., Martinez, G. J. et al.: Molecular antagonism and plasticity of regulatory and inflammatory T cell programs. Immunity, 29, 44-56 (2008)[PubMed]
- Takimoto, T., Wakabayashi, Y., Sekiya, T. et al.: Smad2 and Smad3 are redundantly essential for the TGF-β-mediated regulation of regulatory T plasticity and Th1 development. J. Immunol.. 185, 842-855 (2010)[PubMed]
- Yoshimura, A., Wakabayashi, Y. & Mori, T.: Cellular and molecular basis for the regulation of inflammation by TGF-β. J. Biochem., 147, 781-792 (2010)[PubMed]
- Wynn, T. A.: TH-17: a giant step from TH1 and TH2. Nat. Immunol., 6, 1069-1070 (2005)[PubMed]
- Yang, Y., Xu, J., Niu, Y. et al.: T-bet and eomesodermin play critical roles in directing T cell differentiation to Th1 versus Th17. J. Immunol., 181, 8700-8710 (2008)[PubMed]
著者プロフィール
略歴:2009年 九州大学大学院医学研究科博士課程 修了,同年 慶應義塾大学医学部 博士研究員を経て,2010年より米国Texas大学MD Anderson Cancer Center博士研究員.
研究テーマ:新規のTh17細胞の分化制御タンパク質の探索.
抱負:T細胞の研究を免疫疾患の新規な治療法の開発につなげたい.
吉村 昭彦(Akihiko Yoshimura)
慶応義塾大学医学部 教授.
研究室URL:http://new.immunoreg.jp/
© 2011 市山健司・吉村昭彦 Licensed under CC 表示 2.1 日本