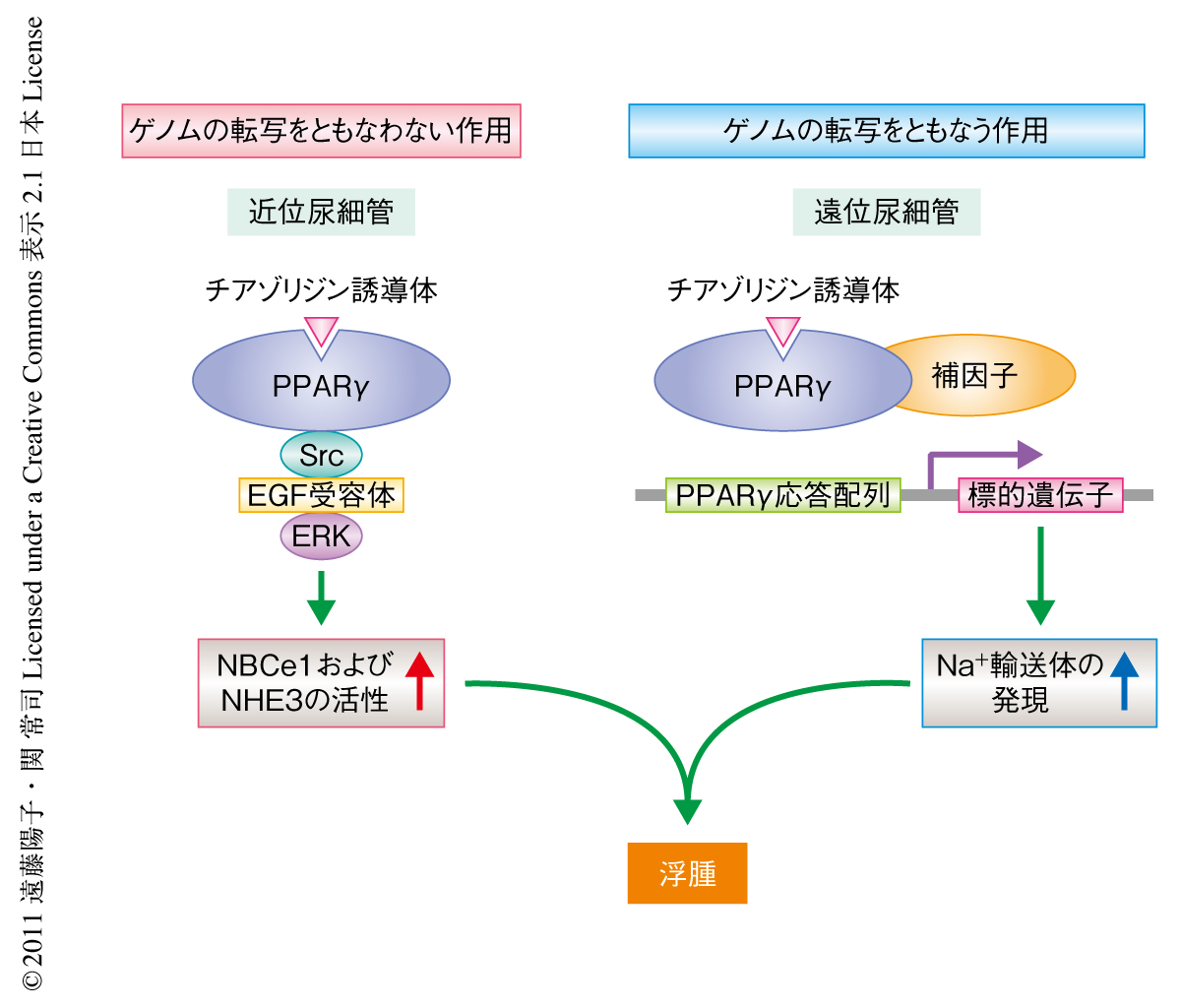
チアゾリジン誘導体はPPARγに依存するがその転写調節作用にはよらないシグナル伝達経路を介して近位尿細管における再吸収を亢進させる
遠藤陽子・関 常司
(東京大学大学院医学系研究科 腎臓内科学)
email:関 常司
DOI: 10.7875/first.author.2011.086
Thiazolidinediones enhance sodium-coupled bicarbonate absorption from renal proximal tubules via PPARγ-dependent nongenomic signaling.
Yoko Endo, Masashi Suzuki, Hideomi Yamada, Shoko Horita, Motoei Kunimi, Osamu Yamazaki, Ayumi Shirai, Motonobu Nakamura, Naoyuki Iso-O, Yuehong Li, Masumi Hara, Kazuhisa Tsukamoto, Nobuo Moriyama, Akihiko Kudo, Hayato Kawakami, Toshimasa Yamauchi, Naoto Kubota, Takashi Kadowaki, Haruki Kume, Yutaka Enomoto, Yukio Homma, George Seki, Toshiro Fujita
Cell Metabolism, 13, 550-561 (2011)
チアゾリジン誘導体は核内受容体PPARγを標的としたインスリン抵抗性の改善薬として2型糖尿病の治療に広く用いられているが,副作用として浮腫の出現が問題となっている.今回,筆者らは,腎臓の尿細管やマウス胎仔線維芽細胞などを用いた解析により,PPARγがその転写調節作用によらないシグナル伝達経路を介してSrc-EGF受容体-ERK経路を活性化すること,および,チアゾリジン誘導体がこの経路を介しラット,ウサギ,および,ヒトにおいて近位尿細管におけるNaHCO3の再吸収を著明に増加させることを見い出した.一方,マウスの近位尿細管では,恒常的に活性化しているSrc-EGF受容体経路がPPARγのゲノムの転写をともなわないシグナルを阻害するため,チアゾリジン誘導体の刺激作用を認めなかった.以上の結果より,チアゾリジン誘導体による浮腫の成因には種差があり,マウス以外の種ではPPARγに依存するがその転写調節作用にはよらないシグナル伝達経路による近位尿細管の再吸収への亢進作用も関与するものと考えられた.
ロシグリタゾンやピオグリタゾンなどのチアゾリジン誘導体は核内受容体PPARγ(peroxisome proliferator-activated receptor γ)を活性化することにより,インスリン抵抗性を改善し血糖を低下させるだけでなく,血圧の低下作用,血管内皮機能の改善作用などをもっている.しかし,チアゾリジン誘導体は腎臓からのNa+の貯留を介する血漿量の増加作用があるため浮腫を起こすことがあり,心不全では使用できない.
当初,マウスを用いた実験により,チアゾリジン誘導体による血漿量の増加にはPPARγを介した遠位尿細管上皮性Na+チャネル(ENaC)γサブユニットの発現増加が中心的な役割をはたしているものと考えられた1,2).しかし,そののちの研究ではENaCの関与についてはむしろ否定的な結果が多く3,4),遠位尿細管におけるチアゾリジン誘導体あるいはPPARγの標的となるNa+輸送体については結論がでていない.一方,チアゾリジン誘導体の近位尿細管への作用を示唆する報告もなされているため5),筆者らは,今回,近位尿細管におけるNa+輸送に対するチアゾリジン誘導体の作用について検討した.
近位尿細管におけるHCO3-の再吸収はNa+と共役しており,その本態は管腔側のNa+/H+交換輸送体NHE3および基底側のNa+-HCO3-共輸送体NBCe1の協調的なはたらきによる6).この研究では,まず,ウサギの近位尿細管を単離し蛍光色素を用いた細胞内pH測定法によりNHE3およびNBCe1の輸送活性に対するチアゾリジン誘導体の影響を検討した.さらには,microspectrofluorometric stop-flow法7) によるHCO3-の吸収量の測定も行った.生理的な濃度(0.03~0.3μM)のチアゾリジン誘導体は数分以内に管腔側のNHE3および基底側のNBCe1を活性化させ,また,Na+およびHCO3-の再吸収量も著明に増加させた.阻害剤による抑制実験や腎臓皮質のウェスタンブロット解析などにより,このチアゾリジン誘導体の輸送刺激作用はPPARγ,Src,EGF受容体,MEK/ERKに依存することが示された.また,免疫組織染色法による解析によりウサギの近位尿細管におけるPPARγのタンパク質レベルでの発現を確認した.
つぎに,チアゾリジン誘導体の近位尿細管における作用について種特異性の有無を検討した.ラットとヒトの近位尿細管はPPARγを発現しており,チアゾリジン誘導体によりNBCe1の活性は著明に亢進した.また,ラットの腎臓皮質を用いた解析により,チアゾリジン誘導体の近位尿細管における輸送亢進作用においてSrcがEGF受容体の上流に位置することが示された.一方,マウスの近位尿細管はPPARγを発現していたがチアゾリジン誘導体にはまったく反応しなかった.その原因を調べてみると,マウス近位尿細管におけるSrc-EGF受容体経路の恒常的な活性化8) がPPARγシグナルを阻害していることが判明した.
以上より,チアゾリジン誘導体はおそらくいままで知られていなかったPPARγに依存性のゲノムの転写をともなわないシグナル伝達経路を介して近位尿細管における輸送を亢進させること,および,この作用には種特異性のあることが示された.
チアゾリジン誘導体の近位尿細管における作用が体液の量にあたえる影響を検討するためラットを用いたin vivo実験を行った.水利尿を起こさせたラットにチアゾリジン誘導体(10 mg/kg)を投与したのち90分間のクリアランス実験を施行したところ,糸球体濾過量や血圧の変化をともなわずに,尿量,リチウム排泄率,自由水クリアランスが有意に低下した.これらの変化は炭酸脱水酵素阻害剤アセタゾラミドの投与により抑制されたため,近位尿細管における再吸収量の増加を反映しているものと考えられた.免疫組織染色法やウェスタンブロット法による解析により,チアゾリジン誘導体のin vivo投与によりラットの近位尿細管においてERKがリン酸化されることが確認された.一方,マウスでは単離した尿細管を用いたin vitro実験と同様に,チアゾリジン誘導体のin vivo投与によっても近位尿細管における再吸収量は変化しなかった.
PPARγに依存性のゲノムの転写をともなわないシグナル伝達経路の性質をさらに調べるため,PPARγノックアウトマウスの由来で唯一の生存細胞である胎仔線維芽細胞を用いた解析を行った.まず,細胞内アシドーシスによりERKを活性化させると,PPARγノックアウト胎仔線維芽細胞においても野生型と同じ程度にNHE1の活性が亢進することを確認した.一方,生理的な濃度のチアゾリジン誘導体(0.3μM)は野生型の胎仔線維芽細胞においては数分以内にNHE1の活性化とERKのリン酸化を生じさせたが,PPARγノックアウト胎仔線維芽細胞ではこれらの反応を認めなかった.また,野生型の胎仔線維芽細胞におけるチアゾリジン誘導体によるNHE1の活性化は転写阻害剤では阻害されないがPPARγ,EGF受容体,MEKの阻害剤では抑制されるため,近位尿細管と同様のゲノムの転写をともなわないシグナル伝達経路を介しているものと考えられた.一方,非生理的な高濃度のチアゾリジン誘導体(30μM)は,すでに報告したとおり9),NHE1の活性をPPARγに非依存的な機序を介し野生型およびPPARγノックアウト胎仔線維芽細胞において同じ程度に抑制した.
つぎに,PPARγノックアウト胎仔線維芽細胞にアデノウイルスベクターを用いて全長のPPARγを発現させたところ,チアゾリジン誘導体によるNHE1活性化反応とERKリン酸化反応が回復した.さらに,全長のPPARγからDNA結合ドメインを削除したリガンド結合ドメインのみをPPARγノックアウト胎仔線維芽細胞に発現させたところ,やはり,チアゾリジン誘導体によるNHE1活性化反応とERKリン酸化反応が回復した.しかし,この回復はリガンドとの結合を阻害する変異10) を挿入したリガンド結合ドメインの発現では生じなかった.一方,PPARγノックアウト胎仔線維芽細胞における脂肪分化反応は全長のPPARγの発現により回復したが,リガンド結合ドメインのみの発現では回復しなかった.
以上の結果から,PPARγのゲノムの転写をともなわないシグナルは,そのリガンド結合能には依存するが転写調節能には依存しないことが確認された.
ゲノムの転写をともなわないシグナル伝達経路を介したチアゾリジン誘導体の作用におけるSrcの役割を検討した.チアゾリジン誘導体によるNHE1活性化反応およびERKリン酸化反応はSrcを発現するマウス胎仔線維芽細胞では確認されたが,Srcノックアウト胎仔線維芽細胞では認めなかった.また,免疫沈降実験にてSrcとPPARγとが共沈し,チアゾリジン誘導体がこの結合を増強することが確認された.PPARγのリガンド結合ドメインを用いても同様の現象を認めたが,リガンドとの結合を阻害する変異を挿入したリガンド結合ドメインでは認めなかった.以上より,PPARγに依存性のゲノムの転写をともなわないシグナル伝達経路を介したチアゾリジン誘導体の作用はSrcに依存すること,および,このシグナル伝達経路にはチアゾリジン誘導体によるSrcとPPARγとの結合の増強が関与していることが示された.
この研究は,核内受容体PPARγがその転写調節作用にはよらないシグナル伝達経路を介してSrc-EGF受容体-ERK経路を活性化すること,および,チアゾリジン誘導体がこの経路を介して近位尿細管における再吸収を著明に増加させることを示した.チアゾリジン誘導体による浮腫は単一利尿剤による治療に対し抵抗性を示すことが知られている.チアゾリジン誘導体による浮腫には,PPARγの転写調節作用に依存しゲノムの転写をともなう遠位尿細管におけるNa+輸送体の発現の増強と,PPARγの転写調節作用には依存せずゲノムの転写をともなわない作用を介した近位尿細管におけるNa+再吸収の亢進の両方が関与するものと考えられた(図1).
チアゾリジン誘導体は浮腫を生じるだけでなく心血管系リスクを増大させる可能性も懸念されている11).従来の研究により,核内受容体であるエストロゲン受容体では,リガンド結合様式の微調整により転写調節作用と遺伝子の転写をともなわない作用とを分離することが可能であるとされている12).選択的なPPARγのモジュレーターもすでに開発されており動物での好成績も報告されているが,これらの臨床への導入が浮腫や心血管系副作用の軽減につながるかどうか,今後の重要な検討課題である.
略歴:2007年 東京大学大学院医学系研究科 修了,東京大学医学部附属病院 医員を経て,2011年より社会保険中央総合病院.
研究テーマ:腎臓の尿細管における輸送.
関 常司(George Seki)
東京大学大学院医学系研究科 講師.
© 2011 遠藤陽子・関 常司 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 腎臓内科学)
email:関 常司
DOI: 10.7875/first.author.2011.086
Thiazolidinediones enhance sodium-coupled bicarbonate absorption from renal proximal tubules via PPARγ-dependent nongenomic signaling.
Yoko Endo, Masashi Suzuki, Hideomi Yamada, Shoko Horita, Motoei Kunimi, Osamu Yamazaki, Ayumi Shirai, Motonobu Nakamura, Naoyuki Iso-O, Yuehong Li, Masumi Hara, Kazuhisa Tsukamoto, Nobuo Moriyama, Akihiko Kudo, Hayato Kawakami, Toshimasa Yamauchi, Naoto Kubota, Takashi Kadowaki, Haruki Kume, Yutaka Enomoto, Yukio Homma, George Seki, Toshiro Fujita
Cell Metabolism, 13, 550-561 (2011)
要 約
チアゾリジン誘導体は核内受容体PPARγを標的としたインスリン抵抗性の改善薬として2型糖尿病の治療に広く用いられているが,副作用として浮腫の出現が問題となっている.今回,筆者らは,腎臓の尿細管やマウス胎仔線維芽細胞などを用いた解析により,PPARγがその転写調節作用によらないシグナル伝達経路を介してSrc-EGF受容体-ERK経路を活性化すること,および,チアゾリジン誘導体がこの経路を介しラット,ウサギ,および,ヒトにおいて近位尿細管におけるNaHCO3の再吸収を著明に増加させることを見い出した.一方,マウスの近位尿細管では,恒常的に活性化しているSrc-EGF受容体経路がPPARγのゲノムの転写をともなわないシグナルを阻害するため,チアゾリジン誘導体の刺激作用を認めなかった.以上の結果より,チアゾリジン誘導体による浮腫の成因には種差があり,マウス以外の種ではPPARγに依存するがその転写調節作用にはよらないシグナル伝達経路による近位尿細管の再吸収への亢進作用も関与するものと考えられた.
はじめに
ロシグリタゾンやピオグリタゾンなどのチアゾリジン誘導体は核内受容体PPARγ(peroxisome proliferator-activated receptor γ)を活性化することにより,インスリン抵抗性を改善し血糖を低下させるだけでなく,血圧の低下作用,血管内皮機能の改善作用などをもっている.しかし,チアゾリジン誘導体は腎臓からのNa+の貯留を介する血漿量の増加作用があるため浮腫を起こすことがあり,心不全では使用できない.
当初,マウスを用いた実験により,チアゾリジン誘導体による血漿量の増加にはPPARγを介した遠位尿細管上皮性Na+チャネル(ENaC)γサブユニットの発現増加が中心的な役割をはたしているものと考えられた1,2).しかし,そののちの研究ではENaCの関与についてはむしろ否定的な結果が多く3,4),遠位尿細管におけるチアゾリジン誘導体あるいはPPARγの標的となるNa+輸送体については結論がでていない.一方,チアゾリジン誘導体の近位尿細管への作用を示唆する報告もなされているため5),筆者らは,今回,近位尿細管におけるNa+輸送に対するチアゾリジン誘導体の作用について検討した.
1.チアゾリジン誘導体の近位尿細管における輸送亢進作用と種特異性
近位尿細管におけるHCO3-の再吸収はNa+と共役しており,その本態は管腔側のNa+/H+交換輸送体NHE3および基底側のNa+-HCO3-共輸送体NBCe1の協調的なはたらきによる6).この研究では,まず,ウサギの近位尿細管を単離し蛍光色素を用いた細胞内pH測定法によりNHE3およびNBCe1の輸送活性に対するチアゾリジン誘導体の影響を検討した.さらには,microspectrofluorometric stop-flow法7) によるHCO3-の吸収量の測定も行った.生理的な濃度(0.03~0.3μM)のチアゾリジン誘導体は数分以内に管腔側のNHE3および基底側のNBCe1を活性化させ,また,Na+およびHCO3-の再吸収量も著明に増加させた.阻害剤による抑制実験や腎臓皮質のウェスタンブロット解析などにより,このチアゾリジン誘導体の輸送刺激作用はPPARγ,Src,EGF受容体,MEK/ERKに依存することが示された.また,免疫組織染色法による解析によりウサギの近位尿細管におけるPPARγのタンパク質レベルでの発現を確認した.
つぎに,チアゾリジン誘導体の近位尿細管における作用について種特異性の有無を検討した.ラットとヒトの近位尿細管はPPARγを発現しており,チアゾリジン誘導体によりNBCe1の活性は著明に亢進した.また,ラットの腎臓皮質を用いた解析により,チアゾリジン誘導体の近位尿細管における輸送亢進作用においてSrcがEGF受容体の上流に位置することが示された.一方,マウスの近位尿細管はPPARγを発現していたがチアゾリジン誘導体にはまったく反応しなかった.その原因を調べてみると,マウス近位尿細管におけるSrc-EGF受容体経路の恒常的な活性化8) がPPARγシグナルを阻害していることが判明した.
以上より,チアゾリジン誘導体はおそらくいままで知られていなかったPPARγに依存性のゲノムの転写をともなわないシグナル伝達経路を介して近位尿細管における輸送を亢進させること,および,この作用には種特異性のあることが示された.
2.チアゾリジン誘導体のin vivoでの急性効果
チアゾリジン誘導体の近位尿細管における作用が体液の量にあたえる影響を検討するためラットを用いたin vivo実験を行った.水利尿を起こさせたラットにチアゾリジン誘導体(10 mg/kg)を投与したのち90分間のクリアランス実験を施行したところ,糸球体濾過量や血圧の変化をともなわずに,尿量,リチウム排泄率,自由水クリアランスが有意に低下した.これらの変化は炭酸脱水酵素阻害剤アセタゾラミドの投与により抑制されたため,近位尿細管における再吸収量の増加を反映しているものと考えられた.免疫組織染色法やウェスタンブロット法による解析により,チアゾリジン誘導体のin vivo投与によりラットの近位尿細管においてERKがリン酸化されることが確認された.一方,マウスでは単離した尿細管を用いたin vitro実験と同様に,チアゾリジン誘導体のin vivo投与によっても近位尿細管における再吸収量は変化しなかった.
3.マウス胎仔線維芽細胞におけるPPARγに依存するNHE1活性化の機構
PPARγに依存性のゲノムの転写をともなわないシグナル伝達経路の性質をさらに調べるため,PPARγノックアウトマウスの由来で唯一の生存細胞である胎仔線維芽細胞を用いた解析を行った.まず,細胞内アシドーシスによりERKを活性化させると,PPARγノックアウト胎仔線維芽細胞においても野生型と同じ程度にNHE1の活性が亢進することを確認した.一方,生理的な濃度のチアゾリジン誘導体(0.3μM)は野生型の胎仔線維芽細胞においては数分以内にNHE1の活性化とERKのリン酸化を生じさせたが,PPARγノックアウト胎仔線維芽細胞ではこれらの反応を認めなかった.また,野生型の胎仔線維芽細胞におけるチアゾリジン誘導体によるNHE1の活性化は転写阻害剤では阻害されないがPPARγ,EGF受容体,MEKの阻害剤では抑制されるため,近位尿細管と同様のゲノムの転写をともなわないシグナル伝達経路を介しているものと考えられた.一方,非生理的な高濃度のチアゾリジン誘導体(30μM)は,すでに報告したとおり9),NHE1の活性をPPARγに非依存的な機序を介し野生型およびPPARγノックアウト胎仔線維芽細胞において同じ程度に抑制した.
つぎに,PPARγノックアウト胎仔線維芽細胞にアデノウイルスベクターを用いて全長のPPARγを発現させたところ,チアゾリジン誘導体によるNHE1活性化反応とERKリン酸化反応が回復した.さらに,全長のPPARγからDNA結合ドメインを削除したリガンド結合ドメインのみをPPARγノックアウト胎仔線維芽細胞に発現させたところ,やはり,チアゾリジン誘導体によるNHE1活性化反応とERKリン酸化反応が回復した.しかし,この回復はリガンドとの結合を阻害する変異10) を挿入したリガンド結合ドメインの発現では生じなかった.一方,PPARγノックアウト胎仔線維芽細胞における脂肪分化反応は全長のPPARγの発現により回復したが,リガンド結合ドメインのみの発現では回復しなかった.
以上の結果から,PPARγのゲノムの転写をともなわないシグナルは,そのリガンド結合能には依存するが転写調節能には依存しないことが確認された.
4.PPARγに依存性のゲノムの転写をともなわないシグナル伝達経路におけるSrcの役割
ゲノムの転写をともなわないシグナル伝達経路を介したチアゾリジン誘導体の作用におけるSrcの役割を検討した.チアゾリジン誘導体によるNHE1活性化反応およびERKリン酸化反応はSrcを発現するマウス胎仔線維芽細胞では確認されたが,Srcノックアウト胎仔線維芽細胞では認めなかった.また,免疫沈降実験にてSrcとPPARγとが共沈し,チアゾリジン誘導体がこの結合を増強することが確認された.PPARγのリガンド結合ドメインを用いても同様の現象を認めたが,リガンドとの結合を阻害する変異を挿入したリガンド結合ドメインでは認めなかった.以上より,PPARγに依存性のゲノムの転写をともなわないシグナル伝達経路を介したチアゾリジン誘導体の作用はSrcに依存すること,および,このシグナル伝達経路にはチアゾリジン誘導体によるSrcとPPARγとの結合の増強が関与していることが示された.
おわりに
この研究は,核内受容体PPARγがその転写調節作用にはよらないシグナル伝達経路を介してSrc-EGF受容体-ERK経路を活性化すること,および,チアゾリジン誘導体がこの経路を介して近位尿細管における再吸収を著明に増加させることを示した.チアゾリジン誘導体による浮腫は単一利尿剤による治療に対し抵抗性を示すことが知られている.チアゾリジン誘導体による浮腫には,PPARγの転写調節作用に依存しゲノムの転写をともなう遠位尿細管におけるNa+輸送体の発現の増強と,PPARγの転写調節作用には依存せずゲノムの転写をともなわない作用を介した近位尿細管におけるNa+再吸収の亢進の両方が関与するものと考えられた(図1).
チアゾリジン誘導体は浮腫を生じるだけでなく心血管系リスクを増大させる可能性も懸念されている11).従来の研究により,核内受容体であるエストロゲン受容体では,リガンド結合様式の微調整により転写調節作用と遺伝子の転写をともなわない作用とを分離することが可能であるとされている12).選択的なPPARγのモジュレーターもすでに開発されており動物での好成績も報告されているが,これらの臨床への導入が浮腫や心血管系副作用の軽減につながるかどうか,今後の重要な検討課題である.
文 献
- Guan, Y., Hao, C., Cha, D. R. et al.: Thiazolidinediones expand body fluid volume through PPARγ stimulation of ENaC-mediated renal salt absorption. Nat. Med., 11, 861-866 (2005)[PubMed]
- Zhang, H., Zhang, A., Kohan, D. E. et al.: Collecting duct-specific deletion of peroxisome proliferator-activated receptor γ blocks thiazolidinedione-induced fluid retention. Proc. Natl. Acad. Sci. USA, 102, 9406-9411 (2005)[PubMed]
- Nofziger, C., Chen, L., Shane, M. A. et al.: PPARγ agonists do not directly enhance basal or insulin-stimulated Na+ transport via the epithelial Na+ channel. Pflugers Arch., 451, 445-453 (2005)[PubMed]
- Vallon, V., Hummler, E., Rieg, T. et al.: Thiazolidinedione-induced fluid retention is independent of collecting duct αENaC activity. J. Am. Soc. Nephrol., 20, 721-729 (2009)[PubMed]
- Muto, S., Miyata, Y., Imai, M. et al.: Troglitazone stimulates basolateral rheogenic Na+/HCO3- cotransport activity in rabbit proximal straight tubules. Exp. Nephrol., 9, 191-197 (2001)[PubMed]
- Li, Y., Yamada, H., Kita, Y. et al.: Roles of ERK and cPLA2 in the angiotensin II-mediated biphasic regulation of Na+-HCO3- transport. J. Am. Soc. Nephrol., 19, 252-259 (2008)[PubMed]
- Muller-Berger, S., Samarzija, I., Kunimi, M. et al.: A stop-flow microperfusion technique for rapid determination of HCO3- absorption/H+ secretion by isolated renal tubules. Pflugers Arch., 439, 208-215 (1999)[PubMed]
- Kiley, S. C. & Chevalier, R. L.: Species differences in renal Src activity direct EGF receptor regulation in life or death response to EGF. Am. J. Physiol. Renal Physiol., 293, F895-F903 (2007)[PubMed]
- Oliver, R., 3rd, Friday, E., Turturro, F. et al.: Troglitazone's rapid and sustained activation of ERK1/2 induces cellular acidosis in LLC-PK1-F+ cells: physiological responses. Am. J. Physiol. Renal Physiol., 288, F1257-F1266 (2005)[PubMed]
- Sarraf, P., Mueller, E., Smith, W. M. et al.: Loss-of-function mutations in PPARγ associated with human colon cancer. Mol. Cell, 3, 799-804 (1999)[PubMed]
- Nissen, S. E. & Wolski, K.: Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N. Engl. J. Med., 356, 2457-2471 (2007)[PubMed]
- Kousteni, S., Bellido, T., Plotkin, L. I. et al.: Nongenotropic, sex-nonspecific signaling through the estrogen or androgen receptors: dissociation from transcriptional activity. Cell, 104, 719-730 (2001)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院医学系研究科 修了,東京大学医学部附属病院 医員を経て,2011年より社会保険中央総合病院.
研究テーマ:腎臓の尿細管における輸送.
関 常司(George Seki)
東京大学大学院医学系研究科 講師.
© 2011 遠藤陽子・関 常司 Licensed under CC 表示 2.1 日本