アルギニン残基の非対称性のジメチル化は転写因子DAF-16の機能制御を介して線虫C. elegansの寿命を決定する
高橋悠太・深水昭吉
(筑波大学生命領域学際研究センター)
email:深水昭吉
DOI: 10.7875/first.author.2011.085
Asymmetric arginine dimethylation determines life span in C. elegans by regulating forkhead transcription factor DAF-16.
Yuta Takahashi, Hiroaki Daitoku, Keiko Hirota, Hiroko Tamiya, Atsuko Yokoyama, Koichiro Kako, Yusuke Nagashima, Ayumi Nakamura, Takashi Shimada, Satoshi Watanabe, Kazuyuki Yamagata, Kayo Yasuda, Naoaki Ishii, Akiyoshi Fukamizu
Cell Metabolism, 13, 505-516 (2011)
アルギニン残基のメチル化はタンパク質アルギニンメチルトランスフェラーゼにより触媒される翻訳後修飾である.この酵素はこれまで,細胞におけるさまざまな機構にかかわっていることが明らかにされてきたが,その生体における役割についてはあまりわかっていなかった.この論文において筆者らは,タンパク質アルギニンメチルトランスフェラーゼのひとつPRMT-1が線虫Caenorhabditis elegansの寿命の延長に寄与していることを解明した.寿命を指標にした遺伝学的な解析によりPRMT-1がその酵素活性および転写因子DAF-16に依存的に寿命を制御していることが明らかになった.また,生化学的な解析から,DAF-16においてPRMT-1によるアルギニンメチル化がAKTによるリン酸化を阻害すること,その結果,DAF-16の転写活性化能が亢進することを見い出した.
アルギニン残基のメチル化はそのグアニジル基の窒素原子にS-アデノシルメチオニンからメチル基の供与される反応であり,タンパク質アルギニンメチルトランスフェラーゼ(protein arginine methyltransferases:PRMT)により触媒される.哺乳類においては9つのタンパク質アルギニンメチルトランスフェラーゼが同定されており,その最終産物の違いから2つのタイプに分けられている.両方のタイプともモノメチル化を触媒できるが,そのあと,I型(PRMT-1,PRMT-2,PRMT-3,PRMT-4,PRMT-6,PRMT-8)は非対称性ジメチル化を触媒し,一方,II型(PRMT-5,PRMT-7,FBOX11)は対称性ジメチル化を触媒する.近年,アルギニンメチル化により機能制御をうける多数のタンパク質が報告されており,タンパク質アルギニンメチルトランスフェラーゼはシグナル伝達,転写制御,および,DNA修復といった細胞における重要な機構に関与していることが明らかになっている1).さらに,筆者らは先行研究において,PRMT-1が転写因子FOXO1をそのメチル化により制御し哺乳類培養細胞の酸化ストレス応答に寄与していることを見い出しており2),培養細胞レベルでのPRMT-1の機能の理解が進んでいる.しかしながら,個体レベルでのPRMT-1の機能については,ノックアウトマウスが発生段階で致死になること3) などを理由に未解明な部分が多い.
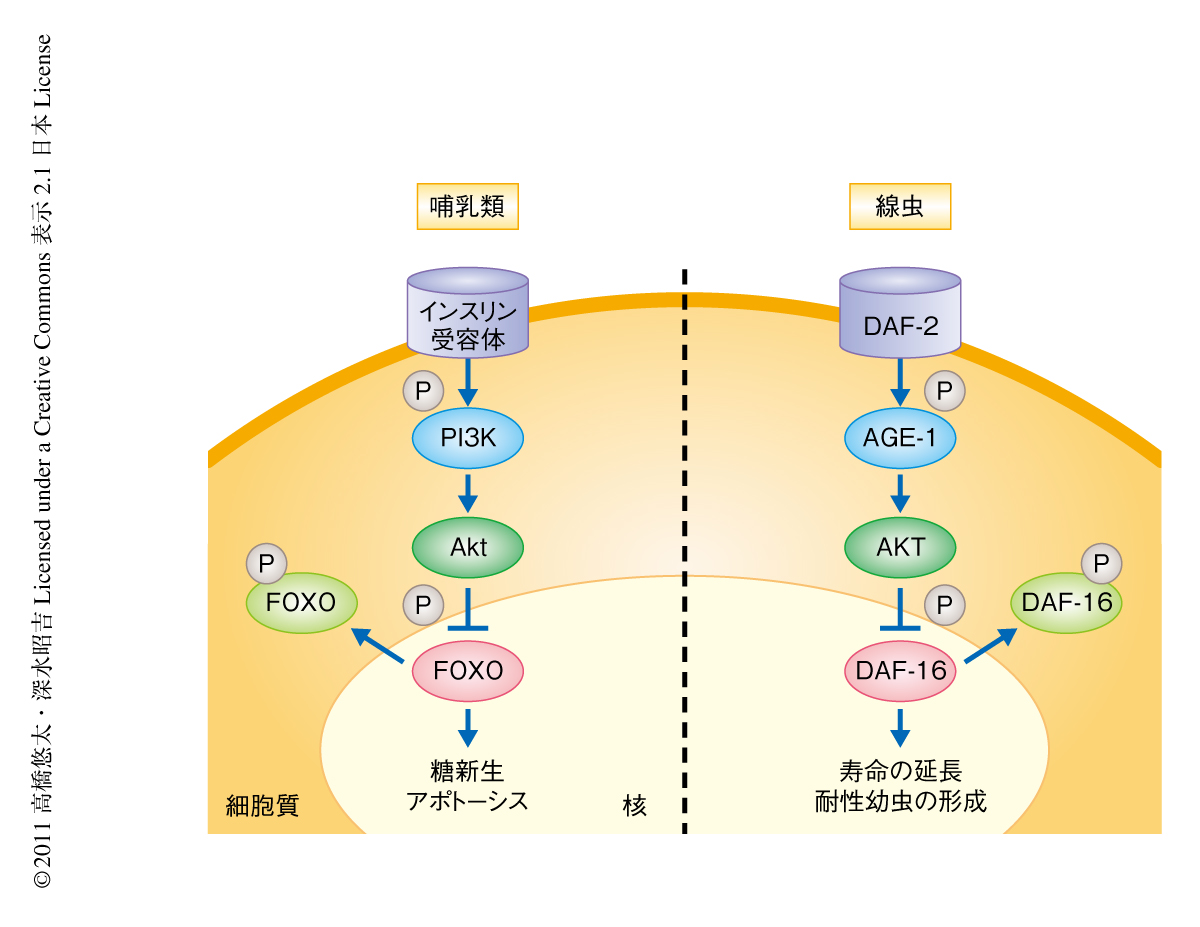
インスリン/IGF-1シグナル伝達経路(図1)は多くの生物種において寿命を制御していることが知られている.まず,線虫Caenorhabditis elegans(C. elegans)において,インスリン受容体のオルソログDAF-2の機能欠損変異体が野生型に比べ2倍以上の長寿命を示すことが報告された4).また,daf-2遺伝子とdaf-16遺伝子との二重変異体は野生型と同じ程度の寿命を示したことからdaf-2変異体の長寿命には転写因子DAF-16が必要であることが明らかになった.くわえて,DAF-2の下流のシグナル伝達タンパク質であるAKTが直接にDAF-16をリン酸化すること,それによりDAF-16は核外に移行しその転写活性化能が抑制されることが解明された5,6).これまでの研究により,DAF-16による標的遺伝子の転写活性化が線虫の長寿命をもたらすものと考えられており,近年の研究においては,DAF-16の機能を調節するさまざまな翻訳後修飾と寿命調節との関係がとくに着目されている.
この研究において筆者らは,線虫における主要なI型タンパク質アルギニンメチルトランスフェラーゼであるPRMT-1が寿命の延長に寄与していることを示した.PRMT-1はDAF-16に依存的に線虫の寿命を正に制御した.また,DAF-16においてAKTによるリン酸化のコンセンサス配列に存在するアルギニン残基をPRMT-1はメチル化し,それによりAKTによるリン酸化をブロックした.PRMT-1が触媒するメチル化とAKTによるリン酸化との修飾間クロストークがDAF-16の機能を制御し線虫の寿命を決定していることが示された.
PRMT-1の生理的な機能を解明するため,遺伝学的な解析を行ううえですぐれたモデル生物である線虫C. elegansを用いた.まず,線虫のオルソログであると予想されるprmt-1遺伝子をクローニングしたのち,PRMT-1とGSTとの融合タンパク質を作製しin vitroにおけるその酵素活性を検討した.その結果,線虫PRMT-1は哺乳類PRMT-1と同様にモノメチル化と非対称性ジメチル化とを触媒するI型タンパク質アルギニンメチルトランスフェラーゼであることがわかった.つぎに,野生型とprmt-1欠損変異体を用いてin vivoでのPRMT-1の活性を解析した.線虫からタンパク質を抽出し,それらの加水分解産物をHPLCに供して非対称性ジメチル化の量を測定した結果,野生型においては非対称性ジメチル化が検出されるのに対しprmt-1欠損変異体では検出されなかった.さらに,prmt-1欠損変異体にprmt-1遺伝子を導入したトランスジェニック線虫において非対称性ジメチル化の量が野生型と同じ程度にまでレスキューされた.これらの結果から,PRMT-1が線虫における主要なI型タンパク質アルギニンメチルトランスフェラーゼであることが明らかになった.
マウスやショウジョウバエのprmt-1欠損変異体は発生の過程で致死となるが,線虫のprmt-1欠損変異体は発生および成長の段階における顕著な異常を示さなかった.そこで,さらに線虫prmt-1欠損変異体の寿命に着目し検討を行った.その結果,prmt-1欠損変異体の寿命が野生型に比べ有意に短いことが明らかになった.また,prmt-1欠損変異体に野生型のprmt-1遺伝子を導入したトランスジェニック線虫の寿命は野生型と同じ程度にまでにレスキューされたが,メチル基転移活性を欠くPRMT-1変異体の遺伝子を導入したprmt-1欠損変異体は短寿命のままであった.これらの結果から,PRMT-1はそのメチル基転移活性に依存的に線虫の寿命を制御していることが示された.
線虫の寿命はインスリン/IGF-1シグナル伝達経路により制御されていることがよく知られている.PRMT-1がこのインスリン/IGF-1シグナル伝達経路を介して寿命を制御しているのかどうかを検討するため,インスリン受容体のオルソログをコードするdaf-2遺伝子とprmt-1遺伝子との二重変異体を作製しその寿命を解析した.その結果,prmt-1遺伝子の欠損はdaf-2変異体の長寿命を抑制した.また,daf-16欠損変異体に対してprmt-1遺伝子を欠損させても野生型と異なり寿命の短縮はみられなかった.一方で,PRMT-1の過剰発現はDAF-16を過剰発現するトランスジェニック線虫の寿命を有意に延長させた.これらの結果は,PRMT-1がDAF-16の上流において寿命を制御していることを示していた.
つぎに,PRMT-1の線虫における発現組織を検討するため,prmt-1遺伝子のプロモーター領域にGFPの遺伝子をつないだレポーターコンストラクトを作製し線虫に導入した.その結果,咽頭や体壁筋,腸といった組織においてPRMT-1の発現が示唆された.DAF-16による寿命制御には腸における発現が重要であることが報告されているため7),PRMT-1とDAF-16とが腸において共発現していることを示すこの結果は,PRMT-1が直接にDAF-16の機能制御を行う可能性を支持するものであった.そこで,GST-PRMT-1融合タンパク質とDAF-16を過剰発現するトランスジェニック線虫から得た抽出液を用いてGSTプルダウンアッセイを行ったところ,in vitroにおいてこの2つのタンパク質の結合することがわかった.さらに,PRMT-1によるDAF-16のアルギニンメチル化を検討したところ,in vitroにおいてDAF-16のアルギニン残基はPRMT-1により強くメチル化されることが明らかになった.
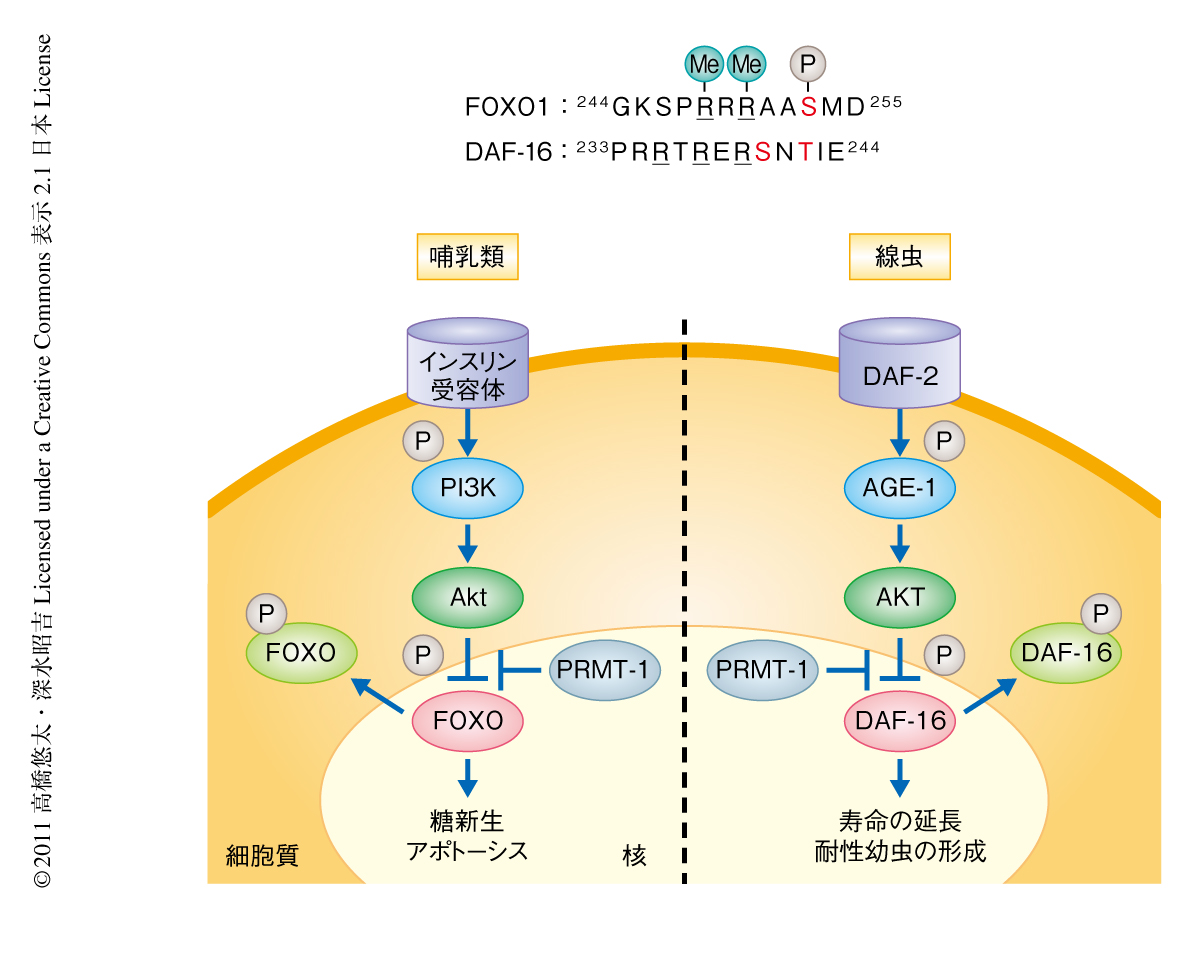
つづいて,DAF-16のメチル化部位の同定を試みた.DAF-16の哺乳類オルソログFOXO1はAKTによるリン酸化のコンセンサス配列にある248番目と250番目のアルギニン残基にPRMT-1によるメチル化をうけることが報告されている2)(図2).それらに相同するアルギニン残基をメチル化部位として着目し,235番目,237番目,239番目のアルギニン残基をリジン残基に置換したDAF-16変異体を作製した.それを基質としてin vitroメチル化アッセイを行った結果,この変異体のPRMT-1によるアルギニンメチル化が野生型DAF-16に比べ顕著に減弱したことから,DAF-16においてAKTによるリン酸化のコンセンサス配列にあるアルギニン残基がPRMT-1によりメチル化されることが示唆された.
DAF-16のアルギニンメチル化部位はAKTによるリン酸化のコンセンサス配列に存在しリン酸化部位(242番目のスレオニン残基)に近接している.そこで,アルギニンメチル化がAKTによるリン酸化に対し影響をあたえるかどうかを検討するため,これらの部位を含む15アミノ酸からなるDAF-16ペプチドを用いてin vitroリン酸化アッセイを行った.その結果,アルギニン残基の修飾されていないペプチドはAKTにより強くリン酸化されたのに対し,あらかじめアルギニン残基をメチル化修飾しておいたペプチドはAKTによるリン酸化をほとんどうけなかった.さらに,線虫の生体内においてもPRMT-1によるDAF-16のメチル化がAKTに依存的なリン酸化を阻害するかについて抗DAF-16リン酸化抗体を用いて検討した.その結果,prmt-1欠損変異体においては野生型に比べDAF-16のリン酸化の亢進がみられた.以上,PRMT-1の触媒するアルギニンメチル化はAKTによるDAF-16のリン酸化を阻害することが明らかになった.
DAF-16による転写活性化と長寿命との関係はよく研究されている8).最後に,PRMT-1がDAF-16の転写活性化能を制御しうるかどうかを検討した.野生型とprmt-1欠損変異体におけるDAF-16標的遺伝子のmRNA量を解析した結果,prmt-1欠損変異体においてsod-3遺伝子やmtl-1遺伝子といったDAF-16標的遺伝子の発現量が減弱していた.さらに,AKTによるリン酸化部位である242番目のスレオニン残基をアラニン残基に置換したDAF-16変異体の遺伝子をdaf-16変異体に導入したトランスジェニック線虫においては,prmt-1遺伝子を欠損させてもDAF-16標的遺伝子の発現量は低下しなかった.これらの結果より,PRMT-1がDAF-16の242番目のスレオニン残基のリン酸化の制御を介してDAF-16の転写活性化能を亢進させていることが示唆された.
この研究により,PRMT-1が線虫の寿命調節タンパク質としてはたらくことが明らかになった.PRMT-1は酵素活性に依存的かつDAF-16に依存的に線虫の寿命延長に寄与していることが見い出された.また,PRMT-1によるアルギニンメチル化がAKTによるDAF-16のリン酸化を阻害し,それによりDAF-16の転写活性化能の亢進をひき起こして寿命制御関連遺伝子の発現を上昇させていることが示された.この論文は,アルギニンメチル化が線虫においてアンチエイジング修飾として機能することを提示した.
略歴:2011年 筑波大学大学院生命環境科学研究科博士課程 修了,同年より日本学術振興会 特別研究員.
研究テーマ:寿命制御機構の解明.
深水 昭吉(Akiyoshi Fukamizu)
筑波大学生命領域学際研究センター 教授.
研究室URL:http://akif2.tara.tsukuba.ac.jp/
© 2011 高橋悠太・深水昭吉 Licensed under CC 表示 2.1 日本
(筑波大学生命領域学際研究センター)
email:深水昭吉
DOI: 10.7875/first.author.2011.085
Asymmetric arginine dimethylation determines life span in C. elegans by regulating forkhead transcription factor DAF-16.
Yuta Takahashi, Hiroaki Daitoku, Keiko Hirota, Hiroko Tamiya, Atsuko Yokoyama, Koichiro Kako, Yusuke Nagashima, Ayumi Nakamura, Takashi Shimada, Satoshi Watanabe, Kazuyuki Yamagata, Kayo Yasuda, Naoaki Ishii, Akiyoshi Fukamizu
Cell Metabolism, 13, 505-516 (2011)
要 約
アルギニン残基のメチル化はタンパク質アルギニンメチルトランスフェラーゼにより触媒される翻訳後修飾である.この酵素はこれまで,細胞におけるさまざまな機構にかかわっていることが明らかにされてきたが,その生体における役割についてはあまりわかっていなかった.この論文において筆者らは,タンパク質アルギニンメチルトランスフェラーゼのひとつPRMT-1が線虫Caenorhabditis elegansの寿命の延長に寄与していることを解明した.寿命を指標にした遺伝学的な解析によりPRMT-1がその酵素活性および転写因子DAF-16に依存的に寿命を制御していることが明らかになった.また,生化学的な解析から,DAF-16においてPRMT-1によるアルギニンメチル化がAKTによるリン酸化を阻害すること,その結果,DAF-16の転写活性化能が亢進することを見い出した.
はじめに
アルギニン残基のメチル化はそのグアニジル基の窒素原子にS-アデノシルメチオニンからメチル基の供与される反応であり,タンパク質アルギニンメチルトランスフェラーゼ(protein arginine methyltransferases:PRMT)により触媒される.哺乳類においては9つのタンパク質アルギニンメチルトランスフェラーゼが同定されており,その最終産物の違いから2つのタイプに分けられている.両方のタイプともモノメチル化を触媒できるが,そのあと,I型(PRMT-1,PRMT-2,PRMT-3,PRMT-4,PRMT-6,PRMT-8)は非対称性ジメチル化を触媒し,一方,II型(PRMT-5,PRMT-7,FBOX11)は対称性ジメチル化を触媒する.近年,アルギニンメチル化により機能制御をうける多数のタンパク質が報告されており,タンパク質アルギニンメチルトランスフェラーゼはシグナル伝達,転写制御,および,DNA修復といった細胞における重要な機構に関与していることが明らかになっている1).さらに,筆者らは先行研究において,PRMT-1が転写因子FOXO1をそのメチル化により制御し哺乳類培養細胞の酸化ストレス応答に寄与していることを見い出しており2),培養細胞レベルでのPRMT-1の機能の理解が進んでいる.しかしながら,個体レベルでのPRMT-1の機能については,ノックアウトマウスが発生段階で致死になること3) などを理由に未解明な部分が多い.
インスリン/IGF-1シグナル伝達経路(図1)は多くの生物種において寿命を制御していることが知られている.まず,線虫Caenorhabditis elegans(C. elegans)において,インスリン受容体のオルソログDAF-2の機能欠損変異体が野生型に比べ2倍以上の長寿命を示すことが報告された4).また,daf-2遺伝子とdaf-16遺伝子との二重変異体は野生型と同じ程度の寿命を示したことからdaf-2変異体の長寿命には転写因子DAF-16が必要であることが明らかになった.くわえて,DAF-2の下流のシグナル伝達タンパク質であるAKTが直接にDAF-16をリン酸化すること,それによりDAF-16は核外に移行しその転写活性化能が抑制されることが解明された5,6).これまでの研究により,DAF-16による標的遺伝子の転写活性化が線虫の長寿命をもたらすものと考えられており,近年の研究においては,DAF-16の機能を調節するさまざまな翻訳後修飾と寿命調節との関係がとくに着目されている.
この研究において筆者らは,線虫における主要なI型タンパク質アルギニンメチルトランスフェラーゼであるPRMT-1が寿命の延長に寄与していることを示した.PRMT-1はDAF-16に依存的に線虫の寿命を正に制御した.また,DAF-16においてAKTによるリン酸化のコンセンサス配列に存在するアルギニン残基をPRMT-1はメチル化し,それによりAKTによるリン酸化をブロックした.PRMT-1が触媒するメチル化とAKTによるリン酸化との修飾間クロストークがDAF-16の機能を制御し線虫の寿命を決定していることが示された.
1.PRMT-1は線虫において主要なI型タンパク質アルギニンメチルトランスフェラーゼである
PRMT-1の生理的な機能を解明するため,遺伝学的な解析を行ううえですぐれたモデル生物である線虫C. elegansを用いた.まず,線虫のオルソログであると予想されるprmt-1遺伝子をクローニングしたのち,PRMT-1とGSTとの融合タンパク質を作製しin vitroにおけるその酵素活性を検討した.その結果,線虫PRMT-1は哺乳類PRMT-1と同様にモノメチル化と非対称性ジメチル化とを触媒するI型タンパク質アルギニンメチルトランスフェラーゼであることがわかった.つぎに,野生型とprmt-1欠損変異体を用いてin vivoでのPRMT-1の活性を解析した.線虫からタンパク質を抽出し,それらの加水分解産物をHPLCに供して非対称性ジメチル化の量を測定した結果,野生型においては非対称性ジメチル化が検出されるのに対しprmt-1欠損変異体では検出されなかった.さらに,prmt-1欠損変異体にprmt-1遺伝子を導入したトランスジェニック線虫において非対称性ジメチル化の量が野生型と同じ程度にまでレスキューされた.これらの結果から,PRMT-1が線虫における主要なI型タンパク質アルギニンメチルトランスフェラーゼであることが明らかになった.
2.PRMT-1はDAF-16に依存的に寿命を制御する
マウスやショウジョウバエのprmt-1欠損変異体は発生の過程で致死となるが,線虫のprmt-1欠損変異体は発生および成長の段階における顕著な異常を示さなかった.そこで,さらに線虫prmt-1欠損変異体の寿命に着目し検討を行った.その結果,prmt-1欠損変異体の寿命が野生型に比べ有意に短いことが明らかになった.また,prmt-1欠損変異体に野生型のprmt-1遺伝子を導入したトランスジェニック線虫の寿命は野生型と同じ程度にまでにレスキューされたが,メチル基転移活性を欠くPRMT-1変異体の遺伝子を導入したprmt-1欠損変異体は短寿命のままであった.これらの結果から,PRMT-1はそのメチル基転移活性に依存的に線虫の寿命を制御していることが示された.
線虫の寿命はインスリン/IGF-1シグナル伝達経路により制御されていることがよく知られている.PRMT-1がこのインスリン/IGF-1シグナル伝達経路を介して寿命を制御しているのかどうかを検討するため,インスリン受容体のオルソログをコードするdaf-2遺伝子とprmt-1遺伝子との二重変異体を作製しその寿命を解析した.その結果,prmt-1遺伝子の欠損はdaf-2変異体の長寿命を抑制した.また,daf-16欠損変異体に対してprmt-1遺伝子を欠損させても野生型と異なり寿命の短縮はみられなかった.一方で,PRMT-1の過剰発現はDAF-16を過剰発現するトランスジェニック線虫の寿命を有意に延長させた.これらの結果は,PRMT-1がDAF-16の上流において寿命を制御していることを示していた.
3.PRMT-1はDAF-16のアルギニン残基をメチル化する
つぎに,PRMT-1の線虫における発現組織を検討するため,prmt-1遺伝子のプロモーター領域にGFPの遺伝子をつないだレポーターコンストラクトを作製し線虫に導入した.その結果,咽頭や体壁筋,腸といった組織においてPRMT-1の発現が示唆された.DAF-16による寿命制御には腸における発現が重要であることが報告されているため7),PRMT-1とDAF-16とが腸において共発現していることを示すこの結果は,PRMT-1が直接にDAF-16の機能制御を行う可能性を支持するものであった.そこで,GST-PRMT-1融合タンパク質とDAF-16を過剰発現するトランスジェニック線虫から得た抽出液を用いてGSTプルダウンアッセイを行ったところ,in vitroにおいてこの2つのタンパク質の結合することがわかった.さらに,PRMT-1によるDAF-16のアルギニンメチル化を検討したところ,in vitroにおいてDAF-16のアルギニン残基はPRMT-1により強くメチル化されることが明らかになった.
つづいて,DAF-16のメチル化部位の同定を試みた.DAF-16の哺乳類オルソログFOXO1はAKTによるリン酸化のコンセンサス配列にある248番目と250番目のアルギニン残基にPRMT-1によるメチル化をうけることが報告されている2)(図2).それらに相同するアルギニン残基をメチル化部位として着目し,235番目,237番目,239番目のアルギニン残基をリジン残基に置換したDAF-16変異体を作製した.それを基質としてin vitroメチル化アッセイを行った結果,この変異体のPRMT-1によるアルギニンメチル化が野生型DAF-16に比べ顕著に減弱したことから,DAF-16においてAKTによるリン酸化のコンセンサス配列にあるアルギニン残基がPRMT-1によりメチル化されることが示唆された.
4.アルギニンメチル化はAKTによるDAF-16のリン酸化を抑制する
DAF-16のアルギニンメチル化部位はAKTによるリン酸化のコンセンサス配列に存在しリン酸化部位(242番目のスレオニン残基)に近接している.そこで,アルギニンメチル化がAKTによるリン酸化に対し影響をあたえるかどうかを検討するため,これらの部位を含む15アミノ酸からなるDAF-16ペプチドを用いてin vitroリン酸化アッセイを行った.その結果,アルギニン残基の修飾されていないペプチドはAKTにより強くリン酸化されたのに対し,あらかじめアルギニン残基をメチル化修飾しておいたペプチドはAKTによるリン酸化をほとんどうけなかった.さらに,線虫の生体内においてもPRMT-1によるDAF-16のメチル化がAKTに依存的なリン酸化を阻害するかについて抗DAF-16リン酸化抗体を用いて検討した.その結果,prmt-1欠損変異体においては野生型に比べDAF-16のリン酸化の亢進がみられた.以上,PRMT-1の触媒するアルギニンメチル化はAKTによるDAF-16のリン酸化を阻害することが明らかになった.
5.PRMT-1はDAF-16の転写活性化能を亢進させる
DAF-16による転写活性化と長寿命との関係はよく研究されている8).最後に,PRMT-1がDAF-16の転写活性化能を制御しうるかどうかを検討した.野生型とprmt-1欠損変異体におけるDAF-16標的遺伝子のmRNA量を解析した結果,prmt-1欠損変異体においてsod-3遺伝子やmtl-1遺伝子といったDAF-16標的遺伝子の発現量が減弱していた.さらに,AKTによるリン酸化部位である242番目のスレオニン残基をアラニン残基に置換したDAF-16変異体の遺伝子をdaf-16変異体に導入したトランスジェニック線虫においては,prmt-1遺伝子を欠損させてもDAF-16標的遺伝子の発現量は低下しなかった.これらの結果より,PRMT-1がDAF-16の242番目のスレオニン残基のリン酸化の制御を介してDAF-16の転写活性化能を亢進させていることが示唆された.
おわりに
この研究により,PRMT-1が線虫の寿命調節タンパク質としてはたらくことが明らかになった.PRMT-1は酵素活性に依存的かつDAF-16に依存的に線虫の寿命延長に寄与していることが見い出された.また,PRMT-1によるアルギニンメチル化がAKTによるDAF-16のリン酸化を阻害し,それによりDAF-16の転写活性化能の亢進をひき起こして寿命制御関連遺伝子の発現を上昇させていることが示された.この論文は,アルギニンメチル化が線虫においてアンチエイジング修飾として機能することを提示した.
文 献
- Bedford, M. T. & Clarke, S. G.: Protein arginine methylation in mammals: who, what, and why. Mol. Cell, 33, 1-13 (2009)[PubMed]
- Yamagata, K., Daitoku, H., Takahashi, Y. et al.: Arginine methylation of FOXO transcription factors inhibits their phosphorylation by Akt. Mol. Cell, 32, 221-231 (2008)[PubMed]
- Pawlak, M. R., Scherer, C. A., Chen, J. et al.: Arginine N-methyltransferase 1 is required for early postimplantation mouse development, but cells deficient in the enzyme are viable. Mol. Cell. Biol., 20, 4859-4869 (2000)[PubMed]
- Kenyon, C., Chang, J., Gensch, E. et al.: A C. elegans mutant that lives twice as long as wild type. Nature, 366, 461-464 (1993)[PubMed]
- Brunet, A., Bonni, A., Zigmond, M. J. et al.: Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor. Cell, 96, 857-868 (1999)[PubMed]
- Lin, K., Hsin, H., Libina, N. et al.: Regulation of the Caenorhabditis elegans longevity protein DAF-16 by insulin/IGF-1 and germline signaling. Nat. Genet., 28, 139-145 (2001)[PubMed]
- Libina, N., Berman, J. R. & Kenyon, C.: Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell, 115, 489-502 (2003)[PubMed]
- Lee, S. S., Kennedy, S., Tolonen, A. C. et al.: DAF-16 target genes that control C. elegans life-span and metabolism. Science, 300, 644-647 (2003)[PubMed]
著者プロフィール
略歴:2011年 筑波大学大学院生命環境科学研究科博士課程 修了,同年より日本学術振興会 特別研究員.
研究テーマ:寿命制御機構の解明.
深水 昭吉(Akiyoshi Fukamizu)
筑波大学生命領域学際研究センター 教授.
研究室URL:http://akif2.tara.tsukuba.ac.jp/
© 2011 高橋悠太・深水昭吉 Licensed under CC 表示 2.1 日本