SHARPINはNF-κBの活性化に必須な直鎖状ポリユビキチン鎖を形成するユビキチンリガーゼのサブユニットである
岩井 一宏
(大阪大学大学院生命機能研究科 代謝調節学研究室)
email:岩井一宏
DOI: 10.7875/first.author.2011.071
SHARPIN is a component of the NF-κB-activating linear ubiquitin chain assembly complex.
Fuminori Tokunaga, Tomoko Nakagawa, Masaki Nakahara, Yasushi Saeki, Masami Taniguchi, Shin-ichi Sakata, Keiji Tanaka, Hiroyasu Nakano, Kazuhiro Iwai
Nature, 471, 633-636 (2011)
NF-κBは種々の刺激により活性化され免疫応答,炎症,細胞の生存など多彩な作用を発揮する転写因子であり,その活性調節の異常は皮膚炎やがんを含む幾多の疾患に関与している.2009年,筆者らは,刺激に応答してNF-κBの活性化を導く新たなシグナル伝達系として,直鎖状ポリユビキチン鎖とよばれる,従来まったく知られていなかったタンパク質修飾系が関与することを報告した.今回,直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼLUBACの新規のサブユニットとしてSHARPINを同定した.SHARPINは慢性皮膚炎など多彩な症状を呈する自然変異マウスであるcpdmマウスの責任遺伝子産物であり,このcpdmマウスではSHARPINの欠損によりNF-κBの活性化は減弱するものの完全には消失しないことにより多彩な症状を呈することを見い出した.cpdmマウスが多彩な症状を呈することを鑑みれば,今回の結果は,これまで推測されていた種々の刺激によるNF-κBの活性化におけるLUBACを介した直鎖状ポリユビキチン化の役割を明確にするのみならず,LUBACの関与するNF-κB活性化経路がさまざまな疾患に関与していることを強く示唆するものであった.
NF-κBはTNFαあるいはToll様受容体のリガンドなどの刺激により活性化され,種々の遺伝子の発現を亢進させることで免疫応答,炎症,細胞の生存など多彩な生理作用を発揮する転写因子である.その活性亢進はアトピー性皮膚炎,自己免疫疾患,がんを含む幾多の疾患に関与していることが知られており,PubMedにおいてNF-κBを検索すると40,000以上の論文がヒットするように,応用面も含めその重要性が広く認知されている1).しかしながら,非常に多くの研究が行われてきたにもかかわらず,刺激に依存的なNF-κBの活性化機構はまだ完全には解明されていなかった.そのような状況において,2009年,筆者らは,直鎖状ポリユビキチン鎖とよばれる,従来まったく知られていなかったタンパク質修飾系がNF-κBの活性化に関与することを報告し,NF-κBの活性化機構の研究に新たなパラダイムを提唱した2).この論文は,直鎖状ポリユビキチン鎖によるNF-κBの活性化機構が慢性皮膚炎などの疾患に関与することを示すなど,筆者らの発見を生化学的また遺伝学的により確固たるものとした.
この論文の紹介のまえに,まず,直鎖状ポリユビキチン鎖に関して概説する.ユビキチン修飾系はほとんどの場合,ユビキチンが数珠状につながって形成されるポリユビキチン鎖をタンパク質に結合させることで,分解のみならず多彩な様式によりタンパク質の機能を調節する翻訳後修飾系である3).われわれの身体には多彩なポリユビキチン鎖が存在しており,ポリユビキチン鎖の種類によりタンパク質の制御のされ方の異なることが明らかになっている4).これまでに同定されていたポリユビキチン鎖はすべて,ユビキチンのリジン残基のεアミノ基と別のユビキチンのC末端グリシン残基のカルボキシル基とのイソペプチド結合を介して形成されている.たとえば,ユビキチンの48番目のリジン残基を介したK48鎖がタンパク質をプロテアソームによる分解へと導くシグナルになるものと考えられている.筆者らは,リジン残基ではなく,ユビキチンのN末端メチオニン残基のαアミノ基とC末端グリシン残基とがペプチド結合することで形成される直鎖状ポリユビキチン鎖が細胞内に存在することを世界ではじめて示し,直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼとしてHOIL-1L-HOIP複合体を同定していた5).
NF-κBはTNFα,IL-1βなどの炎症性サイトカインやToll様受容体のリガンドなどの種々の刺激により迅速に活性化される.NF-κBは未刺激の状態では阻害タンパク質であるIκB(inhibitor of κB)と結合して細胞質に存在しており,種々の刺激によりIKKα,IKKβ(IKK:IκB kinase)と活性調節サブユニットであるNEMO(NF-κB essential modulator)とから構成されるIKK複合体が活性化されるとIκBをリン酸化してユビキチンに依存的な分解へと導く.その結果,NF-κBがIκBから遊離し核に移行して転写因子として機能する1)(図1).2009年,筆者らは,NEMOが刺激に依存的に直鎖状ポリユビキチン化されることがNF-κBの活性化に関与することを報告した2).
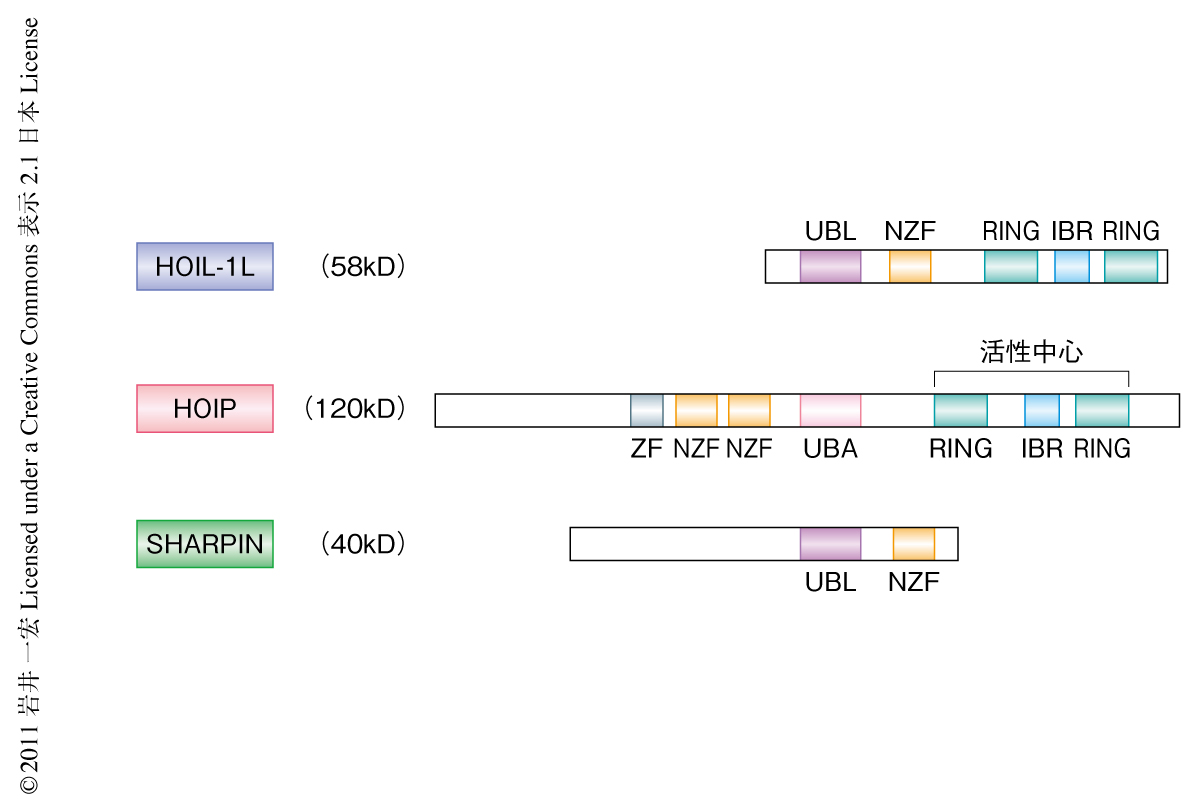
1993年に慢性皮膚炎,種々の免疫異常,関節炎など多彩な症状を呈する自然変異マウスとして報告されたcpdm(chronic proliferative dermatitis)マウスの表現型はNEMOの変異により発症する伴性劣性無汗性外胚葉異形成症にともなう免疫不全症の症状と類似している6).この患者のB細胞ではCD40に依存的なNF-κB活性化の減弱が報告されているのと同じく,cpdmマウスのB細胞においてもCD40に依存的なNF-κB活性化が減弱していることを見い出した.2007年にcpdmマウスの責任遺伝子産物として同定されたSHARPINのC末端側は,HOIPとの結合に重要であるHOIL-1LのN末端側と高い相同性をもっている7)(図2).筆者らは,直鎖状ポリユビキチン鎖の形成における活性中心を構成するHOIPはHOIL-1Lとの複合体としてのみ存在するものと考えていたが2),HOIL-1Lノックアウト細胞でもHOIPは完全には消失しなかったので,HOIL-1LノックアウトマウスではHOIPはSHARPINと結合して存在するのではないかと考え解析を行った.その結果,SHARPINはHOIL-1LおよびHOIPとの三者で直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼ複合体を形成すること,CD40のみならずTNFαなど種々の刺激に依存的にNEMOに直鎖状ポリユビキチン鎖を付加することによりIKKを活性化させることでNF-κBを活性化に導くことを明らかにした(図1).そこで,このHOIL-1L-HOIP-SHARPIN複合体をLUBAC(linear ubiquitin chain assembly complex)と名づけた.
cpdmマウスがさきに述べたような多彩な症状を示す理由は不明であったので解析を進めたところ,cpdmマウスではSHARPINは完全に欠損しているが,LUBACのほかのサブユニットであるHOIL-1LおよびHOIPの発現レベルは非常に低くなるものの完全には消失していなかった.つぎに,cpdmマウスから得たマウス胎仔由来線維芽細胞にSHARPINを発現させたところ,HOIL-1LおよびHOIPの発現も野生型マウスから得たマウス胎仔由来線維芽細胞とほぼ同じ量にまで回復した.NF-κBの活性化を検討する目的でTNFαにより刺激したところ,SHARPINを発現させたcpdmマウス胎仔由来線維芽細胞ではNF-κBの活性化が認められたが,SHARPINを発現していないcpdmマウス胎仔由来線維芽細胞ではNF-κBの活性化は減弱していた.しかしながら,この細胞でもNF-κBの活性化は完全には消失していなかった.そこで,cpdmマウス胎仔由来線維芽細胞においてHOIL-1Lをノックダウンしたところ,HOIL-1LのみならずHOIPの発現もほぼ完全に抑制され,それにともないTNFαあるいはIL-1βに依存的なNF-κBの活性化もほぼ完全に抑制された.それゆえ,cpdmマウスではSHARPINの欠損によりLUBACのほかの2つのサブユニットであるHOIL-1LおよびHOIPが不安定化して減少するが,少量のみ存在するHOIL-1L-HOIP複合体がNEMOを直鎖状ポリユビキチン化してNF-κBを活性化できるので2),刺激に依存的なNF-κB活性化は減弱するものの完全には消失しないために多彩な症状を呈していることが明らかになった.
筆者らは,LUBACを構成する3つのサブユニットのうち,HOIPが直鎖状ポリユビキチン鎖の形成における活性中心であり,HOIL-1LおよびSHARPINは複合体の安定化に必要なサブユニットであることを示してきた(図2).しかし,SHARPINを欠損したcpdmマウスは多彩な症状を示すのに対し,筆者らが樹立したHOIL-1Lノックアウトマウスはcpdmマウスと同様に刺激に依存的なNF-κB活性化は減弱しているにもかかわらず顕著な症状は示さない2).そこで,マウス胎仔由来線維芽細胞を用いてcpdmマウスとHOIL-1Lノックアウトマウスとの相違について解析を進め,cpdmマウス胎仔由来線維芽細胞はHOIL-1Lノックアウトマウス胎仔由来線維芽細胞に比べTNFαに依存的なアポトーシスに高感受性であること,IL-1βに依存的なNF-κB活性化はあまり減弱しないことなどの違いを見い出した.しかしながら,これまでの知見のみでこの2つのマウスの表現型の違いを明確には説明できず,HOIL-1LまたはSHARPINがほかのタンパク質との結合を介してLUBACの機能を制御している,HOIL-1LあるいはSHARPINが特異的に識別するNEMO以外にも直鎖状ポリユビキチン化される標的タンパク質が存在している,などの可能性もふまえた今後の詳細な解析が必要である.
この論文は,直鎖状ポリユビキチン鎖を特異的に形成するLUBACユビキチンリガーゼのサブユニットの欠損により細胞内の直鎖状ポリユビキチン化活性が低下することで,慢性皮膚炎などの多彩な疾患が生じることを明確にした.すなわち,直鎖状ポリユビキチン鎖が細胞内でNF-κBの活性化に関与し,その異常が疾患の原因となることを遺伝学的に証明したものである.NEMOやIKKβなどNF-κBの活性化に必須のタンパク質のノックアウトマウスは胎生致死となるのに対し1),直鎖状ポリユビキチン鎖を形成するユビキチンリガーゼのサブユニットであるHOIL-1Lのノックアウトマウス,および,cpdmマウスにはLUBACのほかの2つのサブユニットから構成される複合体が少量ながら存在するので,NF-κBの活性化能が減弱はしているが残存するため成体まで生存する.それゆえ,LUBACによる直鎖状ポリユビキチン鎖の形成はNF-κBの活性化に必須かどうかまだ明確ではない.HOIL-1Lをノックダウンしたcpdmマウス由来胎仔由来線維芽細胞ではTNF受容体のみならずIL-1受容体の刺激によるNF-κBの活性化がほぼ完全に消失したことからHOIL-1Lは必須である可能性が高いが,最終的な証明のためにはcpdmマウスとHOIL-1Lノックアウトマウスとの交配,また,HOIPノックアウトマウスの解析を待たねばならない.また,LUBACによる直鎖状ポリユビキチン化がTNFαやIL-1βのみならずすべての刺激に依存的なNF-κBの活性化に必須であるかどうかもまだ不明である.
NF-κBの活性化にはユビキチンの63番目のリジン残基を介し形成されるK63鎖の関与が指摘されてきた1).しかしながら,K63鎖を選択的に形成するユビキチン結合酵素であるUbc13のノックアウトマウスではTNFαに依存的なNF-κBの活性化は減弱しなかったことなどから,K63鎖の役割に関しては疑問視されつつある8).しかし,細胞遺伝学的な手法を用いて,K63鎖はIL-1βに依存的なNF-κB活性化には必須であるがTNFαに依存的な活性化には関与しないことも報告されているので9),今後,K63鎖と直鎖状ポリユビキチン鎖との役割分担に関する解析も必要であろう.
NF-κBはリウマチ,膠原病などの免疫疾患,あるいは,がんなど,多彩な疾患において活性亢進が知られており,NF-κB活性化阻害剤はそれら疾患治療薬の有力なターゲットである.直鎖状ポリユビキチン化はほかの刺激のシグナル伝達系には影響を及ぼさずNF-κBを特異的に活性化すると考えられるので10),直鎖状ポリユビキチン化阻害剤はNF-κBを選択的に抑制できるものと考えられ,それら疾患治療薬のよいターゲットとなることが期待される.
また,NF-κBは炎症を惹起する転写因子であると考えられてきた.しかし,cpdmマウスはNF-κBの活性化が減弱しているにもかかわらず慢性皮膚炎をはじめとした多様な慢性炎症の症状を呈する.それゆえ,この論文は慢性炎症におけるNF-κBの役割に関しても新たな視点を提供したといえよう.くわえて,cpdmマウスの皮膚炎は尋常性乾癬とよばれる皮膚炎と類似しており,この尋常性乾癬ではNF-κBの活性化が減弱している可能性も指摘されているので11),LUBAC活性を賦活できれば尋常性乾癬の治療法の開発につながる可能性もあると考えられる.
なお,英国のグループ,および,共同研究者として筆者を含むドイツのグループも,同様の報告をNature誌の同じ号に発表している12,13)(ドイツのグループの論文については,新着論文レビュー でも掲載).
略歴:1992年 京都大学大学院医学研究科 修了,同年 京都大学医学部 助手,1993年 米国NIH研究員,1997年 京都大学大学院医学研究科 助教授,2001年 大阪市立大学大学院医学研究科 教授を経て,2008年より大阪大学大学院生命機能研究科および同 医学系研究科 教授.
研究テーマ:ユビキチン修飾系による細胞機能の制御,直鎖状ポリユビキチン鎖によるNF-κBの制御機構とその生理的な機能,鉄および鉄補欠分子族の動態の調節機構.
抱負:生物学のみならず化学,臨床など多様なバックグラウンドをもつ人たちと,原子間相互作用から個体まで広い視野から先入観をもつことなくサイエンスをみつめて研究を進めたいと考えており,種々の分野からの若い人たちの参加を待ち望んでいる.
研究室URL:http://www.cellbio.med.osaka-u.ac.jp/
© 2011 岩井 一宏 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 代謝調節学研究室)
email:岩井一宏
DOI: 10.7875/first.author.2011.071
SHARPIN is a component of the NF-κB-activating linear ubiquitin chain assembly complex.
Fuminori Tokunaga, Tomoko Nakagawa, Masaki Nakahara, Yasushi Saeki, Masami Taniguchi, Shin-ichi Sakata, Keiji Tanaka, Hiroyasu Nakano, Kazuhiro Iwai
Nature, 471, 633-636 (2011)
要 約
NF-κBは種々の刺激により活性化され免疫応答,炎症,細胞の生存など多彩な作用を発揮する転写因子であり,その活性調節の異常は皮膚炎やがんを含む幾多の疾患に関与している.2009年,筆者らは,刺激に応答してNF-κBの活性化を導く新たなシグナル伝達系として,直鎖状ポリユビキチン鎖とよばれる,従来まったく知られていなかったタンパク質修飾系が関与することを報告した.今回,直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼLUBACの新規のサブユニットとしてSHARPINを同定した.SHARPINは慢性皮膚炎など多彩な症状を呈する自然変異マウスであるcpdmマウスの責任遺伝子産物であり,このcpdmマウスではSHARPINの欠損によりNF-κBの活性化は減弱するものの完全には消失しないことにより多彩な症状を呈することを見い出した.cpdmマウスが多彩な症状を呈することを鑑みれば,今回の結果は,これまで推測されていた種々の刺激によるNF-κBの活性化におけるLUBACを介した直鎖状ポリユビキチン化の役割を明確にするのみならず,LUBACの関与するNF-κB活性化経路がさまざまな疾患に関与していることを強く示唆するものであった.
はじめに
NF-κBはTNFαあるいはToll様受容体のリガンドなどの刺激により活性化され,種々の遺伝子の発現を亢進させることで免疫応答,炎症,細胞の生存など多彩な生理作用を発揮する転写因子である.その活性亢進はアトピー性皮膚炎,自己免疫疾患,がんを含む幾多の疾患に関与していることが知られており,PubMedにおいてNF-κBを検索すると40,000以上の論文がヒットするように,応用面も含めその重要性が広く認知されている1).しかしながら,非常に多くの研究が行われてきたにもかかわらず,刺激に依存的なNF-κBの活性化機構はまだ完全には解明されていなかった.そのような状況において,2009年,筆者らは,直鎖状ポリユビキチン鎖とよばれる,従来まったく知られていなかったタンパク質修飾系がNF-κBの活性化に関与することを報告し,NF-κBの活性化機構の研究に新たなパラダイムを提唱した2).この論文は,直鎖状ポリユビキチン鎖によるNF-κBの活性化機構が慢性皮膚炎などの疾患に関与することを示すなど,筆者らの発見を生化学的また遺伝学的により確固たるものとした.
1.直鎖状ポリユビキチン鎖とは
この論文の紹介のまえに,まず,直鎖状ポリユビキチン鎖に関して概説する.ユビキチン修飾系はほとんどの場合,ユビキチンが数珠状につながって形成されるポリユビキチン鎖をタンパク質に結合させることで,分解のみならず多彩な様式によりタンパク質の機能を調節する翻訳後修飾系である3).われわれの身体には多彩なポリユビキチン鎖が存在しており,ポリユビキチン鎖の種類によりタンパク質の制御のされ方の異なることが明らかになっている4).これまでに同定されていたポリユビキチン鎖はすべて,ユビキチンのリジン残基のεアミノ基と別のユビキチンのC末端グリシン残基のカルボキシル基とのイソペプチド結合を介して形成されている.たとえば,ユビキチンの48番目のリジン残基を介したK48鎖がタンパク質をプロテアソームによる分解へと導くシグナルになるものと考えられている.筆者らは,リジン残基ではなく,ユビキチンのN末端メチオニン残基のαアミノ基とC末端グリシン残基とがペプチド結合することで形成される直鎖状ポリユビキチン鎖が細胞内に存在することを世界ではじめて示し,直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼとしてHOIL-1L-HOIP複合体を同定していた5).
2.SHARPINは直鎖状ポリユビキチン鎖を形成するユビキチンリガーゼLUBACの新規のサブユニットである
NF-κBはTNFα,IL-1βなどの炎症性サイトカインやToll様受容体のリガンドなどの種々の刺激により迅速に活性化される.NF-κBは未刺激の状態では阻害タンパク質であるIκB(inhibitor of κB)と結合して細胞質に存在しており,種々の刺激によりIKKα,IKKβ(IKK:IκB kinase)と活性調節サブユニットであるNEMO(NF-κB essential modulator)とから構成されるIKK複合体が活性化されるとIκBをリン酸化してユビキチンに依存的な分解へと導く.その結果,NF-κBがIκBから遊離し核に移行して転写因子として機能する1)(図1).2009年,筆者らは,NEMOが刺激に依存的に直鎖状ポリユビキチン化されることがNF-κBの活性化に関与することを報告した2).
1993年に慢性皮膚炎,種々の免疫異常,関節炎など多彩な症状を呈する自然変異マウスとして報告されたcpdm(chronic proliferative dermatitis)マウスの表現型はNEMOの変異により発症する伴性劣性無汗性外胚葉異形成症にともなう免疫不全症の症状と類似している6).この患者のB細胞ではCD40に依存的なNF-κB活性化の減弱が報告されているのと同じく,cpdmマウスのB細胞においてもCD40に依存的なNF-κB活性化が減弱していることを見い出した.2007年にcpdmマウスの責任遺伝子産物として同定されたSHARPINのC末端側は,HOIPとの結合に重要であるHOIL-1LのN末端側と高い相同性をもっている7)(図2).筆者らは,直鎖状ポリユビキチン鎖の形成における活性中心を構成するHOIPはHOIL-1Lとの複合体としてのみ存在するものと考えていたが2),HOIL-1Lノックアウト細胞でもHOIPは完全には消失しなかったので,HOIL-1LノックアウトマウスではHOIPはSHARPINと結合して存在するのではないかと考え解析を行った.その結果,SHARPINはHOIL-1LおよびHOIPとの三者で直鎖状ポリユビキチン鎖を選択的に形成するユビキチンリガーゼ複合体を形成すること,CD40のみならずTNFαなど種々の刺激に依存的にNEMOに直鎖状ポリユビキチン鎖を付加することによりIKKを活性化させることでNF-κBを活性化に導くことを明らかにした(図1).そこで,このHOIL-1L-HOIP-SHARPIN複合体をLUBAC(linear ubiquitin chain assembly complex)と名づけた.
3.cpdmマウスの症状の発現機構
cpdmマウスがさきに述べたような多彩な症状を示す理由は不明であったので解析を進めたところ,cpdmマウスではSHARPINは完全に欠損しているが,LUBACのほかのサブユニットであるHOIL-1LおよびHOIPの発現レベルは非常に低くなるものの完全には消失していなかった.つぎに,cpdmマウスから得たマウス胎仔由来線維芽細胞にSHARPINを発現させたところ,HOIL-1LおよびHOIPの発現も野生型マウスから得たマウス胎仔由来線維芽細胞とほぼ同じ量にまで回復した.NF-κBの活性化を検討する目的でTNFαにより刺激したところ,SHARPINを発現させたcpdmマウス胎仔由来線維芽細胞ではNF-κBの活性化が認められたが,SHARPINを発現していないcpdmマウス胎仔由来線維芽細胞ではNF-κBの活性化は減弱していた.しかしながら,この細胞でもNF-κBの活性化は完全には消失していなかった.そこで,cpdmマウス胎仔由来線維芽細胞においてHOIL-1Lをノックダウンしたところ,HOIL-1LのみならずHOIPの発現もほぼ完全に抑制され,それにともないTNFαあるいはIL-1βに依存的なNF-κBの活性化もほぼ完全に抑制された.それゆえ,cpdmマウスではSHARPINの欠損によりLUBACのほかの2つのサブユニットであるHOIL-1LおよびHOIPが不安定化して減少するが,少量のみ存在するHOIL-1L-HOIP複合体がNEMOを直鎖状ポリユビキチン化してNF-κBを活性化できるので2),刺激に依存的なNF-κB活性化は減弱するものの完全には消失しないために多彩な症状を呈していることが明らかになった.
筆者らは,LUBACを構成する3つのサブユニットのうち,HOIPが直鎖状ポリユビキチン鎖の形成における活性中心であり,HOIL-1LおよびSHARPINは複合体の安定化に必要なサブユニットであることを示してきた(図2).しかし,SHARPINを欠損したcpdmマウスは多彩な症状を示すのに対し,筆者らが樹立したHOIL-1Lノックアウトマウスはcpdmマウスと同様に刺激に依存的なNF-κB活性化は減弱しているにもかかわらず顕著な症状は示さない2).そこで,マウス胎仔由来線維芽細胞を用いてcpdmマウスとHOIL-1Lノックアウトマウスとの相違について解析を進め,cpdmマウス胎仔由来線維芽細胞はHOIL-1Lノックアウトマウス胎仔由来線維芽細胞に比べTNFαに依存的なアポトーシスに高感受性であること,IL-1βに依存的なNF-κB活性化はあまり減弱しないことなどの違いを見い出した.しかしながら,これまでの知見のみでこの2つのマウスの表現型の違いを明確には説明できず,HOIL-1LまたはSHARPINがほかのタンパク質との結合を介してLUBACの機能を制御している,HOIL-1LあるいはSHARPINが特異的に識別するNEMO以外にも直鎖状ポリユビキチン化される標的タンパク質が存在している,などの可能性もふまえた今後の詳細な解析が必要である.
4.今後の展望
この論文は,直鎖状ポリユビキチン鎖を特異的に形成するLUBACユビキチンリガーゼのサブユニットの欠損により細胞内の直鎖状ポリユビキチン化活性が低下することで,慢性皮膚炎などの多彩な疾患が生じることを明確にした.すなわち,直鎖状ポリユビキチン鎖が細胞内でNF-κBの活性化に関与し,その異常が疾患の原因となることを遺伝学的に証明したものである.NEMOやIKKβなどNF-κBの活性化に必須のタンパク質のノックアウトマウスは胎生致死となるのに対し1),直鎖状ポリユビキチン鎖を形成するユビキチンリガーゼのサブユニットであるHOIL-1Lのノックアウトマウス,および,cpdmマウスにはLUBACのほかの2つのサブユニットから構成される複合体が少量ながら存在するので,NF-κBの活性化能が減弱はしているが残存するため成体まで生存する.それゆえ,LUBACによる直鎖状ポリユビキチン鎖の形成はNF-κBの活性化に必須かどうかまだ明確ではない.HOIL-1Lをノックダウンしたcpdmマウス由来胎仔由来線維芽細胞ではTNF受容体のみならずIL-1受容体の刺激によるNF-κBの活性化がほぼ完全に消失したことからHOIL-1Lは必須である可能性が高いが,最終的な証明のためにはcpdmマウスとHOIL-1Lノックアウトマウスとの交配,また,HOIPノックアウトマウスの解析を待たねばならない.また,LUBACによる直鎖状ポリユビキチン化がTNFαやIL-1βのみならずすべての刺激に依存的なNF-κBの活性化に必須であるかどうかもまだ不明である.
NF-κBの活性化にはユビキチンの63番目のリジン残基を介し形成されるK63鎖の関与が指摘されてきた1).しかしながら,K63鎖を選択的に形成するユビキチン結合酵素であるUbc13のノックアウトマウスではTNFαに依存的なNF-κBの活性化は減弱しなかったことなどから,K63鎖の役割に関しては疑問視されつつある8).しかし,細胞遺伝学的な手法を用いて,K63鎖はIL-1βに依存的なNF-κB活性化には必須であるがTNFαに依存的な活性化には関与しないことも報告されているので9),今後,K63鎖と直鎖状ポリユビキチン鎖との役割分担に関する解析も必要であろう.
おわりに
NF-κBはリウマチ,膠原病などの免疫疾患,あるいは,がんなど,多彩な疾患において活性亢進が知られており,NF-κB活性化阻害剤はそれら疾患治療薬の有力なターゲットである.直鎖状ポリユビキチン化はほかの刺激のシグナル伝達系には影響を及ぼさずNF-κBを特異的に活性化すると考えられるので10),直鎖状ポリユビキチン化阻害剤はNF-κBを選択的に抑制できるものと考えられ,それら疾患治療薬のよいターゲットとなることが期待される.
また,NF-κBは炎症を惹起する転写因子であると考えられてきた.しかし,cpdmマウスはNF-κBの活性化が減弱しているにもかかわらず慢性皮膚炎をはじめとした多様な慢性炎症の症状を呈する.それゆえ,この論文は慢性炎症におけるNF-κBの役割に関しても新たな視点を提供したといえよう.くわえて,cpdmマウスの皮膚炎は尋常性乾癬とよばれる皮膚炎と類似しており,この尋常性乾癬ではNF-κBの活性化が減弱している可能性も指摘されているので11),LUBAC活性を賦活できれば尋常性乾癬の治療法の開発につながる可能性もあると考えられる.
なお,英国のグループ,および,共同研究者として筆者を含むドイツのグループも,同様の報告をNature誌の同じ号に発表している12,13)(ドイツのグループの論文については,新着論文レビュー でも掲載).
文 献
- Hayden, M. S. & Ghosh, S.: Shared principles in NF-κB signaling. Cell, 132, 344-362 (2008)[PubMed]
- Tokunaga, F., Sakata, S., Saeki, Y. et al.: Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nat. Cell Biol., 11, 123-132 (2009)[PubMed]
- Glickman, M. H. & Ciechanover, A.: The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiol. Rev., 82, 373-428 (2002)[PubMed]
- Ye, Y. & Rape, M.: Building ubiquitin chains: E2 enzymes at work. Nat. Rev. Mol. Cell Biol., 10, 755-764 (2009)[PubMed]
- Kirisako, T., Kamei, K., Murata, S. et al.: A ubiquitin ligase complex assembles linear polyubiquitin chains. EMBO J., 25, 4877-4887 (2006)[PubMed]
- HogenEsch, H., Gijbels, M. J., Offerman, E. et al.: A spontaneous mutation characterized by chronic proliferative dermatitis in C57BL mice. Am. J. Pathol., 143, 972-982 (1993)[PubMed]
- Seymour, R. E., Hasham, M. G., Cox, G. A. et al.: Spontaneous mutations in the mouse Sharpin gene result in multiorgan inflammation, immune system dysregulation and dermatitis. Genes Immun., 8, 416-421 (2007)[PubMed]
- Yamamoto, M., Okamoto, T., Takeda, K. et al.: Key function for the Ubc13 E2 ubiquitin-conjugating enzyme in immune receptor signaling. Nat. Immunol., 7, 962-970 (2006)[PubMed]
- Xu, M., Skaug, B., Zeng, W. et al.: A ubiquitin replacement strategy in human cells reveals distinct mechanisms of IKK activation by TNFα and IL-1β. Mol. Cell, 36, 302-314 (2009)[PubMed]
- Iwai, K. & Tokunaga, F.: Linear polyubiquitination: a new regulator of NF-κB activation. EMBO Rep., 10, 706-713 (2009)[PubMed]
- Stratis, A., Pasparakis, M., Rupec, R. A. et al.: Pathogenic role for skin macrophages in a mouse model of keratinocyte-induced psoriasis-like skin inflammation. J. Clin. Invest., 116, 2094-2104 (2006)[PubMed]
- Gerlach, B., Cordier, S. M., Schmukle, A. C. et al.: Linear ubiquitination prevents inflammation and regulates immune signaling. Nature, 471, 591-596 (2011)[PubMed]
- Ikeda, F., Deribe, Y. L., Skanland, S. S. et al.: SHARPIN forms a linear ubiquitin ligase complex regulating NF-κB activity and apoptosis. Nature, 471, 637-641 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:1992年 京都大学大学院医学研究科 修了,同年 京都大学医学部 助手,1993年 米国NIH研究員,1997年 京都大学大学院医学研究科 助教授,2001年 大阪市立大学大学院医学研究科 教授を経て,2008年より大阪大学大学院生命機能研究科および同 医学系研究科 教授.
研究テーマ:ユビキチン修飾系による細胞機能の制御,直鎖状ポリユビキチン鎖によるNF-κBの制御機構とその生理的な機能,鉄および鉄補欠分子族の動態の調節機構.
抱負:生物学のみならず化学,臨床など多様なバックグラウンドをもつ人たちと,原子間相互作用から個体まで広い視野から先入観をもつことなくサイエンスをみつめて研究を進めたいと考えており,種々の分野からの若い人たちの参加を待ち望んでいる.
研究室URL:http://www.cellbio.med.osaka-u.ac.jp/
© 2011 岩井 一宏 Licensed under CC 表示 2.1 日本