TDY型MAPキナーゼMPK8はカルモジュリン依存的に活性化し活性酸素種の蓄積を制御する
高橋史憲1・溝口 剛2・篠崎一雄3
(1理化学研究所バイオマス工学研究プログラム,2筑波大学大学院生命環境科学研究科 情報生物科学専攻,3理化学研究所植物科学研究センター 機能開発研究グループ)
email:溝口 剛,篠崎一雄
DOI: 10.7875/first.author.2011.068
Calmodulin-dependent activation of MAP kinase for ROS homeostasis in Arabidopsis.
Fuminori Takahashi, Tsuyoshi Mizoguchi, Riichiro Yoshida, Kazuya Ichimura, Kazuo Shinozaki
Molecular Cell, 41, 649-660 (2011)
傷害ストレスを感受する初期応答シグナルにはCa2+やタンパク質のリン酸化,活性酸素種の生成が必須であるが,その詳細なシグナル伝達機構は明らかになっていない.筆者らは,植物に保存されているTDY型MAPキナーゼのひとつであるMPK8が傷害ストレス応答においてMAPキナーゼカスケードとCa2+シグナルのクロストークポイントとして機能し,活性酸素種の蓄積を制御することを明らかにした.MPK8は傷害や活性酸素種により活性化し,その活性化はCa2+依存的にカルモジュリンが結合することで制御される.一方,MPK8はMAPキナーゼキナーゼであるMKK3によりリン酸化されることでも活性化する.傷害によるMPK8の完全な活性化にはMKK3によるリン酸化とカルモジュリンの結合が必要であり,MPK8経路は活性酸素種の生成において主要な役割をはたすRbohD遺伝子の発現を制御することも明らかにした.これらの結果から,植物に特異的なTDY型MAPキナーゼの新規な活性化機構の存在と,過剰な活性酸素種の蓄積を制御する安全弁として機能するMPK8経路の新規の生理的な機能が示された.
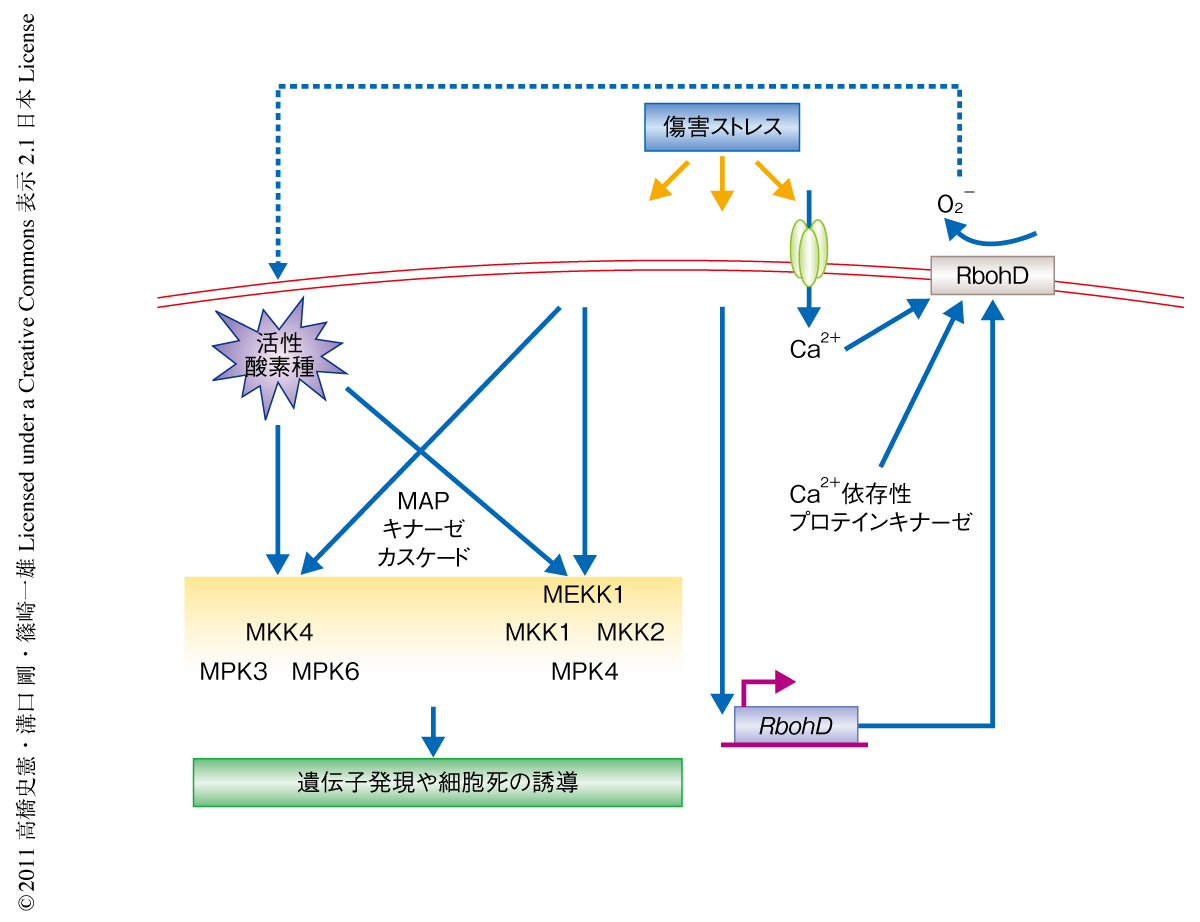
植物は病虫害や低温あるいは高温などの環境ストレスにより起こる傷害を迅速に認識する能力をもっている.この初期応答にかかわるシグナル伝達にはCa2+や活性酸素種,プロテインキナーゼ,さらには,植物ホルモンのひとつであるジャスモン酸がかかわることが知られている.傷害ストレスをうけると細胞におけるCa2+濃度が一過的に上昇し,カルモジュリンやCa2+依存性プロテインキナーゼなどによりシグナルが伝達される1).また,活性酸素種もCa2+シグナルと密接にかかわりあいながらセカンドメッセンジャーとして細胞内シグナル伝達に関与することが報告されている2)(図1).NADPHオキシダーゼは活性酸素種の生成において主要な役割をはたす細胞膜局在型の酵素である3).その活性化にはN末端領域にあるEFハンドにCa2+が結合することと,Ca2+依存性プロテインキナーゼによるリン酸化が必要であることが示されている4,5)(図1)
一方,MAPキナーゼはプロテインキナーゼのひとつとして傷害ストレス応答にかかわる重要なシグナル伝達タンパク質である6,7).シロイヌナズナには20個のMAPキナーゼの遺伝子が存在し,これらは大きく4つのサブグループに分類される8).なかでもサブグループAおよびサブグループBに属するMPK3,MPK6,MPK4の解析が進んでおり,これらのMAPキナーゼは病原菌応答シグナルや活性酸素種シグナルに関与することが報告されている(図1).しかし,傷害ストレス応答にかかわるCa2+や活性酸素種,MAPキナーゼカスケードがどのように関与しあっているのかはほとんど明らかになっていない.筆者らは,以前,MPK1からMPK9までを遺伝子クローニングすることに成功した9).なかでも,MPK8はMAPキナーゼキナーゼ(MAPKK)によるリン酸化部位が植物にのみ特異的に保存されているTDY配列であるという特徴をもち,もっとも大きなサブグループDに属する.したがって,植物におけるTDY型MAPキナーゼの機能解析が必要であると考えて研究を進めた結果,MPK8が傷害ストレスにおける初期シグナルに関与することを見い出した.さらに,MPK8の活性化に関してカルモジュリンの結合により活性化されるという新規の知見を得た.
MPK8のキナーゼドメインはほかのMAPキナーゼと比較して約40%の相同性をもつ.また,C末端領域が長くCDドメインが存在するという構造的な特徴をもつ.RT-PCR解析からMPK8は植物のどの組織においても発現していることが示された.MPK8過剰発現体からMPK8を免疫沈降したのち試験管内リン酸化反応実験を行った結果,MPK8は傷害や活性酸素種,ジャスモン酸により活性化することが明らかになった.つぎに,mpk8変異体やMPK8過剰発現体を用いてMPK8が傷害ストレスによる活性酸素種の蓄積に関与するかどうかを検討した.野生型植物では傷害処理を行った切断面の周辺に活性酸素種の蓄積が認められたのに対し,mpk8変異体では本葉の全体に活性酸素種の蓄積が認められた.一方,MPK8過剰発現体では活性酸素種の蓄積は認められなかったことから,MPK8は傷害をうけた組織から広がる活性酸素種の蓄積を負に制御していることが示された.また,酸化ストレスによる細胞死を誘導するパラコート処理に対しても,mpk8変異体は感受性を,MPK8過剰発現体は耐性を示した.以上の結果から,MPK8は傷害ストレス応答における初期応答に関与し活性酸素種の蓄積にかかわる重要なタンパク質であることが示唆された.
シロイヌナズナには10個のMAPKKの遺伝子が存在する.そこで,MPK8の上流タンパク質となるMAPKKを同定するためGST融合タンパク質を用いたin vitroリン酸化反応実験を行った.その結果,MKK3が上流MAPKKのひとつであることが示唆された.デキサメタゾン誘導型のMKK3過剰発現体を用いた試験管内リン酸化反応,および,mkk3変異体を用いたゲル内リン酸化反応を行った結果,in vivoにおいてMKK3は傷害ストレスに応答してMPK8を活性化し,典型的なリン酸化による活性化のカスケードを構成することが明らかになった.
傷害ストレスにおける活性酸素種の蓄積にはCa2+シグナルとリン酸化シグナルの関与することが報告されている2,6).そこで,傷害ストレスで活性化されるMPK8に対するCa2+シグナルの影響を検討した.野生型植物にCa2+キレート剤であるEGTAを添加してMPK8の活性を測定すると,EGTAをくわえない場合に対して活性強度が半分ほどに低下した.さらに,mkk3変異体ではEGTAの存在下でMPK8の活性は完全に消失することが明らかになった.このことから,傷害によるMPK8の活性化にはMKK3によるリン酸化とCa2+シグナルの両方の制御が関与している可能性が示された.
つぎに,MPK8と直接に結合するタンパク質を探索するため酵母ツーハイブリッドスクリーニングを行った.その結果,38の陽性クローンのすべてがCaM3,CaM4,CaM7を含むカルモジュリンであった.シロイヌナズナの葉肉細胞から分離させたプロトプラストにMPK8とカルモジュリンを一過的に発現させ,これらが結合したときのみYFPの蛍光シグナルが観察されるというBiFC法を用いてin vivoにおけるカルモジュリンとMPK8との結合を解析した.MPK8はCaM3,CaM4,CaM7のいずれとも結合することが明らかになった.一方,シロイヌナズナのほかのMAPキナーゼサブファミリーであるMPK3,MPK4,MPK6はカルモジュリンと結合しなかった.さらに,Ca2+存在下およびCa2+非存在下で抗体を用いた共免疫沈降実験を行った結果,MPK8とカルモジュリンとの結合にはCa2+が必要であることも明らかになった.また,MPK16やMPK17といったほかのTDY型MAPキナーゼもカルモジュリンと結合することから,MPK8を含むいくつかのTDY型MAPキナーゼはin vivoにおいてカルモジュリンと結合することが示唆された.
つぎに,MPK8とカルモジュリンとを共免疫沈降させたのち試験管内リン酸化反応を行った結果,カルモジュリンはMPK8と直接に結合しているときのみMPK8を活性化させることが明らかになった.さらに,MKK3によるリン酸化部位をさまざまなアミノ酸残基に置換したMPK8変異体を用いてカルモジュリンによる活性化を解析した結果,カルモジュリンはリン酸化を介すことなくMPK8を活性化することが示された.これまでに,動物ではTAB1がp38に結合することでp38の自己リン酸化が増幅され活性化が起こることが報告されている10).しかし,カルモジュリンによるMPK8の活性化は自己リン酸化の増幅はともなわないことも示され,これが新規なMAPキナーゼの活性化機構であることが証明された.
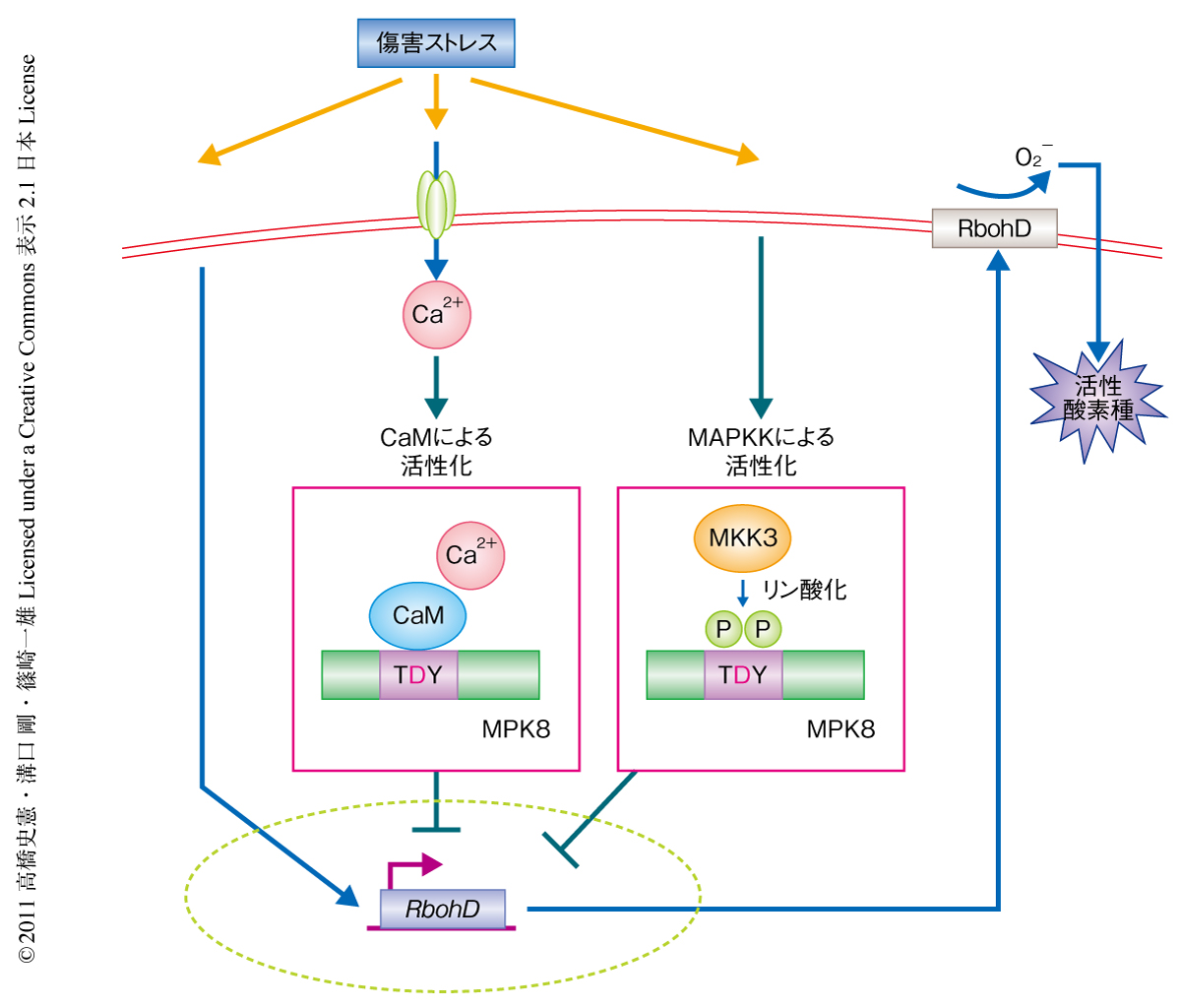
mkk3変異体とカルモジュリンの阻害剤であるW7およびST-Aを用いた実験から,傷害ストレスにおけるMPK8の活性化にはMKK3によるリン酸化とカルモジュリンとの結合が必要であること,さらに,MPK8は傷害ストレス応答におけるCa2+シグナルとMAPキナーゼカスケードとのクロストークポイントとして機能していることが示された.つぎに,MPK8経路の下流の制御タンパク質の探索を行った.傷害ストレスにおける活性酸素種の生成にはNADPHオキシダーゼのひとつRbohDが重要な役割をはたすことが知られている3-5).そこで,MPK8経路によるRbohD遺伝子の発現への影響を検討した.mpk8変異体では傷害処理の30分後に一過的に上昇するRbohD遺伝子の発現が野生型よりも上昇し,MPK8過剰発現体ではこれが抑制されていることが明らかになった.さらに,mkk3変異体にカルモジュリン阻害剤であるW7を処理したのち傷害処理を行いRbohD遺伝子の発現を解析した結果,mpk8変異体と同様にRbohD遺伝子が過剰発現されていることが確認された.つぎに,mpk8 rbohD二重変異体を作製して傷害処理ののちの葉における活性酸素種の蓄積を解析した結果,mpk8変異体で観察された活性酸素種の過剰蓄積はmpk8 rbohD二重変異体では抑制されていることが明らかになった.したがって,傷害ストレスにおいてはカルモジュリンとMKK3という2つのタンパク質によるMPK8の活性化が起こり,MPK8はRbohD遺伝子の発現を負に制御することで活性酸素種の蓄積を制御しているものと考えられた(図2).
この研究によって,TDY型MAPキナーゼのひとつであるMPK8はリン酸化を介すことなくカルモジュリンとの結合により活性化するという,新規なMAPキナーゼの活性化機構の存在することが示された.また,傷害ストレスにおいてCa2+シグナルとMAPキナーゼカスケードがMPK8を介し直接にクロストークし,活性酸素種の過剰蓄積を制御する安全弁として機能していることも明らかになった.筆者らは,ゲノム配列の解析から,TDY型MAPキナーゼは植物だけでなく進化の過程で葉緑体との共生をへたことのあるマラリアやトリパノソーマといった原虫にも存在するという知見を得ている.葉緑体をもつ好気性生物にとって,光合成による酸素の蓄積はストレスをうけた際に爆発的な活性酸素種の生成につながるため,その厳密な制御は生死にかかわる問題である.したがって,これらの生物においてTDY型MAPキナーゼは活性酸素種の過剰蓄積を抑制するために生まれた制御機構であることが推測される.今後は,立体構造解析を基盤とした,カルモジュリンによるTDY型MAPキナーゼの活性化を特異的に阻害する化合物のドラッグデザインの実施が期待される.また,プロテインキナーゼによるリン酸化修飾によらないカルモジュリン-MAPキナーゼ以外の新たな活性化機構の存在を探索するとともに,活性酸素種の蓄積量の制御,および,活性酸素種を利用した細胞間コミュニケーションにかかわるシグナル伝達の詳細を解明していく必要があるものと考えられる.
略歴:2007年 筑波大学大学院生命環境科学研究科博士課程 修了,同年 理化学研究所 植物科学研究センター 特別研究員を経て,2010年より理化学研究所バイオマス工学研究プログラム 研究員.
研究テーマ:環境ストレスに応答する細胞内シグナル伝達系の解明.
溝口 剛(Tsuyoshi Mizoguchi)
筑波大学大学院生命環境科学研究科 准教授.
篠崎 一雄(Kazuo Shinozaki)
理化学研究所植物科学研究センター センター長・グループディレクター,理化学研究所バイオマス工学研究プログラム プログラムディレクター.
© 2011 高橋史憲・溝口 剛・篠崎一雄 Licensed under CC 表示 2.1 日本
(1理化学研究所バイオマス工学研究プログラム,2筑波大学大学院生命環境科学研究科 情報生物科学専攻,3理化学研究所植物科学研究センター 機能開発研究グループ)
email:溝口 剛,篠崎一雄
DOI: 10.7875/first.author.2011.068
Calmodulin-dependent activation of MAP kinase for ROS homeostasis in Arabidopsis.
Fuminori Takahashi, Tsuyoshi Mizoguchi, Riichiro Yoshida, Kazuya Ichimura, Kazuo Shinozaki
Molecular Cell, 41, 649-660 (2011)
要 約
傷害ストレスを感受する初期応答シグナルにはCa2+やタンパク質のリン酸化,活性酸素種の生成が必須であるが,その詳細なシグナル伝達機構は明らかになっていない.筆者らは,植物に保存されているTDY型MAPキナーゼのひとつであるMPK8が傷害ストレス応答においてMAPキナーゼカスケードとCa2+シグナルのクロストークポイントとして機能し,活性酸素種の蓄積を制御することを明らかにした.MPK8は傷害や活性酸素種により活性化し,その活性化はCa2+依存的にカルモジュリンが結合することで制御される.一方,MPK8はMAPキナーゼキナーゼであるMKK3によりリン酸化されることでも活性化する.傷害によるMPK8の完全な活性化にはMKK3によるリン酸化とカルモジュリンの結合が必要であり,MPK8経路は活性酸素種の生成において主要な役割をはたすRbohD遺伝子の発現を制御することも明らかにした.これらの結果から,植物に特異的なTDY型MAPキナーゼの新規な活性化機構の存在と,過剰な活性酸素種の蓄積を制御する安全弁として機能するMPK8経路の新規の生理的な機能が示された.
はじめに
植物は病虫害や低温あるいは高温などの環境ストレスにより起こる傷害を迅速に認識する能力をもっている.この初期応答にかかわるシグナル伝達にはCa2+や活性酸素種,プロテインキナーゼ,さらには,植物ホルモンのひとつであるジャスモン酸がかかわることが知られている.傷害ストレスをうけると細胞におけるCa2+濃度が一過的に上昇し,カルモジュリンやCa2+依存性プロテインキナーゼなどによりシグナルが伝達される1).また,活性酸素種もCa2+シグナルと密接にかかわりあいながらセカンドメッセンジャーとして細胞内シグナル伝達に関与することが報告されている2)(図1).NADPHオキシダーゼは活性酸素種の生成において主要な役割をはたす細胞膜局在型の酵素である3).その活性化にはN末端領域にあるEFハンドにCa2+が結合することと,Ca2+依存性プロテインキナーゼによるリン酸化が必要であることが示されている4,5)(図1)
一方,MAPキナーゼはプロテインキナーゼのひとつとして傷害ストレス応答にかかわる重要なシグナル伝達タンパク質である6,7).シロイヌナズナには20個のMAPキナーゼの遺伝子が存在し,これらは大きく4つのサブグループに分類される8).なかでもサブグループAおよびサブグループBに属するMPK3,MPK6,MPK4の解析が進んでおり,これらのMAPキナーゼは病原菌応答シグナルや活性酸素種シグナルに関与することが報告されている(図1).しかし,傷害ストレス応答にかかわるCa2+や活性酸素種,MAPキナーゼカスケードがどのように関与しあっているのかはほとんど明らかになっていない.筆者らは,以前,MPK1からMPK9までを遺伝子クローニングすることに成功した9).なかでも,MPK8はMAPキナーゼキナーゼ(MAPKK)によるリン酸化部位が植物にのみ特異的に保存されているTDY配列であるという特徴をもち,もっとも大きなサブグループDに属する.したがって,植物におけるTDY型MAPキナーゼの機能解析が必要であると考えて研究を進めた結果,MPK8が傷害ストレスにおける初期シグナルに関与することを見い出した.さらに,MPK8の活性化に関してカルモジュリンの結合により活性化されるという新規の知見を得た.
1.MPK8は傷害により活性化し活性酸素種の蓄積を負に制御する
MPK8のキナーゼドメインはほかのMAPキナーゼと比較して約40%の相同性をもつ.また,C末端領域が長くCDドメインが存在するという構造的な特徴をもつ.RT-PCR解析からMPK8は植物のどの組織においても発現していることが示された.MPK8過剰発現体からMPK8を免疫沈降したのち試験管内リン酸化反応実験を行った結果,MPK8は傷害や活性酸素種,ジャスモン酸により活性化することが明らかになった.つぎに,mpk8変異体やMPK8過剰発現体を用いてMPK8が傷害ストレスによる活性酸素種の蓄積に関与するかどうかを検討した.野生型植物では傷害処理を行った切断面の周辺に活性酸素種の蓄積が認められたのに対し,mpk8変異体では本葉の全体に活性酸素種の蓄積が認められた.一方,MPK8過剰発現体では活性酸素種の蓄積は認められなかったことから,MPK8は傷害をうけた組織から広がる活性酸素種の蓄積を負に制御していることが示された.また,酸化ストレスによる細胞死を誘導するパラコート処理に対しても,mpk8変異体は感受性を,MPK8過剰発現体は耐性を示した.以上の結果から,MPK8は傷害ストレス応答における初期応答に関与し活性酸素種の蓄積にかかわる重要なタンパク質であることが示唆された.
2.MPK8はMKK3によるリン酸化とCa2+シグナルを介して活性化する
シロイヌナズナには10個のMAPKKの遺伝子が存在する.そこで,MPK8の上流タンパク質となるMAPKKを同定するためGST融合タンパク質を用いたin vitroリン酸化反応実験を行った.その結果,MKK3が上流MAPKKのひとつであることが示唆された.デキサメタゾン誘導型のMKK3過剰発現体を用いた試験管内リン酸化反応,および,mkk3変異体を用いたゲル内リン酸化反応を行った結果,in vivoにおいてMKK3は傷害ストレスに応答してMPK8を活性化し,典型的なリン酸化による活性化のカスケードを構成することが明らかになった.
傷害ストレスにおける活性酸素種の蓄積にはCa2+シグナルとリン酸化シグナルの関与することが報告されている2,6).そこで,傷害ストレスで活性化されるMPK8に対するCa2+シグナルの影響を検討した.野生型植物にCa2+キレート剤であるEGTAを添加してMPK8の活性を測定すると,EGTAをくわえない場合に対して活性強度が半分ほどに低下した.さらに,mkk3変異体ではEGTAの存在下でMPK8の活性は完全に消失することが明らかになった.このことから,傷害によるMPK8の活性化にはMKK3によるリン酸化とCa2+シグナルの両方の制御が関与している可能性が示された.
3.カルモジュリンはMPK8と結合してリン酸化非依存的に活性化する
つぎに,MPK8と直接に結合するタンパク質を探索するため酵母ツーハイブリッドスクリーニングを行った.その結果,38の陽性クローンのすべてがCaM3,CaM4,CaM7を含むカルモジュリンであった.シロイヌナズナの葉肉細胞から分離させたプロトプラストにMPK8とカルモジュリンを一過的に発現させ,これらが結合したときのみYFPの蛍光シグナルが観察されるというBiFC法を用いてin vivoにおけるカルモジュリンとMPK8との結合を解析した.MPK8はCaM3,CaM4,CaM7のいずれとも結合することが明らかになった.一方,シロイヌナズナのほかのMAPキナーゼサブファミリーであるMPK3,MPK4,MPK6はカルモジュリンと結合しなかった.さらに,Ca2+存在下およびCa2+非存在下で抗体を用いた共免疫沈降実験を行った結果,MPK8とカルモジュリンとの結合にはCa2+が必要であることも明らかになった.また,MPK16やMPK17といったほかのTDY型MAPキナーゼもカルモジュリンと結合することから,MPK8を含むいくつかのTDY型MAPキナーゼはin vivoにおいてカルモジュリンと結合することが示唆された.
つぎに,MPK8とカルモジュリンとを共免疫沈降させたのち試験管内リン酸化反応を行った結果,カルモジュリンはMPK8と直接に結合しているときのみMPK8を活性化させることが明らかになった.さらに,MKK3によるリン酸化部位をさまざまなアミノ酸残基に置換したMPK8変異体を用いてカルモジュリンによる活性化を解析した結果,カルモジュリンはリン酸化を介すことなくMPK8を活性化することが示された.これまでに,動物ではTAB1がp38に結合することでp38の自己リン酸化が増幅され活性化が起こることが報告されている10).しかし,カルモジュリンによるMPK8の活性化は自己リン酸化の増幅はともなわないことも示され,これが新規なMAPキナーゼの活性化機構であることが証明された.
4.カルモジュリン-MKK3-MPK8経路はRbohD遺伝子の発現を介した活性酸素種の蓄積を負に制御する
mkk3変異体とカルモジュリンの阻害剤であるW7およびST-Aを用いた実験から,傷害ストレスにおけるMPK8の活性化にはMKK3によるリン酸化とカルモジュリンとの結合が必要であること,さらに,MPK8は傷害ストレス応答におけるCa2+シグナルとMAPキナーゼカスケードとのクロストークポイントとして機能していることが示された.つぎに,MPK8経路の下流の制御タンパク質の探索を行った.傷害ストレスにおける活性酸素種の生成にはNADPHオキシダーゼのひとつRbohDが重要な役割をはたすことが知られている3-5).そこで,MPK8経路によるRbohD遺伝子の発現への影響を検討した.mpk8変異体では傷害処理の30分後に一過的に上昇するRbohD遺伝子の発現が野生型よりも上昇し,MPK8過剰発現体ではこれが抑制されていることが明らかになった.さらに,mkk3変異体にカルモジュリン阻害剤であるW7を処理したのち傷害処理を行いRbohD遺伝子の発現を解析した結果,mpk8変異体と同様にRbohD遺伝子が過剰発現されていることが確認された.つぎに,mpk8 rbohD二重変異体を作製して傷害処理ののちの葉における活性酸素種の蓄積を解析した結果,mpk8変異体で観察された活性酸素種の過剰蓄積はmpk8 rbohD二重変異体では抑制されていることが明らかになった.したがって,傷害ストレスにおいてはカルモジュリンとMKK3という2つのタンパク質によるMPK8の活性化が起こり,MPK8はRbohD遺伝子の発現を負に制御することで活性酸素種の蓄積を制御しているものと考えられた(図2).
おわりに
この研究によって,TDY型MAPキナーゼのひとつであるMPK8はリン酸化を介すことなくカルモジュリンとの結合により活性化するという,新規なMAPキナーゼの活性化機構の存在することが示された.また,傷害ストレスにおいてCa2+シグナルとMAPキナーゼカスケードがMPK8を介し直接にクロストークし,活性酸素種の過剰蓄積を制御する安全弁として機能していることも明らかになった.筆者らは,ゲノム配列の解析から,TDY型MAPキナーゼは植物だけでなく進化の過程で葉緑体との共生をへたことのあるマラリアやトリパノソーマといった原虫にも存在するという知見を得ている.葉緑体をもつ好気性生物にとって,光合成による酸素の蓄積はストレスをうけた際に爆発的な活性酸素種の生成につながるため,その厳密な制御は生死にかかわる問題である.したがって,これらの生物においてTDY型MAPキナーゼは活性酸素種の過剰蓄積を抑制するために生まれた制御機構であることが推測される.今後は,立体構造解析を基盤とした,カルモジュリンによるTDY型MAPキナーゼの活性化を特異的に阻害する化合物のドラッグデザインの実施が期待される.また,プロテインキナーゼによるリン酸化修飾によらないカルモジュリン-MAPキナーゼ以外の新たな活性化機構の存在を探索するとともに,活性酸素種の蓄積量の制御,および,活性酸素種を利用した細胞間コミュニケーションにかかわるシグナル伝達の詳細を解明していく必要があるものと考えられる.
文 献
- Bouche, N., Yellin, A., Snedden, W. A. et al.: Plant-specific calmodulin-binding proteins. Annu. Rev. Plant Biol., 56, 435-466 (2005)[PubMed]
- Laloi, C., Apel, K. & Danon, A.: Reactive oxygen signalling: the latest news. Curr. Opin. Plant Biol., 7, 323-328 (2004)[PubMed]
- Torres, M. A. & Dangle, J. L.: Functions of the respiratory burst oxidase in biotic interactions, abiotic stress and development. Curr. Opin. Plant Biol., 8, 397-403 (2005)[PubMed]
- Ogasawara, Y., Kaya, H., Hiraoka, G. et al.: Synergistic activation of the Arabidopsis NADPH oxidase AtrbohD by Ca2+ and phosphorylation. J. Biol. Chem., 283, 8885-8892 (2008)[PubMed]
- Yoshioka, H., Asai, S., Yoshioka, M. et al.: Molecular mechanisms of generation for nitric oxide and reactive oxygen species, and role of the radical burst in plant immunity. Mol. Cell, 28, 321-329 (2009)[PubMed]
- Nakagami, H., Pitzschke, A. & Hirt, H.: Emerging MAP kinase pathways in plant stress signalling. Trends Plant Sci., 10, 339-346 (2005)[PubMed]
- Takahashi, F., Yoshida, R., Ichimura, K. et al.: The mitogen-activated protein kinase cascade MKK3-MPK6 is an important part of the jasmonate signal transduction pathway in Arabidopsis. Plant Cell, 19, 805-818 (2007)[PubMed]
- Ichimura, K., Shinozaki, K., Tena, G. et al.: Mitogen-activated protein kinase cascades in plants: a new nomenclature. Trends Plant Sci., 7, 301-308 (2002)[PubMed]
- Mizoguchi, T., Hayashida, N., Yamaguchi-Shinozaki, K. et al.: ATMPKs: a gene family of plant MAP kinases in Arabidopsis thaliana. FEBS Lett., 336, 440-444 (1993)[PubMed]
- Ge, B., Gram, H., Di Padova, F. et al.: MAPKK-independent activation of p38αmediated by TAB1-dependent autophosphorylation of p38α. Science, 295, 1291-1294 (2002)[PubMed]
著者プロフィール
略歴:2007年 筑波大学大学院生命環境科学研究科博士課程 修了,同年 理化学研究所 植物科学研究センター 特別研究員を経て,2010年より理化学研究所バイオマス工学研究プログラム 研究員.
研究テーマ:環境ストレスに応答する細胞内シグナル伝達系の解明.
溝口 剛(Tsuyoshi Mizoguchi)
筑波大学大学院生命環境科学研究科 准教授.
篠崎 一雄(Kazuo Shinozaki)
理化学研究所植物科学研究センター センター長・グループディレクター,理化学研究所バイオマス工学研究プログラム プログラムディレクター.
© 2011 高橋史憲・溝口 剛・篠崎一雄 Licensed under CC 表示 2.1 日本