RORγt陽性自然リンパ球による腸管免疫系の維持機構
澤 新一郎・Gérard Eberl
(フランスInstitut Pasteur,Lymphoid Tissue Development Unit)
email:澤 新一郎
DOI: 10.7875/first.author.2011.062
RORγt+ innate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota.
Shinichiro Sawa, Matthias Lochner, Naoko Satoh-Takayama, Sophie Dulauroy, Marion Bérard, Melanie Kleinschek, Daniel Cua, James P. Di Santo, Gérard Eberl
Nature Immunology, 12, 320-326 (2011)
核内受容体であるRORγtを発現するリンパ球は炎症性サイトカインであるIL-17またはIL-22を産生し,腸内に共生する細菌叢の保持および病原性細菌からの生体防御において重要なはたらきをしている.これまで,Th17細胞の発生および機能は腸管細菌叢による正の制御をうけていることが報告されていた.今回,筆者らは,RORγt陽性自然リンパ球が腸管における主要なIL-22産生細胞であること,RORγt陽性自然リンパ球に由来するIL-22は恒常的に産生されており,腸管細菌に依存的に腸管上皮より産生されるIL-25による負の制御をうけていることを明らかにした.さらに,RORγt陽性自然リンパ球は獲得免疫系と機能的に競合し,腸管上皮の障害により負の制御系から解放され高活性化状態となって,腸管免疫系の恒常性の再獲得のため重要なはたらきをすることも明らかにした.以上から,腸内細菌,獲得免疫およびRORγt陽性自然リンパ球は腸管において平衡状態をとり,腸管免疫系の恒常性の維持において重要なはたらきを担っていることが明らかになった.
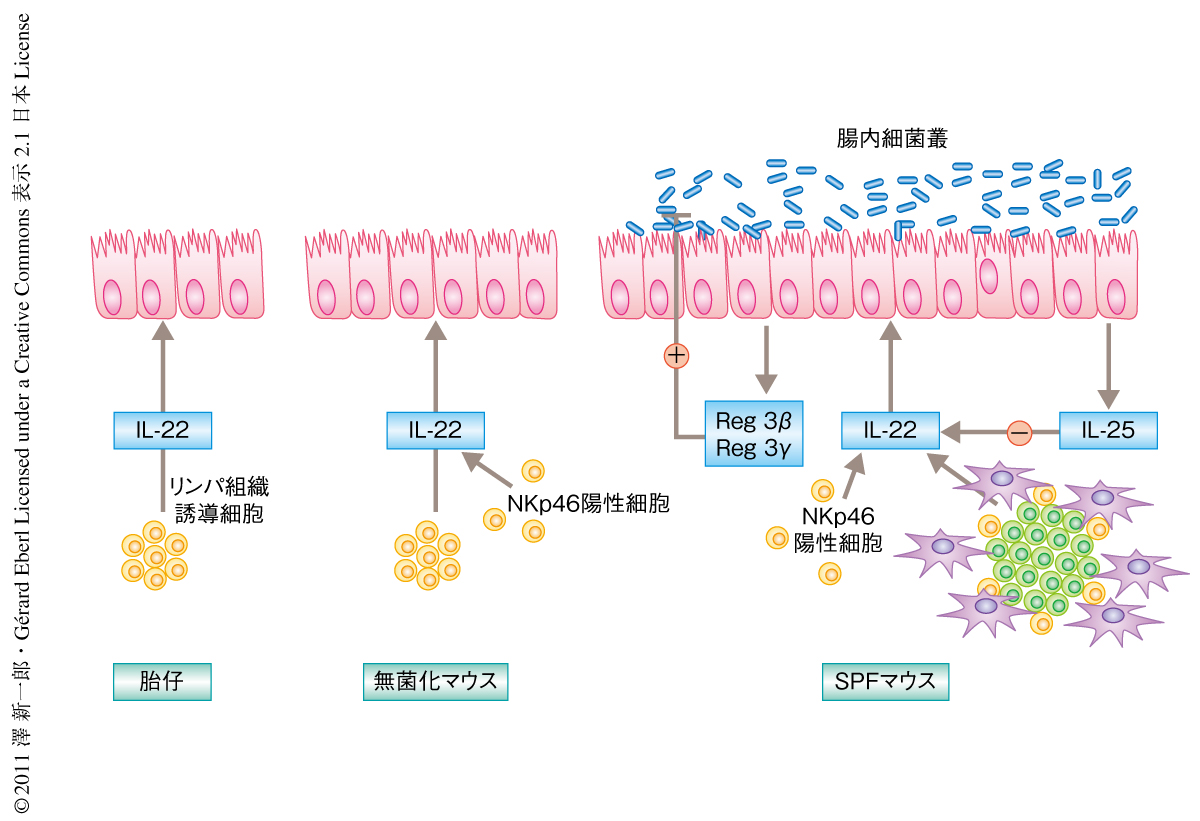
哺乳類の消化管には多種多様な細菌が生着し宿主と共生的な関係を保っている.ヒトの消化管には1×102種から1×103種にもおよぶ多様な細菌が共生し,その細菌の数は1×1014にもおよぶ.共生細菌は宿主の代謝経路の一部を肩代わりするだけでなく,宿主の免疫系の発達にも重要な役割をはたしている.たとえば,IL-17産生性ヘルパーT細胞は腸内細菌叢に依存的に発生することが知られている(IL:interleukin,インターロイキン).腸管免疫系は細菌との共生関係を実現するため,過剰な免疫反応を抑制する巧妙なしくみを用意している.そのひとつは物理的な障壁であり,腸管上皮層およびGoblet細胞から分泌される粘液(ムチン)層が細菌と免疫細胞との直接的な接触をさまたげている1).また,上皮細胞の一種であるPaneth細胞はS100AおよびREGファミリーといった抗菌ペプチドを産生し,病原性細菌のみならず共生細菌の数をも制御している.IL-22はIL-10ファミリーのサイトカインであり,IL-10R2とIL-22R1からなるヘテロ二量体を受容体とする.IL-10R2の発現が多岐にわたるのに対し,IL-22R1の発現は非造血系細胞に限局している.腸管では上皮細胞がおもなIL-22応答細胞であり,細胞内シグナル伝達に機能する転写因子STAT3を介した抗菌ペプチドREG3βの産生を誘導する.さらに,STAT3の下流で発現する抗アポトーシスタンパク質であるBcl2ファミリーが腸管上皮細胞の再生および修復を促進することが知られている2).デキストラン硫酸ナトリウム(DSS)による腸管上皮の障害は常在細菌の粘膜固有層への侵入をゆるしヒトの炎症性腸疾患に類似した病態を惹起する.上皮に特異的にSTAT3を欠失したマウスでは腸管上皮の再生が遅延し炎症が遷延する.IL-22ノックアウトマウスではCitrobacter rodentiumによる腸炎の重症化することが知られており,IL-22の下流で発現する抗菌ペプチドReg3βの発現低下および上皮細胞の修復遅延による障壁機構の喪失が重症化の原因であると考えられている3).筆者らは,マウス胎仔の肝臓にIL-22産生自然リンパ球の前駆細胞が存在し,出生ののちの腸内細菌の定着を予見するべく胎仔においてそれらの分化が準備されていると報告してきた4).
現在まで,腸管におけるIL-22の産生細胞については不明な点が多かった.樹状細胞のサブセットあるいはTh17細胞の一部がIL-22の産生細胞であると報告されてきたが,近年,自然リンパ球のサブセット,リンパ組織誘導細胞やNKp46陽性NK様細胞が粘膜組織においてIL-22を産生することがあいついで報告された5,6).Th17細胞やIL-22産生自然リンパ球の発生においては核内受容体RORγtが必須である5,7).IL-22の産生におけるRORγt依存性を調べるため,定常状態のRORγtノックアウトマウスに由来する腸管組織におけるIL-22遺伝子の発現を定量PCR法により調べた.その結果,RORγtノックアウトマウスではIL-22遺伝子の発現は皆無であり,定常状態におけるIL-22の発現はRORγt依存的に発生する細胞に限局していることが明らかになった.また,フローサイトメーターを用いたIL-22産生細胞の解析を行うと,IL-22産生細胞の約90%がRORγt陽性自然リンパ球であることが明らかになった.RORγtノックアウトマウスはデキストラン硫酸ナトリウムにより誘導される腸炎の罹患率および重症率の高いことが報告されている.この傾向は,獲得免疫系を欠損したRAG2欠損のバックグラウンドにおいても同様であることから,野生型マウスにおいてRORγt陽性自然リンパ球が腸炎の重症化をふせいでいるものと考えられた.
ヘルパーT細胞のサブセットであるTh17細胞は出生ののち腸管細菌叢により誘導されることが知られている.では,RORγt陽性自然リンパ球はどうだろうか? 胎仔のリンパ組織はRORγt陽性自然リンパ球の一種であるリンパ組織誘導細胞に依存的に発生する.胎仔そのものは無菌状態であることから,胎仔におけるリンパ組織誘導細胞の発生に必要なRORγtの発現自体はプログラムされた過程であると考えられた.一方,IL-22産生性のNK様細胞は出生ののち,つまり,腸内細菌叢が定着してから劇的に細胞の数が増加するが,マウスの日齢に依存的に発生がプログラムされている可能性も否定できない.そこで,RORγt-EGFPリポーターマウスを無菌化し腸管におけるRORγt陽性リンパ球の数を調べた.その結果,従来の報告と合致し,Th17細胞の数はSPFマウス(SPF:specific pathogen free,特定の病原体をもたないマウス)に比べ1/10以下に激減していたのに対し,NK様細胞を含めすべてのRORγt陽性自然リンパ球の数には変化がなかった4,8).また,Th17細胞を強力に誘導するセグメント細菌(segmental filamentous bacteria:SFB)のみを腸管に定着させたマウスにおいても,すべてのRORγt陽性リンパ球のサブセットは無菌化マウスと同様に発生していた.このことから,RORγt陽性自然リンパ球の発生は腸内細菌に非依存的に行われ,胎仔期よりプログラムされた過程であることが明らかになった.
IL-22の強力な誘導タンパク質であるIL-23(IL12p19)はマクロファージや樹状細胞などのミエロイド系細胞から産生されるが,その上流のシグナルは細菌に由来するTLRリガンドであることが知られている9).腸炎により腸管上皮が障害されると腸管組織におけるIL-23の濃度は上昇しIL-22が誘導される.腸内細菌叢はTh17細胞の分化を誘導するが,RORγt陽性自然リンパ球の発生は腸内細菌叢に非依存的である.では,定常状態の腸管においてRORγt陽性自然リンパ球に由来するIL-22は常在細菌により誘導されるのであろうか? さまざまな日齢のRORγt陽性自然リンパ球におけるIL-22の発現レベルをPCR法およびフローサイトメーターを用いて調べた.その結果,腸内細菌の数が爆発的に増加するまえの胎仔および新生仔マウスに由来するRORγt陽性自然リンパ球において成体マウスよりも高レベルのIL-22を認めた.また,無菌化マウスおよびSPFマウスに由来するRORγt陽性自然リンパ球を比較すると,無菌化マウスに由来するものに高レベルのIL-22を認めた.一方,無菌化マウスにおけるIL-23の発現は非常に低い.しかし,定常状態のIL-23ノックアウトマウスにおいてもRORγt陽性自然リンパ球におけるIL-22の産生は基礎レベルで認められ,定常状態の腸管におけるIL-22の産生はIL-23以外の因子によっても誘導されることが示唆された.以上から,RORγt陽性自然リンパ球のIL-22産生能は出生まえからプログラムされており,腸内細菌により負に制御されているものと考えられた.
つぎに,無菌化マウスとSPFマウスの腸管上皮細胞における遺伝子発現プロファイルを比較し,腸内細菌の存在において強く発現しているタンパク質のうちTh17細胞の分化抑制タンパク質として知られるIL-25(IL-17E)に注目した10).IL-25ノックアウトマウスに由来するRORγt陽性自然リンパ球ではIL-22の産生能が亢進していた.逆に,組換えIL-25を腹腔内に投与したマウスにおいてはRORγt陽性自然リンパ球におけるIL-22の産生が激減していた.さらに,IL-25がRORγt陽性自然リンパ球に由来するIL-22の産生を抑制する分子機構について解析した.IL-25ノックアウトマウスおよびIL-25を投与したマウスの腸管組織におけるIL-23のレベルは対照と同じ程度であり,IL-23ノックアウトマウスにIL-25を投与した場合もRORγt陽性自然リンパ球に由来するIL-22のレベルが低下していたことから,IL-25によるIL-22の産生抑制経路はIL-23に非依存的であることが明らかになった.また,IL-25受容体のサブユニットであるIL-17BRの発現はRORγt陽性自然リンパ球には認められないことから,IL-25による抑制作用は間接的であるものと考えられた.腸管におけるIL-17BRの発現細胞を検索すると,組織学的にRORγt陽性自然リンパ球と共局在する樹状細胞が見い出された.さらに,このIL-17BR陽性樹状細胞を単離しRORγt陽性自然リンパ球と試験管内で共培養したところ,IL-25の存在およびこの2つの細胞の接触のゆるされる条件においてのみRORγt陽性自然リンパ球に由来するIL-22の発現が低下した.これらの結果から,IL-25が樹状細胞に作用し,RORγt陽性自然リンパ球と直接的に接触することでIL-22の産生を抑制していることが明らかになった(図1).現在,これらの詳細な分子機構を解析中である.
腸内細菌叢によるRORγt陽性自然リンパ球の機能抑制は,さきに述べたIL-25を介した機構のほかに,発達した獲得免疫系の影響も考えられた.なぜならば,RORγt陽性自然リンパ球によるIL-22の産生能は獲得免疫の未発達の新生仔期よりまえや無菌化マウスにおいて高いが,腸内細菌に依存的に発達する獲得免疫系,とくに,Th17細胞の増加する成体マウスにおいては低下するからである.また,遺伝的に獲得免疫系が欠失しているRAG2欠損マウスのRORγt陽性自然リンパ球の数は野生型マウスの約4倍でIL-22の産生能も高値であったことから,腸内の微小環境においてRORγt陽性自然リンパ球は獲得免疫系の細胞,とくに,RORγtに依存的に発達するTh17細胞と競合的な関係にあり,両者は相互抑制関係にあるのではないかと考えられた.
腸炎の発症におけるRORγt陽性自然リンパ球の機能制御は腸管組織において高濃度となったIL-23に依存的であることが報告されている11).デキストラン硫酸ナトリウムにより誘導された腸炎モデルマウスにおいて腸管上皮におけるIL-25の発現が低下していることを見い出した.さらに,デキストラン硫酸ナトリウム誘導性の腸炎を発症しているRAG2欠損マウスに組換えIL-25を腹腔内投与すると,RORγt陽性自然リンパ球におけるIL-22の発現量が抑制され腸炎の重症化も観察された.これらの結果は,腸管上皮により発現量の調節されるIL-25は定常状態における腸管免疫系の恒常性の維持に重要なサイトカインであるだけでなく,炎症により恒常性が破綻した場合,腸管上皮の障壁の修復に必須のタンパク質であるIL-22の発現をも調節しうる重要な機能を備えていることを示唆した.
近年の分子生物学および細胞免疫学の発達により,複雑な腸管免疫系の解明につながるサイトカインネットワークおよび細胞の同定が急速に進められている.常在細菌と免疫系との平衡状態がなんらかの要因によりくずれた結果,ヒトの炎症性腸疾患が発症するのではないかという作業仮説にもとづき,今後も,腸管免疫系の恒常性の維持機構に関しての研究が展開されるであろう.本稿では,マウスにおける自然リンパ球を中心とした腸管免疫系の維持機構について論じた.今後,ヒトの炎症性腸疾患発症における自然リンパ球の詳細な生物学的な意義が解明されることを期待している.
略歴:2006年 大阪大学大学院医学系研究科 単位取得退学,同年 医学博士,同年よりフランスInstitut Pasteur研究員.
研究テーマ:腸管免疫.
抱負:自然リンパ球のヒトの疾患発症における役割を解明したい.
Gérard Eberl
フランスInstitut PasteurにてPrincipal Investigator.
© 2011 澤 新一郎・Gérard Eberl Licensed under CC 表示 2.1 日本
(フランスInstitut Pasteur,Lymphoid Tissue Development Unit)
email:澤 新一郎
DOI: 10.7875/first.author.2011.062
RORγt+ innate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota.
Shinichiro Sawa, Matthias Lochner, Naoko Satoh-Takayama, Sophie Dulauroy, Marion Bérard, Melanie Kleinschek, Daniel Cua, James P. Di Santo, Gérard Eberl
Nature Immunology, 12, 320-326 (2011)
要 約
核内受容体であるRORγtを発現するリンパ球は炎症性サイトカインであるIL-17またはIL-22を産生し,腸内に共生する細菌叢の保持および病原性細菌からの生体防御において重要なはたらきをしている.これまで,Th17細胞の発生および機能は腸管細菌叢による正の制御をうけていることが報告されていた.今回,筆者らは,RORγt陽性自然リンパ球が腸管における主要なIL-22産生細胞であること,RORγt陽性自然リンパ球に由来するIL-22は恒常的に産生されており,腸管細菌に依存的に腸管上皮より産生されるIL-25による負の制御をうけていることを明らかにした.さらに,RORγt陽性自然リンパ球は獲得免疫系と機能的に競合し,腸管上皮の障害により負の制御系から解放され高活性化状態となって,腸管免疫系の恒常性の再獲得のため重要なはたらきをすることも明らかにした.以上から,腸内細菌,獲得免疫およびRORγt陽性自然リンパ球は腸管において平衡状態をとり,腸管免疫系の恒常性の維持において重要なはたらきを担っていることが明らかになった.
はじめに
哺乳類の消化管には多種多様な細菌が生着し宿主と共生的な関係を保っている.ヒトの消化管には1×102種から1×103種にもおよぶ多様な細菌が共生し,その細菌の数は1×1014にもおよぶ.共生細菌は宿主の代謝経路の一部を肩代わりするだけでなく,宿主の免疫系の発達にも重要な役割をはたしている.たとえば,IL-17産生性ヘルパーT細胞は腸内細菌叢に依存的に発生することが知られている(IL:interleukin,インターロイキン).腸管免疫系は細菌との共生関係を実現するため,過剰な免疫反応を抑制する巧妙なしくみを用意している.そのひとつは物理的な障壁であり,腸管上皮層およびGoblet細胞から分泌される粘液(ムチン)層が細菌と免疫細胞との直接的な接触をさまたげている1).また,上皮細胞の一種であるPaneth細胞はS100AおよびREGファミリーといった抗菌ペプチドを産生し,病原性細菌のみならず共生細菌の数をも制御している.IL-22はIL-10ファミリーのサイトカインであり,IL-10R2とIL-22R1からなるヘテロ二量体を受容体とする.IL-10R2の発現が多岐にわたるのに対し,IL-22R1の発現は非造血系細胞に限局している.腸管では上皮細胞がおもなIL-22応答細胞であり,細胞内シグナル伝達に機能する転写因子STAT3を介した抗菌ペプチドREG3βの産生を誘導する.さらに,STAT3の下流で発現する抗アポトーシスタンパク質であるBcl2ファミリーが腸管上皮細胞の再生および修復を促進することが知られている2).デキストラン硫酸ナトリウム(DSS)による腸管上皮の障害は常在細菌の粘膜固有層への侵入をゆるしヒトの炎症性腸疾患に類似した病態を惹起する.上皮に特異的にSTAT3を欠失したマウスでは腸管上皮の再生が遅延し炎症が遷延する.IL-22ノックアウトマウスではCitrobacter rodentiumによる腸炎の重症化することが知られており,IL-22の下流で発現する抗菌ペプチドReg3βの発現低下および上皮細胞の修復遅延による障壁機構の喪失が重症化の原因であると考えられている3).筆者らは,マウス胎仔の肝臓にIL-22産生自然リンパ球の前駆細胞が存在し,出生ののちの腸内細菌の定着を予見するべく胎仔においてそれらの分化が準備されていると報告してきた4).
1.RORγt陽性自然リンパ球は腸管におけるIL-22の主要な産生細胞である
現在まで,腸管におけるIL-22の産生細胞については不明な点が多かった.樹状細胞のサブセットあるいはTh17細胞の一部がIL-22の産生細胞であると報告されてきたが,近年,自然リンパ球のサブセット,リンパ組織誘導細胞やNKp46陽性NK様細胞が粘膜組織においてIL-22を産生することがあいついで報告された5,6).Th17細胞やIL-22産生自然リンパ球の発生においては核内受容体RORγtが必須である5,7).IL-22の産生におけるRORγt依存性を調べるため,定常状態のRORγtノックアウトマウスに由来する腸管組織におけるIL-22遺伝子の発現を定量PCR法により調べた.その結果,RORγtノックアウトマウスではIL-22遺伝子の発現は皆無であり,定常状態におけるIL-22の発現はRORγt依存的に発生する細胞に限局していることが明らかになった.また,フローサイトメーターを用いたIL-22産生細胞の解析を行うと,IL-22産生細胞の約90%がRORγt陽性自然リンパ球であることが明らかになった.RORγtノックアウトマウスはデキストラン硫酸ナトリウムにより誘導される腸炎の罹患率および重症率の高いことが報告されている.この傾向は,獲得免疫系を欠損したRAG2欠損のバックグラウンドにおいても同様であることから,野生型マウスにおいてRORγt陽性自然リンパ球が腸炎の重症化をふせいでいるものと考えられた.
2.RORγt陽性自然リンパ球の発生は胎仔期よりプログラムされている
ヘルパーT細胞のサブセットであるTh17細胞は出生ののち腸管細菌叢により誘導されることが知られている.では,RORγt陽性自然リンパ球はどうだろうか? 胎仔のリンパ組織はRORγt陽性自然リンパ球の一種であるリンパ組織誘導細胞に依存的に発生する.胎仔そのものは無菌状態であることから,胎仔におけるリンパ組織誘導細胞の発生に必要なRORγtの発現自体はプログラムされた過程であると考えられた.一方,IL-22産生性のNK様細胞は出生ののち,つまり,腸内細菌叢が定着してから劇的に細胞の数が増加するが,マウスの日齢に依存的に発生がプログラムされている可能性も否定できない.そこで,RORγt-EGFPリポーターマウスを無菌化し腸管におけるRORγt陽性リンパ球の数を調べた.その結果,従来の報告と合致し,Th17細胞の数はSPFマウス(SPF:specific pathogen free,特定の病原体をもたないマウス)に比べ1/10以下に激減していたのに対し,NK様細胞を含めすべてのRORγt陽性自然リンパ球の数には変化がなかった4,8).また,Th17細胞を強力に誘導するセグメント細菌(segmental filamentous bacteria:SFB)のみを腸管に定着させたマウスにおいても,すべてのRORγt陽性リンパ球のサブセットは無菌化マウスと同様に発生していた.このことから,RORγt陽性自然リンパ球の発生は腸内細菌に非依存的に行われ,胎仔期よりプログラムされた過程であることが明らかになった.
3.腸内細菌叢はRORγt陽性自然リンパ球の機能を負に制御する
IL-22の強力な誘導タンパク質であるIL-23(IL12p19)はマクロファージや樹状細胞などのミエロイド系細胞から産生されるが,その上流のシグナルは細菌に由来するTLRリガンドであることが知られている9).腸炎により腸管上皮が障害されると腸管組織におけるIL-23の濃度は上昇しIL-22が誘導される.腸内細菌叢はTh17細胞の分化を誘導するが,RORγt陽性自然リンパ球の発生は腸内細菌叢に非依存的である.では,定常状態の腸管においてRORγt陽性自然リンパ球に由来するIL-22は常在細菌により誘導されるのであろうか? さまざまな日齢のRORγt陽性自然リンパ球におけるIL-22の発現レベルをPCR法およびフローサイトメーターを用いて調べた.その結果,腸内細菌の数が爆発的に増加するまえの胎仔および新生仔マウスに由来するRORγt陽性自然リンパ球において成体マウスよりも高レベルのIL-22を認めた.また,無菌化マウスおよびSPFマウスに由来するRORγt陽性自然リンパ球を比較すると,無菌化マウスに由来するものに高レベルのIL-22を認めた.一方,無菌化マウスにおけるIL-23の発現は非常に低い.しかし,定常状態のIL-23ノックアウトマウスにおいてもRORγt陽性自然リンパ球におけるIL-22の産生は基礎レベルで認められ,定常状態の腸管におけるIL-22の産生はIL-23以外の因子によっても誘導されることが示唆された.以上から,RORγt陽性自然リンパ球のIL-22産生能は出生まえからプログラムされており,腸内細菌により負に制御されているものと考えられた.
つぎに,無菌化マウスとSPFマウスの腸管上皮細胞における遺伝子発現プロファイルを比較し,腸内細菌の存在において強く発現しているタンパク質のうちTh17細胞の分化抑制タンパク質として知られるIL-25(IL-17E)に注目した10).IL-25ノックアウトマウスに由来するRORγt陽性自然リンパ球ではIL-22の産生能が亢進していた.逆に,組換えIL-25を腹腔内に投与したマウスにおいてはRORγt陽性自然リンパ球におけるIL-22の産生が激減していた.さらに,IL-25がRORγt陽性自然リンパ球に由来するIL-22の産生を抑制する分子機構について解析した.IL-25ノックアウトマウスおよびIL-25を投与したマウスの腸管組織におけるIL-23のレベルは対照と同じ程度であり,IL-23ノックアウトマウスにIL-25を投与した場合もRORγt陽性自然リンパ球に由来するIL-22のレベルが低下していたことから,IL-25によるIL-22の産生抑制経路はIL-23に非依存的であることが明らかになった.また,IL-25受容体のサブユニットであるIL-17BRの発現はRORγt陽性自然リンパ球には認められないことから,IL-25による抑制作用は間接的であるものと考えられた.腸管におけるIL-17BRの発現細胞を検索すると,組織学的にRORγt陽性自然リンパ球と共局在する樹状細胞が見い出された.さらに,このIL-17BR陽性樹状細胞を単離しRORγt陽性自然リンパ球と試験管内で共培養したところ,IL-25の存在およびこの2つの細胞の接触のゆるされる条件においてのみRORγt陽性自然リンパ球に由来するIL-22の発現が低下した.これらの結果から,IL-25が樹状細胞に作用し,RORγt陽性自然リンパ球と直接的に接触することでIL-22の産生を抑制していることが明らかになった(図1).現在,これらの詳細な分子機構を解析中である.
4.RORγt陽性自然リンパ球は生体においてT細胞と機能的に競合する
腸内細菌叢によるRORγt陽性自然リンパ球の機能抑制は,さきに述べたIL-25を介した機構のほかに,発達した獲得免疫系の影響も考えられた.なぜならば,RORγt陽性自然リンパ球によるIL-22の産生能は獲得免疫の未発達の新生仔期よりまえや無菌化マウスにおいて高いが,腸内細菌に依存的に発達する獲得免疫系,とくに,Th17細胞の増加する成体マウスにおいては低下するからである.また,遺伝的に獲得免疫系が欠失しているRAG2欠損マウスのRORγt陽性自然リンパ球の数は野生型マウスの約4倍でIL-22の産生能も高値であったことから,腸内の微小環境においてRORγt陽性自然リンパ球は獲得免疫系の細胞,とくに,RORγtに依存的に発達するTh17細胞と競合的な関係にあり,両者は相互抑制関係にあるのではないかと考えられた.
5.炎症におけるIL-25の役割
腸炎の発症におけるRORγt陽性自然リンパ球の機能制御は腸管組織において高濃度となったIL-23に依存的であることが報告されている11).デキストラン硫酸ナトリウムにより誘導された腸炎モデルマウスにおいて腸管上皮におけるIL-25の発現が低下していることを見い出した.さらに,デキストラン硫酸ナトリウム誘導性の腸炎を発症しているRAG2欠損マウスに組換えIL-25を腹腔内投与すると,RORγt陽性自然リンパ球におけるIL-22の発現量が抑制され腸炎の重症化も観察された.これらの結果は,腸管上皮により発現量の調節されるIL-25は定常状態における腸管免疫系の恒常性の維持に重要なサイトカインであるだけでなく,炎症により恒常性が破綻した場合,腸管上皮の障壁の修復に必須のタンパク質であるIL-22の発現をも調節しうる重要な機能を備えていることを示唆した.
おわりに
近年の分子生物学および細胞免疫学の発達により,複雑な腸管免疫系の解明につながるサイトカインネットワークおよび細胞の同定が急速に進められている.常在細菌と免疫系との平衡状態がなんらかの要因によりくずれた結果,ヒトの炎症性腸疾患が発症するのではないかという作業仮説にもとづき,今後も,腸管免疫系の恒常性の維持機構に関しての研究が展開されるであろう.本稿では,マウスにおける自然リンパ球を中心とした腸管免疫系の維持機構について論じた.今後,ヒトの炎症性腸疾患発症における自然リンパ球の詳細な生物学的な意義が解明されることを期待している.
文 献
- Hooper, L. V. & Macpherson, A. J.: Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol., 10, 159-169 (2010)[PubMed]
- Pickert, G., Neufert, C., Leppkes M. et al.: STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. J. Exp. Med., 206, 1465-1472 (2009)[PubMed]
- Zheng, Y., Valdez, P. A., Danilenko, D. M. et al.: Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens. Nat. Med., 14, 282-289 (2008)[PubMed]
- Sawa, S., Cherrier, M., Lochner, M. et al.: Lineage relationship analysis of RORγt+ innate lymphoid cells. Science, 330, 665-669 (2010)[PubMed]
- Satoh-Takayama, N., Vosshenrich, C. A., Lesjean-Pottier, S. et al.: Microbial flora drives interleukin 22 production in intestinal NKp46+ cells that provide innate mucosal immune defense. Immunity, 29, 958-970 (2008)[PubMed]
- Takatori, H., Kanno, Y., Watford, W. T. et al.: Lymphoid tissue inducer-like cells are an innate source of IL-17 and IL-22. J. Exp. Med., 206, 35-41 (2009)[PubMed]
- Ivanov, I. I., McKenzie, B. S., Zhou, L. et al.: The orphan nuclear receptor RORγt directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell, 126, 1121-1133 (2006)[PubMed]
- Ivanov, I. I., Atarashi, K., Manel, N. et al.: Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 139, 485-498 (2009)[PubMed]
- Kastelein, R. A., Hunter, C. A. & Cua, D. J.: Discovery and biology of IL-23 and IL-27: related but functionally distinct regulators of inflammation. Annu. Rev. Immunol., 25, 221-242 (2007)[PubMed]
- Zaph, C., Du, Y., Saenz, S. A.: Commensal-dependent expression of IL-25 regulates the IL-23 - IL-17 axis in the intestine. J. Exp. Med., 205, 2191-2198 (2008)[PubMed]
- Sonnenberg, G. F., Monticelli, L. A. & Elloso, M. M.: CD4+ lymphoid tissue-inducer cells promote innate immunity in the gut. Immunity, 34, 122-134 (2011)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科 単位取得退学,同年 医学博士,同年よりフランスInstitut Pasteur研究員.
研究テーマ:腸管免疫.
抱負:自然リンパ球のヒトの疾患発症における役割を解明したい.
Gérard Eberl
フランスInstitut PasteurにてPrincipal Investigator.
© 2011 澤 新一郎・Gérard Eberl Licensed under CC 表示 2.1 日本