疾患ヒトiPS細胞を用いたTimothy症候群の患者に由来する心筋細胞の解析
矢澤 真幸
(米国Stanford大学School of Medicine,Department of Neurobiology)
email:矢澤真幸
DOI: 10.7875/first.author.2011.040
Using induced pluripotent stem cells to investigate cardiac phenotypes in Timothy syndrome.
Masayuki Yazawa, Brian Hsueh, Xiaolin Jia, Anca M. Pasca, Jonathan A. Bernstein, Joachim Hallmayer, Ricardo E. Dolmetsch
Nature, 471, 230-234 (2011)
心電図において認められる活動電位時間の延長は心室頻拍を惹起し突然死をひき起こす可能性がある.これまで先天性および後天性の活動電位延長症候群が報告されてきており,前者はおもにイオンチャネルの遺伝子突然変異,後者は薬剤による副作用や環境要因などの関係していることが知られている.この研究は,Timothy症候群に関連している電位依存性L型Ca2+チャネルのひとつCaV1.2における遺伝子突然変異に着目して,Timothy症候群の患者より皮膚細胞を摘出したのちリプログラミングを行い疾患ヒトiPS細胞を樹立した.そののち,このTimothy症候群の患者に由来するiPS細胞を心筋細胞へと分化させ,電気生理学的な解析およびCa2+イメージング法を用いて,患者に由来する心筋細胞における不規則な筋収縮,過剰なCa2+流入,活動電位時間の延長,不規則な活動電位,不規則な自発性Ca2+上昇を明らかにした.さらに,化合物試験を行って,ロスコビチンが患者に由来する心筋細胞においてCa2+流入,活動電位,自発性Ca2+上昇を正常にもどす作用のあることをつきとめた.患者から樹立したiPS細胞に由来する心筋細胞で観察された表現型は患者の心臓に認められた症状と類似していることから,この研究は不整脈の有用なモデルとなり,さらには,今後の薬剤スクリーニングにも役立つことが明らかになった.
心電図において活動電位時間(QT時間)は心室筋の活動電位持続時間の平均的な長さを表すが,遺伝性および薬剤誘導性の活動電位時間の延長による不整脈や突然死は患者のみならず臨床研究および製薬会社においても非常に関心の高い問題である1,2).これまでに,少なくとも10以上の遺伝子突然変異が活動電位延長症候群に関連していると報告されているが,その作用機序はいまだ不明である.また,薬剤誘導性の活動電位時間の延長は,治験において薬剤開発の中止につながる要因となる薬剤の副作用のおもなものにもあげられている.治験前段階でこのような副作用のみすごされる大きな要因として,マウスやウサギといったモデル動物はヒトとは心拍数も電気的な活動も大きく異なるにもかかわらず,初期段階の薬剤スクリーニングをそういったモデル動物にたよってきたという背景がある.したがって,活動電位延長症候群あるいは不整脈のヒト疾患モデルはその分子機構また薬剤の作用機序を研究するうえで必要不可欠なものである.
Ca2+シグナルは心筋細胞における興奮収縮連関において必須であり,電位依存性L型Ca2+チャネルのひとつCaV1.2は細胞外からのCa2+流入の調節を担っている.これまでに,CaV1.2遺伝子の突然変異が活動電位延長症候群や自閉症などを生じるTimothy症候群にかかわっていることが報告されている3).患者に認められた406番目のグリシン残基がアルギニン残基に置換する突然変異はCaV1.2の不活性化に影響することがわかっているが,CaV1.2の変異体がヒトの心臓においてどのように活動電位延長症候群や致死性の不整脈をひき起こすのかはいまだ不明である.
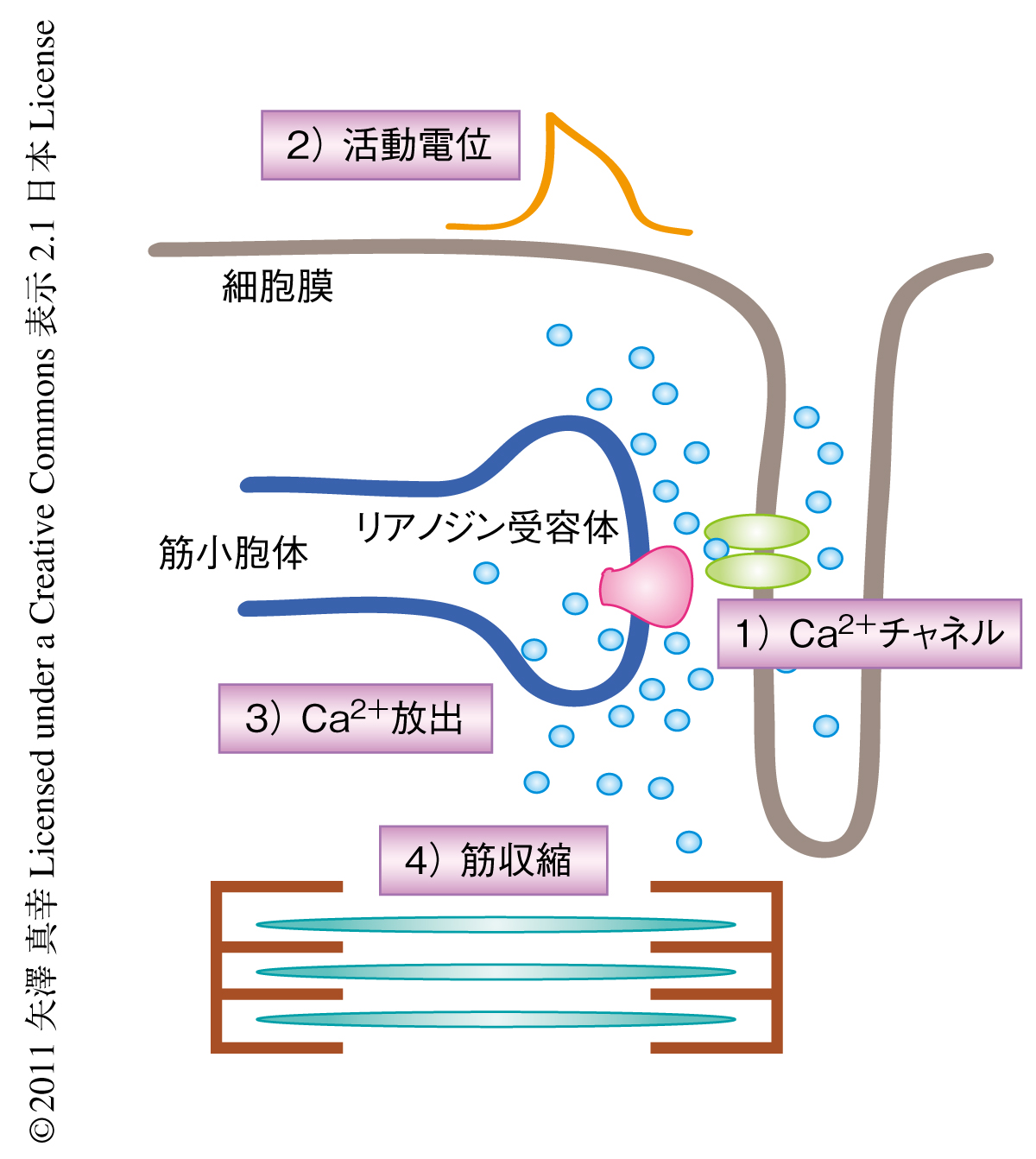
2007年,ヒトの皮膚細胞よりiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が樹立され4),幹細胞の研究は大きな進歩を遂げた.ヒトiPS細胞はヒトES細胞(embryonic stem cell,胚性幹細胞)と同様の機能を示し三胚葉すべての細胞へと分化させることが可能であることから,ヒト疾患モデルを確立するうえでiPS細胞が有効な材料となることは明らかである5).そこで,この研究は,Timothy症候群の患者の皮膚細胞よりiPS細胞を樹立し,心筋細胞へと分化させたのち,活動電位延長症候群や不整脈の分子機構の解明,さらには,薬剤スクリーニングを行った(図1).
Timothy症候群の患者からiPS細胞を樹立するにあたって,はじめに皮膚生検を用いて皮膚細胞を摘出し培養した.皮膚細胞において患者に由来する細胞にはCaV1.2遺伝子の突然変異のあることを確認したのち,山中因子(SOX2,OCT3/4,KLF4,c-MYC)を発現するレトロウイルスを患者の皮膚細胞および対照の細胞に導入することでリプログラミングを行い,患者に由来するiPS細胞を計16株,対照となるiPS細胞を計10株,樹立した.患者と対照のiPS細胞それぞれ5株ずつを機能解析および心筋細胞への分化に利用した.まず,すべての株においてCaV1.2遺伝子の突然変異の有無を確認し,患者に由来するiPS細胞のみにTimothy症候群に関連するCaV1.2遺伝子の突然変異が認められることを確認した.さらに,免疫蛍光染色法,マイクロアレイ,リアルタイムPCR,核型分析,テラトーマ形成試験により,樹立したすべてのiPS細胞が万能性をもち三胚葉すべての細胞へと分化する能力をもつことを明らかにした.また,樹立したすべてのiPS細胞において4種類のレトロウイルスが導入された染色体の位置と数を調べ,レトロウイルスの導入が内在性の遺伝子の発現には影響をもたないことを確認した.さらには,核型分析を行い,樹立したiPS細胞に染色体異常のないことを確認した.
Timothy症候群の患者に由来するiPS細胞から心筋細胞を作製するのにあたっては,胚様体法を用いiPS細胞を心筋細胞に分化させた.分化誘導ののち37日目には平均10%ほどの胚様体が自発性の収縮を示した.心筋細胞に特異的な遺伝子の発現を確認するため,対照および患者に由来する自発性収縮を示す胚様体を回収し,mRNAを調製しcDNAの合成ののちRT-PCR法を行った.対照および患者に由来する自発性収縮を示す胚様体において心筋細胞に特異的な遺伝子であるANP遺伝子およびβミオシン重鎖遺伝子の発現,および,CaV1.2遺伝子の発現が認められた一方,万能細胞に特異的に発現するNanog遺伝子の発現は消失していた.さらに,患者に由来する胚様体の筋収縮の特性を調べるため,毎秒5回の連続写真を撮り毎分の収縮数と筋収縮との規則性を調べた.対照に由来する胚様体に比べ,患者に由来する胚様体において有意な収縮数の減少および不規則性が認められた.これらの表現型はTimothy症候群の患者に認められている徐脈および不整脈に一致するものと思われた.このことは,疾患ヒトiPS細胞を用いて作製したTimothy症候群のモデルが,実際の患者の心臓の症状を細胞培養皿において再現できることを示していた.
iPS細胞から作製した心筋細胞において電気生理学的な手法や生細胞イメージング法を行うため,対照および患者に由来する胚様体をトリプシン処理により単細胞に分離した.まず,免疫蛍光染色法を用いて,対照および患者に由来する心筋細胞において心筋細胞のマーカーであるαアクチニンと心臓トロポニンIの発現を確認した.患者に由来する心筋細胞には顕著なサルコメア構造の障害は認められなかった.つぎに,パッチクランプ法を用いて対照および患者に由来する心筋細胞におけるCa2+流入量および活動電位を測定した.患者に由来する心室性の心筋細胞において有意なCaV1.2の不活性化の減少が認められ,過剰なCa2+流入の生じていることが示された.さらに,活動電位の測定によって有意な自発性の活動電位時間の延長と不規則性,遅延後脱分極の増加していることが明らかになった(図1).この活動電位における障害は患者が示す心室性の不整脈や活動電位時間の延長に一致するものであった.
共焦点顕微鏡およびFluo-4 AMを用いた高速Ca2+濃度測定法を用いて,iPS細胞から作製した心筋細胞における自発性Ca2+上昇を調べた.対照と比較して,患者に由来する心筋細胞において有意に自発性Ca2+上昇量および不規則性の増加が認められた.この表現型はこれまでTimothy症候群の患者に由来する心筋細胞において認められた収縮の不規則性に一致するものであり,また,CaV1.2による細胞外からのCa2+流入が自発性Ca2+放出の調節に役割を担っていることが明らかになった.
患者に由来する心筋細胞において認められた表現型から,このモデルはTimothy症候群の治療に有効な化合物を試験するのに有用な系となることが示唆された.そこで,これまでにCaV1.2の不活性化を促進すると報告されているロスコビチン6) の作用を患者に由来する心筋細胞において調べた.驚くべきことに,33.3μMのロスコビチンが自発性Ca2+上昇量および不規則性を有意に軽減することがわかった.さらに,電気生理学的な手法を用いてロスコビチンのCa2+流入量と活動電位に対する影響を調べたところ,患者に由来する心筋細胞においてロスコビチンがCaV1.2の不活性化を促進して正常値にもどすこと,不規則に延長した活動電位時間を有意に抑制することが認められた(図1).
この研究により,Timothy症候群の患者に由来する心筋細胞において認められた収縮数の減少,不規則な収縮の増加,CaV1.2の不活性化の減少,Ca2+流入量の増加,活動電位の延長,遅延後脱分極の増加,不規則な自発性Ca2+上昇の増加は,Timothy症候群の患者で認められる心臓の表現型に一致するものであり(図2),ロスコビチンにそれらを正常に戻す作用のあることが明らかになった.活動電位延長症候群タイプ8とされるTimothy症候群を対象としたこの研究と同様に,これまで疾患ヒトiPS細胞を用いて,活動電位延長症候群タイプ1とタイプ2のモデルが作製されている7,8).そこでも,患者に由来する心筋細胞において電気生理学的な解析が行われ,活動電位時間の延長に関与する心室性の心筋細胞の活動電位が延長し不規則となっていることが示されている.このことからも,疾患ヒトiPS細胞を用いた不整脈あるいは活動電位延長症候群の疾患モデルがその分子機構を解明するうえで非常に有効な手法であることが証明されている.
また,この研究において,疾患ヒトiPS細胞を用いて樹立されたTimothy症候群の心筋細胞モデルでのロスコビチンの化合物試験とその結果は,この系が化合物スクリーニングに有効であることを示すものであった.ただし,もともとロスコビチンは細胞増殖に関与するサイクリン依存性キナーゼの阻害薬として,現在,治験第II相の開発段階にある薬剤であり,CaV1.2以外への作用の可能性も十分に考えうる.しかしながら,この研究を起点とし,今後,ロスコビチンの化学修飾もしくはその誘導体から,副作用が少なくより特異的にCaV1.2へ作用する化合物の同定に取り組むことも可能であると思われる.この研究により,疾患ヒトiPS細胞を用いた疾患モデルが不整脈の薬剤開発に新たな道を開くことが明らかになった.
略歴:2007年 京都大学薬学研究科博士課程 修了,同年より米国Stanford大学School of Medicineポスドク.
研究テーマ:筋および神経生理学,薬剤スクリーニング,新規のバイオツールの開発.
抱負:生命現象を解明するための新しい扉を開くようなテクノロジーを開発していきたい.
© 2011 矢澤 真幸 Licensed under CC 表示 2.1 日本
(米国Stanford大学School of Medicine,Department of Neurobiology)
email:矢澤真幸
DOI: 10.7875/first.author.2011.040
Using induced pluripotent stem cells to investigate cardiac phenotypes in Timothy syndrome.
Masayuki Yazawa, Brian Hsueh, Xiaolin Jia, Anca M. Pasca, Jonathan A. Bernstein, Joachim Hallmayer, Ricardo E. Dolmetsch
Nature, 471, 230-234 (2011)
要 約
心電図において認められる活動電位時間の延長は心室頻拍を惹起し突然死をひき起こす可能性がある.これまで先天性および後天性の活動電位延長症候群が報告されてきており,前者はおもにイオンチャネルの遺伝子突然変異,後者は薬剤による副作用や環境要因などの関係していることが知られている.この研究は,Timothy症候群に関連している電位依存性L型Ca2+チャネルのひとつCaV1.2における遺伝子突然変異に着目して,Timothy症候群の患者より皮膚細胞を摘出したのちリプログラミングを行い疾患ヒトiPS細胞を樹立した.そののち,このTimothy症候群の患者に由来するiPS細胞を心筋細胞へと分化させ,電気生理学的な解析およびCa2+イメージング法を用いて,患者に由来する心筋細胞における不規則な筋収縮,過剰なCa2+流入,活動電位時間の延長,不規則な活動電位,不規則な自発性Ca2+上昇を明らかにした.さらに,化合物試験を行って,ロスコビチンが患者に由来する心筋細胞においてCa2+流入,活動電位,自発性Ca2+上昇を正常にもどす作用のあることをつきとめた.患者から樹立したiPS細胞に由来する心筋細胞で観察された表現型は患者の心臓に認められた症状と類似していることから,この研究は不整脈の有用なモデルとなり,さらには,今後の薬剤スクリーニングにも役立つことが明らかになった.
はじめに
心電図において活動電位時間(QT時間)は心室筋の活動電位持続時間の平均的な長さを表すが,遺伝性および薬剤誘導性の活動電位時間の延長による不整脈や突然死は患者のみならず臨床研究および製薬会社においても非常に関心の高い問題である1,2).これまでに,少なくとも10以上の遺伝子突然変異が活動電位延長症候群に関連していると報告されているが,その作用機序はいまだ不明である.また,薬剤誘導性の活動電位時間の延長は,治験において薬剤開発の中止につながる要因となる薬剤の副作用のおもなものにもあげられている.治験前段階でこのような副作用のみすごされる大きな要因として,マウスやウサギといったモデル動物はヒトとは心拍数も電気的な活動も大きく異なるにもかかわらず,初期段階の薬剤スクリーニングをそういったモデル動物にたよってきたという背景がある.したがって,活動電位延長症候群あるいは不整脈のヒト疾患モデルはその分子機構また薬剤の作用機序を研究するうえで必要不可欠なものである.
Ca2+シグナルは心筋細胞における興奮収縮連関において必須であり,電位依存性L型Ca2+チャネルのひとつCaV1.2は細胞外からのCa2+流入の調節を担っている.これまでに,CaV1.2遺伝子の突然変異が活動電位延長症候群や自閉症などを生じるTimothy症候群にかかわっていることが報告されている3).患者に認められた406番目のグリシン残基がアルギニン残基に置換する突然変異はCaV1.2の不活性化に影響することがわかっているが,CaV1.2の変異体がヒトの心臓においてどのように活動電位延長症候群や致死性の不整脈をひき起こすのかはいまだ不明である.
2007年,ヒトの皮膚細胞よりiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が樹立され4),幹細胞の研究は大きな進歩を遂げた.ヒトiPS細胞はヒトES細胞(embryonic stem cell,胚性幹細胞)と同様の機能を示し三胚葉すべての細胞へと分化させることが可能であることから,ヒト疾患モデルを確立するうえでiPS細胞が有効な材料となることは明らかである5).そこで,この研究は,Timothy症候群の患者の皮膚細胞よりiPS細胞を樹立し,心筋細胞へと分化させたのち,活動電位延長症候群や不整脈の分子機構の解明,さらには,薬剤スクリーニングを行った(図1).
1.疾患ヒトiPS細胞の樹立
Timothy症候群の患者からiPS細胞を樹立するにあたって,はじめに皮膚生検を用いて皮膚細胞を摘出し培養した.皮膚細胞において患者に由来する細胞にはCaV1.2遺伝子の突然変異のあることを確認したのち,山中因子(SOX2,OCT3/4,KLF4,c-MYC)を発現するレトロウイルスを患者の皮膚細胞および対照の細胞に導入することでリプログラミングを行い,患者に由来するiPS細胞を計16株,対照となるiPS細胞を計10株,樹立した.患者と対照のiPS細胞それぞれ5株ずつを機能解析および心筋細胞への分化に利用した.まず,すべての株においてCaV1.2遺伝子の突然変異の有無を確認し,患者に由来するiPS細胞のみにTimothy症候群に関連するCaV1.2遺伝子の突然変異が認められることを確認した.さらに,免疫蛍光染色法,マイクロアレイ,リアルタイムPCR,核型分析,テラトーマ形成試験により,樹立したすべてのiPS細胞が万能性をもち三胚葉すべての細胞へと分化する能力をもつことを明らかにした.また,樹立したすべてのiPS細胞において4種類のレトロウイルスが導入された染色体の位置と数を調べ,レトロウイルスの導入が内在性の遺伝子の発現には影響をもたないことを確認した.さらには,核型分析を行い,樹立したiPS細胞に染色体異常のないことを確認した.
2.疾患ヒトiPS細胞からの心筋細胞の樹立
Timothy症候群の患者に由来するiPS細胞から心筋細胞を作製するのにあたっては,胚様体法を用いiPS細胞を心筋細胞に分化させた.分化誘導ののち37日目には平均10%ほどの胚様体が自発性の収縮を示した.心筋細胞に特異的な遺伝子の発現を確認するため,対照および患者に由来する自発性収縮を示す胚様体を回収し,mRNAを調製しcDNAの合成ののちRT-PCR法を行った.対照および患者に由来する自発性収縮を示す胚様体において心筋細胞に特異的な遺伝子であるANP遺伝子およびβミオシン重鎖遺伝子の発現,および,CaV1.2遺伝子の発現が認められた一方,万能細胞に特異的に発現するNanog遺伝子の発現は消失していた.さらに,患者に由来する胚様体の筋収縮の特性を調べるため,毎秒5回の連続写真を撮り毎分の収縮数と筋収縮との規則性を調べた.対照に由来する胚様体に比べ,患者に由来する胚様体において有意な収縮数の減少および不規則性が認められた.これらの表現型はTimothy症候群の患者に認められている徐脈および不整脈に一致するものと思われた.このことは,疾患ヒトiPS細胞を用いて作製したTimothy症候群のモデルが,実際の患者の心臓の症状を細胞培養皿において再現できることを示していた.
3.Timothy症候群の患者に由来する心筋細胞の電気生理学的な解析
iPS細胞から作製した心筋細胞において電気生理学的な手法や生細胞イメージング法を行うため,対照および患者に由来する胚様体をトリプシン処理により単細胞に分離した.まず,免疫蛍光染色法を用いて,対照および患者に由来する心筋細胞において心筋細胞のマーカーであるαアクチニンと心臓トロポニンIの発現を確認した.患者に由来する心筋細胞には顕著なサルコメア構造の障害は認められなかった.つぎに,パッチクランプ法を用いて対照および患者に由来する心筋細胞におけるCa2+流入量および活動電位を測定した.患者に由来する心室性の心筋細胞において有意なCaV1.2の不活性化の減少が認められ,過剰なCa2+流入の生じていることが示された.さらに,活動電位の測定によって有意な自発性の活動電位時間の延長と不規則性,遅延後脱分極の増加していることが明らかになった(図1).この活動電位における障害は患者が示す心室性の不整脈や活動電位時間の延長に一致するものであった.
4.Timothy症候群の患者に由来する心筋細胞におけるCa2+シグナル伝達
共焦点顕微鏡およびFluo-4 AMを用いた高速Ca2+濃度測定法を用いて,iPS細胞から作製した心筋細胞における自発性Ca2+上昇を調べた.対照と比較して,患者に由来する心筋細胞において有意に自発性Ca2+上昇量および不規則性の増加が認められた.この表現型はこれまでTimothy症候群の患者に由来する心筋細胞において認められた収縮の不規則性に一致するものであり,また,CaV1.2による細胞外からのCa2+流入が自発性Ca2+放出の調節に役割を担っていることが明らかになった.
5.Timothy症候群の患者に由来する心筋細胞における化合物試験
患者に由来する心筋細胞において認められた表現型から,このモデルはTimothy症候群の治療に有効な化合物を試験するのに有用な系となることが示唆された.そこで,これまでにCaV1.2の不活性化を促進すると報告されているロスコビチン6) の作用を患者に由来する心筋細胞において調べた.驚くべきことに,33.3μMのロスコビチンが自発性Ca2+上昇量および不規則性を有意に軽減することがわかった.さらに,電気生理学的な手法を用いてロスコビチンのCa2+流入量と活動電位に対する影響を調べたところ,患者に由来する心筋細胞においてロスコビチンがCaV1.2の不活性化を促進して正常値にもどすこと,不規則に延長した活動電位時間を有意に抑制することが認められた(図1).
おわりに
この研究により,Timothy症候群の患者に由来する心筋細胞において認められた収縮数の減少,不規則な収縮の増加,CaV1.2の不活性化の減少,Ca2+流入量の増加,活動電位の延長,遅延後脱分極の増加,不規則な自発性Ca2+上昇の増加は,Timothy症候群の患者で認められる心臓の表現型に一致するものであり(図2),ロスコビチンにそれらを正常に戻す作用のあることが明らかになった.活動電位延長症候群タイプ8とされるTimothy症候群を対象としたこの研究と同様に,これまで疾患ヒトiPS細胞を用いて,活動電位延長症候群タイプ1とタイプ2のモデルが作製されている7,8).そこでも,患者に由来する心筋細胞において電気生理学的な解析が行われ,活動電位時間の延長に関与する心室性の心筋細胞の活動電位が延長し不規則となっていることが示されている.このことからも,疾患ヒトiPS細胞を用いた不整脈あるいは活動電位延長症候群の疾患モデルがその分子機構を解明するうえで非常に有効な手法であることが証明されている.
また,この研究において,疾患ヒトiPS細胞を用いて樹立されたTimothy症候群の心筋細胞モデルでのロスコビチンの化合物試験とその結果は,この系が化合物スクリーニングに有効であることを示すものであった.ただし,もともとロスコビチンは細胞増殖に関与するサイクリン依存性キナーゼの阻害薬として,現在,治験第II相の開発段階にある薬剤であり,CaV1.2以外への作用の可能性も十分に考えうる.しかしながら,この研究を起点とし,今後,ロスコビチンの化学修飾もしくはその誘導体から,副作用が少なくより特異的にCaV1.2へ作用する化合物の同定に取り組むことも可能であると思われる.この研究により,疾患ヒトiPS細胞を用いた疾患モデルが不整脈の薬剤開発に新たな道を開くことが明らかになった.
文 献
- Keating, M. T.: The long QT syndrome. A review of recent molecular genetic and physiologic discoveries. Medicine, 75, 1-5 (1996)[PubMed]
- Roden, D. M., Lazzara, R., Rosen, M. et al.: Multiple mechanisms in the long-QT syndrome. Current knowledge, gaps, and future directions. The SADS Foundation Task Force on LQTS. Circulation, 94, 1996-2012 (1996)[PubMed]
- Splawski, I., Timothy, K. W., Sharpe, L. M. et al.: CaV1.2 calcium channel dysfunction causes a multisystem disorder including arrhythmia and autism. Cell, 119, 19-31 (2004)[PubMed]
- Takahashi, K., Tanabe, K., Ohnuki, M. et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131, 861-372 (2007)[PubMed]
- Park, I. H., Arora, N., Huo, H. et al.: Disease-specific induced pluripotent stem cells. Cell, 134, 877-886 (2008)[PubMed]
- Yarotskyy, V., Gao, G., Du, L. et al.: Roscovitine binds to novel L-channel (CaV1.2) sites that separately affect activation and inactivation. J. Biol. Chem., 285, 43-53 (2010)[PubMed]
- Moretti, A., Bellin, M., Welling. et al.: Patient-specific induced pluripotent stem-cell models for long-QT syndrome. N. Engl. J. Med., 363, 1397-1409 (2010)[PubMed]
- Itzhaki, I., Maizels, L., Huber, I. et al.: Modelling the long QT syndrome with induced pluripotent stem cells. Nature, 471, 225-229 (2011)[PubMed]
著者プロフィール
略歴:2007年 京都大学薬学研究科博士課程 修了,同年より米国Stanford大学School of Medicineポスドク.
研究テーマ:筋および神経生理学,薬剤スクリーニング,新規のバイオツールの開発.
抱負:生命現象を解明するための新しい扉を開くようなテクノロジーを開発していきたい.
© 2011 矢澤 真幸 Licensed under CC 表示 2.1 日本