受容体SLAMと結合した麻疹ウイルスHタンパク質の構造
橋口隆生1・前仲勝実2・柳 雄介1
(1九州大学大学院医学研究院 ウイルス学分野,2北海道大学大学院薬学研究院 生体分子機能学研究室)
email:橋口隆生,柳 雄介
DOI: 10.7875/first.author.2011.024
Structure of the measles virus hemagglutinin bound to its cellular receptor SLAM.
Takao Hashiguchi, Toyoyuki Ose, Marie Kubota, Nobuo Maita, Jun Kamishikiryo, Katsumi Maenaka, Yusuke Yanagi
Nature Structural & Molecular Biology, 18, 135-141 (2011)
麻疹はいまなお世界中で多くの感染者と死者をだしている感染力の非常に強い急性のウイルス感染症である.その病原体である麻疹ウイルスは呼吸器から体内へと侵入し,免疫系細胞に特異的に発現するSLAM(CD150)を受容体として細胞に感染する.筆者らは,ウイルス側で受容体との結合能を担う麻疹ウイルスHタンパク質と細胞側で受容体として機能するSLAMとの複合体のX線結晶構造を解明した.その結果,Hタンパク質とSLAMとの結合は近縁のほかのパラミクソウイルスの受容体の結合様式とは大きく異なっていることがわかった.また,その結合様式からなぜ麻疹ワクチンが長年にわたり有効性を保ちつづけているのかを説明することができた.さらに,Hタンパク質とSLAMとの複合体として2種類の4量体構造が観察され,両者のあいだでの構造変化が,麻疹ウイルスの細胞への侵入において重要な膜融合の引き金となっていることが強く示唆された.
麻疹ウイルスは発熱や発疹をおもな症状とする急性のウイルス感染症である麻疹(はしか)をひき起こす.感染時には一過性の免疫抑制が起こり,肺炎などの二次感染を合併して重篤化する例もみられる.麻疹ウイルスの血清型は単一で自然感染では終生免疫が得られる.効果的な弱毒生ワクチンがあるにもかかわらず,ワクチン接種率の低い発展途上国を中心にいまだ世界の5歳未満の小児の主要な死因のひとつであり,2008年には推計で16.4万人の命が奪われた1,2).2007年には日本でも流行し,感染の広がりを抑えるため多くの高校や大学が休校に追い込まれる事態ともなった.
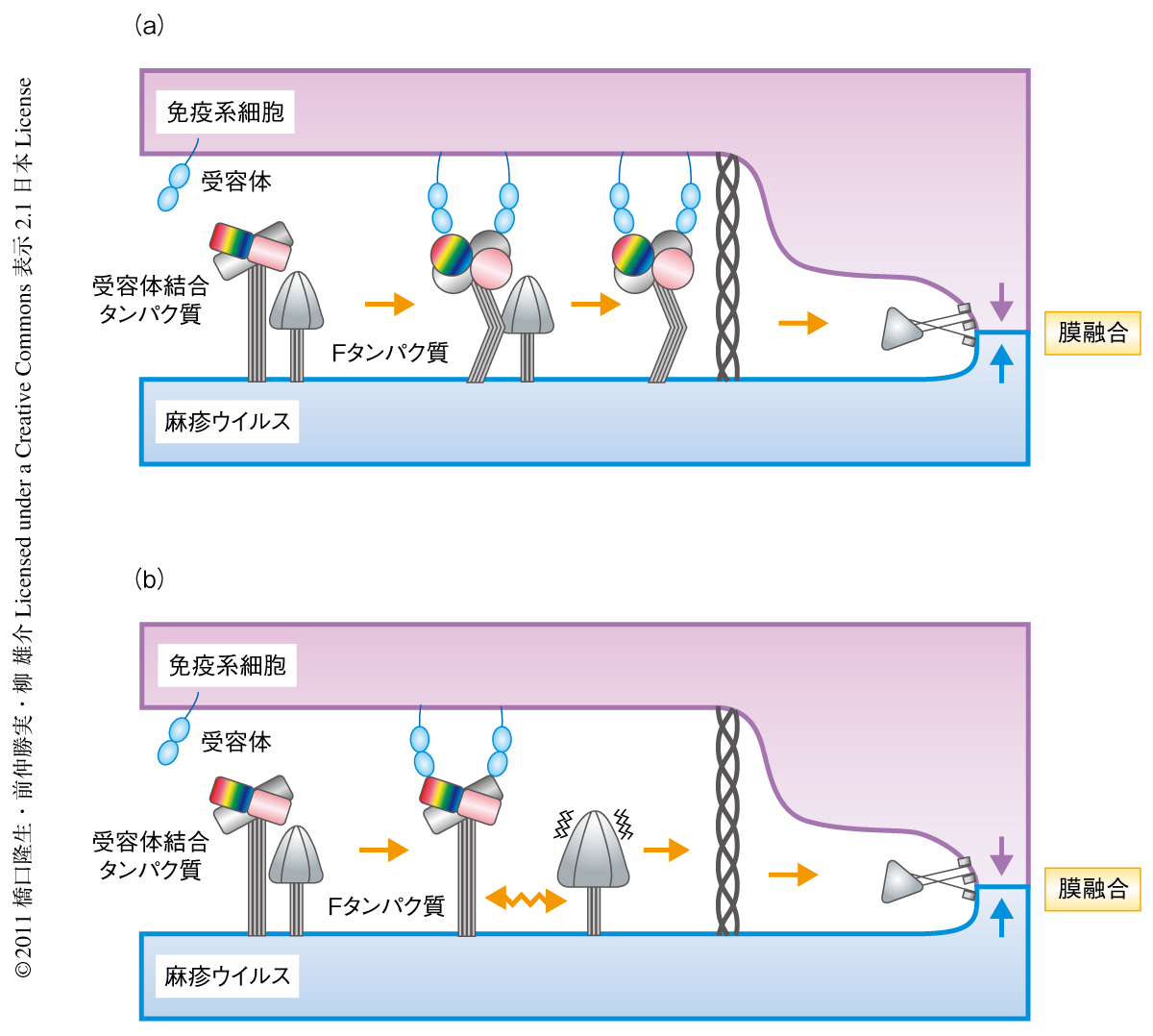
麻疹ウイルスはパラミクソウイルス科モルビリウイルス属に属するマイナス鎖RNAウイルスで,エンベロープ膜上に受容体結合タンパク質であるhemagglutinin(H)タンパク質と膜融合を担うfusion(F)タンパク質という2つの糖タンパク質をもっている3).麻疹ウイルスを含むパラミクソウイルスは細胞表面での膜融合により細胞に侵入する.パラミクソウイルスによる膜融合に関しては2つの主要なモデルが提唱されている4-7)(図1).ひとつは,受容体と結合することによりウイルスの受容体結合タンパク質の構造が大きく変化し,それが隣接するFタンパク質の構造変化を誘導して膜融合が起こるというモデルである.もうひとつは,ウイルスの受容体結合タンパク質が締め金(クランプ)のようにFタンパク質を安定な状態(膜融合能を発揮しない)に保っており,受容体との結合によってその相互作用が失われてFタンパク質が自発的に構造変化を起こして膜融合が起こるというモデルである.このようなモデルを検証するため,筆者らはさきに,麻疹ウイルスHタンパク質を単独の状態で構造決定しその二量体構造を明らかにした8).今回さらに,Hタンパク質と受容体SLAMとの複合体の構造決定を試みた.その結果,適切な条件で結晶を得ることに成功しHタンパク質とSLAMとの複合体の構造を3.15Åの分解能で決定した.
2000年,筆者らが,麻疹ウイルスの受容体がSLAMであることを明らかにして以来9,10),麻疹ウイルスがどのようにSLAMと相互作用して膜融合を起こすかを解明することはウイルスの細胞への侵入機構の研究において大きな目標のひとつであった.とくに,SLAMは麻疹ウイルスの受容体として機能するだけでなく免疫系細胞のあいだのシグナル伝達にもかかわっており11),さらに,マウス血液幹細胞の主要なマーカーのひとつとしても報告されている重要なタンパク質である12).しかし,麻疹ウイルスHタンパク質もSLAMもともに高度に糖鎖修飾されており,この糖鎖が結晶化を阻害すると考えられた.そこで,酵素欠損により均一な高マンノース型の糖鎖修飾を行うヒト培養細胞株(293SGnTI(-) 細胞)を用い,分泌型タンパク質として発現させた8).麻疹ウイルスHタンパク質とヒトSLAMとの組合せでは結晶を得ることができなかったため,小型霊長類であるマーモセットのSLAM(麻疹ウイルスの受容体として機能することがわかっている)を用い,さらに,Hタンパク質とSLAMのリジン残基を化学修飾によりメチル化することで結晶化に成功した.得られた低分解能データをもとに,分解能を改善するためパッキングに悪影響をあたえると考えられたSLAMの糖鎖付加部位の周辺に変異を導入し(Asn102をHisに置換,および,Arg108をTyrに置換),さらに,II型膜タンパク質であるHタンパク質とI型膜タンパク質であるSLAMとを(Gly-Gly-Gly-Ser)×3リンカーでつなぎ融合タンパク質として発現させることで,SLAMを基準として計算するとタンパク質発現量が約30倍も改善し,複合体として安定化させ大量調製することができた(分解能3.55Åの結晶).結合実験やウイルス感染実験にもとづいてHタンパク質にSLAMを介した感染を増強する変異(Leu482をArgに置換)を導入し,最終的に分解能3.15Åで複合体の結晶構造を決定することができた.
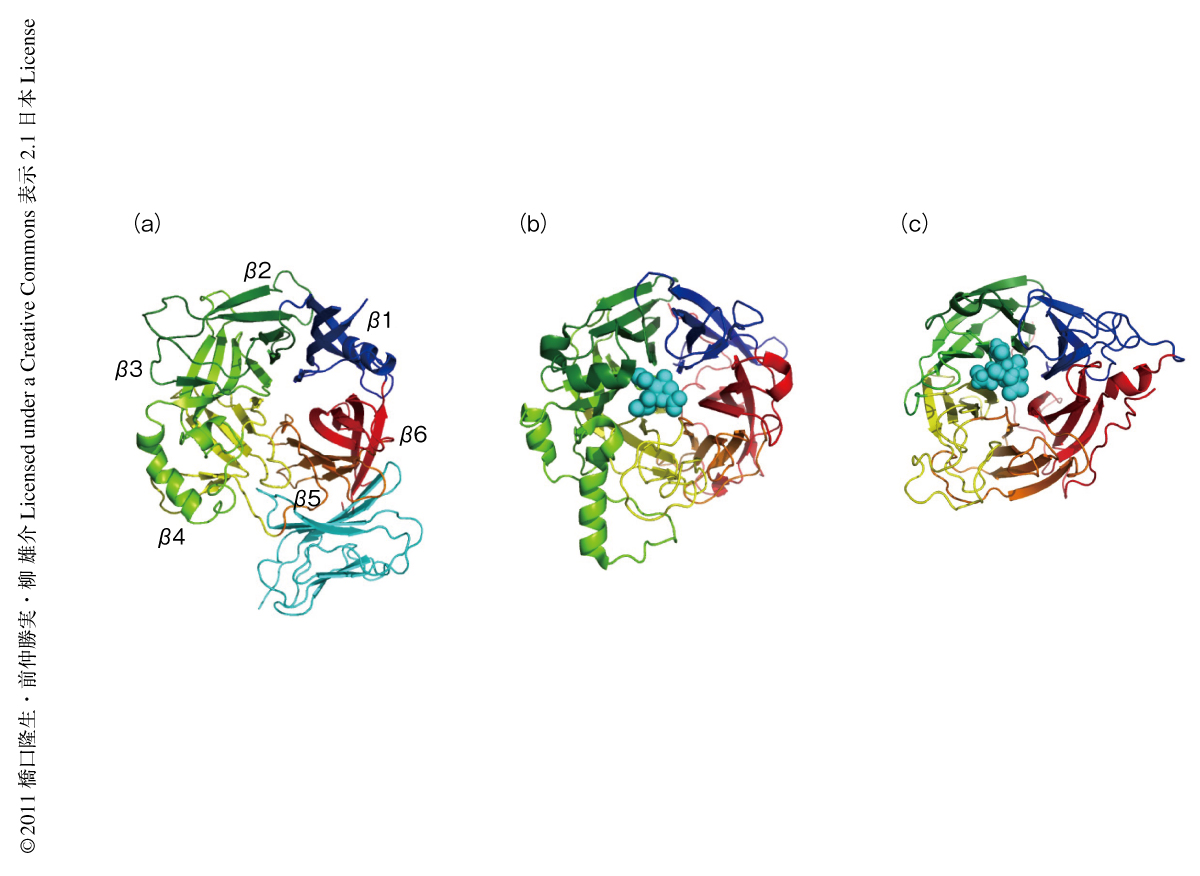
麻疹ウイルスHタンパク質は6組のβシートが円を描くように配置されたβプロペラ構造を示す.同様の骨格をもつインフルエンザウイルスのノイラミニダーゼやほかのパラミクソウイルスの受容体結合タンパク質ではβプロペラ構造の上部中央でリガンドや受容体と相互作用するのに対して,Hタンパク質はその上部中央には自らのN-結合型糖鎖が入り込んでいてリガンドの近づきにくい構造をしており,βプロペラ構造の側面でSLAMと結合することが明らかになった(図2).Hタンパク質およびSLAMの変異体の機能解析から,両者の結合に重要であろうと報告されていたアミノ酸残基のほとんどが実際の結合にかかわっていることが構造的に確認された.Hタンパク質との結合にかかわっているSLAMのアミノ酸残基は,1残基を除きそのすべてがヒトSLAMとマーモセットSLAMとのあいだで保存されていた.また,SLAMは免疫系細胞では自らをリガンドとするホモ二量体を形成するが,SLAM-SLAMの相互作用面とHタンパク質-SLAMの相互作用面はほぼ重なり合っていることがわかった.しかし,Hタンパク質とSLAMとの結合力のほうがSLAMどうしの結合力より100倍以上も強く,麻疹ウイルスの感染時にはHタンパク質が優位にSLAMと結合できることが示唆された.今回,Hタンパク質とSLAMとの複合体の構造が明らかになったのでSLAM結合の前後のHタンパク質の構造比較が可能になった.その結果,SLAMとの結合ののちHタンパク質には大きな構造変化や二量体のあいだの配向の変化は確認できなかった.しかし,予期せぬことに,のちに述べるように2種類の四量体構造が観察された.
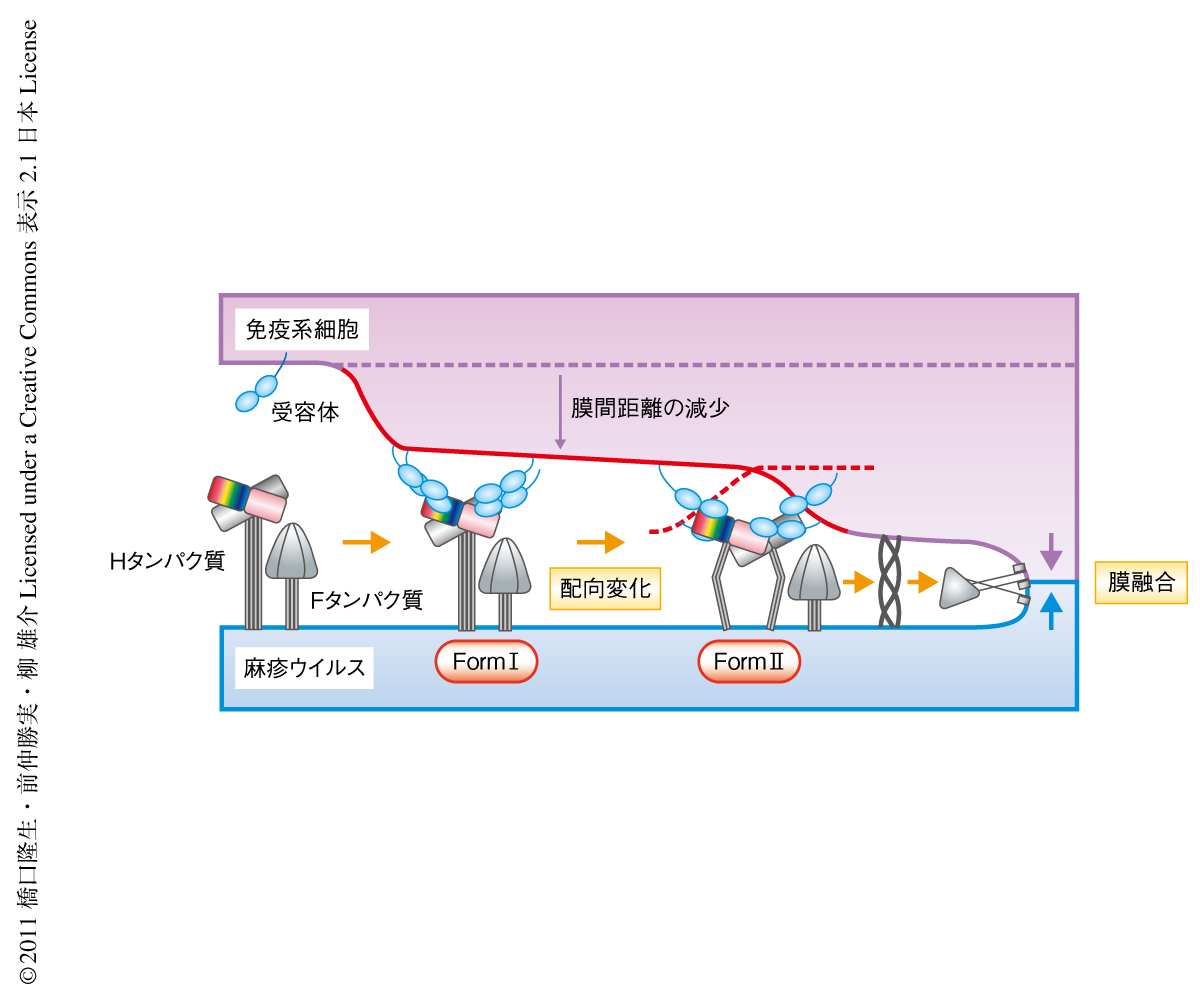
SLAMとの複合体を形成した麻疹ウイルスHタンパク質には単独の状態と比較して大きな構造変化がないという知見は,Hタンパク質とSLAMとが結合しHタンパク質が大きな構造変化を起こすことでウイルスのFタンパク質の構造変化を誘導し膜融合が起こるというモデルを否定する結果にみえた.さまざまな条件での結晶を解析したところ,配向の異なる2種類のHタンパク質-SLAM四量体(Form IとForm II)が観察された(PDB ID:3ALZ,3ALW,3ALX).培養細胞に全長のHタンパク質を一過性に発現させ,ブルーネイティブポリアクリルアミドゲル電気泳動およびウェスタンブロット解析を行ったところ,Hタンパク質は単独で発現させたときでも細胞表面で四量体を形成していることが確認された.Form Iはほかのパラミクソウイルスの受容体結合タンパク質でも似たような構造が報告されているので,Form IIの機能確認を行った.Hタンパク質との結合面とは正反対の面にあるがForm IIで四量体の界面の付近に存在するSLAMのN-結合型糖鎖を取り除くためにAsn53をGlnに置換した変異体を作製し,ウイルスの細胞侵入効率や増殖効率を調べた.その結果,糖鎖による立体障害がなくなったことでこの変異体では細胞侵入効率は約5倍に,増殖効率は約27倍に増加した.一方で,そのとなりに位置するLys54をSerに変異させたSLAMでは麻疹ウイルス感染がまったくみられなくなった.これら2つの変異体が大きくウイルス感染を増加もしくは消失させるにもかかわらず,結合実験ではともにHタンパク質との結合力にほとんど変化のみられないことから,Form IIはFタンパク質の構造変化の引き金をひく際の構造であることが示唆された.
Hタンパク質とSLAMの四量体構造はウイルスのエンベロープ膜と宿主の細胞膜とのあいだの距離を非常に近接させ(約140Å),膜融合を誘導するために理想的な疎水性環境を形成しているものと思われた(図3).受容体との結合にともない,この四量体構造がおそらくForm IからForm IIへと変化することによりFタンパク質を活性化すると考えられた.このとき,Hタンパク質四量体がFタンパク質と積極的に相互作用してFタンパク質の構造変化を誘導するのか,もしくは,Hタンパク質四量体の配向変化によりHタンパク質とFタンパク質との相互作用がなくなりFタンパク質を不安定化することで自発的な構造変化が進むのかは,今後の研究課題として解明する予定である.
麻疹ウイルスHタンパク質の単独での構造から,Hタンパク質は表面の大部分が糖鎖によっておおわれており1箇所だけが大きく露出していることが予想された8).この部分はSLAMの結合部位と予測される一方で,Hタンパク質に対する抗体のエピトープの大多数も同じ領域にマッピングされた.すなわち,Hタンパク質では糖鎖修飾により受容体の結合部位と抗体の結合可能部位が共通領域に限定されることになると考えられた.今回,実際に複合体の構造を決定したことで,確かにHタンパク質の糖鎖におおわれていない領域のほとんどをしめるかたちでSLAMが結合することを確認できた.Hタンパク質の受容体および抗体の共通結合領域に対する宿主免疫応答から回避するようなウイルス変異体は,受容体との結合をも失うことになりウイルスにとって致命的である.このことが50年以上も同一系統の麻疹ワクチンが効果を発揮しつづけ,麻疹ウイルスが単一の血清型のままいちど感染すると終生にわたり免疫が得られる理由と考えられた8).このことは,同じ免疫系細胞を標的としながら受容体の結合部位を抗体から隠し,抗体へのおとり領域まで存在するHIVの受容体結合タンパク質gp120とは非常に対照的であった.
麻疹ウイルスHタンパク質とSLAMとの複合体の構造決定により,麻疹ウイルスが受容体であるSLAMに結合して細胞に侵入する過程の一端が明らかになった.さらに,50年以上にわたり麻疹ワクチンが成功しつづけている理由を構造的な側面から説明することが可能になった.今後はさらに,Hタンパク質とFタンパク質との複合体の構造決定を含め,これらのタンパク質がどのような相互作用をしているのかを明らかにすることにより,ウイルスの細胞への侵入機構の詳細な理解が進展すると期待される.
略歴:2008年 九州大学大学院医学研究院博士課程 修了,同年 同 日本学術振興会特別研究員を経て,2010年より米国The Scripps Research Institute日本学術振興会海外特別研究員.
研究テーマ:ウイルス感染症の構造生物学.
抱負:ウイルスの細胞侵入,および,ウイルスと免疫との攻防を構造という側面から分子レベルで議論,理解したい.
前仲 勝実(Katsumi Maenaka)
北海道大学大学院薬学研究院 教授.
柳 雄介(Yusuke Yanagi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/virus/index.html
© 2011 橋口隆生・前仲勝実・柳 雄介 Licensed under CC 表示 2.1 日本
(1九州大学大学院医学研究院 ウイルス学分野,2北海道大学大学院薬学研究院 生体分子機能学研究室)
email:橋口隆生,柳 雄介
DOI: 10.7875/first.author.2011.024
Structure of the measles virus hemagglutinin bound to its cellular receptor SLAM.
Takao Hashiguchi, Toyoyuki Ose, Marie Kubota, Nobuo Maita, Jun Kamishikiryo, Katsumi Maenaka, Yusuke Yanagi
Nature Structural & Molecular Biology, 18, 135-141 (2011)
要 約
麻疹はいまなお世界中で多くの感染者と死者をだしている感染力の非常に強い急性のウイルス感染症である.その病原体である麻疹ウイルスは呼吸器から体内へと侵入し,免疫系細胞に特異的に発現するSLAM(CD150)を受容体として細胞に感染する.筆者らは,ウイルス側で受容体との結合能を担う麻疹ウイルスHタンパク質と細胞側で受容体として機能するSLAMとの複合体のX線結晶構造を解明した.その結果,Hタンパク質とSLAMとの結合は近縁のほかのパラミクソウイルスの受容体の結合様式とは大きく異なっていることがわかった.また,その結合様式からなぜ麻疹ワクチンが長年にわたり有効性を保ちつづけているのかを説明することができた.さらに,Hタンパク質とSLAMとの複合体として2種類の4量体構造が観察され,両者のあいだでの構造変化が,麻疹ウイルスの細胞への侵入において重要な膜融合の引き金となっていることが強く示唆された.
はじめに
麻疹ウイルスは発熱や発疹をおもな症状とする急性のウイルス感染症である麻疹(はしか)をひき起こす.感染時には一過性の免疫抑制が起こり,肺炎などの二次感染を合併して重篤化する例もみられる.麻疹ウイルスの血清型は単一で自然感染では終生免疫が得られる.効果的な弱毒生ワクチンがあるにもかかわらず,ワクチン接種率の低い発展途上国を中心にいまだ世界の5歳未満の小児の主要な死因のひとつであり,2008年には推計で16.4万人の命が奪われた1,2).2007年には日本でも流行し,感染の広がりを抑えるため多くの高校や大学が休校に追い込まれる事態ともなった.
麻疹ウイルスはパラミクソウイルス科モルビリウイルス属に属するマイナス鎖RNAウイルスで,エンベロープ膜上に受容体結合タンパク質であるhemagglutinin(H)タンパク質と膜融合を担うfusion(F)タンパク質という2つの糖タンパク質をもっている3).麻疹ウイルスを含むパラミクソウイルスは細胞表面での膜融合により細胞に侵入する.パラミクソウイルスによる膜融合に関しては2つの主要なモデルが提唱されている4-7)(図1).ひとつは,受容体と結合することによりウイルスの受容体結合タンパク質の構造が大きく変化し,それが隣接するFタンパク質の構造変化を誘導して膜融合が起こるというモデルである.もうひとつは,ウイルスの受容体結合タンパク質が締め金(クランプ)のようにFタンパク質を安定な状態(膜融合能を発揮しない)に保っており,受容体との結合によってその相互作用が失われてFタンパク質が自発的に構造変化を起こして膜融合が起こるというモデルである.このようなモデルを検証するため,筆者らはさきに,麻疹ウイルスHタンパク質を単独の状態で構造決定しその二量体構造を明らかにした8).今回さらに,Hタンパク質と受容体SLAMとの複合体の構造決定を試みた.その結果,適切な条件で結晶を得ることに成功しHタンパク質とSLAMとの複合体の構造を3.15Åの分解能で決定した.
1.Hタンパク質とSLAMの調製と結晶化
2000年,筆者らが,麻疹ウイルスの受容体がSLAMであることを明らかにして以来9,10),麻疹ウイルスがどのようにSLAMと相互作用して膜融合を起こすかを解明することはウイルスの細胞への侵入機構の研究において大きな目標のひとつであった.とくに,SLAMは麻疹ウイルスの受容体として機能するだけでなく免疫系細胞のあいだのシグナル伝達にもかかわっており11),さらに,マウス血液幹細胞の主要なマーカーのひとつとしても報告されている重要なタンパク質である12).しかし,麻疹ウイルスHタンパク質もSLAMもともに高度に糖鎖修飾されており,この糖鎖が結晶化を阻害すると考えられた.そこで,酵素欠損により均一な高マンノース型の糖鎖修飾を行うヒト培養細胞株(293SGnTI(-) 細胞)を用い,分泌型タンパク質として発現させた8).麻疹ウイルスHタンパク質とヒトSLAMとの組合せでは結晶を得ることができなかったため,小型霊長類であるマーモセットのSLAM(麻疹ウイルスの受容体として機能することがわかっている)を用い,さらに,Hタンパク質とSLAMのリジン残基を化学修飾によりメチル化することで結晶化に成功した.得られた低分解能データをもとに,分解能を改善するためパッキングに悪影響をあたえると考えられたSLAMの糖鎖付加部位の周辺に変異を導入し(Asn102をHisに置換,および,Arg108をTyrに置換),さらに,II型膜タンパク質であるHタンパク質とI型膜タンパク質であるSLAMとを(Gly-Gly-Gly-Ser)×3リンカーでつなぎ融合タンパク質として発現させることで,SLAMを基準として計算するとタンパク質発現量が約30倍も改善し,複合体として安定化させ大量調製することができた(分解能3.55Åの結晶).結合実験やウイルス感染実験にもとづいてHタンパク質にSLAMを介した感染を増強する変異(Leu482をArgに置換)を導入し,最終的に分解能3.15Åで複合体の結晶構造を決定することができた.
2.Hタンパク質とSLAMとの複合体の構造
麻疹ウイルスHタンパク質は6組のβシートが円を描くように配置されたβプロペラ構造を示す.同様の骨格をもつインフルエンザウイルスのノイラミニダーゼやほかのパラミクソウイルスの受容体結合タンパク質ではβプロペラ構造の上部中央でリガンドや受容体と相互作用するのに対して,Hタンパク質はその上部中央には自らのN-結合型糖鎖が入り込んでいてリガンドの近づきにくい構造をしており,βプロペラ構造の側面でSLAMと結合することが明らかになった(図2).Hタンパク質およびSLAMの変異体の機能解析から,両者の結合に重要であろうと報告されていたアミノ酸残基のほとんどが実際の結合にかかわっていることが構造的に確認された.Hタンパク質との結合にかかわっているSLAMのアミノ酸残基は,1残基を除きそのすべてがヒトSLAMとマーモセットSLAMとのあいだで保存されていた.また,SLAMは免疫系細胞では自らをリガンドとするホモ二量体を形成するが,SLAM-SLAMの相互作用面とHタンパク質-SLAMの相互作用面はほぼ重なり合っていることがわかった.しかし,Hタンパク質とSLAMとの結合力のほうがSLAMどうしの結合力より100倍以上も強く,麻疹ウイルスの感染時にはHタンパク質が優位にSLAMと結合できることが示唆された.今回,Hタンパク質とSLAMとの複合体の構造が明らかになったのでSLAM結合の前後のHタンパク質の構造比較が可能になった.その結果,SLAMとの結合ののちHタンパク質には大きな構造変化や二量体のあいだの配向の変化は確認できなかった.しかし,予期せぬことに,のちに述べるように2種類の四量体構造が観察された.
3.Hタンパク質-SLAM複合体の2種類の四量体構造と膜融合
SLAMとの複合体を形成した麻疹ウイルスHタンパク質には単独の状態と比較して大きな構造変化がないという知見は,Hタンパク質とSLAMとが結合しHタンパク質が大きな構造変化を起こすことでウイルスのFタンパク質の構造変化を誘導し膜融合が起こるというモデルを否定する結果にみえた.さまざまな条件での結晶を解析したところ,配向の異なる2種類のHタンパク質-SLAM四量体(Form IとForm II)が観察された(PDB ID:3ALZ,3ALW,3ALX).培養細胞に全長のHタンパク質を一過性に発現させ,ブルーネイティブポリアクリルアミドゲル電気泳動およびウェスタンブロット解析を行ったところ,Hタンパク質は単独で発現させたときでも細胞表面で四量体を形成していることが確認された.Form Iはほかのパラミクソウイルスの受容体結合タンパク質でも似たような構造が報告されているので,Form IIの機能確認を行った.Hタンパク質との結合面とは正反対の面にあるがForm IIで四量体の界面の付近に存在するSLAMのN-結合型糖鎖を取り除くためにAsn53をGlnに置換した変異体を作製し,ウイルスの細胞侵入効率や増殖効率を調べた.その結果,糖鎖による立体障害がなくなったことでこの変異体では細胞侵入効率は約5倍に,増殖効率は約27倍に増加した.一方で,そのとなりに位置するLys54をSerに変異させたSLAMでは麻疹ウイルス感染がまったくみられなくなった.これら2つの変異体が大きくウイルス感染を増加もしくは消失させるにもかかわらず,結合実験ではともにHタンパク質との結合力にほとんど変化のみられないことから,Form IIはFタンパク質の構造変化の引き金をひく際の構造であることが示唆された.
Hタンパク質とSLAMの四量体構造はウイルスのエンベロープ膜と宿主の細胞膜とのあいだの距離を非常に近接させ(約140Å),膜融合を誘導するために理想的な疎水性環境を形成しているものと思われた(図3).受容体との結合にともない,この四量体構造がおそらくForm IからForm IIへと変化することによりFタンパク質を活性化すると考えられた.このとき,Hタンパク質四量体がFタンパク質と積極的に相互作用してFタンパク質の構造変化を誘導するのか,もしくは,Hタンパク質四量体の配向変化によりHタンパク質とFタンパク質との相互作用がなくなりFタンパク質を不安定化することで自発的な構造変化が進むのかは,今後の研究課題として解明する予定である.
4.麻疹ワクチンの有効性の構造的な基盤
麻疹ウイルスHタンパク質の単独での構造から,Hタンパク質は表面の大部分が糖鎖によっておおわれており1箇所だけが大きく露出していることが予想された8).この部分はSLAMの結合部位と予測される一方で,Hタンパク質に対する抗体のエピトープの大多数も同じ領域にマッピングされた.すなわち,Hタンパク質では糖鎖修飾により受容体の結合部位と抗体の結合可能部位が共通領域に限定されることになると考えられた.今回,実際に複合体の構造を決定したことで,確かにHタンパク質の糖鎖におおわれていない領域のほとんどをしめるかたちでSLAMが結合することを確認できた.Hタンパク質の受容体および抗体の共通結合領域に対する宿主免疫応答から回避するようなウイルス変異体は,受容体との結合をも失うことになりウイルスにとって致命的である.このことが50年以上も同一系統の麻疹ワクチンが効果を発揮しつづけ,麻疹ウイルスが単一の血清型のままいちど感染すると終生にわたり免疫が得られる理由と考えられた8).このことは,同じ免疫系細胞を標的としながら受容体の結合部位を抗体から隠し,抗体へのおとり領域まで存在するHIVの受容体結合タンパク質gp120とは非常に対照的であった.
おわりに
麻疹ウイルスHタンパク質とSLAMとの複合体の構造決定により,麻疹ウイルスが受容体であるSLAMに結合して細胞に侵入する過程の一端が明らかになった.さらに,50年以上にわたり麻疹ワクチンが成功しつづけている理由を構造的な側面から説明することが可能になった.今後はさらに,Hタンパク質とFタンパク質との複合体の構造決定を含め,これらのタンパク質がどのような相互作用をしているのかを明らかにすることにより,ウイルスの細胞への侵入機構の詳細な理解が進展すると期待される.
文 献
- Bryce, J., Boschi-Pinto, C., Shibuya, K. et al.: WHO estimates of the causes of death in children. Lancet, 365, 1147-1152 (2005)[PubMed]
- Moss, W. J. & Griffin, D. E.: Global measles elimination. Nat. Rev. Microbiol., 4, 900-908 (2006)[PubMed]
- Griffin, D. E.: in Fields Virology, 5th Ed. (Knipe, D. M. & Howley, P. M. eds.), pp. 1551-1585, Lippincott Williams & Wilkins, Philadelphia (2007)
- Lamb, R. A. & Parks, G. D.: in Fields Virology, 5th Ed. (Knipe, D. M. & Howley, P. M. eds.), pp. 1449-1496, Lippincott Williams & Wilkins, Philadelphia (2007)
- Iorio, R. M. & Mahon, P. J.: Paramyxoviruses: different receptors: different mechanisms of fusion. Trends Microbiol., 16, 135-137 (2008)[PubMed]
- Smith, E. C., Popa, A., Chang, A. et al.: Viral entry mechanisms: the increasing diversity of paramyxovirus entry. FEBS J., 276, 7217-7227 (2009)[PubMed]
- Connolly, S. A., Leser, G. P., Jardetzky, T. S. et al.: Bimolecular complementation of paramyxovirus fusion and hemagglutinin-neuraminidase proteins enhances fusion: implications for the mechanism of fusion triggering. J. Virol., 83, 10857-10868 (2009)[PubMed]
- Hashiguchi, T., Kajikawa, M., Maita, N. et al.: Crystal structure of measles virus hemagglutinin provides insight into effective vaccines. Proc. Natl. Acad. Sci. USA, 104, 19535-19540 (2007)[PubMed]
- Tatsuo, H., Ono, N., Tanaka, K. et al.: SLAM (CDw150) is a cellular receptor for measles virus. Nature, 406, 893-897 (2000)[PubMed]
- Yanagi, Y., Takeda, M., Ohno, S. et al.: Measles virus receptors. Curr. Top. Microbiol. Immunol., 329, 13-30 (2009)[PubMed]
- Schwartzberg, P. L., Mueller, K. L., Qi, H. et al.: SLAM receptors and SAP influence lymphocyte interactions, development and function. Nat. Rev. Immunol., 9, 39-46 (2009)[PubMed]
- Kiel, M. J., Yilmaz, O. H., Iwashita, T. et al.: SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell, 121, 1109-1121 (2005)[PubMed]
著者プロフィール
略歴:2008年 九州大学大学院医学研究院博士課程 修了,同年 同 日本学術振興会特別研究員を経て,2010年より米国The Scripps Research Institute日本学術振興会海外特別研究員.
研究テーマ:ウイルス感染症の構造生物学.
抱負:ウイルスの細胞侵入,および,ウイルスと免疫との攻防を構造という側面から分子レベルで議論,理解したい.
前仲 勝実(Katsumi Maenaka)
北海道大学大学院薬学研究院 教授.
柳 雄介(Yusuke Yanagi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/virus/index.html
© 2011 橋口隆生・前仲勝実・柳 雄介 Licensed under CC 表示 2.1 日本