CD169陽性マクロファージによるがん免疫の制御
浅野謙一・田中正人
(理化学研究所免疫・アレルギー科学総合研究センター 自然免疫研究チーム)
email:田中正人
DOI: 10.7875/first.author.2011.022
CD169-positive macrophages dominate antitumor immunity by crosspresenting dead cell-associated antigens.
Kenichi Asano, Ami Nabeyama, Yasunobu Miyake, Chun-Hong Qiu, Ai Kurita, Michio Tomura, Osami Kanagawa, Shin-ichiro Fujii, Masato Tanaka
Immunity, 34, 1-11 (2011)
がんの排除にはCD8陽性T細胞が重要な役割を担う.がん特異的なCD8陽性T細胞を活性化するため,抗原提示細胞はまずがん抗原を取り込み,その抗原をCD8陽性T細胞に提示する必要がある.この過程をクロスプレゼンテーションとよぶ.がん抗原は主として死んだがん細胞から供給されると考えられるものの,抗原のクロスプレゼンテーションを担当している細胞もがん免疫の成立のプロセスもいまだ解明されていない.筆者らは,今回,リンパ節に常在するCD169陽性マクロファージががん死細胞を貪食し,そのうちCD11c CD169二重陽性サブセットががん抗原をCD8陽性T細胞に直接クロスプレゼンテーションすることを発見した.放射線を照射したがん死細胞をマウスに皮下投与しておくと同種のがん細胞の増殖を抑制できることが知られている.しかし,がん死細胞の投与のときCD169陽性マクロファージを欠損したマウスではワクチン効果が得られずがんの増殖を抑制できなかった.このモデルにおけるがん免疫の活性化には末梢組織からの移動性樹状細胞やリンパ節に常在する樹状細胞は必要のないことも確認された.つまり,CD169陽性マクロファージはがん細胞死にともなうがん免疫の成立に中心的な役割を担う抗原提示細胞であることが証明された.
がん細胞は,本来,正常な細胞から派生した“異常な自己”であるといえる.がんはなんらかの方法で自らに対する寛容を維持し宿主からの免疫監視をのがれていると考えられる.この寛容状態は既存の化学療法や放射線治療の効果を限定する要因と考えられ,がん免疫を効率的に活性化するための研究がさかんに行われている.
がん免疫の成立にはがん特異的なCD8陽性T細胞(細胞傷害性T細胞)を活性化することが重要である.そのため,抗原提示細胞はまずがん抗原を取り込み,リンパ節において抗原をクロスプレゼンテーションしなければならない.このがん抗原は主として死んだがん細胞から供給されると考えられるものの1),がん死細胞がどのようにリンパ節に運ばれ,どの抗原提示細胞に取り込まれるのかはほとんどわかっていない.
生体内で生じた死細胞は周囲の食細胞によって貪食されすみやかに排除される.この貪食は自己組織に対する寛容を誘導するのに必要で,貪食の異常は自己免疫疾患の発症の一因であることが,近年,明らかにされた2,3).さらに筆者らの研究グループは以前,死細胞をマウスに静脈内投与することで抗原特異的な免疫寛容を人為的に誘導し自己免疫疾患の発症を予防しうることを示した4).
静脈内に投与した場合とは対照的に,皮下に投与した死細胞は免疫系を活性化する場合のあることが知られている5).この活性化現象はがん死細胞の皮下投与によるがんワクチンとして昔から知られている.これらの知見より,死細胞はその投与経路(存在部位)によってまったく異なる方法で処理され,寛容あるいは活性化という正反対の免疫応答を誘導していると考えられる.
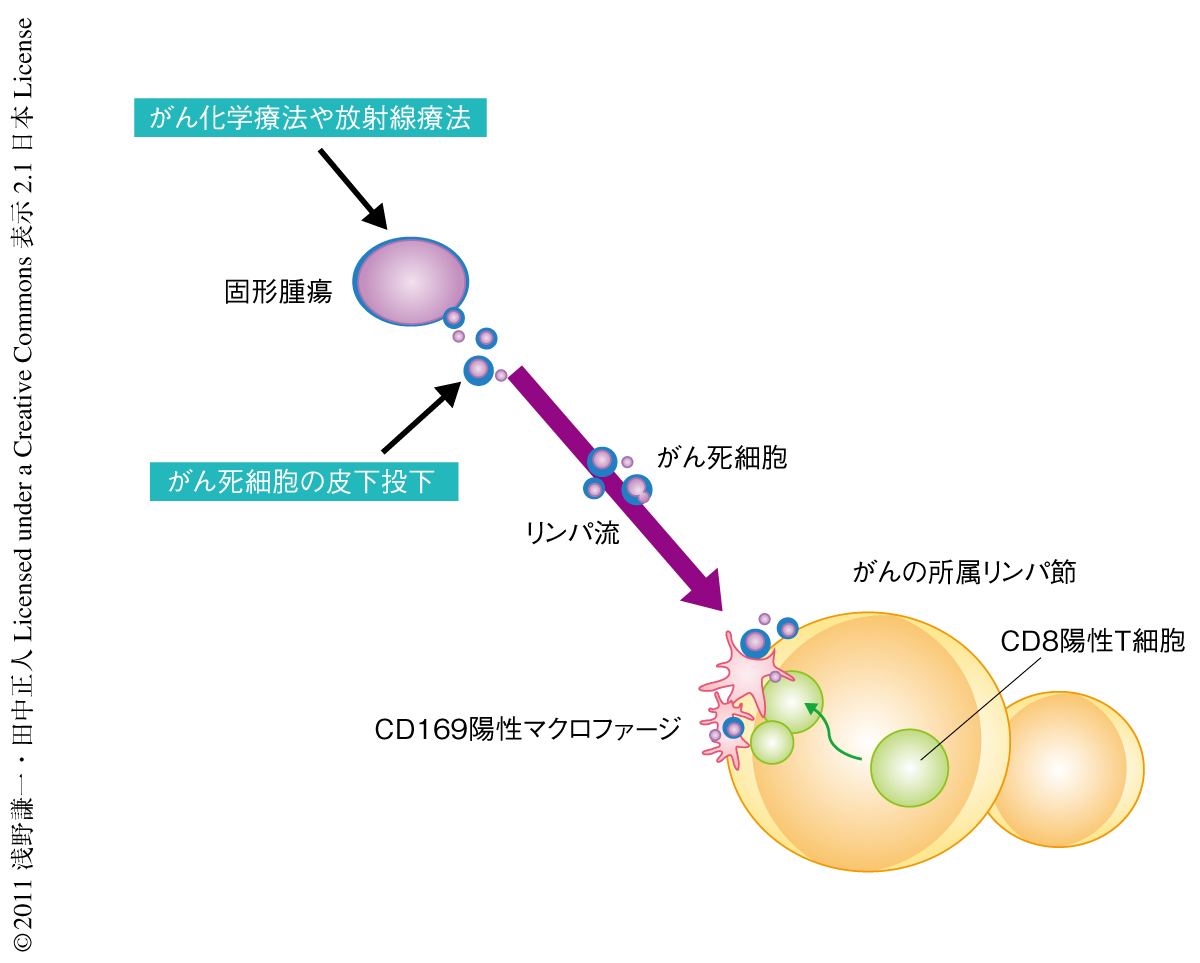
この論文で筆者らは,リンパ節に常在するCD169陽性マクロファージががん死細胞を貪食し,そのうちCD11c CD169二重陽性サブセットががん抗原をCD8陽性T細胞に直接クロスプレゼンテーションすることを証明した.がんワクチンの投与のときCD169陽性マクロファージを欠失したマウスではワクチン効果が得られず,同種のがん増殖を抑制できなかった.また,移動性樹状細胞やリンパ節に常在するほかの樹状細胞は,がん死細胞の輸送や抗原提示に主体的には関与していないことも明らかになった.以上の発見は,がん細胞死にともなうがん免疫の成立にCD169陽性マクロファージが中心的な役割を担っていることを示している(図1).
まず,放射線を照射したEG7細胞(C57BL/6マウスの胸腺種に由来するEL4細胞にオボアルブミン抗原を発現させたがん細胞)のがん増殖に対する抑制効果をC57BL/6マウスで確かめた.放射線を照射したEG7細胞を一晩培養して死を誘導し,これをマウスに皮下投与した.10日後に生きたEG7細胞を接種すると,事前にEG7死細胞を投与したマウスではがんの形成を認めず,がん死細胞の皮下投与が確かにがんワクチンとしてはたらくことがわかった.
がん死細胞が末梢皮下組織から所属リンパ節へ到達するには,移動性樹状細胞による輸送と,死細胞が直接リンパ流に乗るという2つの経路が考えられた.
最初に,皮下投与した死細胞は皮膚の移動性樹状細胞(ランゲルハンス細胞や真皮樹状細胞)にいちど貪食され所属リンパ節に輸送されるという可能性を考えた.この仮説を証明するため,Kaedeトランスジェニックマウスの足踵部に死細胞あるいはFreundアジュバントを皮下投与したのち同じ部位に紫色線を照射し,皮下から所属リンパ節へ移動した樹状細胞の数を調べた.なお,Kaedeトランスジェニックマウスは,紫色線の照射により緑色から赤色へと変色する蛍光タンパク質を全身の細胞で発現する遺伝子改変マウスである6).24時間後の所属リンパ節における赤色の樹状細胞(足踵から移動した細胞)の数をフローサイトメトリーで調べたところ,Freundアジュバント投与マウスでは対照マウスに比べ約15倍に増加していた.ところが,死細胞を投与しても所属リンパ節に移動する樹状細胞の数は増加しなかった.つまり,死細胞の投与は末梢皮下組織の樹状細胞の移動を促さず,移動性樹状細胞は死細胞の輸送にはあまり関与しないことが示された.
皮下投与した死細胞を追跡するため,あらかじめ蛍光標識した死細胞を皮下投与し,投与後の所属リンパ節を経時的に蛍光顕微鏡で観察した.すると,死細胞は投与からわずか3時間後にはリンパ節洞へ到達しその場に蓄積することがわかった.これは移動性樹状細胞がリンパ節に到達する速度をはるかにうわまわっていることから,死細胞はリンパ流に乗ってすみやかに所属リンパ節へ到達したと結論した.
つづいて,リンパ節洞に蓄積した死細胞を貪食する食細胞の同定を試みた.蛍光標識した死細胞をマウスに皮下投与し,24時間後に所属リンパ節を摘出した.このリンパ節をコラゲナーゼで処理し,さらに磁気ビーズで食細胞のみを分取した.フローサイトメトリーで解析したところ,リンパ節にはCD11c陽性とCD11c陰性のCD169陽性マクロファージ,CD8α陽性とCD8α陰性の樹状細胞の4種類の食細胞が存在することがわかった.このうち死細胞は2種類のCD169陽性マクロファージによって貪食され,樹状細胞にはほとんど取り込まれないことがわかった.
ところで,死細胞はその表面にホスファチジルセリンを露出し,食細胞はこのホスファチジルセリンを認識することで死細胞のみを選択的に貪食している.マクロファージから産生される可溶性タンパク質MFG-E8は死細胞のホスファチジルセリンと食細胞のインテグリンとを架橋し貪食を促進している7).また,MFG-E8の変異体であるD89Eはホスファチジルセリンをマスクすることでさまざまな食細胞による死細胞の貪食を阻害する.D89Eでホスファチジルセリンをマスクしたがん死細胞を投与するとCD169陽性マクロファージによる貪食が抑制されたことから,CD169陽性マクロファージもホスファチジルセリン依存的に死細胞を取り込んでいることがわかった.
それでは,CD169陽性マクロファージによるがん死細胞の貪食は実際のがん免疫にどのような影響をあたえているのだろうか? 筆者らは,CD169をコードする遺伝子のプロモーターの下流にヒトジフテリアトキシン受容体を発現した遺伝子改変マウス(CD169-DTRマウス)を作製している4).このマウスにジフテリアトキシンを投与すると一過性にCD169陽性細胞を消失させることができるので,これを利用してがん免疫におけるCD169陽性マクロファージの役割を解析した.
野生型マウスおよびCD169-DTRマウスにEG7死細胞を皮下投与し,その10日後に生きたEG7細胞を接種した.腫瘍の径の変化を2群のあいだで比較したところ,事前に死細胞を投与した野生型マウスではがんの成長が抑制されたが,CD169-DTRマウスでは抑制効果が得られなかった.すなわち,CD169陽性マクロファージはがん死細胞の投与によるがん免疫の活性化に中心的な役割を担う細胞であることが証明された.
つぎに,オボアルブミン抗原を発現した死細胞を皮下投与したマウスから所属リンパ節を摘出し,抗原提示細胞を磁気ビーズで分取した.この抗原提示細胞をオボアルブミン抗原に特異的なCD8陽性T細胞とin vitroで共培養すると,野生型マウスではこのCD8陽性T細胞が増殖したのに対し,CD169-DTRマウスでは野生型マウスの20%しか増殖できなかった.すなわち,がん死細胞を投与してもCD169陽性マクロファージがいないとうまくがん抗原(このモデルでは,オボアルブミン抗原)をクロスプレゼンテーションできないことがわかった.
リンパ節のどの細胞が死細胞の抗原を直接クロスプレゼンテーションしているのか確認するため,さきと同様に磁気ビーズで分取した抗原提示細胞をさらにセルソーターで分画精製した.精製した抗原提示細胞とオボアルブミン抗原に特異的なCD8陽性T細胞をin vitroで共培養したところ,CD169陽性マクロファージのうちCD11c陽性サブセットのみが特異的にこのCD8陽性T細胞を増殖することがわかった.また,CD8α陽性およびCD8α陰性どちらの樹状状細胞もこのCD8陽性T細胞を活性化しなかった.
以上の結果より,がん死細胞はCD11c陽性とCD11c陰性どちらのCD169陽性マクロファージにも取り込まれ,つづく抗原のクロスプレゼンテーションはCD11c陽性サブセットのみが単独で遂行することが示された.強いクロスプレゼンテーション能力をもつことが知られているCD8α陽性樹状細胞は,意外なことに皮下投与したがん死細胞の貪食にも抗原提示にも関与しなかった.これは樹状細胞がリンパ節の深部に局在しリンパ節洞に蓄積した細胞性抗原にアクセスできないためと考えられた.
以前,血流のアポトーシス死細胞が脾臓の辺縁帯のCD169陽性マクロファージに処理され免疫寛容を誘導することを見い出して以来,このマクロファージの機能に強い関心をもって研究をつづけてきた.今回,末梢組織のがん死細胞が所属リンパ節のCD169陽性マクロファージに貪食され,この場合は逆に,免疫を活性化することがわかり,たいへん驚かされた.CD169陽性マクロファージは細胞死とそれにつづく抗原特異的な免疫応答の制御に中心的な役割を担っているものと考えられる.以上の発見は,細胞の死の様式を選択し,適切なルートで投与することで人為的に免疫応答を制御しうることを示している.CD169陽性マクロファージに選択的にがん抗原を取り込ませることで,今後,効率よくがん免疫を賦活化する新しい治療法を開発したい.
略歴:2006年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 米国Harvard Medical School研究員を経て,2008年より理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員.
研究テーマ:マクロファージによる死細胞の貪食の免疫学的な意義.
関心事:死細胞を利用した人為的な免疫制御,人工死細胞の開発.
田中 正人(Masato Tanaka)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー.
© 2011 浅野謙一・田中正人 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 自然免疫研究チーム)
email:田中正人
DOI: 10.7875/first.author.2011.022
CD169-positive macrophages dominate antitumor immunity by crosspresenting dead cell-associated antigens.
Kenichi Asano, Ami Nabeyama, Yasunobu Miyake, Chun-Hong Qiu, Ai Kurita, Michio Tomura, Osami Kanagawa, Shin-ichiro Fujii, Masato Tanaka
Immunity, 34, 1-11 (2011)
要 約
がんの排除にはCD8陽性T細胞が重要な役割を担う.がん特異的なCD8陽性T細胞を活性化するため,抗原提示細胞はまずがん抗原を取り込み,その抗原をCD8陽性T細胞に提示する必要がある.この過程をクロスプレゼンテーションとよぶ.がん抗原は主として死んだがん細胞から供給されると考えられるものの,抗原のクロスプレゼンテーションを担当している細胞もがん免疫の成立のプロセスもいまだ解明されていない.筆者らは,今回,リンパ節に常在するCD169陽性マクロファージががん死細胞を貪食し,そのうちCD11c CD169二重陽性サブセットががん抗原をCD8陽性T細胞に直接クロスプレゼンテーションすることを発見した.放射線を照射したがん死細胞をマウスに皮下投与しておくと同種のがん細胞の増殖を抑制できることが知られている.しかし,がん死細胞の投与のときCD169陽性マクロファージを欠損したマウスではワクチン効果が得られずがんの増殖を抑制できなかった.このモデルにおけるがん免疫の活性化には末梢組織からの移動性樹状細胞やリンパ節に常在する樹状細胞は必要のないことも確認された.つまり,CD169陽性マクロファージはがん細胞死にともなうがん免疫の成立に中心的な役割を担う抗原提示細胞であることが証明された.
はじめに
がん細胞は,本来,正常な細胞から派生した“異常な自己”であるといえる.がんはなんらかの方法で自らに対する寛容を維持し宿主からの免疫監視をのがれていると考えられる.この寛容状態は既存の化学療法や放射線治療の効果を限定する要因と考えられ,がん免疫を効率的に活性化するための研究がさかんに行われている.
がん免疫の成立にはがん特異的なCD8陽性T細胞(細胞傷害性T細胞)を活性化することが重要である.そのため,抗原提示細胞はまずがん抗原を取り込み,リンパ節において抗原をクロスプレゼンテーションしなければならない.このがん抗原は主として死んだがん細胞から供給されると考えられるものの1),がん死細胞がどのようにリンパ節に運ばれ,どの抗原提示細胞に取り込まれるのかはほとんどわかっていない.
生体内で生じた死細胞は周囲の食細胞によって貪食されすみやかに排除される.この貪食は自己組織に対する寛容を誘導するのに必要で,貪食の異常は自己免疫疾患の発症の一因であることが,近年,明らかにされた2,3).さらに筆者らの研究グループは以前,死細胞をマウスに静脈内投与することで抗原特異的な免疫寛容を人為的に誘導し自己免疫疾患の発症を予防しうることを示した4).
静脈内に投与した場合とは対照的に,皮下に投与した死細胞は免疫系を活性化する場合のあることが知られている5).この活性化現象はがん死細胞の皮下投与によるがんワクチンとして昔から知られている.これらの知見より,死細胞はその投与経路(存在部位)によってまったく異なる方法で処理され,寛容あるいは活性化という正反対の免疫応答を誘導していると考えられる.
この論文で筆者らは,リンパ節に常在するCD169陽性マクロファージががん死細胞を貪食し,そのうちCD11c CD169二重陽性サブセットががん抗原をCD8陽性T細胞に直接クロスプレゼンテーションすることを証明した.がんワクチンの投与のときCD169陽性マクロファージを欠失したマウスではワクチン効果が得られず,同種のがん増殖を抑制できなかった.また,移動性樹状細胞やリンパ節に常在するほかの樹状細胞は,がん死細胞の輸送や抗原提示に主体的には関与していないことも明らかになった.以上の発見は,がん細胞死にともなうがん免疫の成立にCD169陽性マクロファージが中心的な役割を担っていることを示している(図1).
1.がん死細胞の皮下投与によりがん免疫が活性化される
まず,放射線を照射したEG7細胞(C57BL/6マウスの胸腺種に由来するEL4細胞にオボアルブミン抗原を発現させたがん細胞)のがん増殖に対する抑制効果をC57BL/6マウスで確かめた.放射線を照射したEG7細胞を一晩培養して死を誘導し,これをマウスに皮下投与した.10日後に生きたEG7細胞を接種すると,事前にEG7死細胞を投与したマウスではがんの形成を認めず,がん死細胞の皮下投与が確かにがんワクチンとしてはたらくことがわかった.
2.がん死細胞はリンパ流に乗ってリンパ節に運ばれリンパ節洞に蓄積する
がん死細胞が末梢皮下組織から所属リンパ節へ到達するには,移動性樹状細胞による輸送と,死細胞が直接リンパ流に乗るという2つの経路が考えられた.
最初に,皮下投与した死細胞は皮膚の移動性樹状細胞(ランゲルハンス細胞や真皮樹状細胞)にいちど貪食され所属リンパ節に輸送されるという可能性を考えた.この仮説を証明するため,Kaedeトランスジェニックマウスの足踵部に死細胞あるいはFreundアジュバントを皮下投与したのち同じ部位に紫色線を照射し,皮下から所属リンパ節へ移動した樹状細胞の数を調べた.なお,Kaedeトランスジェニックマウスは,紫色線の照射により緑色から赤色へと変色する蛍光タンパク質を全身の細胞で発現する遺伝子改変マウスである6).24時間後の所属リンパ節における赤色の樹状細胞(足踵から移動した細胞)の数をフローサイトメトリーで調べたところ,Freundアジュバント投与マウスでは対照マウスに比べ約15倍に増加していた.ところが,死細胞を投与しても所属リンパ節に移動する樹状細胞の数は増加しなかった.つまり,死細胞の投与は末梢皮下組織の樹状細胞の移動を促さず,移動性樹状細胞は死細胞の輸送にはあまり関与しないことが示された.
皮下投与した死細胞を追跡するため,あらかじめ蛍光標識した死細胞を皮下投与し,投与後の所属リンパ節を経時的に蛍光顕微鏡で観察した.すると,死細胞は投与からわずか3時間後にはリンパ節洞へ到達しその場に蓄積することがわかった.これは移動性樹状細胞がリンパ節に到達する速度をはるかにうわまわっていることから,死細胞はリンパ流に乗ってすみやかに所属リンパ節へ到達したと結論した.
3.CD169陽性マクロファージはリンパ節に流入したがん死細胞を貪食する
つづいて,リンパ節洞に蓄積した死細胞を貪食する食細胞の同定を試みた.蛍光標識した死細胞をマウスに皮下投与し,24時間後に所属リンパ節を摘出した.このリンパ節をコラゲナーゼで処理し,さらに磁気ビーズで食細胞のみを分取した.フローサイトメトリーで解析したところ,リンパ節にはCD11c陽性とCD11c陰性のCD169陽性マクロファージ,CD8α陽性とCD8α陰性の樹状細胞の4種類の食細胞が存在することがわかった.このうち死細胞は2種類のCD169陽性マクロファージによって貪食され,樹状細胞にはほとんど取り込まれないことがわかった.
ところで,死細胞はその表面にホスファチジルセリンを露出し,食細胞はこのホスファチジルセリンを認識することで死細胞のみを選択的に貪食している.マクロファージから産生される可溶性タンパク質MFG-E8は死細胞のホスファチジルセリンと食細胞のインテグリンとを架橋し貪食を促進している7).また,MFG-E8の変異体であるD89Eはホスファチジルセリンをマスクすることでさまざまな食細胞による死細胞の貪食を阻害する.D89Eでホスファチジルセリンをマスクしたがん死細胞を投与するとCD169陽性マクロファージによる貪食が抑制されたことから,CD169陽性マクロファージもホスファチジルセリン依存的に死細胞を取り込んでいることがわかった.
4.CD169陽性マクロファージはがん特異的なCD8陽性T細胞を活性化しがん免疫を確立する
それでは,CD169陽性マクロファージによるがん死細胞の貪食は実際のがん免疫にどのような影響をあたえているのだろうか? 筆者らは,CD169をコードする遺伝子のプロモーターの下流にヒトジフテリアトキシン受容体を発現した遺伝子改変マウス(CD169-DTRマウス)を作製している4).このマウスにジフテリアトキシンを投与すると一過性にCD169陽性細胞を消失させることができるので,これを利用してがん免疫におけるCD169陽性マクロファージの役割を解析した.
野生型マウスおよびCD169-DTRマウスにEG7死細胞を皮下投与し,その10日後に生きたEG7細胞を接種した.腫瘍の径の変化を2群のあいだで比較したところ,事前に死細胞を投与した野生型マウスではがんの成長が抑制されたが,CD169-DTRマウスでは抑制効果が得られなかった.すなわち,CD169陽性マクロファージはがん死細胞の投与によるがん免疫の活性化に中心的な役割を担う細胞であることが証明された.
つぎに,オボアルブミン抗原を発現した死細胞を皮下投与したマウスから所属リンパ節を摘出し,抗原提示細胞を磁気ビーズで分取した.この抗原提示細胞をオボアルブミン抗原に特異的なCD8陽性T細胞とin vitroで共培養すると,野生型マウスではこのCD8陽性T細胞が増殖したのに対し,CD169-DTRマウスでは野生型マウスの20%しか増殖できなかった.すなわち,がん死細胞を投与してもCD169陽性マクロファージがいないとうまくがん抗原(このモデルでは,オボアルブミン抗原)をクロスプレゼンテーションできないことがわかった.
リンパ節のどの細胞が死細胞の抗原を直接クロスプレゼンテーションしているのか確認するため,さきと同様に磁気ビーズで分取した抗原提示細胞をさらにセルソーターで分画精製した.精製した抗原提示細胞とオボアルブミン抗原に特異的なCD8陽性T細胞をin vitroで共培養したところ,CD169陽性マクロファージのうちCD11c陽性サブセットのみが特異的にこのCD8陽性T細胞を増殖することがわかった.また,CD8α陽性およびCD8α陰性どちらの樹状状細胞もこのCD8陽性T細胞を活性化しなかった.
以上の結果より,がん死細胞はCD11c陽性とCD11c陰性どちらのCD169陽性マクロファージにも取り込まれ,つづく抗原のクロスプレゼンテーションはCD11c陽性サブセットのみが単独で遂行することが示された.強いクロスプレゼンテーション能力をもつことが知られているCD8α陽性樹状細胞は,意外なことに皮下投与したがん死細胞の貪食にも抗原提示にも関与しなかった.これは樹状細胞がリンパ節の深部に局在しリンパ節洞に蓄積した細胞性抗原にアクセスできないためと考えられた.
おわりに
以前,血流のアポトーシス死細胞が脾臓の辺縁帯のCD169陽性マクロファージに処理され免疫寛容を誘導することを見い出して以来,このマクロファージの機能に強い関心をもって研究をつづけてきた.今回,末梢組織のがん死細胞が所属リンパ節のCD169陽性マクロファージに貪食され,この場合は逆に,免疫を活性化することがわかり,たいへん驚かされた.CD169陽性マクロファージは細胞死とそれにつづく抗原特異的な免疫応答の制御に中心的な役割を担っているものと考えられる.以上の発見は,細胞の死の様式を選択し,適切なルートで投与することで人為的に免疫応答を制御しうることを示している.CD169陽性マクロファージに選択的にがん抗原を取り込ませることで,今後,効率よくがん免疫を賦活化する新しい治療法を開発したい.
文 献
- Melief, C. J.: Cancer immunotherapy by dendritic cells. Immunity, 29, 372-383 (2008)[PubMed]
- Hanayama, R., Tanaka, M., Miyasaka, K. et al.: Autoimmune disease and impaired uptake of apoptotic cells in MFG-E8-deficient mice. Science, 304, 1147-1150 (2004)[PubMed]
- Asano, K., Miwa, M., Miwa, K. et al.: Masking of phosphatidylserine inhibits apoptotic cell engulfment and induces autoantibody production in mice. J. Exp. Med., 200, 459-467 (2004)[PubMed]
- Miyake, Y., Asano, K., Kaise, H. et al.: Critical role of macrophages in the marginal zone in the suppression of immune responses to apoptotic cell-associated antigens. J. Clin. Invest., 117, 2268-2278 (2007)[PubMed]
- Obeid, M., Tesniere, A., Ghiringhelli, F. et al.: Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat. Med., 13, 54-61 (2007)[PubMed]
- Tomura, M., Yoshida, N., Tanaka, J. et al.: Monitoring cellular movement in vivo with photoconvertible fluorescence protein "Kaede" transgenic mice. Proc. Natl. Acad. Sci. USA, 105, 10871-10876 (2008)[PubMed]
- Hanayama, R., Tanaka, M., Miwa, K. et al.: Identification of a factor that links apoptotic cells to phagocytes. Nature, 417, 182-187 (2002)[PubMed]
著者プロフィール
略歴:2006年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 米国Harvard Medical School研究員を経て,2008年より理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員.
研究テーマ:マクロファージによる死細胞の貪食の免疫学的な意義.
関心事:死細胞を利用した人為的な免疫制御,人工死細胞の開発.
田中 正人(Masato Tanaka)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー.
© 2011 浅野謙一・田中正人 Licensed under CC 表示 2.1 日本