RIG-I依存的な自然免疫応答においてユビキチンリガーゼRipletは必須の役割をはたす
押海 裕之
(北海道大学大学院医学研究科 免疫学分野)
email:押海裕之
DOI: 10.7875/first.author.2011.012
The ubiquitin ligase Riplet is essential for RIG-I-dependent innate immune responses to RNA virus infection.
Hiroyuki Oshiumi, Moeko Miyashita, Naokazu Inoue, Masaru Okabe, Misako Matsumoto, Tsukasa Seya
Cell Host & Microbe, 8, 496-509 (2010)
ウイルスが宿主の細胞に感染すると強い抗ウイルス作用をもつI型インターフェロンなどの炎症性サイトカインが分泌される.インフルエンザウイルスやC型肝炎ウイルスのようなRNAをゲノムにもつRNAウイルスの多くは,細胞質でそのゲノムRNAがRIG-IとよばれるRNAヘリカーゼにより認識される.このウイルス認識センサーとしてはたらくRIG-Iはユビキチン化による制御をうけている.筆者らが単離したRipletと名づけたユビキチンリガーゼは,RIG-IのC末端ドメインをLys63鎖を介したポリユビキチン化することによりRIG-Iを活性化させる.しかし,Ripletによるユビキチン化がRIG-Iの活性化に必須であるのか補助的な役割であるのかは不明であり,さらに,生体での重要性も未解明であった.今回,筆者らは,このRipletのノックアウトマウスを作製しその機能解析を行ったところ,ウイルス感染のときのRIG-Iの活性化にRipletが必須の役割をもっていることを明らかにした.
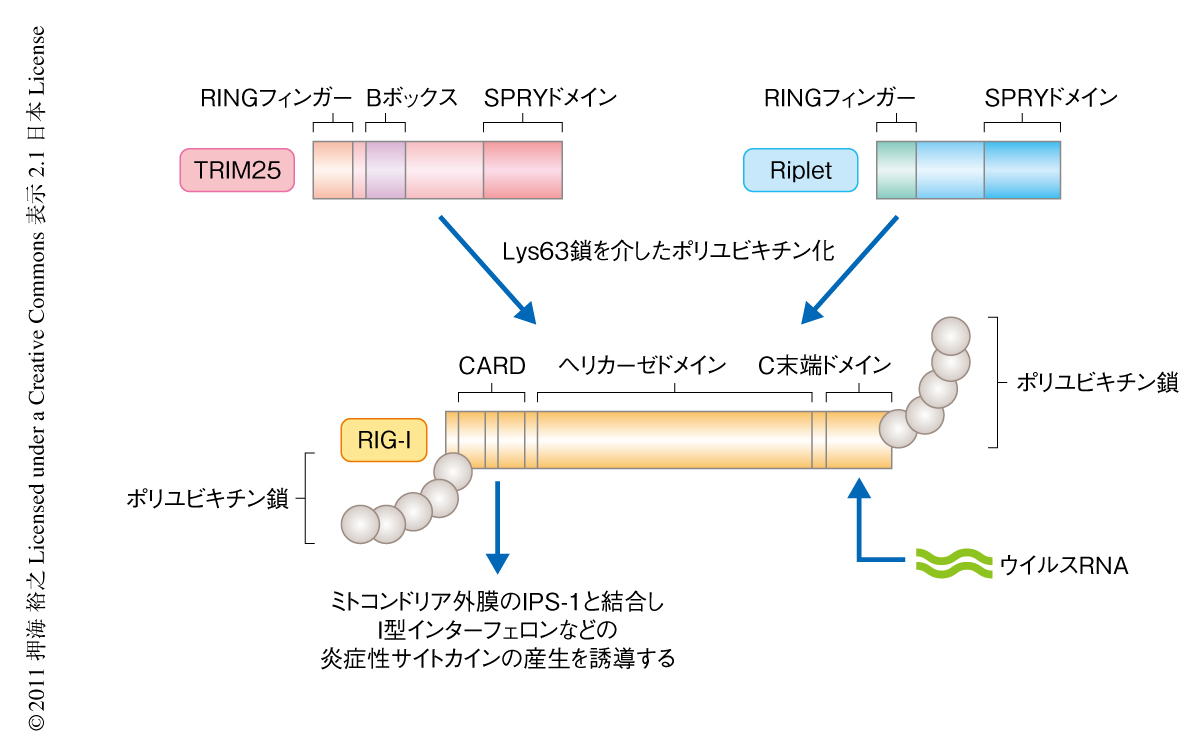
インフルエンザウイルス,C型肝炎ウイルス,日本脳炎ウイルスや麻疹ウイルスなど,ゲノムがRNAで構成されるRNAウイルスがヒトの細胞に感染すると,自然免疫応答として強い抗ウイルス作用をもつI型インターフェロンを含む炎症性サイトカインが産生される.細胞質に存在するRNAヘリカーゼRIG-IはウイルスRNAを認識するセンサーである1).このRIG-Iはウイルスに由来するRNAを認識すると活性化し,ミトコンドリア外膜に存在するIPS-1とよばれるタンパク質と結合してシグナルを下流に伝える2).RIG-Iは上皮細胞やマクロファージ,樹状細胞などさまざまな細胞で発現し,RIG-IによるI型インターフェロンの産生はウイルスに対する生体防御に非常に重要な役割をはたしている3)(図1).
RIG-Iはユビキチンによる制御をうけていることが知られている.TRIM25とよばれるユビキチンリガーゼはRIG-IのN末端側のCARDとよばれる領域に対しLys63鎖を介したポリユビキチン化をひき起こすことや,TRIM25により形成されたポリユビキチン鎖がRIG-IのCARDと結合することでRIG-Iを活性化することが報告されている4,5),筆者らが単離したRipletと名づけたユビキチンリガーゼは,RIG-Iと結合しLys63鎖を介したポリユビキチン化をひき起こす(図1).Ripletには,RIG-IのC末端ドメインをユビキチン化するという筆者らの報告と,N末端側をユビキチン化するという別のグループによる報告とがあり,RipletがRIG-Iの活性化における必須のタンパク質であるのか補助的なタンパク質であるのかも不明であった6,7).
そこで,RipletによるRIG-Iのユビキチン化の役割を明らかにすることを目的としてRipletのノックアウトマウスを作製しその解析を行った.また,RipletがRIG-IのC末端ドメインのユビキチン化にはたす役割についても再検討を行った.
ユビキチンリガーゼであるRipletがRIG-Iのユビキチン化やその活性化に必須であれば,RIG-Iと同様に上皮細胞やマクロファージ,樹状細胞においても発現しているものと予想される.そこでまず,さまざまな臓器,および,樹状細胞,マクロファージ,繊維芽細胞でのRipletのmRNAの発現について調べた.その結果,Ripletは調べたすべての臓器においてその発現が確認され,骨髄から誘導した樹状細胞やマクロファージ,あるいは,マウス胎仔に由来する繊維芽細胞においても発現が確認された.さらに,ヒトの単球に由来する樹状細胞やHeLa細胞においても発現が確認され,RIG-Iと同様にほぼすべての臓器や細胞において発現していることが確認された.
つづいて,Ripletのノックアウトマウスを作製した.ヒトではRipletの遺伝子はRNF135遺伝子とよばれ,このRNF135遺伝子にヘテロの変異をもつ場合,発達の異常や学習障害をひき起こされる8).Ripletノックアウトマウスはヘテロノックアウトの場合もホモノックアウトの場合も調べるかぎりにおいて行動や発生には異常は観察されなかった.また,ヘテロノックアウトマウスどうしを交配した場合でもRipletをホモで欠損した仔もメンデルの法則どおりに生まれた.
野生型マウスとRipletノックアウトマウスよりマウス胎仔に由来する繊維芽細胞を作製し,ウイルス感染のときのI型インターフェロンを含む炎症性サイトカインの産生能を比較した.RNAウイルスのなかでも実験的によく用いられるウシ水泡性口内炎ウイルスとインフルエンザウイルスを用いて細胞への感染実験を行ったところ,これらのウイルス感染のときのI型インターフェロンのmRNAの発現上昇や細胞上清へのインターフェロンの分泌はRipletノックアウト細胞では著しく減少していた.また,C型肝炎ウイルスのRNAを使って細胞を刺激したときのI型インターフェロンの産生もRipletノックアウト細胞では著しく減少した.I型インターフェロンの遺伝子の発現に必須な転写因子IRF3の活性化もRipletノックアウト細胞では消失し,さらに,I型インターフェロン受容体の下流ではたらく転写因子STAT1のリン酸化も消失しており,Ripletがマウス胎仔に由来する繊維芽細胞においてウイルス感染のときのI型インターフェロンの産生に必須であることが明らかになった.この表現型は報告されているRIG-Iノックアウト細胞の表現型と同じであったことから9),つぎに,RIG-Iそのものの活性化について調べた.
マウス胎仔に由来する繊維芽細胞を用い,RIG-Iに依存的なI型インターフェロンのmRNAの発現上昇をレポーター遺伝子法により詳細に調べた.その結果,RIG-IによるI型インターフェロンのmRNAの発現上昇がRipletノックアウト細胞では著しく減少しており,RipletがRIG-Iの活性化に必須であることが明らかになった.さらに,RIG-IのC末端ドメインのみを細胞に発現させたところウイルス感染のときにユビキチン化されること,Ripletノックアウト細胞ではこのユビキチン化が消失していることを確認し,RipletがRIG-IのC末端ドメインをユビキチン化していることが示唆された.
生体にはさまざまな細胞が存在し,それぞれの細胞ごとにウイルス感染のときの応答は異なっている.これまで,樹状細胞のなかでも形質細胞様樹状細胞がウイルス感染のときに大量のI型インターフェロンを産生することが知られていたが,ウイルス感染の初期においてはマクロファージや古典的樹状細胞とよばれる樹状細胞によってI型インターフェロンの産生されることが知られている.RIG-Iは上皮細胞やマクロファージ,古典的樹状細胞において発現しており,形質細胞様樹状細胞ではエンドソームに存在するTLR7によってウイルスRNAが認識されている10).
そこで,さまざまな細胞においてRipletがI型インターフェロンの産生に必須であるかどうかを調べた.その結果,Ripletノックアウトマウスの腹腔内マクロファージや骨髄細胞から誘導したマクロファージ,古典的樹状細胞ではRNAウイルス感染のときのI型インターフェロンの産生にRipletが必須であった.逆に,骨髄細胞からFlt3リガンドにより誘導した形質細胞様樹状細胞を多く含む細胞集団ではRipetに依存せずにI型インターフェロンが産生された.これらはRIG-Iノックアウトマウスの結果と同じであり,RipletがRIG-Iを活性化することでI型インターフェロンの産生に関与しているというモデルと一致した.
最後に,ウイルス感染のときのRipletの生体での役割を明らかにするため,マウスへウイルスを経鼻感染させた.興味深いことに,ウイルス感染ののちの血中のI型インターフェロン量は,感染初期ではRipletに依存するが24時間以上経過した段階ではRipletに依存しなくなった.しかし,ウイルスに感染したマウスの生存率をみるとRipletノックアウトマウスは野生型マウスと比較して非常にすみやかに死亡し,また,生体でのウイルスの量についても野生型マウスと比べRipletノックアウトマウスでは非常に増加していた.これらの結果は,マクロファージや古典的樹状細胞でのRipletのはたらきがウイルス感染の初期のI型インターフェロンの産生に重要な役割をはたすこと,さらに,この初期のI型インターフェロンの産生がウイルスに対する生体防御において重要な役割をはたすことを示唆していた(図2).
今回の実験から,1)ユビキチンリガーゼであるRipletは細胞質のウイルス認識センサーであるRIG-IのC末端ドメインをユビキチン化することでI型インターフェロンの産生を誘導すること,2)このRipletによるRIG-Iの活性化はマクロファージや古典的樹状細胞ではたらき生体でのウイルス感染の初期のI型インターフェロンの産生を担っていること,3)この初期のI型インターフェロンの産生がウイルスに対する生体防御において重要であること,が明らかとなった.
RIG-IはC型肝炎ウイルスのRNAを認識することが知られている.筆者らは,すでに予備実験からC型肝炎ウイルスのもつタンパク質がRipletを破壊することを発見しており,今後,この詳細な分子機構の解明によりC型肝炎ウイルスに対する新たな治療薬の開発へとつながることが期待される.
略歴:2001年 大阪大学大学院理学研究科 修了,同年 大阪府立成人病センター研究所 研究員,2003年 大阪大学大学院理学研究科 特任教員,2004年 大阪大学蛋白質研究所 教務職員,2005年 大阪大学タンパク質研究所 助手,2006年 北海道大学大学院医学研究科 助手を経て,2009年より北海道大学大学院医学研究科 講師.
研究テーマ:自然免疫の分子生物学.
関心事:老化および意識の分子機構.
© 2011 押海 裕之 Licensed under CC 表示 2.1 日本
(北海道大学大学院医学研究科 免疫学分野)
email:押海裕之
DOI: 10.7875/first.author.2011.012
The ubiquitin ligase Riplet is essential for RIG-I-dependent innate immune responses to RNA virus infection.
Hiroyuki Oshiumi, Moeko Miyashita, Naokazu Inoue, Masaru Okabe, Misako Matsumoto, Tsukasa Seya
Cell Host & Microbe, 8, 496-509 (2010)
要 約
ウイルスが宿主の細胞に感染すると強い抗ウイルス作用をもつI型インターフェロンなどの炎症性サイトカインが分泌される.インフルエンザウイルスやC型肝炎ウイルスのようなRNAをゲノムにもつRNAウイルスの多くは,細胞質でそのゲノムRNAがRIG-IとよばれるRNAヘリカーゼにより認識される.このウイルス認識センサーとしてはたらくRIG-Iはユビキチン化による制御をうけている.筆者らが単離したRipletと名づけたユビキチンリガーゼは,RIG-IのC末端ドメインをLys63鎖を介したポリユビキチン化することによりRIG-Iを活性化させる.しかし,Ripletによるユビキチン化がRIG-Iの活性化に必須であるのか補助的な役割であるのかは不明であり,さらに,生体での重要性も未解明であった.今回,筆者らは,このRipletのノックアウトマウスを作製しその機能解析を行ったところ,ウイルス感染のときのRIG-Iの活性化にRipletが必須の役割をもっていることを明らかにした.
はじめに
インフルエンザウイルス,C型肝炎ウイルス,日本脳炎ウイルスや麻疹ウイルスなど,ゲノムがRNAで構成されるRNAウイルスがヒトの細胞に感染すると,自然免疫応答として強い抗ウイルス作用をもつI型インターフェロンを含む炎症性サイトカインが産生される.細胞質に存在するRNAヘリカーゼRIG-IはウイルスRNAを認識するセンサーである1).このRIG-Iはウイルスに由来するRNAを認識すると活性化し,ミトコンドリア外膜に存在するIPS-1とよばれるタンパク質と結合してシグナルを下流に伝える2).RIG-Iは上皮細胞やマクロファージ,樹状細胞などさまざまな細胞で発現し,RIG-IによるI型インターフェロンの産生はウイルスに対する生体防御に非常に重要な役割をはたしている3)(図1).
RIG-Iはユビキチンによる制御をうけていることが知られている.TRIM25とよばれるユビキチンリガーゼはRIG-IのN末端側のCARDとよばれる領域に対しLys63鎖を介したポリユビキチン化をひき起こすことや,TRIM25により形成されたポリユビキチン鎖がRIG-IのCARDと結合することでRIG-Iを活性化することが報告されている4,5),筆者らが単離したRipletと名づけたユビキチンリガーゼは,RIG-Iと結合しLys63鎖を介したポリユビキチン化をひき起こす(図1).Ripletには,RIG-IのC末端ドメインをユビキチン化するという筆者らの報告と,N末端側をユビキチン化するという別のグループによる報告とがあり,RipletがRIG-Iの活性化における必須のタンパク質であるのか補助的なタンパク質であるのかも不明であった6,7).
そこで,RipletによるRIG-Iのユビキチン化の役割を明らかにすることを目的としてRipletのノックアウトマウスを作製しその解析を行った.また,RipletがRIG-IのC末端ドメインのユビキチン化にはたす役割についても再検討を行った.
1.RipletをコードするmRNAはほぼすべての組織や細胞において発現している
ユビキチンリガーゼであるRipletがRIG-Iのユビキチン化やその活性化に必須であれば,RIG-Iと同様に上皮細胞やマクロファージ,樹状細胞においても発現しているものと予想される.そこでまず,さまざまな臓器,および,樹状細胞,マクロファージ,繊維芽細胞でのRipletのmRNAの発現について調べた.その結果,Ripletは調べたすべての臓器においてその発現が確認され,骨髄から誘導した樹状細胞やマクロファージ,あるいは,マウス胎仔に由来する繊維芽細胞においても発現が確認された.さらに,ヒトの単球に由来する樹状細胞やHeLa細胞においても発現が確認され,RIG-Iと同様にほぼすべての臓器や細胞において発現していることが確認された.
2.Ripletノックアウトマウスの作製
つづいて,Ripletのノックアウトマウスを作製した.ヒトではRipletの遺伝子はRNF135遺伝子とよばれ,このRNF135遺伝子にヘテロの変異をもつ場合,発達の異常や学習障害をひき起こされる8).Ripletノックアウトマウスはヘテロノックアウトの場合もホモノックアウトの場合も調べるかぎりにおいて行動や発生には異常は観察されなかった.また,ヘテロノックアウトマウスどうしを交配した場合でもRipletをホモで欠損した仔もメンデルの法則どおりに生まれた.
3.RipletはRIG-Iの活性化に必須である
野生型マウスとRipletノックアウトマウスよりマウス胎仔に由来する繊維芽細胞を作製し,ウイルス感染のときのI型インターフェロンを含む炎症性サイトカインの産生能を比較した.RNAウイルスのなかでも実験的によく用いられるウシ水泡性口内炎ウイルスとインフルエンザウイルスを用いて細胞への感染実験を行ったところ,これらのウイルス感染のときのI型インターフェロンのmRNAの発現上昇や細胞上清へのインターフェロンの分泌はRipletノックアウト細胞では著しく減少していた.また,C型肝炎ウイルスのRNAを使って細胞を刺激したときのI型インターフェロンの産生もRipletノックアウト細胞では著しく減少した.I型インターフェロンの遺伝子の発現に必須な転写因子IRF3の活性化もRipletノックアウト細胞では消失し,さらに,I型インターフェロン受容体の下流ではたらく転写因子STAT1のリン酸化も消失しており,Ripletがマウス胎仔に由来する繊維芽細胞においてウイルス感染のときのI型インターフェロンの産生に必須であることが明らかになった.この表現型は報告されているRIG-Iノックアウト細胞の表現型と同じであったことから9),つぎに,RIG-Iそのものの活性化について調べた.
マウス胎仔に由来する繊維芽細胞を用い,RIG-Iに依存的なI型インターフェロンのmRNAの発現上昇をレポーター遺伝子法により詳細に調べた.その結果,RIG-IによるI型インターフェロンのmRNAの発現上昇がRipletノックアウト細胞では著しく減少しており,RipletがRIG-Iの活性化に必須であることが明らかになった.さらに,RIG-IのC末端ドメインのみを細胞に発現させたところウイルス感染のときにユビキチン化されること,Ripletノックアウト細胞ではこのユビキチン化が消失していることを確認し,RipletがRIG-IのC末端ドメインをユビキチン化していることが示唆された.
4.細胞に特異的なRipletの役割
生体にはさまざまな細胞が存在し,それぞれの細胞ごとにウイルス感染のときの応答は異なっている.これまで,樹状細胞のなかでも形質細胞様樹状細胞がウイルス感染のときに大量のI型インターフェロンを産生することが知られていたが,ウイルス感染の初期においてはマクロファージや古典的樹状細胞とよばれる樹状細胞によってI型インターフェロンの産生されることが知られている.RIG-Iは上皮細胞やマクロファージ,古典的樹状細胞において発現しており,形質細胞様樹状細胞ではエンドソームに存在するTLR7によってウイルスRNAが認識されている10).
そこで,さまざまな細胞においてRipletがI型インターフェロンの産生に必須であるかどうかを調べた.その結果,Ripletノックアウトマウスの腹腔内マクロファージや骨髄細胞から誘導したマクロファージ,古典的樹状細胞ではRNAウイルス感染のときのI型インターフェロンの産生にRipletが必須であった.逆に,骨髄細胞からFlt3リガンドにより誘導した形質細胞様樹状細胞を多く含む細胞集団ではRipetに依存せずにI型インターフェロンが産生された.これらはRIG-Iノックアウトマウスの結果と同じであり,RipletがRIG-Iを活性化することでI型インターフェロンの産生に関与しているというモデルと一致した.
5.Ripletの生体での役割
最後に,ウイルス感染のときのRipletの生体での役割を明らかにするため,マウスへウイルスを経鼻感染させた.興味深いことに,ウイルス感染ののちの血中のI型インターフェロン量は,感染初期ではRipletに依存するが24時間以上経過した段階ではRipletに依存しなくなった.しかし,ウイルスに感染したマウスの生存率をみるとRipletノックアウトマウスは野生型マウスと比較して非常にすみやかに死亡し,また,生体でのウイルスの量についても野生型マウスと比べRipletノックアウトマウスでは非常に増加していた.これらの結果は,マクロファージや古典的樹状細胞でのRipletのはたらきがウイルス感染の初期のI型インターフェロンの産生に重要な役割をはたすこと,さらに,この初期のI型インターフェロンの産生がウイルスに対する生体防御において重要な役割をはたすことを示唆していた(図2).
おわりに
今回の実験から,1)ユビキチンリガーゼであるRipletは細胞質のウイルス認識センサーであるRIG-IのC末端ドメインをユビキチン化することでI型インターフェロンの産生を誘導すること,2)このRipletによるRIG-Iの活性化はマクロファージや古典的樹状細胞ではたらき生体でのウイルス感染の初期のI型インターフェロンの産生を担っていること,3)この初期のI型インターフェロンの産生がウイルスに対する生体防御において重要であること,が明らかとなった.
RIG-IはC型肝炎ウイルスのRNAを認識することが知られている.筆者らは,すでに予備実験からC型肝炎ウイルスのもつタンパク質がRipletを破壊することを発見しており,今後,この詳細な分子機構の解明によりC型肝炎ウイルスに対する新たな治療薬の開発へとつながることが期待される.
文 献
- Yoneyama, M., Kikuchi, M., Natsukawa, T. et al.: The RNA helicase RIG-I has an essential function in double-stranded RNA-induced innate antiviral responses. Nat. Immunol., 5, 730-737 (2004)[PubMed]
- Kawai, T., Takahashi, K., Sato, S. et al.: IPS-1, an adaptor triggering RIG-I- and Mda5-mediated type I interferon induction. Nat. Immunol., 6, 981-988 (2005)[PubMed]
- Kato, H., Sato, S., Yoneyama, M. et al.: Cell type-specific involvement of RIG-I in antiviral response. Immunity, 23, 19-28 (2005)[PubMed]
- Zeng, W., Sun, L., Jiang, X. et al.: Reconstitution of the RIG-I pathway reveals a signaling role of unanchored polyubiquitin chains in innate immunity. Cell, 141, 315-330 (2010)[PubMed]
- Gack, M. U., Shin, Y. C., Joo, C. H. et al.: TRIM25 RING-finger E3 ubiquitin ligase is essential for RIG-I-mediated antiviral activity. Nature, 446, 916-920 (2007)[PubMed]
- Oshiumi, H., Matsumoto, M., Hatakeyama, S. et al.: Riplet/RNF135, a RING finger protein, ubiquitinates RIG-I to promote interferon-β induction during the early phase of viral infection. J. Biol. Chem., 284, 807-817 (2009)[PubMed]
- Gao, D., Yang, Y. K., Wang, R. P. et al.: REUL is a novel E3 ubiquitin ligase and stimulator of retinoic-acid-inducible gene-I. PLoS One, 4, e5760 (2009)[PubMed]
- Douglas, J., Cilliers, D., Coleman, K. et al.: Mutations in RNF135, a gene within the NF1 microdeletion region, cause phenotypic abnormalities including overgrowth. Nat. Genet., 39, 963-965 (2007)[PubMed]
- Kato, H., Takeuchi, O., Sato, S. et al.: Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses. Nature, 441, 101-105 (2006)[PubMed]
- Diebold, S. S., Kaisho, T., Hemmi, H. et al.: Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science, 303, 1529-1531 (2004)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院理学研究科 修了,同年 大阪府立成人病センター研究所 研究員,2003年 大阪大学大学院理学研究科 特任教員,2004年 大阪大学蛋白質研究所 教務職員,2005年 大阪大学タンパク質研究所 助手,2006年 北海道大学大学院医学研究科 助手を経て,2009年より北海道大学大学院医学研究科 講師.
研究テーマ:自然免疫の分子生物学.
関心事:老化および意識の分子機構.
© 2011 押海 裕之 Licensed under CC 表示 2.1 日本