アクチン線維の二重らせん鎖にそったフォルミンmDia1の回転運動
渡邊直樹・水野裕昭
(東北大学大学院生命科学研究科 分子生命科学専攻単分子動態生物学分野)
email:渡邊直樹
DOI: 10.7875/first.author.2011.016
Rotational movement of the formin mDia1 along the double helical strand of an actin filament.
Hiroaki Mizuno, Chiharu Higashida, Yunfeng Yuan, Toshimasa Ishizaki, Shuh Narumiya, Naoki Watanabe
Science, 331, 80-83 (2011)
アクチン重合の力は細胞のかたちづくりや運動を駆動する.アクチン重合促進タンパク質であるフォルミンファミリーは,伸長するアクチン重合端に結合したまま連続的にアクチン線維を伸長させる.この性質から,重合中のアクチンを細胞構造にアンカーする機能をもつことが示唆されてきた.一方,フォルミンファミリーは重合しているアクチン線維の二重らせん構造にそって回転していること(以後,らせん回転とよぶ)が予想されるが,このらせん回転の有無は未確認のまま残されていた.筆者らは,単分子蛍光偏光を用いてフォルミンファミリーのひとつmDia1のらせん回転を可視化した.ガラス面に固相化されたmDia1から伸長,あるいは,mDia1にむかって脱重合するアクチン線維から捕捉された蛍光は,アクチン線維のらせん周期構造に一致してその偏光の向きが振動した.また,この振動はアクチンに結合したATPあるいはADPやプロフィリンの有無に関係なく観察された.フォルミンファミリーのらせん回転はアクチン線維の構造に由来する固有の性質であった.また,付随的に,mDia1とプロフィリンとがアクチン線維の伸長を加速する際に,ATPが必須の因子であることを見い出した.この研究の結果は,アクチン重合の力とアクチン線維軸のまわりのトルクの相互作用による新たなアクチン線維ネットワークの形成や維持および崩壊の制御のしくみを示唆する.
アクチン線維の重合および崩壊はRhoファミリー低分子量Gタンパク質やアクチン重合核形成促進分子により制御されている1).なかでも,mDia1やそれが属するフォルミンファミリーは,細胞質分裂や細胞の極性形成および接着などにおいてアクチン線維を供給する主要なアクチン重合促進因子である.細胞内での蛍光単分子可視化による以前の筆者らの研究により,mDia1がアクチン線維の速い重合端(反矢じり端)に結合したまま毎秒720個ものアクチン分子をつぎつぎと取り込み,アクチン線維を伸長させながら毎秒2μmの速さで移動することが可視化された2).この速度はアクチン線維や微小管をレールとして移動するミオシンやキネシンといったモータータンパク質の能力に匹敵する.よって,フォルミンファミリーが細胞構造にアンカーされることで,アクチン重合の力を細胞小器官の輸送や細胞変形のための力へと変換する機構が考えられてきた.実際,in vitroではガラス面に固相化されたフォルミンファミリーから伸長するアクチン線維は数pNの力を発生する3).筆者らの先行研究において,線維芽細胞内で分子可視化された野生型mDia1ではプロセッシブに移動するものは4.3%であって,多くの分子(47.5%)は静止していた4).この後者がアクチン重合端に会合しているかどうかは未解決である.一方,アクチン線維は約72 nmで1回転する二重らせん構造をもつため,フォルミンファミリーは回転しながらアクチンを重合することが予測された.このらせん回転の性質は,さきに述べたモータータンパク質のように“もの”を運ぶ機能と干渉する可能性があり,その有無はフォルミンファミリーの機能を知るうえで重要な未解決な課題として残されていた.
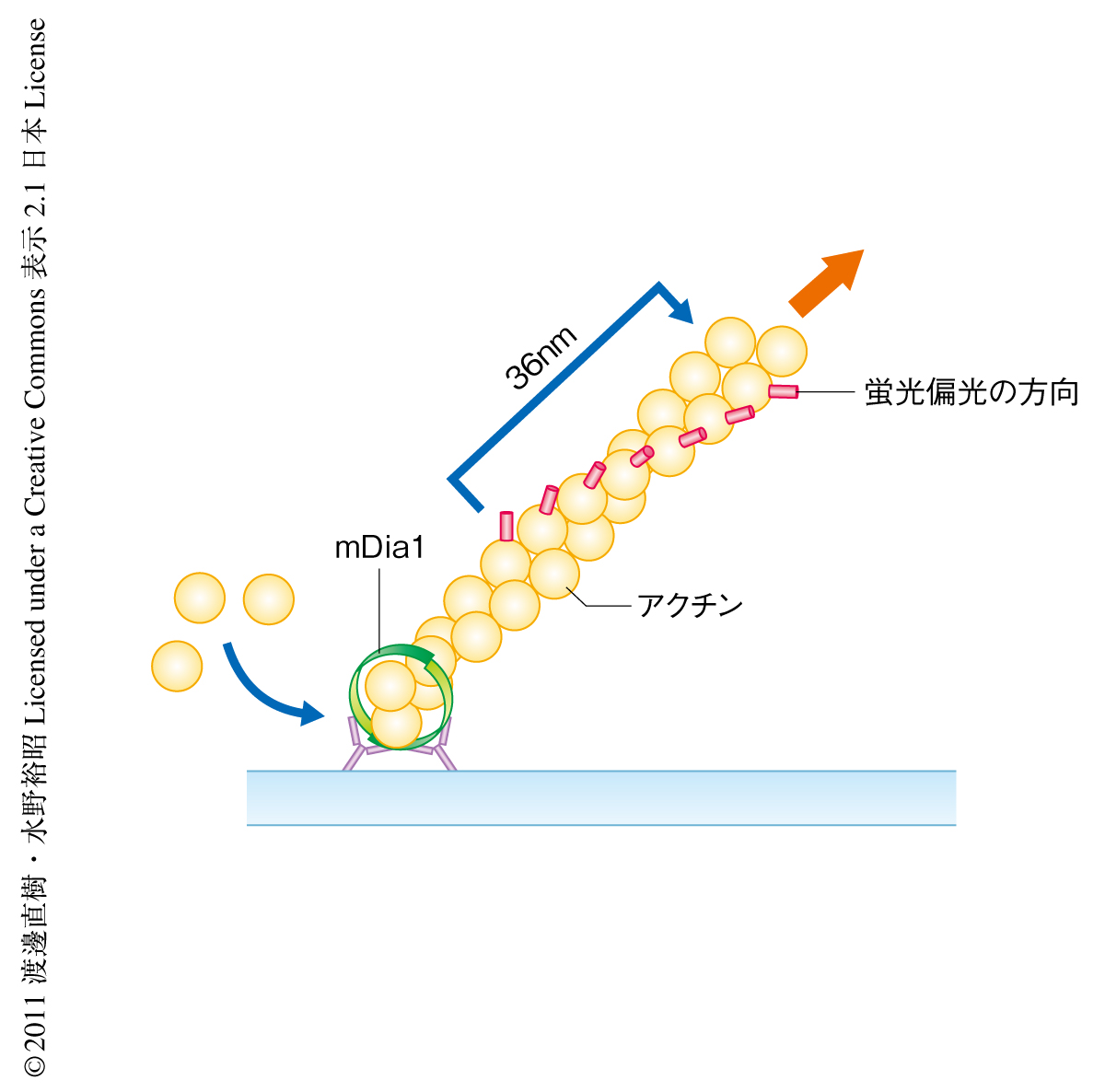
らせん回転を検証するため,ガラスに固定したmDia1から伸長するアクチン線維を低密度のテトラメチルローダミン色素で標識し,この色素1分子の蛍光偏光を高感度顕微鏡で観察した.この色素標識アクチンは線維軸から45度の方向に偏光した蛍光を発する5).よって,斜め方向に伸長するアクチン線維が回転した場合,色素分子からでる蛍光の偏光成分が縦から横さらに縦へと変化するため,らせん回転の有無を直接的に可視化し検証することができる(図1).
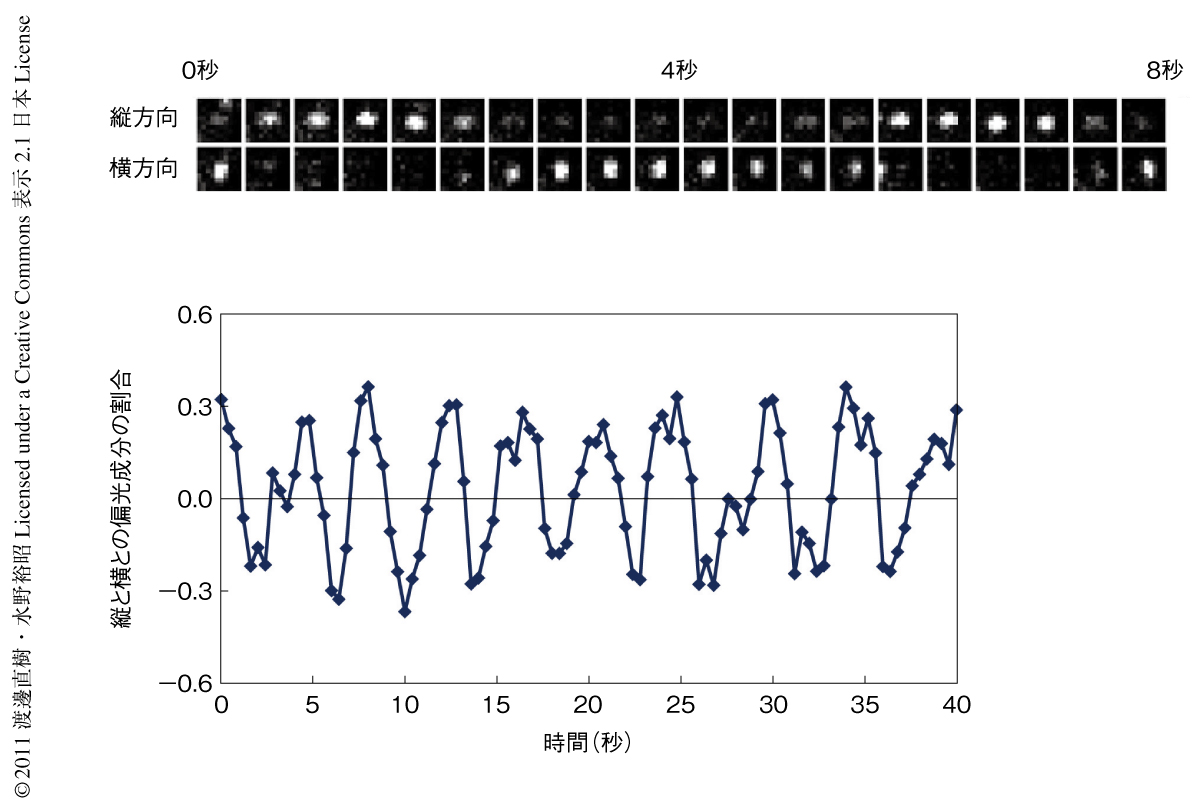
まず,ATPアクチンによる通常の重合条件でmDia1からプロセッシブに伸長するアクチン線維からの単分子蛍光の向きが周期的に変動することを観察した(図2).また,蛍光スポットの移動距離との変動の回数の比較から,約36 nm伸長するごとに1回,偏光が縦から横,あるいは,横から縦に切り替わることを確認した.この距離はアクチン線維構造のらせん周期に一致しており,mDia1がらせん回転の性質をもつことが示された.
以前,酵母のフォルミンファミリーBni1pとアクチン線維の遅い重合端(矢じり端)をガラス面に固着させプロセッシブにアクチン線維を伸長させた際に,アクチン線維が超らせんを形成することなくたわみながら伸長することが発見され,Bni1pはアクチン線維の軸のまわりにそってベアリングのように滑り回転すると結論づけられた3).これは,筆者らのらせん回転の結果とは矛盾する.この問題を解決するため,以前の実験のようにGST-mDia1をガラスに非特異的に吸着させた場合と3),筆者らの手法である抗GST抗体と2次抗体とによってmDia1をタンパク質凝集体に固相化した場合とで2),その比較を行った.異なる手法で固相化されたmDia1からプロセッシブに伸長するアクチン線維の矢じり端側が固定された際に,たわみながら伸長する頻度を計測したところ,前者の方法が後者の方法よりたわみながら伸長する頻度が高い結果を得た.固相化法の違いにより差がでたことから,いずれの実験条件においてもガラス面とフォルミンファミリーとのあいだで滑りが生ずることが推測できた.さらに,酵母のBni1pを用いても同様のらせん回転が観察された.これらの所見から,強いねじれトルクがかかったときにフォルミンファミリーが反矢じり端の周囲をベアリング様に滑り回転する可能性は残されるものの,通常はフォルミンファミリーはらせん回転をしながらアクチン線維を伸長すると結論づけた.
ATPやアクチン結合タンパク質プロフィリンの有無などさまざまな条件でもらせん回転の性質は変化しないことも確認した.プロフィリンとそれが結合するポリプロリン配列からなるフォルミンのFH1ドメインは,FH2ドメインによるATPアクチンのプロセッシブな重合を著明に加速する6).また,あとで述べるように,ADPアクチンを用いるとプロフィリンがmDia1によるプロセッシブな重合を阻止するという報告もあった7).そこで,プロフィリンの有無,ATPアクチンとADPアクチンとの違い,ATPの加水分解後にアクチン線維から放出される無機リン酸の影響を順次検討したところ,どの条件でもmDia1のらせん回転が観察された.また,今回はじめて,フォルミンファミリーに結合したアクチン線維の反矢じり端がプロセッシブに脱重合するのを可視化することに成功したが,その際にもらせん回転が観察された.いずれの場合においても,蛍光偏光の向きの変動は34.6~36.8 nmの周期で観察された.以上の結果から,フォルミンファミリーのらせん回転はアクチン線維の構造に依存する根本的な性質だと考えられた.
また,今回のアクチン線維の伸長速度の詳細な解析から,アクチンに結合したATPがmDia1によるアクチン伸長の加速に必須の因子であるという付随的な知見が得られた.アクチン線維は速い重合端である反矢じり端と遅い重合端である矢じり端をもち,定常状態ではこの反矢じり端が伸び矢じり端が縮むというトレッドミリングを起こす.トレッドミリングの実現にはアクチン単量体に結合したATPが重合ののちADPに加水分解される際に生じるエネルギーが役立つが,現在のところ,ATPの加水分解がアクチン線維のどの部分で起こりどのような効果を及ぼしているのかは未解決である.
これまでに,mDia1によるプロセッシブなアクチン重合において,ある論文は,ADPアクチンとプロフィリンとの組合せではアクチン線維の伸長が停止することを報告し,ATP加水分解はmDia1の結合する反矢じり端で起こると提唱した7).それとは対照的に,別の論文では,ADPアクチンを用いてもプロフィリンは伸長速度をゆるやか(約2倍)に加速すると報告した6).筆者らは,この両者とも異なる見解を得た.まず,さきに述べたように,mDia1の結合した反矢じり端がプロセッシブに脱重合するのを可視化したが,プロフィリンが数倍脱重合を加速することを見い出した.この脱重合はアクチン線維に無機リン酸が結合することで阻害された.一方,mDia1によるADPアクチンの伸長ではプロフィリン添加ののちも伸長は維持されるもののその速度が低下したが,無機リン酸がアクチン線維に結合するとこのプロフィリンによる阻害作用が消失した.これらのことより,プロフィリンはADPアクチンの伸長を直接阻害するのではなく,mDia1が結合した反矢じり端からのアクチンの解離を促進しているものと判断できる.以上のように,ATP加水分解がなくてもmDia1を介するプロセッシブなアクチンの伸長は進行するものの,アクチン線維の伸長の加速にはATPが必須であると結論づけた.この知見はATP加水分解の謎を解くものではないが,ATPのはたす役割の重要性を再認識させるものである.
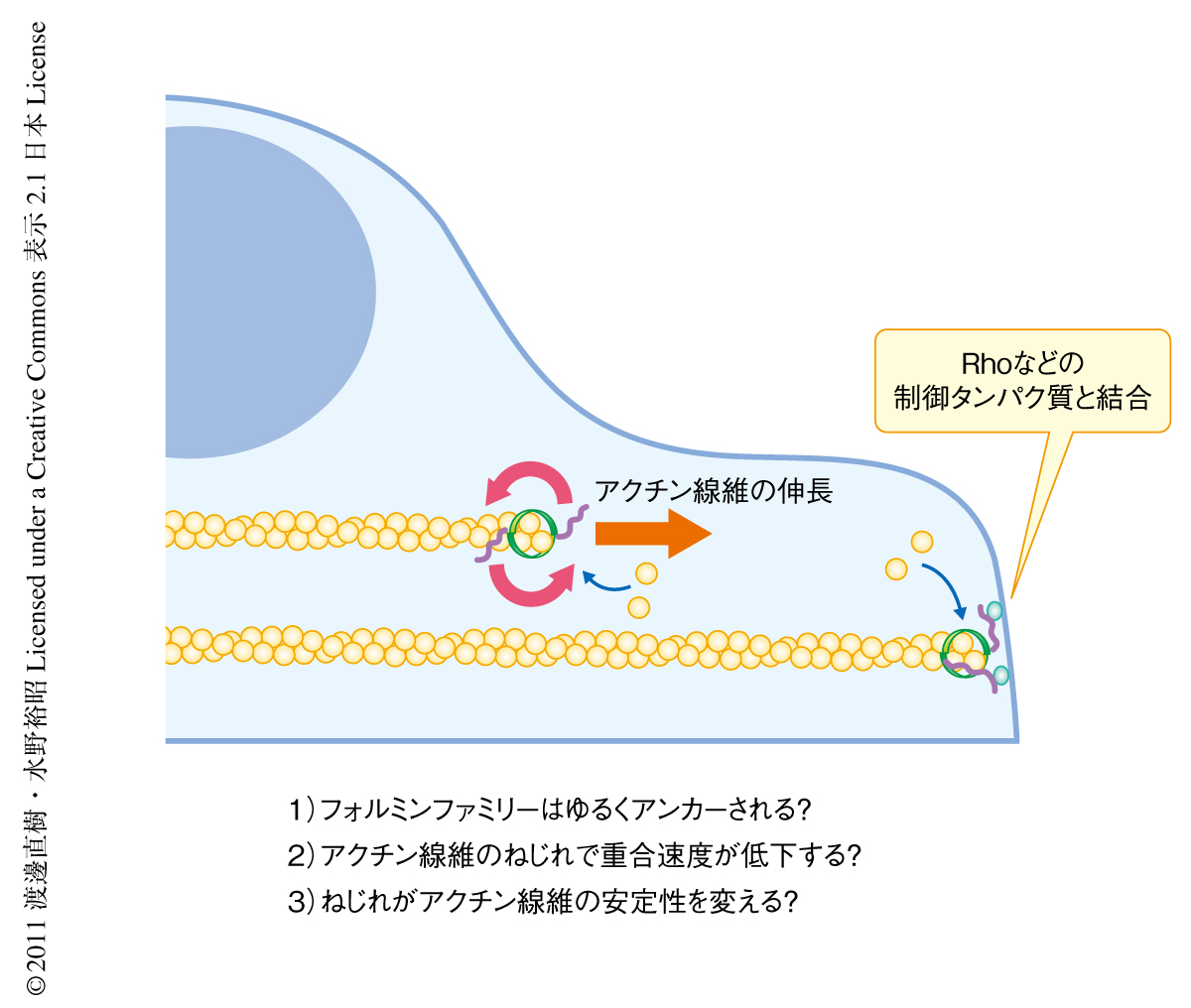
細胞構造にフォルミンファミリーが接したままアクチン線維を重合させると,フォルミンファミリーが回転する分,アクチン線維にねじれが生じることが今回の結果より予想される.このことから,細胞骨格線維の力学的な制御の新しい機構がいくつかみえてきた(図3).ひとつは,フォルミンファミリーが伸長するアクチン線維をアンカーする際に細胞構造にフレキシブルに結合する必要があることである.もうひとつは,フォルミンファミリーを介したアクチン伸長が,線維に蓄積したねじれによって制御される可能性である.あるいは逆に,フォルミンファミリーはらせん回転の性質を利用してアクチン線維のねじれを変化させることで,アクチンネットワークの安定性を制御している可能性も考えられる.たとえば,アクチン脱重合タンパク質であるコフィリンが結合したアクチン線維は,ねじれが強くなることが知られている8).らせん回転がアクチン脱重合機構と力学的に相互作用している可能性が考えられる.この研究の成果はアクチン重合の機構を明らかにするだけでなく,フォルミンファミリーに制御される細胞内アクチン線維ネットワークの形成,および,その維持および崩壊の力学的な制御機構の詳細を解明するうえで,重要な知見を提供することが期待される.
略歴:1990年 京都大学医学部 卒業,1998年 京都大学大学院医学研究科 助手,1999年 米国Harvard Medical School研究員,2002年 京都大学大学院医学研究科 助教授を経て,2010年より東北大学大学院生命科学研究科 教授.
研究テーマ:細胞内蛍光分子可視化による細胞骨格制御と細胞シグナルの解明,分子標的薬の作用可視化など.
水野 裕昭(Hiroaki Mizuno)
略歴:2007年 長岡技術科学大学大学院工学研究科博士課程 修了,同年 米国Massachusetts大学Medical School研究員,2008年 京都大学大学院医学研究科 研究員を経て,2010年より東北大学大学院生命科学研究科 研究員.
研究テーマ:分子可視化による細胞骨格調節タンパク質の制御機構の解明.
関心事:フォルミンファミリーのらせん回転があたえるアクチン線維へのねじれ負荷が,細胞内アクチン線維ネットワークの構築および崩壊にどのように関係するか.
© 2011 渡邊直樹・水野裕昭 Licensed under CC 表示 2.1 日本
(東北大学大学院生命科学研究科 分子生命科学専攻単分子動態生物学分野)
email:渡邊直樹
DOI: 10.7875/first.author.2011.016
Rotational movement of the formin mDia1 along the double helical strand of an actin filament.
Hiroaki Mizuno, Chiharu Higashida, Yunfeng Yuan, Toshimasa Ishizaki, Shuh Narumiya, Naoki Watanabe
Science, 331, 80-83 (2011)
要 約
アクチン重合の力は細胞のかたちづくりや運動を駆動する.アクチン重合促進タンパク質であるフォルミンファミリーは,伸長するアクチン重合端に結合したまま連続的にアクチン線維を伸長させる.この性質から,重合中のアクチンを細胞構造にアンカーする機能をもつことが示唆されてきた.一方,フォルミンファミリーは重合しているアクチン線維の二重らせん構造にそって回転していること(以後,らせん回転とよぶ)が予想されるが,このらせん回転の有無は未確認のまま残されていた.筆者らは,単分子蛍光偏光を用いてフォルミンファミリーのひとつmDia1のらせん回転を可視化した.ガラス面に固相化されたmDia1から伸長,あるいは,mDia1にむかって脱重合するアクチン線維から捕捉された蛍光は,アクチン線維のらせん周期構造に一致してその偏光の向きが振動した.また,この振動はアクチンに結合したATPあるいはADPやプロフィリンの有無に関係なく観察された.フォルミンファミリーのらせん回転はアクチン線維の構造に由来する固有の性質であった.また,付随的に,mDia1とプロフィリンとがアクチン線維の伸長を加速する際に,ATPが必須の因子であることを見い出した.この研究の結果は,アクチン重合の力とアクチン線維軸のまわりのトルクの相互作用による新たなアクチン線維ネットワークの形成や維持および崩壊の制御のしくみを示唆する.
はじめに
アクチン線維の重合および崩壊はRhoファミリー低分子量Gタンパク質やアクチン重合核形成促進分子により制御されている1).なかでも,mDia1やそれが属するフォルミンファミリーは,細胞質分裂や細胞の極性形成および接着などにおいてアクチン線維を供給する主要なアクチン重合促進因子である.細胞内での蛍光単分子可視化による以前の筆者らの研究により,mDia1がアクチン線維の速い重合端(反矢じり端)に結合したまま毎秒720個ものアクチン分子をつぎつぎと取り込み,アクチン線維を伸長させながら毎秒2μmの速さで移動することが可視化された2).この速度はアクチン線維や微小管をレールとして移動するミオシンやキネシンといったモータータンパク質の能力に匹敵する.よって,フォルミンファミリーが細胞構造にアンカーされることで,アクチン重合の力を細胞小器官の輸送や細胞変形のための力へと変換する機構が考えられてきた.実際,in vitroではガラス面に固相化されたフォルミンファミリーから伸長するアクチン線維は数pNの力を発生する3).筆者らの先行研究において,線維芽細胞内で分子可視化された野生型mDia1ではプロセッシブに移動するものは4.3%であって,多くの分子(47.5%)は静止していた4).この後者がアクチン重合端に会合しているかどうかは未解決である.一方,アクチン線維は約72 nmで1回転する二重らせん構造をもつため,フォルミンファミリーは回転しながらアクチンを重合することが予測された.このらせん回転の性質は,さきに述べたモータータンパク質のように“もの”を運ぶ機能と干渉する可能性があり,その有無はフォルミンファミリーの機能を知るうえで重要な未解決な課題として残されていた.
1.アクチン線維サブユニットの向きの捕捉
らせん回転を検証するため,ガラスに固定したmDia1から伸長するアクチン線維を低密度のテトラメチルローダミン色素で標識し,この色素1分子の蛍光偏光を高感度顕微鏡で観察した.この色素標識アクチンは線維軸から45度の方向に偏光した蛍光を発する5).よって,斜め方向に伸長するアクチン線維が回転した場合,色素分子からでる蛍光の偏光成分が縦から横さらに縦へと変化するため,らせん回転の有無を直接的に可視化し検証することができる(図1).
2.mDia1からプロセッシブに重合するアクチン線維のらせん回転
まず,ATPアクチンによる通常の重合条件でmDia1からプロセッシブに伸長するアクチン線維からの単分子蛍光の向きが周期的に変動することを観察した(図2).また,蛍光スポットの移動距離との変動の回数の比較から,約36 nm伸長するごとに1回,偏光が縦から横,あるいは,横から縦に切り替わることを確認した.この距離はアクチン線維構造のらせん周期に一致しており,mDia1がらせん回転の性質をもつことが示された.
3.フォルミンファミリーがアクチン線維軸のまわりを滑ると結論した報告との相違の理由
以前,酵母のフォルミンファミリーBni1pとアクチン線維の遅い重合端(矢じり端)をガラス面に固着させプロセッシブにアクチン線維を伸長させた際に,アクチン線維が超らせんを形成することなくたわみながら伸長することが発見され,Bni1pはアクチン線維の軸のまわりにそってベアリングのように滑り回転すると結論づけられた3).これは,筆者らのらせん回転の結果とは矛盾する.この問題を解決するため,以前の実験のようにGST-mDia1をガラスに非特異的に吸着させた場合と3),筆者らの手法である抗GST抗体と2次抗体とによってmDia1をタンパク質凝集体に固相化した場合とで2),その比較を行った.異なる手法で固相化されたmDia1からプロセッシブに伸長するアクチン線維の矢じり端側が固定された際に,たわみながら伸長する頻度を計測したところ,前者の方法が後者の方法よりたわみながら伸長する頻度が高い結果を得た.固相化法の違いにより差がでたことから,いずれの実験条件においてもガラス面とフォルミンファミリーとのあいだで滑りが生ずることが推測できた.さらに,酵母のBni1pを用いても同様のらせん回転が観察された.これらの所見から,強いねじれトルクがかかったときにフォルミンファミリーが反矢じり端の周囲をベアリング様に滑り回転する可能性は残されるものの,通常はフォルミンファミリーはらせん回転をしながらアクチン線維を伸長すると結論づけた.
4.プロフィリンやATPとADPおよび脱重合のらせん回転への影響
ATPやアクチン結合タンパク質プロフィリンの有無などさまざまな条件でもらせん回転の性質は変化しないことも確認した.プロフィリンとそれが結合するポリプロリン配列からなるフォルミンのFH1ドメインは,FH2ドメインによるATPアクチンのプロセッシブな重合を著明に加速する6).また,あとで述べるように,ADPアクチンを用いるとプロフィリンがmDia1によるプロセッシブな重合を阻止するという報告もあった7).そこで,プロフィリンの有無,ATPアクチンとADPアクチンとの違い,ATPの加水分解後にアクチン線維から放出される無機リン酸の影響を順次検討したところ,どの条件でもmDia1のらせん回転が観察された.また,今回はじめて,フォルミンファミリーに結合したアクチン線維の反矢じり端がプロセッシブに脱重合するのを可視化することに成功したが,その際にもらせん回転が観察された.いずれの場合においても,蛍光偏光の向きの変動は34.6~36.8 nmの周期で観察された.以上の結果から,フォルミンファミリーのらせん回転はアクチン線維の構造に依存する根本的な性質だと考えられた.
5.ATPはフォルミンファミリーとプロフィリンによるアクチン線維の伸長の加速に必須である
また,今回のアクチン線維の伸長速度の詳細な解析から,アクチンに結合したATPがmDia1によるアクチン伸長の加速に必須の因子であるという付随的な知見が得られた.アクチン線維は速い重合端である反矢じり端と遅い重合端である矢じり端をもち,定常状態ではこの反矢じり端が伸び矢じり端が縮むというトレッドミリングを起こす.トレッドミリングの実現にはアクチン単量体に結合したATPが重合ののちADPに加水分解される際に生じるエネルギーが役立つが,現在のところ,ATPの加水分解がアクチン線維のどの部分で起こりどのような効果を及ぼしているのかは未解決である.
これまでに,mDia1によるプロセッシブなアクチン重合において,ある論文は,ADPアクチンとプロフィリンとの組合せではアクチン線維の伸長が停止することを報告し,ATP加水分解はmDia1の結合する反矢じり端で起こると提唱した7).それとは対照的に,別の論文では,ADPアクチンを用いてもプロフィリンは伸長速度をゆるやか(約2倍)に加速すると報告した6).筆者らは,この両者とも異なる見解を得た.まず,さきに述べたように,mDia1の結合した反矢じり端がプロセッシブに脱重合するのを可視化したが,プロフィリンが数倍脱重合を加速することを見い出した.この脱重合はアクチン線維に無機リン酸が結合することで阻害された.一方,mDia1によるADPアクチンの伸長ではプロフィリン添加ののちも伸長は維持されるもののその速度が低下したが,無機リン酸がアクチン線維に結合するとこのプロフィリンによる阻害作用が消失した.これらのことより,プロフィリンはADPアクチンの伸長を直接阻害するのではなく,mDia1が結合した反矢じり端からのアクチンの解離を促進しているものと判断できる.以上のように,ATP加水分解がなくてもmDia1を介するプロセッシブなアクチンの伸長は進行するものの,アクチン線維の伸長の加速にはATPが必須であると結論づけた.この知見はATP加水分解の謎を解くものではないが,ATPのはたす役割の重要性を再認識させるものである.
おわりに
細胞構造にフォルミンファミリーが接したままアクチン線維を重合させると,フォルミンファミリーが回転する分,アクチン線維にねじれが生じることが今回の結果より予想される.このことから,細胞骨格線維の力学的な制御の新しい機構がいくつかみえてきた(図3).ひとつは,フォルミンファミリーが伸長するアクチン線維をアンカーする際に細胞構造にフレキシブルに結合する必要があることである.もうひとつは,フォルミンファミリーを介したアクチン伸長が,線維に蓄積したねじれによって制御される可能性である.あるいは逆に,フォルミンファミリーはらせん回転の性質を利用してアクチン線維のねじれを変化させることで,アクチンネットワークの安定性を制御している可能性も考えられる.たとえば,アクチン脱重合タンパク質であるコフィリンが結合したアクチン線維は,ねじれが強くなることが知られている8).らせん回転がアクチン脱重合機構と力学的に相互作用している可能性が考えられる.この研究の成果はアクチン重合の機構を明らかにするだけでなく,フォルミンファミリーに制御される細胞内アクチン線維ネットワークの形成,および,その維持および崩壊の力学的な制御機構の詳細を解明するうえで,重要な知見を提供することが期待される.
文 献
- Watanabe, N.: Inside view of cell locomotion through single-molecule: fast F-/G-actin cycle and G-actin regulation of polymer restoration. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci., 86, 62-83 (2010)[PubMed]
- Higashida, C., Miyoshi, T., Fujita, A. et al.: Actin polymerization-driven molecular movement of mDia1 in living cells. Science, 303, 2007-2010 (2004)[PubMed]
- Kovar, D. R. & Pollard, T. D.: Insertional assembly of actin filament barbed ends in association with formins produces piconewton forces. Proc. Natl. Acad. Sci. USA, 101, 14725-14730 (2004)[PubMed]
- Higashida, C., Suetsugu, S., Tsuji, T. et al.: G-actin regulates rapid induction of actin nucleation by mDia1 to restore cellular actin polymers. J. Cell Sci., 121, 3403-3412 (2008)[PubMed]
- Sase, I., Miyata, H., Ishiwata, S. et al.: Axial rotation of sliding actin filaments revealed by single-fluorophore imaging. Proc. Natl. Acad. Sci. USA, 94, 5646-5650 (1997)[PubMed]
- Kovar, D. R., Harris, E. S., Mahaffy, R. et al.: Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell, 124, 423-435 (2006)[PubMed]
- Romero, S., Didry, D., Larquet, E. et al.: How ATP hydrolysis controls filament assembly from profilin-actin: implication for formin processivity. J. Biol. Chem., 282, 8435-8445 (2007)[PubMed]
- McGough, A., Pope, B., Chiu, W. et al.: Cofilin changes the twist of F-actin: implications for actin filament dynamics and cellular function. J. Cell Biol., 138, 771-781 (1997)[PubMed]
著者プロフィール
略歴:1990年 京都大学医学部 卒業,1998年 京都大学大学院医学研究科 助手,1999年 米国Harvard Medical School研究員,2002年 京都大学大学院医学研究科 助教授を経て,2010年より東北大学大学院生命科学研究科 教授.
研究テーマ:細胞内蛍光分子可視化による細胞骨格制御と細胞シグナルの解明,分子標的薬の作用可視化など.
水野 裕昭(Hiroaki Mizuno)
略歴:2007年 長岡技術科学大学大学院工学研究科博士課程 修了,同年 米国Massachusetts大学Medical School研究員,2008年 京都大学大学院医学研究科 研究員を経て,2010年より東北大学大学院生命科学研究科 研究員.
研究テーマ:分子可視化による細胞骨格調節タンパク質の制御機構の解明.
関心事:フォルミンファミリーのらせん回転があたえるアクチン線維へのねじれ負荷が,細胞内アクチン線維ネットワークの構築および崩壊にどのように関係するか.
© 2011 渡邊直樹・水野裕昭 Licensed under CC 表示 2.1 日本