細胞の膨張を感知する陰イオンチャネルLRRC8Aのクライオ電子顕微鏡による構造解析
糟谷 豪・石谷隆一郎・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:糟谷 豪,石谷隆一郎,濡木 理
DOI: 10.7875/first.author.2018.090
Cryo-EM structures of the human volume-regulated anion channel LRRC8.
Go Kasuya, Takanori Nakane, Takeshi Yokoyama, Yanyan Jia, Masato Inoue, Kengo Watanabe, Ryoki Nakamura, Tomohiro Nishizawa, Tsukasa Kusakizako, Akihisa Tsutsumi, Haruaki Yanagisawa, Naoshi Dohmae, Motoyuki Hattori, Hidenori Ichijo, Zhiqiang Yan, Masahide Kikkawa, Mikako Shirouzu, Ryuichiro Ishitani, Osamu Nureki
Nature Structural & Molecular Biology, 25, 797-804 (2018)
細胞外の浸透圧の変化に応じ細胞の容積をつねに一定の値に維持することは,動物細胞が正常に機能するために重要である.LRRC8ファミリーは細胞の膨張を感知して活性化する陰イオンチャネルであり,塩化物イオンなど浸透圧を調節する物質を細胞の外へと排出することにより細胞の容積の維持に貢献する.この研究において,筆者らは,クライオ電子顕微鏡による解析によりヒトに由来するLRRC8Aの構造を決定した.LRRC8Aは六量体を形成し,膜貫通領域はギャップ結合チャネルと同様のトポロジーをもつ一方,LRR領域は長い弧を形成していた.イオンの透過孔は六量体の中心軸に存在し,細胞の外側にて狭窄していた.狭窄した部位には保存された極性アミノ酸残基が確認され,これらの残基が基質の選択性に寄与することが示唆された.構造解析の過程において,LRR領域が“閉じた構造”と“緩んだ構造”の2つが確認され,これらの構造の比較から,LRR領域が剛体として動くことによりイオンの透過孔を開閉する可能性が示唆された.
すべての生物は細胞外の浸透圧の変化に応じて細胞の容積を制御することにより,その容積をつねに一定の値に維持するしくみを備える1).細胞の容積の変化は細胞の増殖や遊走などさまざまな生理機能と関連する.また,等張下における細胞の容積の減少はアポトーシス性容積減少とよばれる細胞死をひき起こす2).細胞の容積の制御には細胞膜に存在するイオンチャネルやトランスポーター,細胞質に存在するキナーゼなど,さまざまなタンパク質が関与する.このうち,細胞容積感受性陰イオンチャネルは細胞の膨張を感知して活性化する陰イオンチャネルで,塩化物イオンなど浸透圧を調節する物質の細胞の外への排出,および,それにともなう細胞からの水分子の放出および細胞の容積の減少をひき起こす.膨張した細胞において細胞容積感受性陰イオンチャネルの活性化がもたらすこの一連の反応は制御性容積減少とよばれ,多くの真核生物において観察される.
これまでの研究から,細胞容積感受性陰イオンチャネルの特徴として,細胞の膨張にともない活性化されること,外向きの整流性をもつこと,陰イオンのほかの浸透圧を調節する物質も輸送の基質としうること,などが明らかにされていた.その一方で,その分子実体はながらく不明であり,いくつもの膜タンパク質が候補としてあげられては否定されるといった状況が数十年にわたりつづいていた.このような状況において,細胞容積感受性陰イオンチャネルを構成する必須の膜タンパク質として2014年に同定されたのがLRRC8Aである3,4).LRRC8Aは自然免疫の不全とのかかわりから注目された膜タンパク質で5),ほかの4つのアイソフォームとともにLRRC8(leucine-rich repeat-containing 8)ファミリーを構成する.すべてのLRRC8ファミリーは800~850アミノ酸残基からなり,その配列は高度に保存されている.アミノ酸配列にもとづく構造の予測や系統樹の解析から,LRRC8ファミリーのN末端側の半分は4本の膜貫通ヘリックスをもち,そのトポロジーはコネクシンやイネキシンなどのギャップ結合チャネルと類似の構造をもつこと,C末端側の半分は最大で17個のロイシンリッチリピート(leucine-rich repeat:LRR)をもつことが示唆されていた.また,電気生理学的な手法にもとづく解析から,LRRC8ファミリーは細胞においてはLRRC8Aを必須の構成タンパク質とするヘテロ多量体を形成することで機能するものの,精製したヒトに由来するLRRC8Aのホモ多量体は浸透圧の変化に応じたチャネルの活性化能をもつことが明らかにされていた6).
LRRC8ファミリーの全長のアミノ酸配列はこれまでに知られているほかのクラスのイオンチャネルとの相同性が非常に低い.そのため,LRRC8ファミリーにおける基質の透過の機構やチャネルの開閉の機構といった,細胞容積感受性陰イオンチャネルとして機能しうるしくみの理解にむけ立体構造の解明が待たれてきた.そこで,筆者らは,LRRC8ファミリーの立体構造をクライオ電子顕微鏡を用いて解明することをめざした.
立体構造の解析のため,さまざまな真核生物に由来するLRRC8ファミリーの発現スクリーニングを実施した結果,これまで機能の解析がもっとも進められてきたヒトに由来するLRRC8Aが高い発現量および安定性を示すことが見い出された.また,精製したヒトに由来するLRRC8Aをリポソームに埋め込み,内外の溶液に浸透圧の差をつけ電気生理学的な手法により解析したところ,LRRC8Aに由来する電流が観測された.精製したヒトに由来するLRRC8Aを非晶質の氷に埋め込んで試料とし,クライオ電子顕微鏡にて5000枚以上の画像を取得するとともに(EMPIAR ID:10196),単粒子解析法により最終的に4.25Å分解能のマップを取得した.過去に解かれた線虫に由来するイネキシン6の構造7) やヒトに由来するコネクシン26の構造8) を参照してマップにあてはめ精密化し,ヒトに由来するLRRC8Aの構造を決定した(図1,PDB ID:5ZSU).
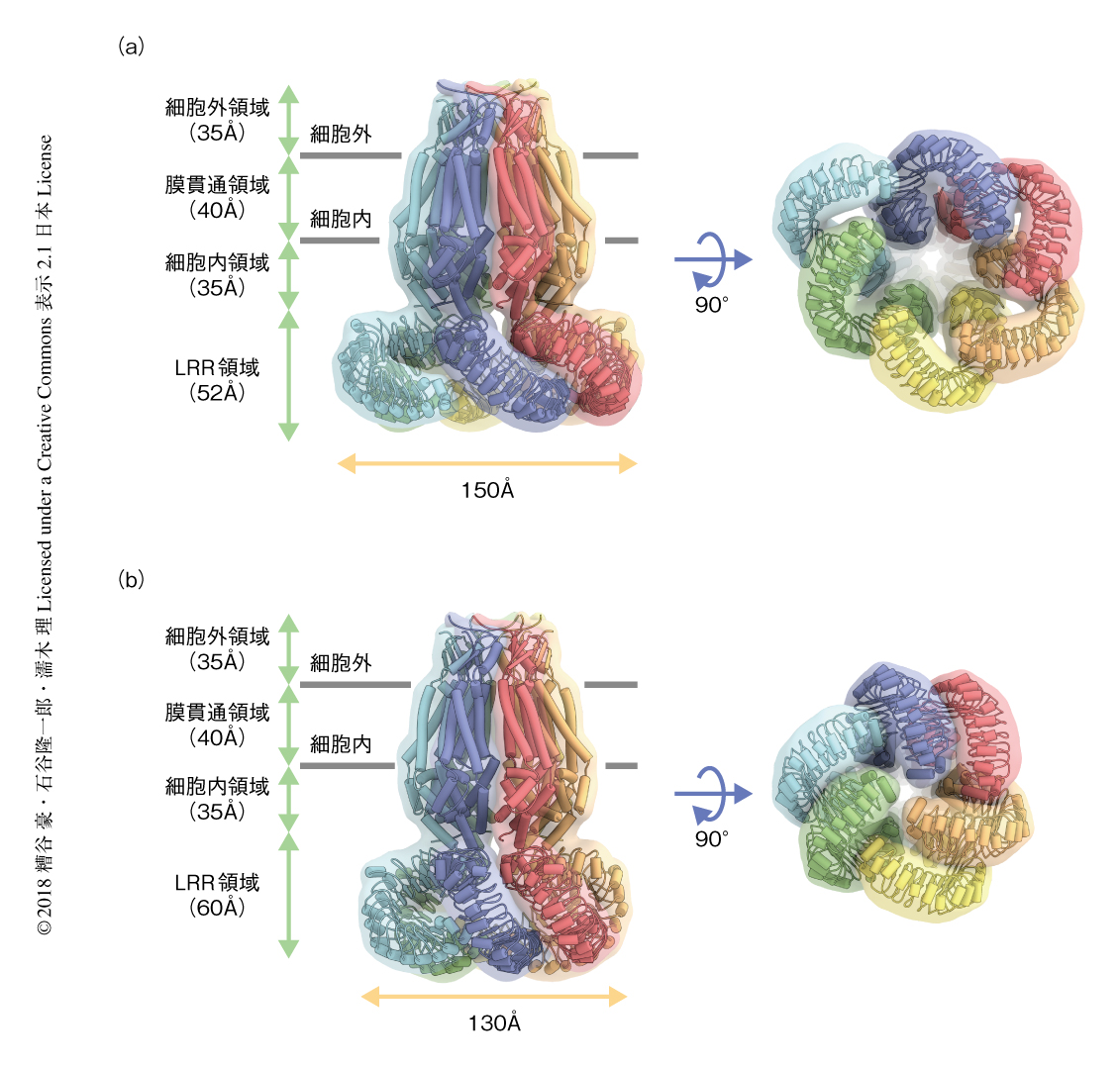
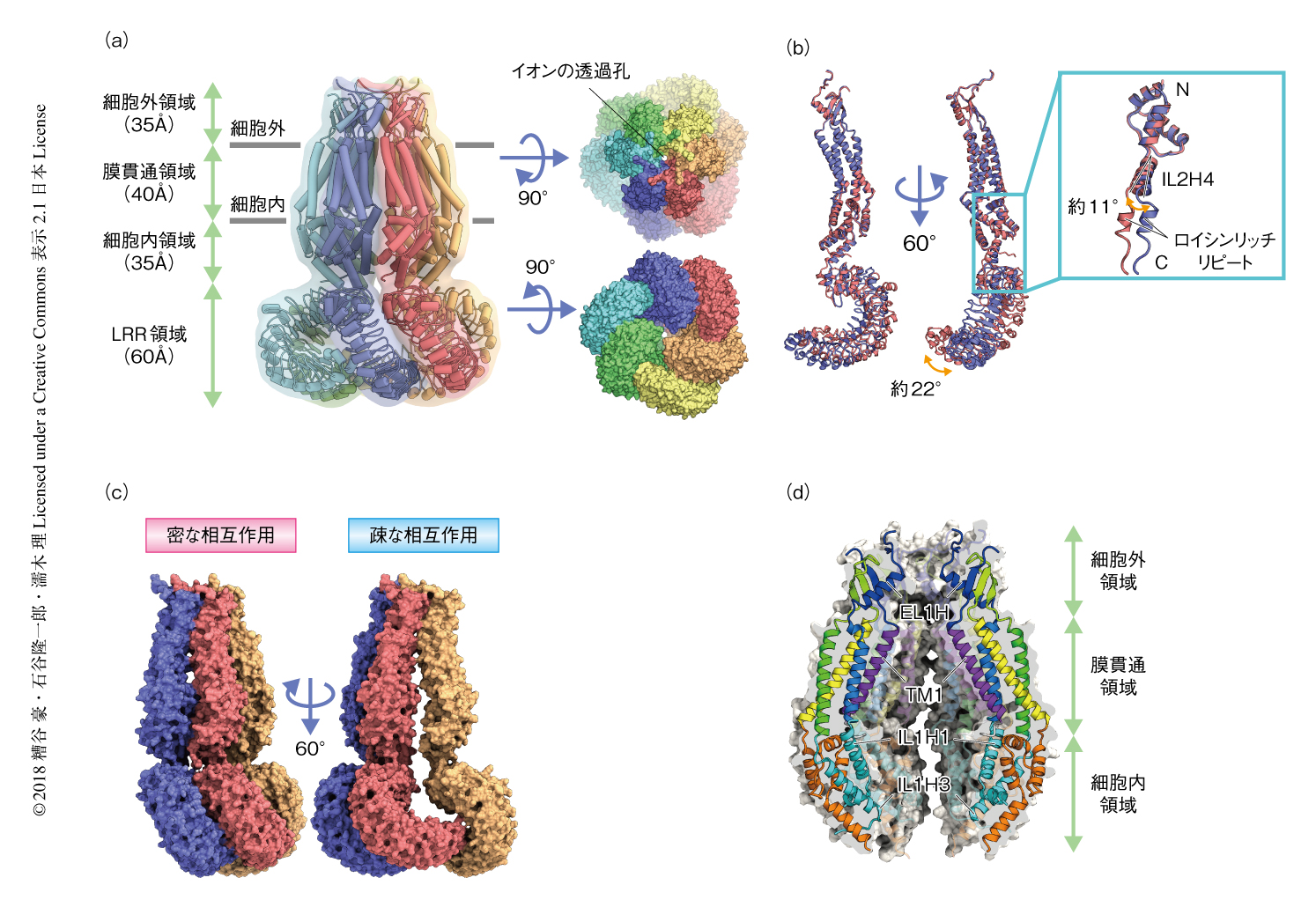
ヒトに由来するLRRC8Aはホモ六量体を形成し,細胞外領域,膜貫通領域,細胞内領域,LRR領域の4つの領域から構成されていた(図1a).細胞外領域は細胞膜から35Åほどつき出ており,膜貫通領域や細胞内領域とともにイオンの透過孔を形成していた.LRR領域は細胞の内部につき出ており,細胞の内部からみると時計回りに弧を形成していた.おのおののサブユニットにおいて,N末端およびC末端は細胞の内部に位置し,膜貫通領域には4本の膜貫通ヘリックスがあった.また,LRR領域には15個のロイシンリッチリピートが確認された.細胞外領域や膜貫通領域に相当する部分の密度と比較してLRR領域や細胞内領域の一部の密度は低く,これらの領域がフレキシブルであることが示唆された.
ヒトに由来するLRRC8Aはホモ六量体を形成していたものの,完全な6回対称軸はもたず3回対称軸をもつ“二量体の三量体”を形成していた.すなわち,6つのサブユニットα~ζにおいて,α,γ,ε,ならびに,β,δ,ζがそれぞれ同一のトポロジーを示していた.他方で,となりあった2つのサブユニットを比較すると,おのおのの領域に大きな構造の変化はみられないものの,細胞内領域に位置し細胞内領域とLRR領域をつなぐIL2H4ヘリックスの回転にともないLRR領域が22度ほどかたむいていた(図1b).また,このLRR領域のかたむきにともない,となりあう3つのサブユニットのあいだの接触の面積に違いが生じていた.たとえば,αサブユニットはとなりあうβサブユニットとは密に相互作用する一方で,反対側でとなりあうεサブユニットとは疎に相互作用していた.密な相互作用においては細胞外領域からLRR領域にかけて広範な接触がみられた一方で,疎な相互作用においては細胞外領域とLRR領域のC末端側でのみ接触がみられた(図1c).過去の知見において,LRRC8AのC末端が60アミノ酸残基ほど短くなることにより,チャネルの活性が抑制されるとともに自然免疫の不全をひき起こすヘテロ接合変異が知られている5).このヘテロ接合変異においては,とくに疎な相互作用におけるLRR領域どうしの接触が失われることにより,活性をもつ適切な六量体が形成されない可能性が考えられた.以上のサブユニットの比較から,細胞内領域とLRR領域とをつなぐヘリックスの回転にともないサブユニットのあいだに構造の変化がひき起こされるとともに,二量体の三量体からなる六量体の形成に寄与することが示唆された.
LRRC8Aにおいてイオンの透過孔は細胞膜に垂直に六量体の中心軸にそって存在した(図1d).イオンの透過孔はおもに,細胞外領域に位置するEL1Hヘリックス,膜貫通領域に位置するTM1ヘリックス,細胞内領域に位置するIL1H1ヘリックスおよびILH3ヘリックスから構成されていた.イオンの透過孔の直径は細胞内領域において約25Åであり,膜貫通領域の下部にかけて約50Åまで広がり,そのさき細胞外領域の先端にかけて10Å以下まで狭まっていた.イオンの透過孔にそって位置するアミノ酸残基はおもに親水性であり,うち,塩基性アミノ酸残基も多く確認されたことから,イオンの透過孔が陰イオンの透過に適した環境を形成することが示唆された.イオンの透過孔のうちもっとも狭窄した部位は細胞外領域の末端に存在し,おもにArg103により構成されていた.また,Arg103のうえにはAsp102がArg103のふたのようなかたちで存在した.以上のことから,イオンの透過の際にはAsp102やArg103が重要な役割をはたす可能性が示唆された.
ヒトに由来するLRRC8Aのマップの取得の過程において,最終的に4.25Å分解能に達したクラス1およびクラス2にくわえ,LRR領域が明瞭にみえるクラス7が得られた.クラス1あるいはクラス2と比較して,クラス7はLRR領域の密度がゆがんでおり,両者は異なる構造の状態を表わす可能性が示唆された.そこで,クラス7についても解析を進め9.17Å分解能のマップを得るとともに,クラス1およびクラス2の構造をあてはめることにより精密化した(図2).クラス7に由来するLRRC8Aの構造においてはLRR領域の相互作用が緩くなっており,クラス7に由来する構造を“緩んだ構造”,クラス1およびクラス2に由来する構造を“閉じた構造”とそれぞれ名づけた.閉じた構造と比較して緩んだ構造のLRR領域は大きくかたむいており,六量体の中心軸からはなれるように構造が変化するとともに,対称性を失っていた.その一方で,LRR領域のほかに大きな違いはみられなかった.また,LRR領域それ自体には曲率を含め大きな構造の変化はみられず,緩んだ構造と閉じた構造との違いはLRR領域が剛体として動くことに起因することが明らかにされた.このことから,LRRC8Aにおけるチャネルの活性化においてもLRR領域の剛体としての動きが重要であることが示唆された.
この研究において,筆者らは,細胞の膨張を感知して活性化する陰イオンチャネルであるLRRC8Aの立体構造をクライオ電子顕微鏡による解析により決定した.高分解能に達したクラスに由来する構造からは,LRRC8Aの全体構造やイオンの透過孔が明らかにされるとともに,基質の選択性についての示唆が得られた.一方で,低分解能のクラスに由来する構造においては,LRR領域が剛体として動くことが明らかにされるとともに,このような動きがチャネルの活性化の際にも重要である可能性が示唆された.
この論文の投稿ののち,スイスの研究グループからマウスに由来するLRRC8Aのホモ六量体の構造(PDB ID:6G9O)がNature誌に発表されるとともに9),米国の研究グループからヒトに由来するLRRC8Aのホモ六量体の構造(PDB ID:6DJB)がプレプリントサーバーbioRxivに投稿された(のちに,eLife誌に発表10)).この論文の改訂のときに構造情報の利用の可能なものがマウスに由来するLRRC8Aホモ六量体の構造だけであったこともあり,ここでは,筆者らによるヒトに由来するLRRC8Aの構造と,マウスに由来するLRRC8Aの構造との比較についてのみ述べる.なお,ヒトに由来するLRRC8Aとマウスに由来するLRRC8Aのアミノ酸配列の相同性は99%である.ヒトおよびマウスのLRRC8Aの構造の多くは類似していた.しかしながら,大きな違いとして,膜貫通領域において,ヒトに由来するLRRC8Aの構造は疎な相互作用と密な相互作用に起因する3回対称軸をもつ一方で,マウスに由来するLRRC8Aの構造は6回対称軸をもっていた.この結果として,ヒトの構造と比較してマウスの構造においては膜貫通領域が密に相互作用していた.この違いについて現時点で確かなことはいえないが,過去の電気生理学的な手法による解析によりLRRC8ファミリーはイオン強度の違いを感知して活性化する可能性が示唆されており6),精製の際の塩濃度の違いなどが影響した可能性があるのではと考えている.このことも含め,今後もLRRC8の機能の詳細な理解をめざしていきたい.
実験ノートをみかえしたところ,この研究を開始したのは2017年2月であった.それから約8カ月のちには,LRRC8Aの構造情報が得られていた.これまでX線結晶構造解析が専門であった筆者にとり,このスピード感は衝撃的であるとともに,研究グループのあいだの競争の激化も含め,現在,構造生物学に大きな影響をあたえるクライオ電子顕微鏡の威力の陰と陽を実感した.
略歴:東京大学大学院理学系研究科博士課程 修了.
研究テーマ:刺激の受容にかかわる膜輸送体の作動機構.
関心事:10年後さらに20年後の生物学.サイエンスコミュニケーション.減量法.
石谷 隆一郎(Ryuichiro Ishitani)
東京大学大学院理学系研究科 准教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2018 糟谷 豪・石谷隆一郎・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:糟谷 豪,石谷隆一郎,濡木 理
DOI: 10.7875/first.author.2018.090
Cryo-EM structures of the human volume-regulated anion channel LRRC8.
Go Kasuya, Takanori Nakane, Takeshi Yokoyama, Yanyan Jia, Masato Inoue, Kengo Watanabe, Ryoki Nakamura, Tomohiro Nishizawa, Tsukasa Kusakizako, Akihisa Tsutsumi, Haruaki Yanagisawa, Naoshi Dohmae, Motoyuki Hattori, Hidenori Ichijo, Zhiqiang Yan, Masahide Kikkawa, Mikako Shirouzu, Ryuichiro Ishitani, Osamu Nureki
Nature Structural & Molecular Biology, 25, 797-804 (2018)
要 約
細胞外の浸透圧の変化に応じ細胞の容積をつねに一定の値に維持することは,動物細胞が正常に機能するために重要である.LRRC8ファミリーは細胞の膨張を感知して活性化する陰イオンチャネルであり,塩化物イオンなど浸透圧を調節する物質を細胞の外へと排出することにより細胞の容積の維持に貢献する.この研究において,筆者らは,クライオ電子顕微鏡による解析によりヒトに由来するLRRC8Aの構造を決定した.LRRC8Aは六量体を形成し,膜貫通領域はギャップ結合チャネルと同様のトポロジーをもつ一方,LRR領域は長い弧を形成していた.イオンの透過孔は六量体の中心軸に存在し,細胞の外側にて狭窄していた.狭窄した部位には保存された極性アミノ酸残基が確認され,これらの残基が基質の選択性に寄与することが示唆された.構造解析の過程において,LRR領域が“閉じた構造”と“緩んだ構造”の2つが確認され,これらの構造の比較から,LRR領域が剛体として動くことによりイオンの透過孔を開閉する可能性が示唆された.
はじめに
すべての生物は細胞外の浸透圧の変化に応じて細胞の容積を制御することにより,その容積をつねに一定の値に維持するしくみを備える1).細胞の容積の変化は細胞の増殖や遊走などさまざまな生理機能と関連する.また,等張下における細胞の容積の減少はアポトーシス性容積減少とよばれる細胞死をひき起こす2).細胞の容積の制御には細胞膜に存在するイオンチャネルやトランスポーター,細胞質に存在するキナーゼなど,さまざまなタンパク質が関与する.このうち,細胞容積感受性陰イオンチャネルは細胞の膨張を感知して活性化する陰イオンチャネルで,塩化物イオンなど浸透圧を調節する物質の細胞の外への排出,および,それにともなう細胞からの水分子の放出および細胞の容積の減少をひき起こす.膨張した細胞において細胞容積感受性陰イオンチャネルの活性化がもたらすこの一連の反応は制御性容積減少とよばれ,多くの真核生物において観察される.
これまでの研究から,細胞容積感受性陰イオンチャネルの特徴として,細胞の膨張にともない活性化されること,外向きの整流性をもつこと,陰イオンのほかの浸透圧を調節する物質も輸送の基質としうること,などが明らかにされていた.その一方で,その分子実体はながらく不明であり,いくつもの膜タンパク質が候補としてあげられては否定されるといった状況が数十年にわたりつづいていた.このような状況において,細胞容積感受性陰イオンチャネルを構成する必須の膜タンパク質として2014年に同定されたのがLRRC8Aである3,4).LRRC8Aは自然免疫の不全とのかかわりから注目された膜タンパク質で5),ほかの4つのアイソフォームとともにLRRC8(leucine-rich repeat-containing 8)ファミリーを構成する.すべてのLRRC8ファミリーは800~850アミノ酸残基からなり,その配列は高度に保存されている.アミノ酸配列にもとづく構造の予測や系統樹の解析から,LRRC8ファミリーのN末端側の半分は4本の膜貫通ヘリックスをもち,そのトポロジーはコネクシンやイネキシンなどのギャップ結合チャネルと類似の構造をもつこと,C末端側の半分は最大で17個のロイシンリッチリピート(leucine-rich repeat:LRR)をもつことが示唆されていた.また,電気生理学的な手法にもとづく解析から,LRRC8ファミリーは細胞においてはLRRC8Aを必須の構成タンパク質とするヘテロ多量体を形成することで機能するものの,精製したヒトに由来するLRRC8Aのホモ多量体は浸透圧の変化に応じたチャネルの活性化能をもつことが明らかにされていた6).
LRRC8ファミリーの全長のアミノ酸配列はこれまでに知られているほかのクラスのイオンチャネルとの相同性が非常に低い.そのため,LRRC8ファミリーにおける基質の透過の機構やチャネルの開閉の機構といった,細胞容積感受性陰イオンチャネルとして機能しうるしくみの理解にむけ立体構造の解明が待たれてきた.そこで,筆者らは,LRRC8ファミリーの立体構造をクライオ電子顕微鏡を用いて解明することをめざした.
1.ヒトに由来するLRRC8Aの全体構造
立体構造の解析のため,さまざまな真核生物に由来するLRRC8ファミリーの発現スクリーニングを実施した結果,これまで機能の解析がもっとも進められてきたヒトに由来するLRRC8Aが高い発現量および安定性を示すことが見い出された.また,精製したヒトに由来するLRRC8Aをリポソームに埋め込み,内外の溶液に浸透圧の差をつけ電気生理学的な手法により解析したところ,LRRC8Aに由来する電流が観測された.精製したヒトに由来するLRRC8Aを非晶質の氷に埋め込んで試料とし,クライオ電子顕微鏡にて5000枚以上の画像を取得するとともに(EMPIAR ID:10196),単粒子解析法により最終的に4.25Å分解能のマップを取得した.過去に解かれた線虫に由来するイネキシン6の構造7) やヒトに由来するコネクシン26の構造8) を参照してマップにあてはめ精密化し,ヒトに由来するLRRC8Aの構造を決定した(図1,PDB ID:5ZSU).
ヒトに由来するLRRC8Aはホモ六量体を形成し,細胞外領域,膜貫通領域,細胞内領域,LRR領域の4つの領域から構成されていた(図1a).細胞外領域は細胞膜から35Åほどつき出ており,膜貫通領域や細胞内領域とともにイオンの透過孔を形成していた.LRR領域は細胞の内部につき出ており,細胞の内部からみると時計回りに弧を形成していた.おのおののサブユニットにおいて,N末端およびC末端は細胞の内部に位置し,膜貫通領域には4本の膜貫通ヘリックスがあった.また,LRR領域には15個のロイシンリッチリピートが確認された.細胞外領域や膜貫通領域に相当する部分の密度と比較してLRR領域や細胞内領域の一部の密度は低く,これらの領域がフレキシブルであることが示唆された.
2.サブユニットのあいだの相互作用
ヒトに由来するLRRC8Aはホモ六量体を形成していたものの,完全な6回対称軸はもたず3回対称軸をもつ“二量体の三量体”を形成していた.すなわち,6つのサブユニットα~ζにおいて,α,γ,ε,ならびに,β,δ,ζがそれぞれ同一のトポロジーを示していた.他方で,となりあった2つのサブユニットを比較すると,おのおのの領域に大きな構造の変化はみられないものの,細胞内領域に位置し細胞内領域とLRR領域をつなぐIL2H4ヘリックスの回転にともないLRR領域が22度ほどかたむいていた(図1b).また,このLRR領域のかたむきにともない,となりあう3つのサブユニットのあいだの接触の面積に違いが生じていた.たとえば,αサブユニットはとなりあうβサブユニットとは密に相互作用する一方で,反対側でとなりあうεサブユニットとは疎に相互作用していた.密な相互作用においては細胞外領域からLRR領域にかけて広範な接触がみられた一方で,疎な相互作用においては細胞外領域とLRR領域のC末端側でのみ接触がみられた(図1c).過去の知見において,LRRC8AのC末端が60アミノ酸残基ほど短くなることにより,チャネルの活性が抑制されるとともに自然免疫の不全をひき起こすヘテロ接合変異が知られている5).このヘテロ接合変異においては,とくに疎な相互作用におけるLRR領域どうしの接触が失われることにより,活性をもつ適切な六量体が形成されない可能性が考えられた.以上のサブユニットの比較から,細胞内領域とLRR領域とをつなぐヘリックスの回転にともないサブユニットのあいだに構造の変化がひき起こされるとともに,二量体の三量体からなる六量体の形成に寄与することが示唆された.
3.イオンの透過孔
LRRC8Aにおいてイオンの透過孔は細胞膜に垂直に六量体の中心軸にそって存在した(図1d).イオンの透過孔はおもに,細胞外領域に位置するEL1Hヘリックス,膜貫通領域に位置するTM1ヘリックス,細胞内領域に位置するIL1H1ヘリックスおよびILH3ヘリックスから構成されていた.イオンの透過孔の直径は細胞内領域において約25Åであり,膜貫通領域の下部にかけて約50Åまで広がり,そのさき細胞外領域の先端にかけて10Å以下まで狭まっていた.イオンの透過孔にそって位置するアミノ酸残基はおもに親水性であり,うち,塩基性アミノ酸残基も多く確認されたことから,イオンの透過孔が陰イオンの透過に適した環境を形成することが示唆された.イオンの透過孔のうちもっとも狭窄した部位は細胞外領域の末端に存在し,おもにArg103により構成されていた.また,Arg103のうえにはAsp102がArg103のふたのようなかたちで存在した.以上のことから,イオンの透過の際にはAsp102やArg103が重要な役割をはたす可能性が示唆された.
4.LRR領域の構造の変化
ヒトに由来するLRRC8Aのマップの取得の過程において,最終的に4.25Å分解能に達したクラス1およびクラス2にくわえ,LRR領域が明瞭にみえるクラス7が得られた.クラス1あるいはクラス2と比較して,クラス7はLRR領域の密度がゆがんでおり,両者は異なる構造の状態を表わす可能性が示唆された.そこで,クラス7についても解析を進め9.17Å分解能のマップを得るとともに,クラス1およびクラス2の構造をあてはめることにより精密化した(図2).クラス7に由来するLRRC8Aの構造においてはLRR領域の相互作用が緩くなっており,クラス7に由来する構造を“緩んだ構造”,クラス1およびクラス2に由来する構造を“閉じた構造”とそれぞれ名づけた.閉じた構造と比較して緩んだ構造のLRR領域は大きくかたむいており,六量体の中心軸からはなれるように構造が変化するとともに,対称性を失っていた.その一方で,LRR領域のほかに大きな違いはみられなかった.また,LRR領域それ自体には曲率を含め大きな構造の変化はみられず,緩んだ構造と閉じた構造との違いはLRR領域が剛体として動くことに起因することが明らかにされた.このことから,LRRC8Aにおけるチャネルの活性化においてもLRR領域の剛体としての動きが重要であることが示唆された.
おわりに
この研究において,筆者らは,細胞の膨張を感知して活性化する陰イオンチャネルであるLRRC8Aの立体構造をクライオ電子顕微鏡による解析により決定した.高分解能に達したクラスに由来する構造からは,LRRC8Aの全体構造やイオンの透過孔が明らかにされるとともに,基質の選択性についての示唆が得られた.一方で,低分解能のクラスに由来する構造においては,LRR領域が剛体として動くことが明らかにされるとともに,このような動きがチャネルの活性化の際にも重要である可能性が示唆された.
この論文の投稿ののち,スイスの研究グループからマウスに由来するLRRC8Aのホモ六量体の構造(PDB ID:6G9O)がNature誌に発表されるとともに9),米国の研究グループからヒトに由来するLRRC8Aのホモ六量体の構造(PDB ID:6DJB)がプレプリントサーバーbioRxivに投稿された(のちに,eLife誌に発表10)).この論文の改訂のときに構造情報の利用の可能なものがマウスに由来するLRRC8Aホモ六量体の構造だけであったこともあり,ここでは,筆者らによるヒトに由来するLRRC8Aの構造と,マウスに由来するLRRC8Aの構造との比較についてのみ述べる.なお,ヒトに由来するLRRC8Aとマウスに由来するLRRC8Aのアミノ酸配列の相同性は99%である.ヒトおよびマウスのLRRC8Aの構造の多くは類似していた.しかしながら,大きな違いとして,膜貫通領域において,ヒトに由来するLRRC8Aの構造は疎な相互作用と密な相互作用に起因する3回対称軸をもつ一方で,マウスに由来するLRRC8Aの構造は6回対称軸をもっていた.この結果として,ヒトの構造と比較してマウスの構造においては膜貫通領域が密に相互作用していた.この違いについて現時点で確かなことはいえないが,過去の電気生理学的な手法による解析によりLRRC8ファミリーはイオン強度の違いを感知して活性化する可能性が示唆されており6),精製の際の塩濃度の違いなどが影響した可能性があるのではと考えている.このことも含め,今後もLRRC8の機能の詳細な理解をめざしていきたい.
実験ノートをみかえしたところ,この研究を開始したのは2017年2月であった.それから約8カ月のちには,LRRC8Aの構造情報が得られていた.これまでX線結晶構造解析が専門であった筆者にとり,このスピード感は衝撃的であるとともに,研究グループのあいだの競争の激化も含め,現在,構造生物学に大きな影響をあたえるクライオ電子顕微鏡の威力の陰と陽を実感した.
文 献
- Hoffmann, E. K., Sorensen, B. H., Sauter, D. P. et al.: Role of volume-regulated and calcium-activated anion channels in cell volume homeostasis, cancer and drug resistance. Channels, 9, 380-396 (2015)[PubMed]
- Okada, Y., Maeno, E., Shimizu, T. et al.: Receptor-mediated control of regulatory volume decrease (RVD) and apoptotic volume decrease (AVD). J. Physiol., 532, 3-16 (2001)[PubMed]
- Qiu, Z., Dubin, A. E., Mathur, J. et al.: SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell, 157, 447-458 (2014)[PubMed]
- Voss, F. K., Ullrich, F., Munch, J. et al.: Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science, 344, 634-638 (2014)[PubMed]
- Sawada, A., Takihara, Y., Kim, J. Y. et al.: A congenital mutation of the novel gene LRRC8 causes agammaglobulinemia in humans. J. Clin. Invest., 112, 1707-1713 (2003)[PubMed]
- Syeda, R., Qiu, Z., Dubin, A. E. et al.: LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell, 164, 499-511 (2016)[PubMed]
- Oshima, A., Tani, K. & Fujiyoshi, Y.: Atomic structure of the innexin-6 gap junction channel determined by cryo-EM. Nat. Commun., 7, 13681 (2016)[PubMed]
- Maeda, S., Nakagawa, S., Suga, M. et al.: Structure of the connexin 26 gap junction channel at 3.5Å resolution. Nature, 458, 597-602 (2009)[PubMed]
- Deneka, D., Sawicka, M., Lam, A. K. M. et al.: Structure of a volume-regulated anion channel of the LRRC8 family. Nature, 558, 254-259 (2018)[PubMed]
- Kefauver, J. M., Saotome, K., Dubin, A. E. et al.: Structure of the human volume regulated anion channel. Elife, 7, e38461 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 修了.
研究テーマ:刺激の受容にかかわる膜輸送体の作動機構.
関心事:10年後さらに20年後の生物学.サイエンスコミュニケーション.減量法.
石谷 隆一郎(Ryuichiro Ishitani)
東京大学大学院理学系研究科 准教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2018 糟谷 豪・石谷隆一郎・濡木 理 Licensed under CC 表示 2.1 日本