自己免疫性膵炎の自己抗原はラミニン511である
塩川雅広・児玉裕三
(京都大学大学院医学研究科 消化器内科学)
email:塩川雅広,児玉裕三
DOI: 10.7875/first.author.2018.089
Laminin 511 is a target antigen in autoimmune pancreatitis.
Masahiro Shiokawa, Yuzo Kodama, Kiyotoshi Sekiguchi, Takeshi Kuwada, Teruko Tomono, Katsutoshi Kuriyama, Hajime Yamazaki, Toshihiro Morita, Saiko Marui, Yuko Sogabe, Nobuyuki Kakiuchi, Tomoaki Matsumori, Atsushi Mima, Yoshihiro Nishikawa, Tatsuki Ueda, Motoyuki Tsuda, Yuki Yamauchi, Yojiro Sakuma, Takahisa Maruno, Norimitsu Uza, Tatsuaki Tsuruyama, Tsuneyo Mimori, Hiroshi Seno, Tsutomu Chiba
Science Translational Medicine, 10, eaaq0997 (2018)
IgG4関連疾患の病因として,B細胞に特異的な治療薬であるリツキシマブへの反応性などから自己免疫の関与が考えられていたが,その病因となる自己抗原については不明であった.これまでに,筆者らは,IgG4関連疾患のひとつである自己免疫性膵炎において,患者の免疫グロブリンGをマウスに投与すると細胞外マトリックスに沈着し膵臓に障害をひき起こしたことから病原性の自己抗体の存在を明らかにしてきた.この研究においては,この自己抗体の標的となる自己抗原を同定するため,膵臓の細胞外マトリックスタンパク質を中心にELISA法を用いてスクリーニングを実施した.その結果,自己免疫性膵炎の患者において,ラミニン511がエラスターゼにより切断されて生じるラミニン511-E8に対する自己抗体の存在が明らかにされた.また,ラミニン511-E8をマウスに免疫することにより,自己免疫性膵炎の病理像と合致する膵臓の病変が確認された.さらに,抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像は異なった.以上の結果より,ラミニン511-E8が自己免疫性膵炎の病因をなす自己抗原であると考えられた.
自己免疫性膵炎はわが国から提唱されその概念が確立された疾患であり,血清における免疫グロブリンG4(IgG4)の高値,膵臓の組織への免疫グロブリンG4陽性細胞の浸潤,線維化を特徴とする1).さらに,自己免疫性膵炎は同様の機序により全身のさまざまな臓器を同時性あるいは異時性に障害することが明らかにされてきた.これらの病変は,以前は異なる疾患とれていたが,現在ではすべて一連の病態と考えられるようになり,2007年にわが国を中心に“IgG4関連疾患”として新たな疾患の概念が確立された2,3).そののち,2014年には原因の不明な難治性の疾患として国の指定難病に指定された.わが国からの報告ののち,全世界においてこのような患者が認識され,その疾患の概念は広がった.自己免疫性膵炎は膵臓がんと画像の所見がよく似ていることからしばしばその診断が困難であったり,膵臓に機能の障害を起こし糖尿病をひき起こしたりすることが問題となっている.
自己免疫性膵炎はB細胞に特異的な治療薬であるリツキシマブにより効果のあったことから4),自己免疫疾患であることが示唆されていたが,IgG4関連疾患および自己免疫性膵炎において自己抗体およびその標的となる自己抗原は不明であった.自己抗体の病原性を示す実験系として患者の免疫グロブリンGをマウスに投与し病態を解析するというモデルがあり5),免疫グロブリンGが病原性を示す重症筋無力症,天疱瘡,類天疱瘡などにおいてはこのモデルが確立されてきた.以前に,筆者らは,自己免疫性膵炎の患者の血清から抽出した免疫グロブリンGをマウスに投与し全身の臓器を解析した結果,患者において罹患のみられる臓器と同一の臓器,すなわち,膵臓のみに病変がひき起こされることを見い出し,自己免疫性膵炎の患者の血中に病原性をもつ自己抗体が存在することが明らかにした6).さらに,このマウスモデルにおいて患者の免疫グロブリンGがマウスの細胞外マトリックスと結合していること,また,患者の自己免疫性膵炎を起こした組織においても,患者の免疫グロブリンGが細胞外マトリックスに沈着していることが確認され,自己抗体が細胞外マトリックスタンパク質を標的とすることが強く示唆された.
ELISA法を用いて,細胞外マトリックスタンパク質を中心に自己免疫性膵炎の患者免疫グロブリンGが結合するタンパク質のスクリーニングを実施した.その結果,自己抗原の候補としてラミニン511-E8が同定された.ラミニン511-E8はエラスターゼにより切断されたラミニン511のC末端側の断片であるが,膵臓において同様のタンパク質の存在が確認された.また,患者の自己免疫性膵炎を起こした組織において免疫組織化学染色法により解析したところ,患者の免疫グロブリンGとラミニン511の局在は一致し,自己抗体がラミニン511を標的とすることが示唆された.
ヒトのラミニン511-E8の組換えタンパク質を用いたELISA法により,自己免疫性膵炎の患者の血清における自己抗体の有無について検討した.その結果,健常者において自己抗体は認められなかったのに対し,自己免疫性膵炎の患者の約半数においてラミニン511-E8に対する自己抗体が認められた.
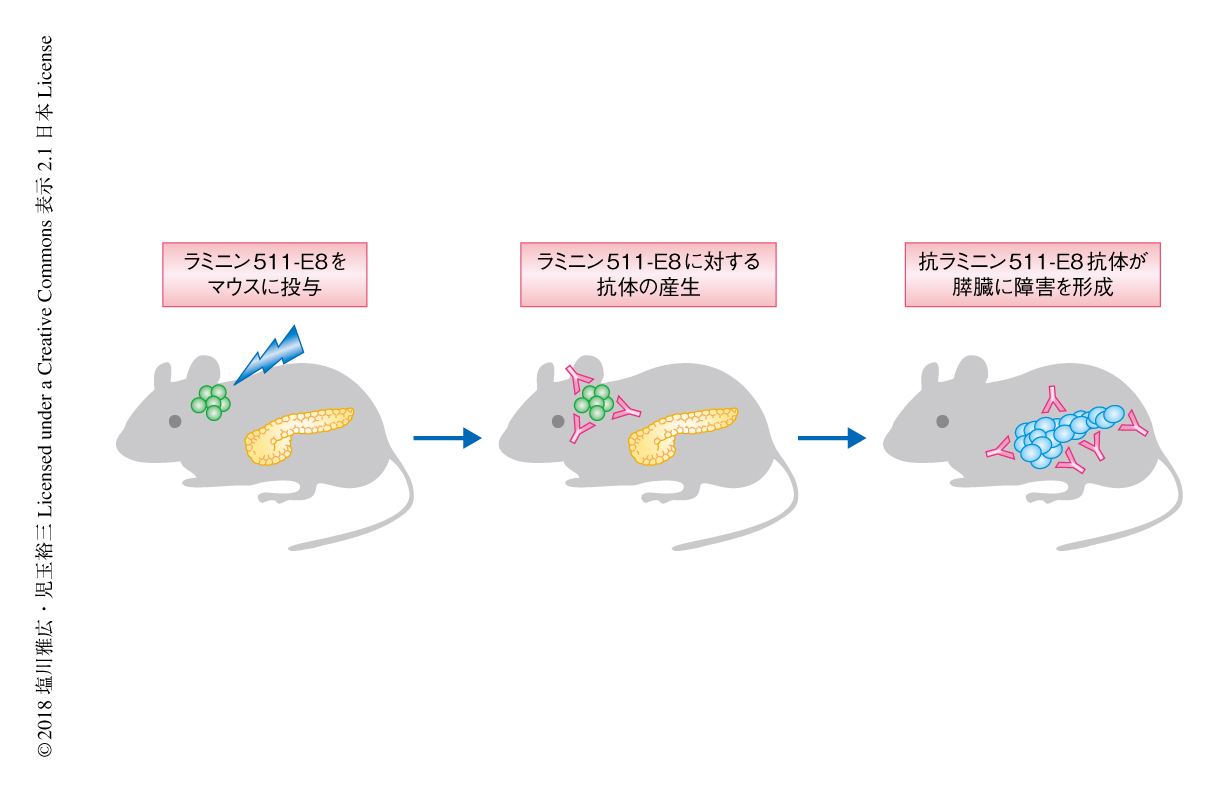
ラミニン511-E8はマウスとヒトとのあいだで90%の相同性をもつ.ラミニン511-E8が真の自己抗原であるかどうかを確かめるため,マウスに対しラミニン511-E8をアジュバントとともに免疫した.その結果,抗ラミニン511-E8抗体が産生され,膵臓においてのみ自己免疫性膵炎に合致する病理像がみられた.このことより,ラミニン511-E8は自己免疫性膵炎の病因となる自己抗原であることが強く示唆された(図1).
抗ラミニン511-E8抗体が病態に関連したものであれば臨床像とも関連すると考えられたことから,抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像を比較した.その結果,陽性例においては陰性例と比較し,膵臓の頭部の病変,アレルギーの合併,悪性腫瘍の合併が有意に少なかった.これは,陰性例においてはラミニン511-E8とは異なるタンパク質が自己抗原となっており,罹患の部位を含む病態が異なることを意味するのであろうと考えられた.
ラミニンは多数のサブファミリーをもつことが知られている.自己免疫性膵炎の症例のうち,IgG4関連疾患として腎臓に病変をもつ例のみにおいて,ラミニン511のサブファミリーであるラミニン521に対する自己抗体が検出された.このことから,ラミニンのどのサブファミリーに対し自己抗体をもつかにより,IgG4関連疾患の臓器への特異性や病型が異なる可能性が示唆された.天疱瘡における自己抗原はデスモグレインであるが,どのサブファミリーが自己抗原になるかにより罹患の部位が異なることが知られている.同様のことがIgG4関連疾患においても起こる可能性があり,現在,検討中である.
IgG4関連疾患および自己免疫性膵炎においては,その病態の形成の原因となる真の自己抗原が不明であった.この研究において,1)自己免疫性膵炎の患者において自己抗体となる抗ラミニン511-E8抗体が存在すること,2)患者の自己免疫性膵炎を起こした組織においてラミニン511とヒト免疫グロブリンGの局在が一致すること,3)ラミニン511をマウスに免疫すると自己免疫性膵炎様の病変を形成すること,4)抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像が異なること,が明らかにされ,ラミニン511-E8が自己免疫性膵炎の真の自己抗原である可能性は高いと考えられた.この研究における自己抗原の同定は自己免疫性膵炎の病態の解明に寄与するのみならず,自己抗原の測定法の開発により自己免疫性膵炎の診断,病型の分類,治療の方針の決定,治療の効果の判定,新たな治療方法の開発などに大きく貢献するものと期待される(図1).
略歴:2010年 京都大学大学院医学研究科博士課程 修了,2014年 京都大学医学部附属病院 医員を経て,2017年より神戸大学大学院科学技術イノベーション研究科 特別研究員.
研究テーマ:自己免疫疾患および胆膵疾患.
抱負:患者に役だつ発見あるいは研究をめざしたい.
児玉 裕三(Yuzo Kodama)
神戸大学大学院医学研究科 教授.
© 2018 塩川雅広・児玉裕三 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 消化器内科学)
email:塩川雅広,児玉裕三
DOI: 10.7875/first.author.2018.089
Laminin 511 is a target antigen in autoimmune pancreatitis.
Masahiro Shiokawa, Yuzo Kodama, Kiyotoshi Sekiguchi, Takeshi Kuwada, Teruko Tomono, Katsutoshi Kuriyama, Hajime Yamazaki, Toshihiro Morita, Saiko Marui, Yuko Sogabe, Nobuyuki Kakiuchi, Tomoaki Matsumori, Atsushi Mima, Yoshihiro Nishikawa, Tatsuki Ueda, Motoyuki Tsuda, Yuki Yamauchi, Yojiro Sakuma, Takahisa Maruno, Norimitsu Uza, Tatsuaki Tsuruyama, Tsuneyo Mimori, Hiroshi Seno, Tsutomu Chiba
Science Translational Medicine, 10, eaaq0997 (2018)
要 約
IgG4関連疾患の病因として,B細胞に特異的な治療薬であるリツキシマブへの反応性などから自己免疫の関与が考えられていたが,その病因となる自己抗原については不明であった.これまでに,筆者らは,IgG4関連疾患のひとつである自己免疫性膵炎において,患者の免疫グロブリンGをマウスに投与すると細胞外マトリックスに沈着し膵臓に障害をひき起こしたことから病原性の自己抗体の存在を明らかにしてきた.この研究においては,この自己抗体の標的となる自己抗原を同定するため,膵臓の細胞外マトリックスタンパク質を中心にELISA法を用いてスクリーニングを実施した.その結果,自己免疫性膵炎の患者において,ラミニン511がエラスターゼにより切断されて生じるラミニン511-E8に対する自己抗体の存在が明らかにされた.また,ラミニン511-E8をマウスに免疫することにより,自己免疫性膵炎の病理像と合致する膵臓の病変が確認された.さらに,抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像は異なった.以上の結果より,ラミニン511-E8が自己免疫性膵炎の病因をなす自己抗原であると考えられた.
はじめに
自己免疫性膵炎はわが国から提唱されその概念が確立された疾患であり,血清における免疫グロブリンG4(IgG4)の高値,膵臓の組織への免疫グロブリンG4陽性細胞の浸潤,線維化を特徴とする1).さらに,自己免疫性膵炎は同様の機序により全身のさまざまな臓器を同時性あるいは異時性に障害することが明らかにされてきた.これらの病変は,以前は異なる疾患とれていたが,現在ではすべて一連の病態と考えられるようになり,2007年にわが国を中心に“IgG4関連疾患”として新たな疾患の概念が確立された2,3).そののち,2014年には原因の不明な難治性の疾患として国の指定難病に指定された.わが国からの報告ののち,全世界においてこのような患者が認識され,その疾患の概念は広がった.自己免疫性膵炎は膵臓がんと画像の所見がよく似ていることからしばしばその診断が困難であったり,膵臓に機能の障害を起こし糖尿病をひき起こしたりすることが問題となっている.
自己免疫性膵炎はB細胞に特異的な治療薬であるリツキシマブにより効果のあったことから4),自己免疫疾患であることが示唆されていたが,IgG4関連疾患および自己免疫性膵炎において自己抗体およびその標的となる自己抗原は不明であった.自己抗体の病原性を示す実験系として患者の免疫グロブリンGをマウスに投与し病態を解析するというモデルがあり5),免疫グロブリンGが病原性を示す重症筋無力症,天疱瘡,類天疱瘡などにおいてはこのモデルが確立されてきた.以前に,筆者らは,自己免疫性膵炎の患者の血清から抽出した免疫グロブリンGをマウスに投与し全身の臓器を解析した結果,患者において罹患のみられる臓器と同一の臓器,すなわち,膵臓のみに病変がひき起こされることを見い出し,自己免疫性膵炎の患者の血中に病原性をもつ自己抗体が存在することが明らかにした6).さらに,このマウスモデルにおいて患者の免疫グロブリンGがマウスの細胞外マトリックスと結合していること,また,患者の自己免疫性膵炎を起こした組織においても,患者の免疫グロブリンGが細胞外マトリックスに沈着していることが確認され,自己抗体が細胞外マトリックスタンパク質を標的とすることが強く示唆された.
1.自己免疫性膵炎の患者の血清における自己抗体の検出
ELISA法を用いて,細胞外マトリックスタンパク質を中心に自己免疫性膵炎の患者免疫グロブリンGが結合するタンパク質のスクリーニングを実施した.その結果,自己抗原の候補としてラミニン511-E8が同定された.ラミニン511-E8はエラスターゼにより切断されたラミニン511のC末端側の断片であるが,膵臓において同様のタンパク質の存在が確認された.また,患者の自己免疫性膵炎を起こした組織において免疫組織化学染色法により解析したところ,患者の免疫グロブリンGとラミニン511の局在は一致し,自己抗体がラミニン511を標的とすることが示唆された.
ヒトのラミニン511-E8の組換えタンパク質を用いたELISA法により,自己免疫性膵炎の患者の血清における自己抗体の有無について検討した.その結果,健常者において自己抗体は認められなかったのに対し,自己免疫性膵炎の患者の約半数においてラミニン511-E8に対する自己抗体が認められた.
2.ラミニン511-E8のマウスへの免疫による自己免疫性膵炎の形成
ラミニン511-E8はマウスとヒトとのあいだで90%の相同性をもつ.ラミニン511-E8が真の自己抗原であるかどうかを確かめるため,マウスに対しラミニン511-E8をアジュバントとともに免疫した.その結果,抗ラミニン511-E8抗体が産生され,膵臓においてのみ自己免疫性膵炎に合致する病理像がみられた.このことより,ラミニン511-E8は自己免疫性膵炎の病因となる自己抗原であることが強く示唆された(図1).
3.抗ラミニン511-E8抗体の有無による臨床像の相違
抗ラミニン511-E8抗体が病態に関連したものであれば臨床像とも関連すると考えられたことから,抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像を比較した.その結果,陽性例においては陰性例と比較し,膵臓の頭部の病変,アレルギーの合併,悪性腫瘍の合併が有意に少なかった.これは,陰性例においてはラミニン511-E8とは異なるタンパク質が自己抗原となっており,罹患の部位を含む病態が異なることを意味するのであろうと考えられた.
4.膵臓のほかの病変における自己抗原の探索
ラミニンは多数のサブファミリーをもつことが知られている.自己免疫性膵炎の症例のうち,IgG4関連疾患として腎臓に病変をもつ例のみにおいて,ラミニン511のサブファミリーであるラミニン521に対する自己抗体が検出された.このことから,ラミニンのどのサブファミリーに対し自己抗体をもつかにより,IgG4関連疾患の臓器への特異性や病型が異なる可能性が示唆された.天疱瘡における自己抗原はデスモグレインであるが,どのサブファミリーが自己抗原になるかにより罹患の部位が異なることが知られている.同様のことがIgG4関連疾患においても起こる可能性があり,現在,検討中である.
おわりに
IgG4関連疾患および自己免疫性膵炎においては,その病態の形成の原因となる真の自己抗原が不明であった.この研究において,1)自己免疫性膵炎の患者において自己抗体となる抗ラミニン511-E8抗体が存在すること,2)患者の自己免疫性膵炎を起こした組織においてラミニン511とヒト免疫グロブリンGの局在が一致すること,3)ラミニン511をマウスに免疫すると自己免疫性膵炎様の病変を形成すること,4)抗ラミニン511-E8抗体の陽性例と陰性例とで臨床像が異なること,が明らかにされ,ラミニン511-E8が自己免疫性膵炎の真の自己抗原である可能性は高いと考えられた.この研究における自己抗原の同定は自己免疫性膵炎の病態の解明に寄与するのみならず,自己抗原の測定法の開発により自己免疫性膵炎の診断,病型の分類,治療の方針の決定,治療の効果の判定,新たな治療方法の開発などに大きく貢献するものと期待される(図1).
文 献
- Hamano, H., Kawa, S., Horiuchi, A. et al.: High serum IgG4 concentrations in patients with sclerosing pancreatitis. N. Engl. J. Med., 344, 732-738 (2001)[PubMed]
- Stone, H., Zen, Y. & Deshpande, V.: IgG4-related disease. N. Engl. J. Med., 366, 539-551 (2012)[PubMed]
- Umehara, H., Okazaki, K., Masaki, Y. et al.: Comprehensive diagnostic criteria for IgG4-related disease (IgG4-RD), 2011. Mod. Rheumatol., 22, 21-30 (2012)[PubMed]
- Hart, P. A., Topazian, M. D., Witzig, T. E. et al.: Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut, 62, 1607-1615 (2013)[PubMed]
- Anhalt, G. J., Labib, R. S., Voorhees, J. J. et al.: Induction of pemphigus in neonatal mice by passive transfer of IgG from patients with the disease. N. Engl. J. Med., 306, 1189-1196 (1982)[PubMed]
- Shiokawa, M., Kodama, Y., Kuriyama, K. et al.: Pathogenicity of IgG in patients with IgG4-related disease. Gut, 65, 1322-1332 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 京都大学大学院医学研究科博士課程 修了,2014年 京都大学医学部附属病院 医員を経て,2017年より神戸大学大学院科学技術イノベーション研究科 特別研究員.
研究テーマ:自己免疫疾患および胆膵疾患.
抱負:患者に役だつ発見あるいは研究をめざしたい.
児玉 裕三(Yuzo Kodama)
神戸大学大学院医学研究科 教授.
© 2018 塩川雅広・児玉裕三 Licensed under CC 表示 2.1 日本