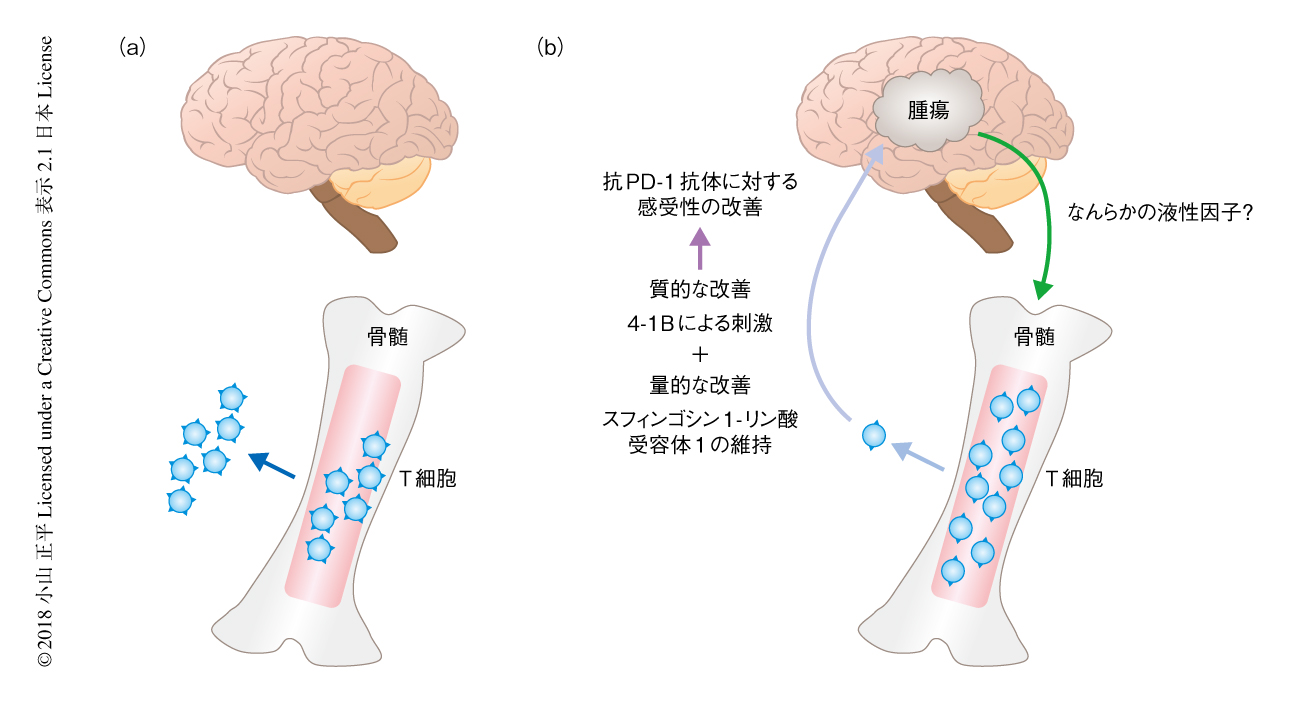
頭蓋内の腫瘍性の病変によりT細胞は骨髄に隔絶される
小山 正平
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:小山正平
DOI: 10.7875/first.author.2018.082
Sequestration of T cells in bone marrow in the setting of glioblastoma and other intracranial tumors.
Pakawat Chongsathidkiet, Christina Jackson, Shohei Koyama, Franziska Loebel, Xiuyu Cui, S. Harrison Farber, Karolina Woroniecka, Aladine A. Elsamadicy, Cosette A. Dechant, Hanna R. Kemeny, Luis Sanchez-Perez, Tooba A. Cheema, Nicholas C. Souders, James E. Herndon, Jean-Valery Coumans, Jeffrey I. Everitt, Brian V. Nahed, John H. Sampson, Michael D. Gunn, Robert L. Martuza, Glenn Dranoff, William T. Curry, Peter E. Fecci
Nature Medicine, 24, 1459-1468 (2018)
グリオブラストーマは脳腫瘍のなかでもっとも悪性度が高く,固形がんの全体のなかでももっとも予後不良のカテゴリーに属する腫瘍であり,新規の治療法の開発が望まれている.古くから,グリオブラストーマの患者においては末梢血のT細胞が著明に減少することが知られていたが,その理由は不明であった.また,近年,複数のがんに対し有効性が示されている抗PD-1抗体に代表される免疫チェックポイント阻害剤について,現時点ではグリオブラストーマに対し明らかな有効性が示されたという報告はない.筆者らは,グリオブラストーマのモデルマウスおよび患者の解析により,これら2つの臨床的な問題点の解決につながる新しい事象を見い出した.それは,グリオブラストーマをはじめとして脳に占拠する腫瘍性の病変が存在する際には,抗腫瘍免疫のキープレーヤーであるT細胞が骨髄に隔絶されるという現象であり,これはT細胞の表面におけるスフィンゴシン1-リン酸受容体1の減少に起因することが明らかにされた.さらに,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスにおいては,この隔絶されたT細胞が骨髄の外へと移動できるようになるとともに,抗PD-1抗体に対する治療感受性の改善につながることが明らかにされた.これまで,脳腫瘍の患者において血液あるいは骨髄における細胞の動態を検討した報告はなく,この研究により,腫瘍の存在する臓器あるいは組織により全身における免疫細胞の動態が変化する可能性が示唆された.
脳にはニューロンだけでなく,それを固定し栄養や神経伝達物質の供給などを助けるグリア細胞が存在する.悪性の脳腫瘍のうち約20%ともっとも頻度の高いのがグリア細胞に由来するグリオーマであり,悪性度により大きく4つのグレードに分類される.そのなかでもっとも悪性度の高いグレード4に相当するのがグリオブラストーマである.治療としては外科的な切除にくわえ放射線療法および化学療法が選択されるが,5年生存率が20%に達しない非常に予後不良のがんである.グリオブラストーマは治療抵抗性であるという特徴のほか,患者の末梢血においてT細胞が著明に減少するという現象が古くから報告されていたが1),その発症の機序については明らかではなかった.
近年,複数の固形がんに対し有効性の認められている抗PD-1抗体に代表される免疫チェックポイント阻害剤は,その効果を発揮するため腫瘍浸潤リンパ球の存在が重要であるとともに2),腫瘍浸潤リンパ球の活性化あるいは疲弊の状態が治療感受性に関与する可能性が示されている3,4).
この研究において,筆者らは,末梢血においてT細胞が減少するという現象がどのようにして起こるのかを解析するとともに,グリオブラストーマに対する免疫チェックポイント阻害剤の適応の可能性を検証するため,グリオブラストーマのモデルマウスおよび患者の検体を解析した.
グリオブラストーマ細胞株であるCT2A細胞あるいはSMA-560細胞をマウスの頭蓋内に投与するモデルを用いて,腫瘍の増殖にともない免疫細胞,とくにT細胞の全身における分布がどのように変化するかを解析した.その結果,腫瘍のあるマウスは末梢血においてT細胞が著明に減少するだけでなく,脾臓が顕著に萎縮することが明らかにされた.グリオブラストーマの患者においては末梢血におけるT細胞の減少が知られていたが,脾臓の萎縮について評価された報告はなかったため,CT検査による画像を用いて脾臓の容積を解析したところ,マウスにおいて認められた現象と同様に,グリオブラストーマの患者は健常者と比べ脾臓の萎縮をともなうことが明らかにされた.マウスにおいては脾臓の萎縮だけでなく,胸腺および頸部リンパ節も同時に萎縮したが,その一方で,同じくリンパに関連する組織である骨髄においてはむしろT細胞は増加した.成人の胸腺はすでに萎縮していること,また,リンパ節の容積の定量はむずかしいことから,患者の骨髄に焦点をあて同じ現象が認められるかどうか検討した.グリオブラストーマの患者の外科的な切除の際に骨髄の穿刺を行い,対照として,脊髄に関連する手術をうける患者からも同様に骨髄の穿刺を行い,同一の患者に由来する血液とあわせT細胞の数を比較した.その結果,マウスと同様に,T細胞は末梢血においては減少していたのに対し,骨髄においてはむしろ増加していることが明らかにされた.臨床検体の解析においては,骨髄におけるT細胞の増加の証明はグリオブラストーマの患者においてのみ施行が可能であったが,マウスにおいて別の細胞株を頭蓋内に投与した場合でも同様に,骨髄においてT細胞が増加する傾向が確認された.以上から,細胞の由来に関係なく,頭蓋内に腫瘍性の病変が生じた際に,骨髄においてT細胞が増加するような免疫細胞の動態がひき起こされることが示唆された(図1).
グリオブラストーマ細胞株であるCT2A細胞を用いて,骨髄においてT細胞が増加する現象についてさらに検討した.CT2A細胞を皮下に投与した場合と頭蓋内に投与した場合とで比較すると,骨髄においてT細胞が増加する現象は頭蓋内に投与した場合のみ起こることがわかった.また,正常なマウスに由来する骨髄細胞を蛍光により染色して正常なマウスおよび腫瘍のあるマウスに投与した場合,頭蓋内にCT2A細胞を投与したマウスにおいてのみ,蛍光により標識されたT細胞が骨髄に集積したことから,頭蓋内に腫瘍が存在すること自体が,骨髄にT細胞が集積しやすくなる要因になることが明らかにされた.
リンパ球がリンパ組織から遊走する際に関与する経路として,CXCL12-CXCR4経路5) やスフィンゴシン1-リン酸受容体1経路6) などが報告されているが,頭蓋内に腫瘍のあるマウスおよびグリオブラストーマの患者においては,骨髄のT細胞においてスフィンゴシン1-リン酸受容体1が著明に減少していることが見い出された.この事象にもとづき,スフィンゴシン1-リン酸受容体1を欠損した骨髄細胞をグリオブラストーマのモデルマウスに投与したところ,T細胞の骨髄への集積が促進された.また,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスの頭蓋内にCT2A細胞を投与したところ,骨髄に集積するT細胞が有意に減少した.以上から,頭蓋内に腫瘍が存在すること自体が骨髄においてT細胞が増加する要因になっており,T細胞においてスフィンゴシン1-リン酸受容体1の内在化が促進されることにより骨髄に隔絶されるという分子機構の存在が判明した.頭蓋内に占拠性の腫瘍が存在することと,T細胞においてスフィンゴシン1-リン酸受容体1の内在化が促進されることとをつなぐ因子については,今後の検討が必要である.
CT2A細胞を頭蓋内に投与したマウスにおいて,抗PD-1抗体の単独の治療による効果は認められなかった.そこで,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスを用いたところ,やはり,抗PD-1抗体は単独では有意な生存の改善は認められなかったが,T細胞の活性化および生存の維持にかかわる4-1BBのアゴニストを同時に投与すると,それぞれの単独の治療では効果が認められなかったのに対し,有意な生存の回復が認められた.もともと,グリオブラストーマのモデルマウスおよび患者に由来する腫瘍の解析において,T細胞が非常に強く疲弊していることが示されており,単純に免疫チェックポイントを阻害するだけでなく,T細胞の活性化および生存の維持にかかわるシグナルによりサポートすることも,グリオブラストーマの免疫チェックポイント阻害剤に対する感受性の改善に重要であることが明らかにされた.
以上から,臨床的に認められたグリオブラストーマの抗PD-1抗体に対する抵抗性は,T細胞が骨髄に隔絶されることによる“量的な因子”だけでなく,T細胞の強い疲弊により免疫チェックポイントの阻害のみではT細胞の機能のバックアップができないことによる“質的な因子”により起こっている可能性が示唆された.
古くから知られていたグリオブラストーマの患者における末梢血のリンパ球の減少の一因として,T細胞が骨髄に隔絶される病態がモデルマウスおよび患者の解析により示された.この現象は,T細胞におけるスフィンゴシン1-リン酸受容体1の内在化による細胞の表面における減少によりもたらされると考えられた.グリオブラストーマのモデルマウスを用いた検討において,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスを用いた実験では抗PD-1抗体と4-1BBのアゴニストの併用により有意に生存の改善が認められたことから,抗PD-1抗体に対する治療抵抗性をもたらす因子として,T細胞が骨髄に隔絶されることによる量的な因子と,腫瘍におけるT細胞の強い疲弊による質的な因子のかかわることが示唆された.頭蓋内に腫瘍性の病変が存在することによりなぜT細胞の表面のスフィンゴシン1-リン酸受容体1の減少が起こるのか,その背景にある分子機構の解明,および,グリオブラストーマの患者に対する免疫療法において感受性の改善をもたらすための新たな治療戦略の樹立が今後の課題である.
略歴:2009年 東北大学大学院医学系研究科博士課程 修了,2010年 米国Dana-Farber Cancer Institute研究員,2015年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2018年より大阪大学大学院医学系研究科 助教.
研究テーマ:肺がんの微小環境,がん免疫療法,気道免疫.
© 2018 著者名 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:小山正平
DOI: 10.7875/first.author.2018.082
Sequestration of T cells in bone marrow in the setting of glioblastoma and other intracranial tumors.
Pakawat Chongsathidkiet, Christina Jackson, Shohei Koyama, Franziska Loebel, Xiuyu Cui, S. Harrison Farber, Karolina Woroniecka, Aladine A. Elsamadicy, Cosette A. Dechant, Hanna R. Kemeny, Luis Sanchez-Perez, Tooba A. Cheema, Nicholas C. Souders, James E. Herndon, Jean-Valery Coumans, Jeffrey I. Everitt, Brian V. Nahed, John H. Sampson, Michael D. Gunn, Robert L. Martuza, Glenn Dranoff, William T. Curry, Peter E. Fecci
Nature Medicine, 24, 1459-1468 (2018)
要 約
グリオブラストーマは脳腫瘍のなかでもっとも悪性度が高く,固形がんの全体のなかでももっとも予後不良のカテゴリーに属する腫瘍であり,新規の治療法の開発が望まれている.古くから,グリオブラストーマの患者においては末梢血のT細胞が著明に減少することが知られていたが,その理由は不明であった.また,近年,複数のがんに対し有効性が示されている抗PD-1抗体に代表される免疫チェックポイント阻害剤について,現時点ではグリオブラストーマに対し明らかな有効性が示されたという報告はない.筆者らは,グリオブラストーマのモデルマウスおよび患者の解析により,これら2つの臨床的な問題点の解決につながる新しい事象を見い出した.それは,グリオブラストーマをはじめとして脳に占拠する腫瘍性の病変が存在する際には,抗腫瘍免疫のキープレーヤーであるT細胞が骨髄に隔絶されるという現象であり,これはT細胞の表面におけるスフィンゴシン1-リン酸受容体1の減少に起因することが明らかにされた.さらに,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスにおいては,この隔絶されたT細胞が骨髄の外へと移動できるようになるとともに,抗PD-1抗体に対する治療感受性の改善につながることが明らかにされた.これまで,脳腫瘍の患者において血液あるいは骨髄における細胞の動態を検討した報告はなく,この研究により,腫瘍の存在する臓器あるいは組織により全身における免疫細胞の動態が変化する可能性が示唆された.
はじめに
脳にはニューロンだけでなく,それを固定し栄養や神経伝達物質の供給などを助けるグリア細胞が存在する.悪性の脳腫瘍のうち約20%ともっとも頻度の高いのがグリア細胞に由来するグリオーマであり,悪性度により大きく4つのグレードに分類される.そのなかでもっとも悪性度の高いグレード4に相当するのがグリオブラストーマである.治療としては外科的な切除にくわえ放射線療法および化学療法が選択されるが,5年生存率が20%に達しない非常に予後不良のがんである.グリオブラストーマは治療抵抗性であるという特徴のほか,患者の末梢血においてT細胞が著明に減少するという現象が古くから報告されていたが1),その発症の機序については明らかではなかった.
近年,複数の固形がんに対し有効性の認められている抗PD-1抗体に代表される免疫チェックポイント阻害剤は,その効果を発揮するため腫瘍浸潤リンパ球の存在が重要であるとともに2),腫瘍浸潤リンパ球の活性化あるいは疲弊の状態が治療感受性に関与する可能性が示されている3,4).
この研究において,筆者らは,末梢血においてT細胞が減少するという現象がどのようにして起こるのかを解析するとともに,グリオブラストーマに対する免疫チェックポイント阻害剤の適応の可能性を検証するため,グリオブラストーマのモデルマウスおよび患者の検体を解析した.
1.グリオブラストーマのモデルマウスおよび患者の検体における免疫細胞の動態の解析
グリオブラストーマ細胞株であるCT2A細胞あるいはSMA-560細胞をマウスの頭蓋内に投与するモデルを用いて,腫瘍の増殖にともない免疫細胞,とくにT細胞の全身における分布がどのように変化するかを解析した.その結果,腫瘍のあるマウスは末梢血においてT細胞が著明に減少するだけでなく,脾臓が顕著に萎縮することが明らかにされた.グリオブラストーマの患者においては末梢血におけるT細胞の減少が知られていたが,脾臓の萎縮について評価された報告はなかったため,CT検査による画像を用いて脾臓の容積を解析したところ,マウスにおいて認められた現象と同様に,グリオブラストーマの患者は健常者と比べ脾臓の萎縮をともなうことが明らかにされた.マウスにおいては脾臓の萎縮だけでなく,胸腺および頸部リンパ節も同時に萎縮したが,その一方で,同じくリンパに関連する組織である骨髄においてはむしろT細胞は増加した.成人の胸腺はすでに萎縮していること,また,リンパ節の容積の定量はむずかしいことから,患者の骨髄に焦点をあて同じ現象が認められるかどうか検討した.グリオブラストーマの患者の外科的な切除の際に骨髄の穿刺を行い,対照として,脊髄に関連する手術をうける患者からも同様に骨髄の穿刺を行い,同一の患者に由来する血液とあわせT細胞の数を比較した.その結果,マウスと同様に,T細胞は末梢血においては減少していたのに対し,骨髄においてはむしろ増加していることが明らかにされた.臨床検体の解析においては,骨髄におけるT細胞の増加の証明はグリオブラストーマの患者においてのみ施行が可能であったが,マウスにおいて別の細胞株を頭蓋内に投与した場合でも同様に,骨髄においてT細胞が増加する傾向が確認された.以上から,細胞の由来に関係なく,頭蓋内に腫瘍性の病変が生じた際に,骨髄においてT細胞が増加するような免疫細胞の動態がひき起こされることが示唆された(図1).
2.骨髄においてT細胞が増加する要因
グリオブラストーマ細胞株であるCT2A細胞を用いて,骨髄においてT細胞が増加する現象についてさらに検討した.CT2A細胞を皮下に投与した場合と頭蓋内に投与した場合とで比較すると,骨髄においてT細胞が増加する現象は頭蓋内に投与した場合のみ起こることがわかった.また,正常なマウスに由来する骨髄細胞を蛍光により染色して正常なマウスおよび腫瘍のあるマウスに投与した場合,頭蓋内にCT2A細胞を投与したマウスにおいてのみ,蛍光により標識されたT細胞が骨髄に集積したことから,頭蓋内に腫瘍が存在すること自体が,骨髄にT細胞が集積しやすくなる要因になることが明らかにされた.
リンパ球がリンパ組織から遊走する際に関与する経路として,CXCL12-CXCR4経路5) やスフィンゴシン1-リン酸受容体1経路6) などが報告されているが,頭蓋内に腫瘍のあるマウスおよびグリオブラストーマの患者においては,骨髄のT細胞においてスフィンゴシン1-リン酸受容体1が著明に減少していることが見い出された.この事象にもとづき,スフィンゴシン1-リン酸受容体1を欠損した骨髄細胞をグリオブラストーマのモデルマウスに投与したところ,T細胞の骨髄への集積が促進された.また,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスの頭蓋内にCT2A細胞を投与したところ,骨髄に集積するT細胞が有意に減少した.以上から,頭蓋内に腫瘍が存在すること自体が骨髄においてT細胞が増加する要因になっており,T細胞においてスフィンゴシン1-リン酸受容体1の内在化が促進されることにより骨髄に隔絶されるという分子機構の存在が判明した.頭蓋内に占拠性の腫瘍が存在することと,T細胞においてスフィンゴシン1-リン酸受容体1の内在化が促進されることとをつなぐ因子については,今後の検討が必要である.
3.グリオブラストーマのモデルマウスにおいてはT細胞の量的および質的な改善により抗PD-1抗体に対する感受性の改善がもたらされる
CT2A細胞を頭蓋内に投与したマウスにおいて,抗PD-1抗体の単独の治療による効果は認められなかった.そこで,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスを用いたところ,やはり,抗PD-1抗体は単独では有意な生存の改善は認められなかったが,T細胞の活性化および生存の維持にかかわる4-1BBのアゴニストを同時に投与すると,それぞれの単独の治療では効果が認められなかったのに対し,有意な生存の回復が認められた.もともと,グリオブラストーマのモデルマウスおよび患者に由来する腫瘍の解析において,T細胞が非常に強く疲弊していることが示されており,単純に免疫チェックポイントを阻害するだけでなく,T細胞の活性化および生存の維持にかかわるシグナルによりサポートすることも,グリオブラストーマの免疫チェックポイント阻害剤に対する感受性の改善に重要であることが明らかにされた.
以上から,臨床的に認められたグリオブラストーマの抗PD-1抗体に対する抵抗性は,T細胞が骨髄に隔絶されることによる“量的な因子”だけでなく,T細胞の強い疲弊により免疫チェックポイントの阻害のみではT細胞の機能のバックアップができないことによる“質的な因子”により起こっている可能性が示唆された.
おわりに
古くから知られていたグリオブラストーマの患者における末梢血のリンパ球の減少の一因として,T細胞が骨髄に隔絶される病態がモデルマウスおよび患者の解析により示された.この現象は,T細胞におけるスフィンゴシン1-リン酸受容体1の内在化による細胞の表面における減少によりもたらされると考えられた.グリオブラストーマのモデルマウスを用いた検討において,スフィンゴシン1-リン酸受容体1を細胞の表面に恒常的に発現するマウスを用いた実験では抗PD-1抗体と4-1BBのアゴニストの併用により有意に生存の改善が認められたことから,抗PD-1抗体に対する治療抵抗性をもたらす因子として,T細胞が骨髄に隔絶されることによる量的な因子と,腫瘍におけるT細胞の強い疲弊による質的な因子のかかわることが示唆された.頭蓋内に腫瘍性の病変が存在することによりなぜT細胞の表面のスフィンゴシン1-リン酸受容体1の減少が起こるのか,その背景にある分子機構の解明,および,グリオブラストーマの患者に対する免疫療法において感受性の改善をもたらすための新たな治療戦略の樹立が今後の課題である.
文 献
- Brooks, W. H., Roszman, T. L., Mahaley, M. S. et al.: Immunobiology of primary intracranial tumours. II. Analysis of lymphocyte subpopulations in patients with primary brain tumours. Clin. Exp. Immunol., 29, 61-66 (1977)[PubMed]
- Filley, A. C., Henriquez, M. & Dey, M.: Recurrent glioma clinical trial, CheckMate-143: the game is not over yet. Oncotarget, 8, 91779-91794 (2017)[PubMed]
- Woroniecka, K., Chongsathidkiet, P., Rhodin, K. et al.: T-cell exhaustion signatures vary with tumor type and are severe in glioblastoma. Clin Cancer Res., 24, 4175-4186 (2018)[PubMed]
- Koyama, S., Akbay, E. A., Li, Y. Y. et al.: Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints. Nat. Commun., 7, 10501 (2016)[PubMed]
- Cecchinato, V., D'Agostino, G., Raeli, L. et al.: Chemokine interaction with synergy-inducing molecules: fine tuning modulation of cell trafficking. J. Leukoc. Biol., 99, 851-855 (2016)[PubMed]
- Tiper, I. V., East, J. E., Subrahmanyam, P. B. et al.: Sphingosine 1-phosphate signaling impacts lymphocyte migration, inflammation and infection. Pathog Dis., 74, ftw063 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2009年 東北大学大学院医学系研究科博士課程 修了,2010年 米国Dana-Farber Cancer Institute研究員,2015年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2018年より大阪大学大学院医学系研究科 助教.
研究テーマ:肺がんの微小環境,がん免疫療法,気道免疫.
© 2018 著者名 Licensed under CC 表示 2.1 日本