メモリーB細胞はインターロイキン9を介し抗体の迅速な産生を可能にする
高塚翔吾・北村大介
(東京理科大学生命医科学研究所 分子生物学研究部門)
email:北村大介
DOI: 10.7875/first.author.2018.081
IL-9 receptor signaling in memory B cells regulates humoral recall responses.
Shogo Takatsuka, Hiroyuki Yamada, Kei Haniuda, Hiroshi Saruwatari, Marina Ichihashi, Jean-Christophe Renauld, Daisuke Kitamura
Nature Immunology, 19, 1025-1034 (2018)
免疫記憶は病原体の感染をふせぐ生体防御機構のひとつであり,いちど出会った抗原を記憶し,ふたたび感染した際には病原体をすばやく排除するという機構である.この研究において,筆者らは,免疫記憶の形成を担うメモリーB細胞にはインターロイキン9受容体が選択的に発現することを見い出した.in vitroにおいては,インターロイキン9受容体の発現はB細胞の表面に存在するCD40を介して誘導され,インターロイキン4あるいはインターロイキン21の刺激により抑制された.インターロイキン9受容体ノックアウトマウスは2次応答におけるメモリーB細胞の増殖および抗体の産生が選択的に抑制され,この異常はB細胞が原因であった.さらに,2次応答の際に活性化したメモリーB細胞の一部がインターロイキン9を産生しており,インターロイキン9の自己分泌による制御が示唆された.この研究により,記憶免疫におけるメモリーB細胞による抗体の迅速な産生はインターロイキン9により正に制御されることが明らかにされた.
免疫記憶は獲得免疫における中心的な概念であり,ワクチンの基本的な原理でもある.よって,免疫記憶の形成および2次応答の機構をより詳細に明らかにすることは,よりすぐれたワクチンを開発するために重要な意義をもつと考えられる.
免疫記憶は1次応答の際に抗原を認識して活性化されたB細胞1) およびヘルパーT細胞がクローン増殖したのち分化したメモリーB細胞およびメモリーT細胞により担われる.病原体などの抗原がはじめて進入した際に抗原受容体により抗原を認識したB細胞は,同じ抗原を認識して活性化したヘルパーT細胞により,CD40Lやインターロイキン4をはじめとするサイトカインを介して刺激をうけて,クローン増殖を起こし,また,クラススイッチによりIgM型の抗原受容体がIgG型やIgA型に変化する.それらの一部はすぐに形質細胞へと分化して抗体を産生するが,それらは短命であり数日で死滅する.別の一部はB細胞濾胞において濾胞ヘルパーT細胞により産生されるインターロイキン21などのサイトカインの刺激によりいちじるしく増殖し胚中心を形成する.胚中心B細胞においては免疫グロブリン遺伝子に体細胞変異が起こり抗原受容体の抗原に対する特異性が多様化する.そのなかから,抗原に対する親和性の向上したB細胞が選択され,さらに,そのなかからメモリーB細胞あるいは長期にわたり生存する形質細胞が分化する.抗原に特異的なヘルパーT細胞の一部もメモリーT細胞へと分化し,メモリーB細胞とともに数十年にわたりリンパ組織を巡回しながら特異的な抗原の侵入を監視する.
メモリーB細胞がふたたび特異的な抗原に曝露されると,1次応答と同様に,メモリーT細胞のヘルプによりすみやかに活性化して増殖し形質細胞へと分化し,おもにIgG抗体を大量に産生する.しかし,この2次応答の制御機構についてはほとんどわかっていない.生体に維持される抗原に特異的なメモリーB細胞の数は非常に少なく,その解析は困難であることがその一因であった.筆者らは,B細胞の生存因子であるBAFFおよびCD40Lを発現させた線維芽細胞株である40LB株をフィーダー細胞として,生体から単離したB細胞をin vitroにおいていちじるしく増殖させるiGB培養法2) を開発した.インターロイキン4を添加して増殖させた胚中心様B細胞をマウスに移入すると,メモリーB細胞様の細胞に分化し比較的長期にわたり維持された.このようにして得られた多数のメモリーB細胞様の細胞について遺伝子発現プロファイルを解析したところ,インターロイキン9受容体 3) をコードする遺伝子が選択的に発現していた.これまで,インターロイキン9 4,5) はマスト細胞,一部の活性化したT細胞,2型自然リンパ球などにおいて産生が認められており,α鎖と共通γ鎖からなるインターロイキン9受容体から,おもにSTAT1,STAT3,STAT5を介して細胞内にシグナルを伝達しさまざまな活性をもたらす.
免疫されたマウスの脾臓細胞において,未感作の濾胞B細胞,辺縁帯B細胞,胚中心B細胞と比較して,メモリーB細胞においてインターロイキン9受容体α鎖がmRNAのレベルでいちじるしく高く発現していた.インターロイキン9受容体のタンパク質レベルでの発現を解析するにあたり,その時点では,フローサイトメトリー解析に用いることの可能なインターロイキン9受容体に対する抗体は入手できなかった.そこで,独自のDNA免疫法6) により,4クローンの抗マウスインターロイキン9受容体モノクローナル抗体を作製した.それらを用いたフローサイトメトリー解析の結果,メモリーB細胞に特異的なインターロイキン9受容体の発現が確認された.また,in vitroにおいては,インターロイキン9受容体の発現はB細胞の表面に存在するCD40からのシグナルを介して誘導されることが明らかにされ,リポ多糖やB細胞受容体の架橋による刺激では発現は誘導されなかった.さらに,このB細胞におけるインターロイキン9受容体の発現はインターロイキン4あるいはインターロイキン21が存在する際にはいちじるしく抑制された.この発現制御機構から,インターロイキン4やインターロイキン21の刺激により増殖する胚中心B細胞においてはインターロイキン9受容体の発現がほとんどみられないことが説明できた.インターロイキン4およびインターロイキン21をつづけてくわえて増殖させた胚中心様B細胞においてインターロイキン9受容体の発現はみられなかったが,この細胞をサイトカインを含まない培地で2日間培養した細胞にはインターロイキン9受容体が発現していた.そこで,この細胞をインターロイキン9により刺激したところ,増殖および形質細胞への分化が促進された.
生体におけるインターロイキン9受容体の機能をついて明らかにするため,野生型のマウスおよびインターロイキン9受容体ノックアウトマウス7) を用いた.モデル抗原として,典型的なT細胞に依存性の抗原として古くから用いられてきたNP-CGGを用いた.水酸化アルミニウムにより沈降させたNP-CGGをマウスに免疫し,血清における抗体価を経時的に測定したところ,1次応答においては野生型のマウスとインターロイキン9受容体ノックアウトマウスとのあいだに抗原に特異的なIgG1抗体の量や抗原に対する親和性に差はみられず,胚中心B細胞の形成についても大きな差異はなかった.しかし,1次免疫から6週間のちに可溶性のNP-CGGを投与して2次応答をひき起こしたところ,インターロイキン9受容体ノックアウトマウスにおいて抗原に特異的なIgG1抗体の抗体価の有意な低下が確認された.また,B細胞に特異的にインターロイキン9受容体を欠損させた骨髄混合キメラマウスを用いた系においても,同様の結果が得られた.
この結果は,生体におけるメモリーB細胞の数の差による可能性があったため,免疫から長い期間が経過したのちに抗原に特異的なメモリーB細胞の数を比較したが,IgG型のみならずIgM型のメモリーB細胞の数についても野生型のマウスとインターロイキン9受容体ノックアウトマウスとのあいだに有意な差異はなかった.さらに,2次応答の際に優先的に形質細胞へと分化することが報告されているCD80陽性PD-L2陽性のメモリーB細胞サブセット8) についても,その割合はほぼ同等であった.すなわち,1次応答の際に分化したメモリーB細胞の数と機能別のサブセットの割合,および,その維持はインターロイキン9受容体の有無に影響されないことがわかった.
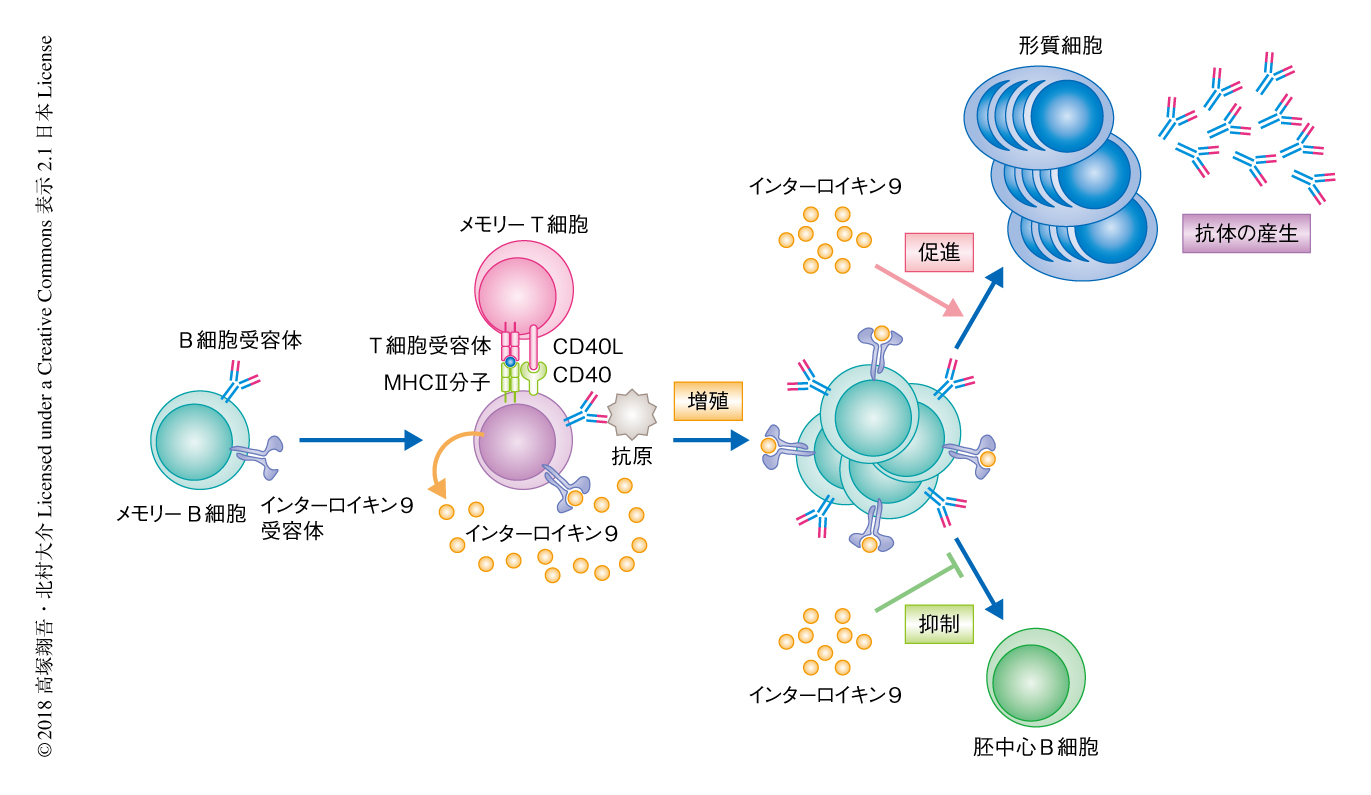
以上の結果から,メモリーB細胞の機能の違いについて調べた.野生型のマウスおよびインターロイキン9受容体ノックアウトマウスに同様の方法により免疫し,2次免疫ののちのメモリーB細胞の増殖および形質細胞への分化について解析した.その結果,インターロイキン9受容体ノックアウトマウスにおいてはメモリーB細胞の増殖および形質細胞への分化が有意に低下した.さらに,免疫したマウスから抗原に特異的なメモリーB細胞を回収し,iGB培養法と同様にフィーダー細胞のうえでインターロイキン9を添加して培養したところ,インターロイキン9受容体に依存してメモリーB細胞の増殖および形質細胞への分化が促進された.よって,メモリーB細胞は2次応答の際にインターロイキン9受容体を介してインターロイキン9をうけとることにより,迅速な増殖および形質細胞への分化が促進されることがわかった(図1).
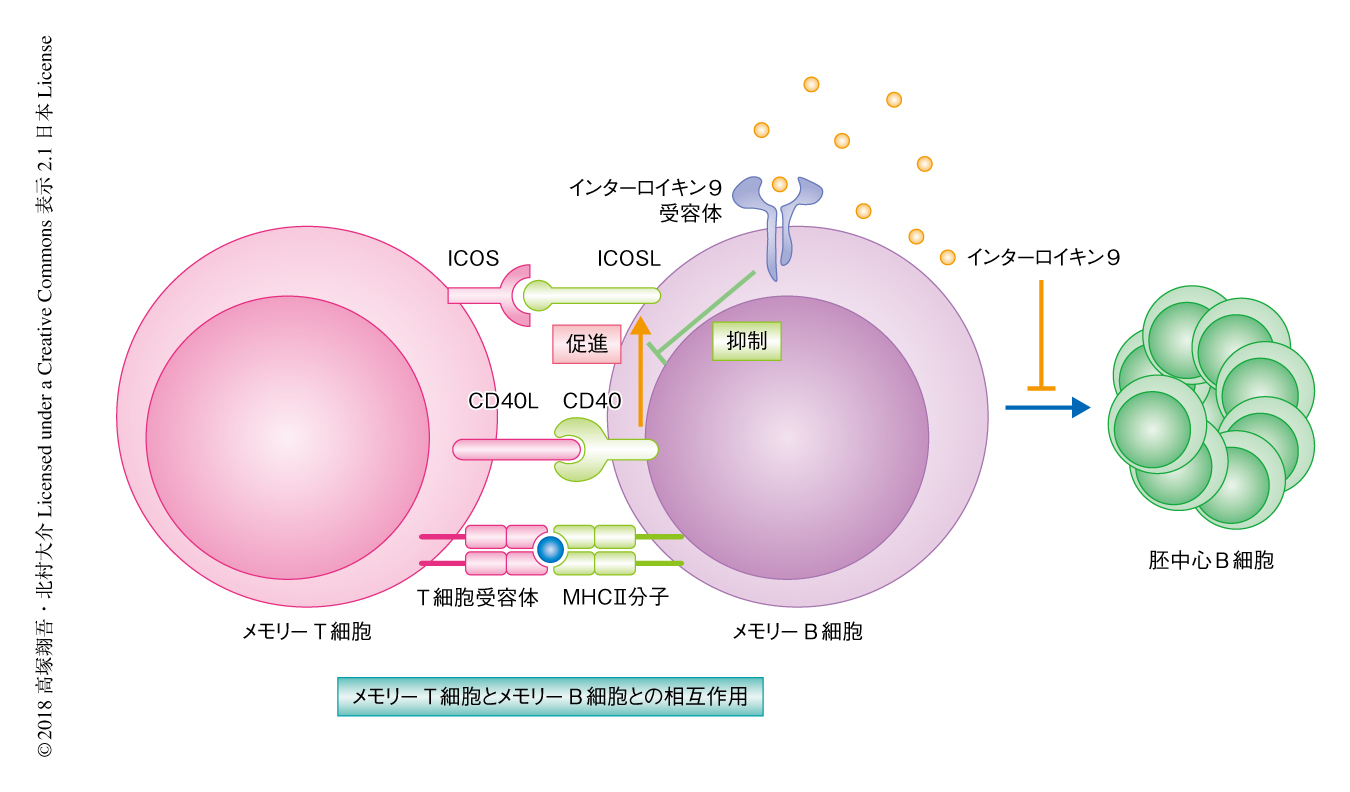
一方,2次応答において分化する胚中心B細胞について野生型のマウスとインターロイキン9受容体ノックアウトマウスとで比較したところ,インターロイキン9受容体ノックアウトマウスにおいては胚中心B細胞への分化が促進されることがわかった.そこで,胚中心B細胞の分化にかかわるタンパク質の発現を調べたところ,in vitroにおいて,メモリーB細胞の表面におけるICOSL 9) の発現がインターロイキン9受容体に依存的にインターロイキン9の添加により低下することが見い出された.さらに,in vivoにおいて,2次応答ののちのインターロイキン9受容体ノックアウトマウスにおける胚中心B細胞の形成の促進は,ICOSLの中和抗体により野生型のマウスと同等のレベルまで低下した.以上の結果から,インターロイキン9はメモリーB細胞においてICOSLの発現を低下させ,ICOSを発現するメモリーT細胞の活性化を抑制することにより,2次応答ののちの胚中心の再形成を抑制することが明らかにされた(図2).
これまでの結果から,2次応答の制御においてインターロイキン9が重要な役割をはたすと考えられた.実際に,2次免疫ののちマウスの脾臓細胞をin vitroにおいて培養するとその上清にインターロイキン9が検出されたが,未感作の脾臓細胞においては検出されなかった.アジュバントを含まない抗原についてはおもにメモリーB細胞およびメモリーT細胞により2次応答がひき起こされることが知られている.そこで,これらの細胞からインターロイキン9を産生する細胞を探索したところ,2次応答の際に活性化したメモリーT細胞においてインターロイキン9は検出されず,活性化したメモリーB細胞の一部の集団がインターロイキン9を産生することがわかった.メモリーB細胞の数%は1次免疫ののち2週目ごろからインターロイキン9を産生したが,2次免疫ののち2日目からインターロイキン9を産生する細胞が増加し,3日目には10~25%にもおよぶメモリーB細胞がインターロイキン9を産生した.以上の結果から,メモリーB細胞によるインターロイキン9の自己分泌あるいは傍分泌が2次応答の際のメモリーB細胞のすみやかな増殖および形質細胞への分化を促進し,同時に,胚中心B細胞の形成を抑制することが示唆された(図1).
病原体のなかには免疫記憶の成立が困難であるものも多く存在し,これらに対しては,古くから,特異的な抗原の探索とともにT細胞を効率よく活性化するアジュバントの探索がさかんに研究されてきた.さらに現在は,免疫記憶が効率よく成立するような新たなワクチンのデザインおよび接種法の開発が急がれている.この研究により,インターロイキン9がメモリーB細胞の2次応答を促進することが明らかにされたことから,ワクチンの2次接種の際にインターロイキン9あるいはその模倣体を投与することにより,病原体に特異的な抗体の産生を増強させ病原体の排除の効率を高めるという戦略が考えられる.また,メモリーB細胞から胚中心B細胞への分化をインターロイキン9が抑制することを応用し,インターロイキン9あるいはインターロイキン9受容体の阻害剤により2次接種の際にメモリーB細胞から胚中心B細胞への分化を促進し,抗原との親和性をさらに高めたメモリーB細胞の再生をひき起こすことのできる可能性もある.
近年,病原体それ自体が高頻度に変異を起こし宿主の免疫系からのがれるHIVやインフルエンザウイルスなどのように,これまでのワクチンでは対応が困難なケースが明らかにされてきた10).このような場合,単純なワクチンの追加接種では産生された抗体の免疫抗原に対する選択性が高まるため,変異した多くの型に対応できなくなる可能性が問題になる.そのような場合には,メモリーB細胞から胚中心B細胞への分化を抑制するインターロイキン9の制御機構を応用し,広範な抗原に対する結合性を維持した免疫記憶10) をひき起こす接種法を開発することができるかもしれない.このように,この研究の成果は,目的の病原体の特徴にあわせた次世代のワクチンの開発につながるものと期待される.
略歴:2011年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 東京理科大学生命医科学研究所 助教を経て,2016年より国立感染症研究所 研究員.
研究テーマ:免疫学.
北村 大介(Daisuke Kitamura)
東京理科大学生命医科学研究所 教授.
研究室URL:https://dai3kitamura.jimdofree.com/
© 2018 高塚翔吾・北村大介 Licensed under CC 表示 2.1 日本
(東京理科大学生命医科学研究所 分子生物学研究部門)
email:北村大介
DOI: 10.7875/first.author.2018.081
IL-9 receptor signaling in memory B cells regulates humoral recall responses.
Shogo Takatsuka, Hiroyuki Yamada, Kei Haniuda, Hiroshi Saruwatari, Marina Ichihashi, Jean-Christophe Renauld, Daisuke Kitamura
Nature Immunology, 19, 1025-1034 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
インターロイキン9(P15247), IL-9 receptor(Q01114), インターロイキン9受容体(Q01114), CD40(P27512), インターロイキン4(P07750), インターロイキン21(Q9ES17), CD40L(P27548), サイトカイン, IgM, IgG, IgA, 免疫グロブリン, BAFF(Q9WU72), STAT1(P42225), STAT3(P42227), STAT5, IgG1, CD80(Q00609), PD-L2(Q9WUL5), ICOSL(Q9JHJ8), ICOS(Q9WVS0)
要 約
免疫記憶は病原体の感染をふせぐ生体防御機構のひとつであり,いちど出会った抗原を記憶し,ふたたび感染した際には病原体をすばやく排除するという機構である.この研究において,筆者らは,免疫記憶の形成を担うメモリーB細胞にはインターロイキン9受容体が選択的に発現することを見い出した.in vitroにおいては,インターロイキン9受容体の発現はB細胞の表面に存在するCD40を介して誘導され,インターロイキン4あるいはインターロイキン21の刺激により抑制された.インターロイキン9受容体ノックアウトマウスは2次応答におけるメモリーB細胞の増殖および抗体の産生が選択的に抑制され,この異常はB細胞が原因であった.さらに,2次応答の際に活性化したメモリーB細胞の一部がインターロイキン9を産生しており,インターロイキン9の自己分泌による制御が示唆された.この研究により,記憶免疫におけるメモリーB細胞による抗体の迅速な産生はインターロイキン9により正に制御されることが明らかにされた.
はじめに
免疫記憶は獲得免疫における中心的な概念であり,ワクチンの基本的な原理でもある.よって,免疫記憶の形成および2次応答の機構をより詳細に明らかにすることは,よりすぐれたワクチンを開発するために重要な意義をもつと考えられる.
免疫記憶は1次応答の際に抗原を認識して活性化されたB細胞1) およびヘルパーT細胞がクローン増殖したのち分化したメモリーB細胞およびメモリーT細胞により担われる.病原体などの抗原がはじめて進入した際に抗原受容体により抗原を認識したB細胞は,同じ抗原を認識して活性化したヘルパーT細胞により,CD40Lやインターロイキン4をはじめとするサイトカインを介して刺激をうけて,クローン増殖を起こし,また,クラススイッチによりIgM型の抗原受容体がIgG型やIgA型に変化する.それらの一部はすぐに形質細胞へと分化して抗体を産生するが,それらは短命であり数日で死滅する.別の一部はB細胞濾胞において濾胞ヘルパーT細胞により産生されるインターロイキン21などのサイトカインの刺激によりいちじるしく増殖し胚中心を形成する.胚中心B細胞においては免疫グロブリン遺伝子に体細胞変異が起こり抗原受容体の抗原に対する特異性が多様化する.そのなかから,抗原に対する親和性の向上したB細胞が選択され,さらに,そのなかからメモリーB細胞あるいは長期にわたり生存する形質細胞が分化する.抗原に特異的なヘルパーT細胞の一部もメモリーT細胞へと分化し,メモリーB細胞とともに数十年にわたりリンパ組織を巡回しながら特異的な抗原の侵入を監視する.
メモリーB細胞がふたたび特異的な抗原に曝露されると,1次応答と同様に,メモリーT細胞のヘルプによりすみやかに活性化して増殖し形質細胞へと分化し,おもにIgG抗体を大量に産生する.しかし,この2次応答の制御機構についてはほとんどわかっていない.生体に維持される抗原に特異的なメモリーB細胞の数は非常に少なく,その解析は困難であることがその一因であった.筆者らは,B細胞の生存因子であるBAFFおよびCD40Lを発現させた線維芽細胞株である40LB株をフィーダー細胞として,生体から単離したB細胞をin vitroにおいていちじるしく増殖させるiGB培養法2) を開発した.インターロイキン4を添加して増殖させた胚中心様B細胞をマウスに移入すると,メモリーB細胞様の細胞に分化し比較的長期にわたり維持された.このようにして得られた多数のメモリーB細胞様の細胞について遺伝子発現プロファイルを解析したところ,インターロイキン9受容体 3) をコードする遺伝子が選択的に発現していた.これまで,インターロイキン9 4,5) はマスト細胞,一部の活性化したT細胞,2型自然リンパ球などにおいて産生が認められており,α鎖と共通γ鎖からなるインターロイキン9受容体から,おもにSTAT1,STAT3,STAT5を介して細胞内にシグナルを伝達しさまざまな活性をもたらす.
1.B細胞におけるインターロイキン9受容体の発現
免疫されたマウスの脾臓細胞において,未感作の濾胞B細胞,辺縁帯B細胞,胚中心B細胞と比較して,メモリーB細胞においてインターロイキン9受容体α鎖がmRNAのレベルでいちじるしく高く発現していた.インターロイキン9受容体のタンパク質レベルでの発現を解析するにあたり,その時点では,フローサイトメトリー解析に用いることの可能なインターロイキン9受容体に対する抗体は入手できなかった.そこで,独自のDNA免疫法6) により,4クローンの抗マウスインターロイキン9受容体モノクローナル抗体を作製した.それらを用いたフローサイトメトリー解析の結果,メモリーB細胞に特異的なインターロイキン9受容体の発現が確認された.また,in vitroにおいては,インターロイキン9受容体の発現はB細胞の表面に存在するCD40からのシグナルを介して誘導されることが明らかにされ,リポ多糖やB細胞受容体の架橋による刺激では発現は誘導されなかった.さらに,このB細胞におけるインターロイキン9受容体の発現はインターロイキン4あるいはインターロイキン21が存在する際にはいちじるしく抑制された.この発現制御機構から,インターロイキン4やインターロイキン21の刺激により増殖する胚中心B細胞においてはインターロイキン9受容体の発現がほとんどみられないことが説明できた.インターロイキン4およびインターロイキン21をつづけてくわえて増殖させた胚中心様B細胞においてインターロイキン9受容体の発現はみられなかったが,この細胞をサイトカインを含まない培地で2日間培養した細胞にはインターロイキン9受容体が発現していた.そこで,この細胞をインターロイキン9により刺激したところ,増殖および形質細胞への分化が促進された.
2.メモリーB細胞におけるインターロイキン9受容体の機能
生体におけるインターロイキン9受容体の機能をついて明らかにするため,野生型のマウスおよびインターロイキン9受容体ノックアウトマウス7) を用いた.モデル抗原として,典型的なT細胞に依存性の抗原として古くから用いられてきたNP-CGGを用いた.水酸化アルミニウムにより沈降させたNP-CGGをマウスに免疫し,血清における抗体価を経時的に測定したところ,1次応答においては野生型のマウスとインターロイキン9受容体ノックアウトマウスとのあいだに抗原に特異的なIgG1抗体の量や抗原に対する親和性に差はみられず,胚中心B細胞の形成についても大きな差異はなかった.しかし,1次免疫から6週間のちに可溶性のNP-CGGを投与して2次応答をひき起こしたところ,インターロイキン9受容体ノックアウトマウスにおいて抗原に特異的なIgG1抗体の抗体価の有意な低下が確認された.また,B細胞に特異的にインターロイキン9受容体を欠損させた骨髄混合キメラマウスを用いた系においても,同様の結果が得られた.
この結果は,生体におけるメモリーB細胞の数の差による可能性があったため,免疫から長い期間が経過したのちに抗原に特異的なメモリーB細胞の数を比較したが,IgG型のみならずIgM型のメモリーB細胞の数についても野生型のマウスとインターロイキン9受容体ノックアウトマウスとのあいだに有意な差異はなかった.さらに,2次応答の際に優先的に形質細胞へと分化することが報告されているCD80陽性PD-L2陽性のメモリーB細胞サブセット8) についても,その割合はほぼ同等であった.すなわち,1次応答の際に分化したメモリーB細胞の数と機能別のサブセットの割合,および,その維持はインターロイキン9受容体の有無に影響されないことがわかった.
以上の結果から,メモリーB細胞の機能の違いについて調べた.野生型のマウスおよびインターロイキン9受容体ノックアウトマウスに同様の方法により免疫し,2次免疫ののちのメモリーB細胞の増殖および形質細胞への分化について解析した.その結果,インターロイキン9受容体ノックアウトマウスにおいてはメモリーB細胞の増殖および形質細胞への分化が有意に低下した.さらに,免疫したマウスから抗原に特異的なメモリーB細胞を回収し,iGB培養法と同様にフィーダー細胞のうえでインターロイキン9を添加して培養したところ,インターロイキン9受容体に依存してメモリーB細胞の増殖および形質細胞への分化が促進された.よって,メモリーB細胞は2次応答の際にインターロイキン9受容体を介してインターロイキン9をうけとることにより,迅速な増殖および形質細胞への分化が促進されることがわかった(図1).
一方,2次応答において分化する胚中心B細胞について野生型のマウスとインターロイキン9受容体ノックアウトマウスとで比較したところ,インターロイキン9受容体ノックアウトマウスにおいては胚中心B細胞への分化が促進されることがわかった.そこで,胚中心B細胞の分化にかかわるタンパク質の発現を調べたところ,in vitroにおいて,メモリーB細胞の表面におけるICOSL 9) の発現がインターロイキン9受容体に依存的にインターロイキン9の添加により低下することが見い出された.さらに,in vivoにおいて,2次応答ののちのインターロイキン9受容体ノックアウトマウスにおける胚中心B細胞の形成の促進は,ICOSLの中和抗体により野生型のマウスと同等のレベルまで低下した.以上の結果から,インターロイキン9はメモリーB細胞においてICOSLの発現を低下させ,ICOSを発現するメモリーT細胞の活性化を抑制することにより,2次応答ののちの胚中心の再形成を抑制することが明らかにされた(図2).
3.インターロイキン9はメモリーB細胞から産生される
これまでの結果から,2次応答の制御においてインターロイキン9が重要な役割をはたすと考えられた.実際に,2次免疫ののちマウスの脾臓細胞をin vitroにおいて培養するとその上清にインターロイキン9が検出されたが,未感作の脾臓細胞においては検出されなかった.アジュバントを含まない抗原についてはおもにメモリーB細胞およびメモリーT細胞により2次応答がひき起こされることが知られている.そこで,これらの細胞からインターロイキン9を産生する細胞を探索したところ,2次応答の際に活性化したメモリーT細胞においてインターロイキン9は検出されず,活性化したメモリーB細胞の一部の集団がインターロイキン9を産生することがわかった.メモリーB細胞の数%は1次免疫ののち2週目ごろからインターロイキン9を産生したが,2次免疫ののち2日目からインターロイキン9を産生する細胞が増加し,3日目には10~25%にもおよぶメモリーB細胞がインターロイキン9を産生した.以上の結果から,メモリーB細胞によるインターロイキン9の自己分泌あるいは傍分泌が2次応答の際のメモリーB細胞のすみやかな増殖および形質細胞への分化を促進し,同時に,胚中心B細胞の形成を抑制することが示唆された(図1).
おわりに
病原体のなかには免疫記憶の成立が困難であるものも多く存在し,これらに対しては,古くから,特異的な抗原の探索とともにT細胞を効率よく活性化するアジュバントの探索がさかんに研究されてきた.さらに現在は,免疫記憶が効率よく成立するような新たなワクチンのデザインおよび接種法の開発が急がれている.この研究により,インターロイキン9がメモリーB細胞の2次応答を促進することが明らかにされたことから,ワクチンの2次接種の際にインターロイキン9あるいはその模倣体を投与することにより,病原体に特異的な抗体の産生を増強させ病原体の排除の効率を高めるという戦略が考えられる.また,メモリーB細胞から胚中心B細胞への分化をインターロイキン9が抑制することを応用し,インターロイキン9あるいはインターロイキン9受容体の阻害剤により2次接種の際にメモリーB細胞から胚中心B細胞への分化を促進し,抗原との親和性をさらに高めたメモリーB細胞の再生をひき起こすことのできる可能性もある.
近年,病原体それ自体が高頻度に変異を起こし宿主の免疫系からのがれるHIVやインフルエンザウイルスなどのように,これまでのワクチンでは対応が困難なケースが明らかにされてきた10).このような場合,単純なワクチンの追加接種では産生された抗体の免疫抗原に対する選択性が高まるため,変異した多くの型に対応できなくなる可能性が問題になる.そのような場合には,メモリーB細胞から胚中心B細胞への分化を抑制するインターロイキン9の制御機構を応用し,広範な抗原に対する結合性を維持した免疫記憶10) をひき起こす接種法を開発することができるかもしれない.このように,この研究の成果は,目的の病原体の特徴にあわせた次世代のワクチンの開発につながるものと期待される.
文 献
- Shlomchik, M. J. & Weisel, F.: Germinal center selection and the development of memory B and plasma cells. Immunol. Rev., 247, 52-63 (2012)[PubMed]
- Nojima, T., Haniuda, K., Moutai, T. et al.: In-vitro derived germinal centre B cells di erentially generate memory B or plasma cells in vivo. Nat. Commun., 2, 465 (2011)[PubMed]
- Renauld, J. C., Druez, C., Kermouni, A. et al.: Expression cloning of the murine and human interleukin 9 receptor cDNAs. Proc. Natl. Acad. Sci. USA, 89, 5690-5694 (1992)[PubMed]
- Noelle, R. J. & Nowak, E. C.: Cellular sources and immune functions of interleukin-9. Nat. Rev. Immunol., 10, 683-687 (2010)[PubMed]
- Bauer, J. H., Liu, K. D., You, Y. et al.: Heteromerization of the γc chain with the interleukin-9 receptor α subunit leads to STAT activation and prevention of apoptosis. J. Biol. Chem., 273, 9255-9260 (1998)[PubMed]
- Takatsuka, S., Sekiguchi, A., Tokunaga, M. et al.: Generation of a panel of monoclonal antibodies against atypical chemokine receptor CCX-CKR by DNA immunization. J. Pharmacol. Toxicol. Methods, 63, 250-257 (2011)[PubMed]
- Vink, A., Warnier, G., Brombacher, F. et al.: Interleukin 9-induced in vivo expansion of the B-1 lymphocyte population. J. Exp. Med., 189, 1413-1423 (1999)[PubMed]
- Zuccarino-Catania, G. V., Sadanand, S., Weisel, F. J. et al.: CD80 and PD-L2 de ne functionally distinct memory B cell subsets that are independent of antibody isotype. Nat. Immunol., 15, 631-637 (2014)[PubMed]
- Dong, C., Temann, U. A. & Flavell, R. A.: Cutting edge: critical role of inducible costimulator in germinal center reactions. J. Immunol., 166, 3659-3662 (2001)[PubMed]
- Corti, D. & Lanzavecchia, A.: Broadly neutralizing antiviral antibodies. Annu. Rev. Immunol., 31, 705-742 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 東京理科大学生命医科学研究所 助教を経て,2016年より国立感染症研究所 研究員.
研究テーマ:免疫学.
北村 大介(Daisuke Kitamura)
東京理科大学生命医科学研究所 教授.
研究室URL:https://dai3kitamura.jimdofree.com/
© 2018 高塚翔吾・北村大介 Licensed under CC 表示 2.1 日本