糖尿病とインスリンの脳におけるコレステロール代謝への影響
鈴木 亮・C. Ronald Kahn
(米国Harvard Medical School,Joslin Diabetes Center)
email:鈴木 亮
DOI: 10.7875/first.author.2011.006
Diabetes and insulin in regulation of brain cholesterol metabolism.
Ryo Suzuki, Kevin Lee, Enxuan Jing, Sudha B. Biddinger, Jeffrey G. McDonald, Thomas J. Montine, Suzanne Craft, C. Ronald Kahn
Cell Metabolism, 12, 567-579 (2010)
脳は全身でもっともコレステロールの豊富な臓器であり,脳のコレステロールの大部分は脳によって合成されている.筆者らは,インスリンの欠乏をともなう糖尿病マウスの視床下部および大脳皮質において,コレステロールの合成を制御する転写因子SREBP2とその下流遺伝子の発現が低下し,その結果,脳におけるコレステロール合成とシナプトソーム膜のコレステロール含量が低下することを明らかにした.この変化にはニューロンとグリア細胞の両者におけるインスリンの直接作用が寄与し,インスリンを糖尿病マウスの脳室に投与すると視床下部におけるコレステロール合成経路の抑制が正常化した.初代培養ニューロンにおいてSREBP2の発現を抑制するとシナプス形成のマーカーが減少し,マウスの視床下部でSREBP2の発現を抑制すると摂食量と体重が増加した.以上の結果は,インスリンおよび糖尿病が脳におけるコレステロールの代謝に影響することを示しており,糖尿病やほかの疾患でみられる神経学的な機能不全や代謝異常の発症機序に関与している可能性が考えられた.
糖尿病ではさまざまな臓器において炭水化物,脂質,タンパク質の代謝異常をきたし合併症をひき起こす.脳もその例外ではなく,糖尿病の発症ののちの急性期の精神状態の変容にはじまり,慢性的には加齢にともなう認知機能低下の加速1),うつ病の増加2),アルツハイマー病の罹患リスクの増大3),が認められる.
脳はもっともコレステロールが豊富な臓器であり,ヒト成人の場合,全身に存在するコレステロールの約25%が脳に局在する.血液脳関門のため血中から脳へのコレステロール取り込みはほとんどみられず,脳のコレステロールの95%以上は脳によって合成される4).先天性コレステロール代謝異常の多くは中枢神経症状を呈し,糖尿病との関連が指摘されるアルツハイマー病においてもっとも強力である遺伝的な危険因子は脳におけるコレステロール代謝に関連したAPOEε4対立遺伝子である5).脳におけるコレステロール代謝はミエリン合成に重要であるだけでなく,シナプスの形成やシナプス小胞のエキソサイトーシスへの関与が示唆されている6).
糖尿病モデルマウスでは記憶能やシナプス可塑性,グルタミン酸神経伝達などの障害が多数報告されている7).インスリン受容体ヘテロノックアウトマウスも認識能の低下をきたす8).さらに,インスリンの経鼻投与は血糖値への影響なしに糖尿病マウスの認知機能を改善させる9).しかし,糖尿病やインスリンが中枢神経の機能にあたえる数々の影響が指摘されているにもかかわらずその分子機構は不明である.この研究では,糖尿病が脳におけるコレステロール合成経路の抑制をきたし,シナプトソーム膜のコレステロール含量を減少させ神経機能の変化をもたらすことを示した.
視床下部は内分泌,食欲,エネルギーのバランス制御の主要な場である.糖尿病が視床下部の機能にあたえる影響を解明するため,ストレプトゾトシン投与により惹起したインスリン欠乏性糖尿病マウスの視床下部における遺伝子発現パターンをマイクロアレイにより解析した.GSEA(gene set enrichment analysis)法の結果,ストレプトゾトシン糖尿病マウスの視床下部でもっとも変動が大きい代謝経路としてコレステロール生合成経路が同定された.定量リアルタイムPCR法の結果,アセチルCoAからコレステロールを合成する経路をつかさどる大部分の遺伝子の発現が(律速酵素であるHMGCRをコードするmRNAの26%低下を含めて)7~36%の範囲で有意に低下していた.これらの低下はストレプトゾトシン糖尿病マウスに対しインスリンの皮下投与による治療を行うことですべて正常化した.細胞内のコレステロールの恒常性は転写因子SREBP2(sterol regulatory element-binding protein 2)により制御されている.定量リアルタイムPCR法の結果,ストレプトゾトシン糖尿病マウスの視床下部ではSREBP2をコードするSrebf2遺伝子mRNAの発現が34%低下していた.ウェスタンブロットの結果,転写因子として活性をもつ核型SREBP2および細胞質でのHMGCRなどがタンパク質レベルでも同様に低下していた.
脳におけるコレステロール合成経路の酵素の発現の低下は血中インスリンが減少する複数の糖尿病モデルマウスで観察される.自己免疫性1型糖尿病のモデルであるNODマウスや,肥満およびインスリン抵抗性と進行性膵β細胞障害を呈するC57Bl/Ksバックグラウンドdb/dbマウスの視床下部においても,Srebf2遺伝子および下流のコレステロール合成経路の遺伝子の発現がおよそ30%低下していた.対照的に,インスリン分泌に異常をきたさず高血糖の程度も軽度である高脂肪食負荷肥満マウスやob/obマウスの視床下部ではこのような異常は認めなかった.この結果は,肥満やインスリン抵抗性よりもむしろ血中インスリンの低下や著明な高血糖が脳におけるSREBP2の発現抑制に寄与していることを示唆していた.野生型マウスを24時間絶食させてインスリン値と血糖値を低下させた場合も視床下部のSrebf2遺伝子の発現が低下した.脳に特異的にインスリン受容体を欠損したマウスの視床下部でも同様にSrebf2遺伝子の発現が低下し絶食による変化はみられなかった.ストレプトゾトシン投与による糖尿病マウスにおけるSREBP2およびコレステロール合成経路の酵素の発現の低下は視床下部だけではなく大脳皮質においても同様にmRNAレベルおよびタンパク質レベルの両方で確認された.
糖尿病マウスの脳におけるコレステロール合成経路の抑制が著明な高血糖によるものかインスリン欠乏によるものかを明らかにするため,ストレプトゾトシン投与による糖尿病マウスにフロリジンを投与し強制的に尿糖排泄を増加させ,インスリン分泌能に影響をあたえず高血糖を是正したところ,血糖値の低下は視床下部におけるSREBP2および下流遺伝子の発現抑制をまったく改善しなかった.つぎに,インスリンの影響を評価するため,ストレプトゾトシン糖尿病マウスの脳室に直接にインスリンを投与した.この脳室へのインスリン投与は血糖値を改善しなかったが,視床下部におけるSREBP2および下流遺伝子の発現抑制をほぼ完全に正常化した.これらの結果は,高血糖ではなくインスリンの欠乏がストレプトゾトシン糖尿病マウスの脳におけるコレステロール合成経路の抑制のおもな原因であることを示していた.
糖尿病マウスの脳におけるコレステロール合成経路の遺伝子の発現低下が実際のコレステロール合成に影響するかどうかを評価するため,ストレプトゾトシン投与による糖尿病マウスに3H水を腹腔内投与し脳コレステロール画分への3Hの取り込みを測定した.糖尿病マウスの脳は対照マウスの脳と比較して生体内でのコレステロール合成が24%減少していた.ストレプトゾトシン投与後18日後の時点で脳全体のコレステロール含量は対照マウスと差を認めなかったが,代謝的に安定しているミエリン画分を除去してシナプトソーム膜におけるコレステロール含量を測定すると糖尿病マウスにおいて22%の有意な減少を認めた.糖尿病におけるコレステロール合成経路の広範な抑制はコレステロール合成の複数のステップに影響をあたえた.ストレプトゾトシン糖尿病マウスの脳においてコレステロール前駆体であるデスモステロール,ラソステロール,ラノステロールがそれぞれ26%,44%,60%減少していた.すなわち,糖尿病は脳においてコレステロールだけでなくドリコールやユビキノンなどイソプレノイドをはじめとするほかの重要な派生脂質産物の合成も同様に抑制する可能性が考えられた.
コレステロール合成を制御する因子と細胞種を決定するため,胎齢16日マウスの大脳から皮質ニューロン,生後1日齢マウスの大脳皮質からグリア細胞(アストロサイト)の初代培養を行いインスリンおよびグルコースで刺激した.いずれの細胞種においても6時間のインスリン刺激(10~100 nM)によってコレステロール合成経路の遺伝子の発現が30%から270%増加した.3日間の高濃度(25 mM)グルコース培養によってグリア細胞では一部の遺伝子の発現が低下したものの,ニューロンでは有意な変化は認めなかった.この結果は,さきに述べたin vivo実験の結果と合致して,高血糖ではなくインスリンの低下が糖尿病状態の脳におけるコレステロール合成経路の抑制のおもな原因であることを示唆した.
コレステロールはシナプスの構造,機能,生成にきわめて重要とされる.脳におけるコレステロール合成経路の遺伝子の発現抑制の影響を調べるため,SREBP2に対するshRNAとGFPをコードする遺伝子とを同時に発現するレンチウイルスベクターを作製した.このベクターを初代培養マウス海馬ニューロンに感染させSREBP2の発現をノックダウンしたところ,対照ベクターと比較して神経突起の後シナプスマーカーであるPSD95陽性部位の密度が40%減少した.同様に,シナプス小胞に存在しエキソサイトーシスに重要な前シナプスマーカーVAMP2の染色輝度が34%減少した.この結果は,ストレプトゾトシン投与による糖尿病マウスの海馬や大脳皮質でシナプスマーカーの減少を認めた報告9) に合致すると同時に,糖尿病とシナプス機能低下とのあいだにSREBP2の発現抑制が介在する可能性を示唆した.
脳におけるSREBP2の生理的な役割をin vivoで解明することを目的に,脳固定装置を用いてさきに述べたSREBP2に対するshRNAをコードするレンチウイルスベクターをC57Bl/6マウスの視床下部に直接に投与しSREBP2の発現をノックダウンした.対照ベクターと比較して,SREBP2の発現を視床下部で抑制したマウスは暗期の摂食量が14%増え1日の摂食量も有意に増加した.その結果,ベクター投与後21日間で対照群よりも有意に体重が増加した.視床下部の腹内側核ニューロンにおけるグルタミン酸の放出は低血糖時の拮抗ホルモンの分泌制御に重要とされる10).SREBP2の発現を視床下部で抑制したマウスは空腹時の循環血液中のノルアドレナリン濃度が34%減少し空腹時のインスリン値が有意に増加した.
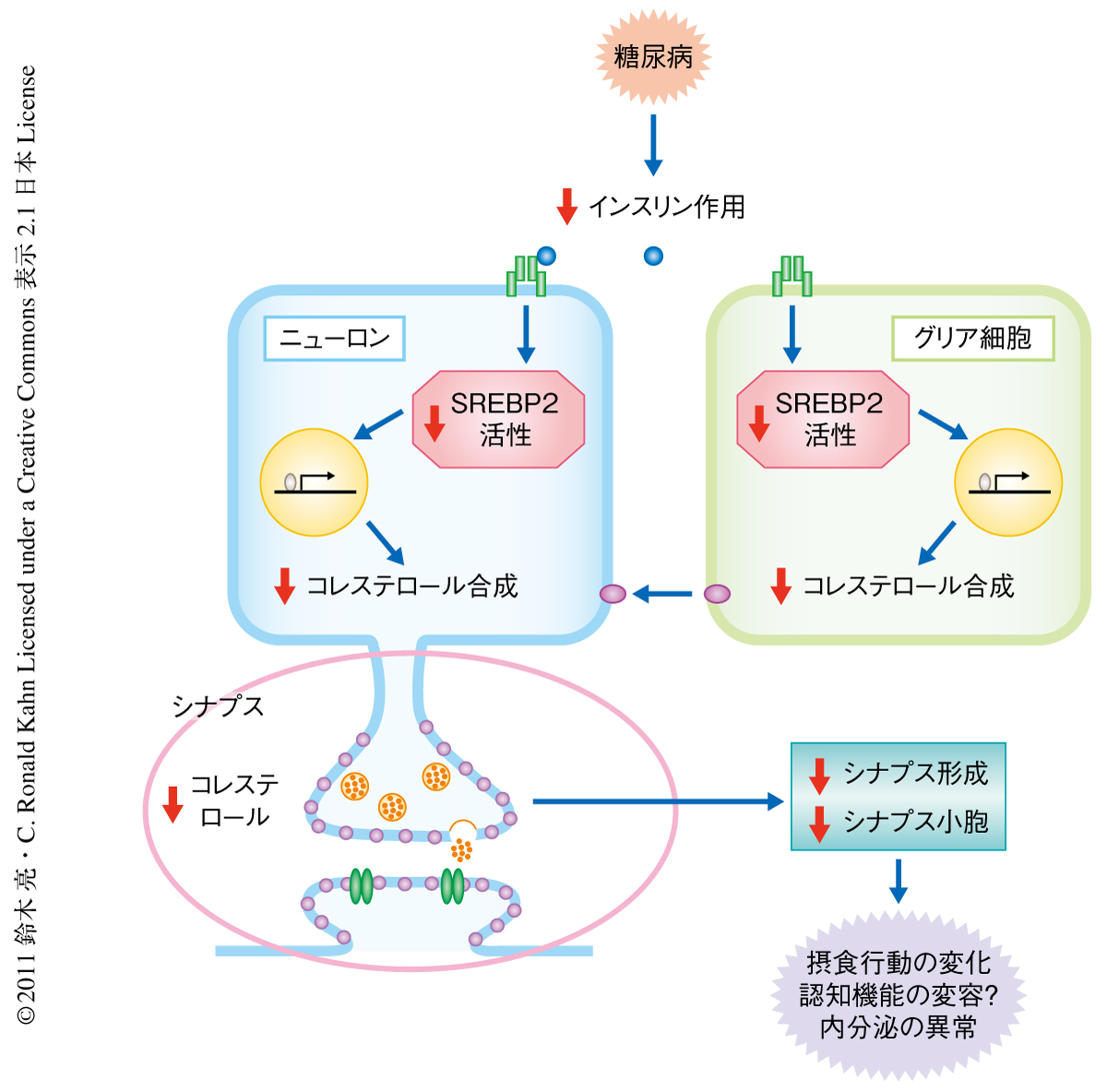
以上の結果から,筆者らは,糖尿病状態の脳機能の障害を説明する新たな分子機構としてインスリンによるコレステロール合成制御の破綻を介したモデルを提唱した(図1).糖尿病によるインスリン作用の減弱はニューロンとグリア細胞の両者においてSREBP2の活性低下をもたらす.その結果,コレステロールの合成が低下し,シナプス合成やシナプス小胞のエキソサイトーシスが障害されて,神経の興奮性や機能の異常をひき起こす.
略歴:2002年 東京大学大学院医学系研究科博士課程 修了(医学博士),2004年 東京大学医学部附属病院 助手,2005年 米国Harvard Medical Schoolリサーチフェローを経て,2010年より東京大学システム疾患生命科学による先端医療技術開発拠点 特任助教.
研究テーマ:中枢神経系におけるインスリンシグナル伝達経路の役割.糖尿病が中枢神経にあたえる影響.新規の食欲抑制物質の探索.
関心事:慢性全身疾患である糖尿病が患者の何をどう変えていくのか,全人的により深く理解したいと日々考えています.
C. Ronald Kahn
米国Harvard Medical SchoolにてMary K. Iacocca Professor of Medicine.
© 2011 鈴木 亮・C. Ronald Kahn Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Joslin Diabetes Center)
email:鈴木 亮
DOI: 10.7875/first.author.2011.006
Diabetes and insulin in regulation of brain cholesterol metabolism.
Ryo Suzuki, Kevin Lee, Enxuan Jing, Sudha B. Biddinger, Jeffrey G. McDonald, Thomas J. Montine, Suzanne Craft, C. Ronald Kahn
Cell Metabolism, 12, 567-579 (2010)
要 約
脳は全身でもっともコレステロールの豊富な臓器であり,脳のコレステロールの大部分は脳によって合成されている.筆者らは,インスリンの欠乏をともなう糖尿病マウスの視床下部および大脳皮質において,コレステロールの合成を制御する転写因子SREBP2とその下流遺伝子の発現が低下し,その結果,脳におけるコレステロール合成とシナプトソーム膜のコレステロール含量が低下することを明らかにした.この変化にはニューロンとグリア細胞の両者におけるインスリンの直接作用が寄与し,インスリンを糖尿病マウスの脳室に投与すると視床下部におけるコレステロール合成経路の抑制が正常化した.初代培養ニューロンにおいてSREBP2の発現を抑制するとシナプス形成のマーカーが減少し,マウスの視床下部でSREBP2の発現を抑制すると摂食量と体重が増加した.以上の結果は,インスリンおよび糖尿病が脳におけるコレステロールの代謝に影響することを示しており,糖尿病やほかの疾患でみられる神経学的な機能不全や代謝異常の発症機序に関与している可能性が考えられた.
はじめに
糖尿病ではさまざまな臓器において炭水化物,脂質,タンパク質の代謝異常をきたし合併症をひき起こす.脳もその例外ではなく,糖尿病の発症ののちの急性期の精神状態の変容にはじまり,慢性的には加齢にともなう認知機能低下の加速1),うつ病の増加2),アルツハイマー病の罹患リスクの増大3),が認められる.
脳はもっともコレステロールが豊富な臓器であり,ヒト成人の場合,全身に存在するコレステロールの約25%が脳に局在する.血液脳関門のため血中から脳へのコレステロール取り込みはほとんどみられず,脳のコレステロールの95%以上は脳によって合成される4).先天性コレステロール代謝異常の多くは中枢神経症状を呈し,糖尿病との関連が指摘されるアルツハイマー病においてもっとも強力である遺伝的な危険因子は脳におけるコレステロール代謝に関連したAPOEε4対立遺伝子である5).脳におけるコレステロール代謝はミエリン合成に重要であるだけでなく,シナプスの形成やシナプス小胞のエキソサイトーシスへの関与が示唆されている6).
糖尿病モデルマウスでは記憶能やシナプス可塑性,グルタミン酸神経伝達などの障害が多数報告されている7).インスリン受容体ヘテロノックアウトマウスも認識能の低下をきたす8).さらに,インスリンの経鼻投与は血糖値への影響なしに糖尿病マウスの認知機能を改善させる9).しかし,糖尿病やインスリンが中枢神経の機能にあたえる数々の影響が指摘されているにもかかわらずその分子機構は不明である.この研究では,糖尿病が脳におけるコレステロール合成経路の抑制をきたし,シナプトソーム膜のコレステロール含量を減少させ神経機能の変化をもたらすことを示した.
1.糖尿病マウスの視床下部ではコレステロール合成経路が抑制される
視床下部は内分泌,食欲,エネルギーのバランス制御の主要な場である.糖尿病が視床下部の機能にあたえる影響を解明するため,ストレプトゾトシン投与により惹起したインスリン欠乏性糖尿病マウスの視床下部における遺伝子発現パターンをマイクロアレイにより解析した.GSEA(gene set enrichment analysis)法の結果,ストレプトゾトシン糖尿病マウスの視床下部でもっとも変動が大きい代謝経路としてコレステロール生合成経路が同定された.定量リアルタイムPCR法の結果,アセチルCoAからコレステロールを合成する経路をつかさどる大部分の遺伝子の発現が(律速酵素であるHMGCRをコードするmRNAの26%低下を含めて)7~36%の範囲で有意に低下していた.これらの低下はストレプトゾトシン糖尿病マウスに対しインスリンの皮下投与による治療を行うことですべて正常化した.細胞内のコレステロールの恒常性は転写因子SREBP2(sterol regulatory element-binding protein 2)により制御されている.定量リアルタイムPCR法の結果,ストレプトゾトシン糖尿病マウスの視床下部ではSREBP2をコードするSrebf2遺伝子mRNAの発現が34%低下していた.ウェスタンブロットの結果,転写因子として活性をもつ核型SREBP2および細胞質でのHMGCRなどがタンパク質レベルでも同様に低下していた.
2.コレステロール合成経路はさまざまな糖尿病モデルの脳の全体で抑制されている
脳におけるコレステロール合成経路の酵素の発現の低下は血中インスリンが減少する複数の糖尿病モデルマウスで観察される.自己免疫性1型糖尿病のモデルであるNODマウスや,肥満およびインスリン抵抗性と進行性膵β細胞障害を呈するC57Bl/Ksバックグラウンドdb/dbマウスの視床下部においても,Srebf2遺伝子および下流のコレステロール合成経路の遺伝子の発現がおよそ30%低下していた.対照的に,インスリン分泌に異常をきたさず高血糖の程度も軽度である高脂肪食負荷肥満マウスやob/obマウスの視床下部ではこのような異常は認めなかった.この結果は,肥満やインスリン抵抗性よりもむしろ血中インスリンの低下や著明な高血糖が脳におけるSREBP2の発現抑制に寄与していることを示唆していた.野生型マウスを24時間絶食させてインスリン値と血糖値を低下させた場合も視床下部のSrebf2遺伝子の発現が低下した.脳に特異的にインスリン受容体を欠損したマウスの視床下部でも同様にSrebf2遺伝子の発現が低下し絶食による変化はみられなかった.ストレプトゾトシン投与による糖尿病マウスにおけるSREBP2およびコレステロール合成経路の酵素の発現の低下は視床下部だけではなく大脳皮質においても同様にmRNAレベルおよびタンパク質レベルの両方で確認された.
3.コレステロール合成制御におけるインスリンと高血糖の役割
糖尿病マウスの脳におけるコレステロール合成経路の抑制が著明な高血糖によるものかインスリン欠乏によるものかを明らかにするため,ストレプトゾトシン投与による糖尿病マウスにフロリジンを投与し強制的に尿糖排泄を増加させ,インスリン分泌能に影響をあたえず高血糖を是正したところ,血糖値の低下は視床下部におけるSREBP2および下流遺伝子の発現抑制をまったく改善しなかった.つぎに,インスリンの影響を評価するため,ストレプトゾトシン糖尿病マウスの脳室に直接にインスリンを投与した.この脳室へのインスリン投与は血糖値を改善しなかったが,視床下部におけるSREBP2および下流遺伝子の発現抑制をほぼ完全に正常化した.これらの結果は,高血糖ではなくインスリンの欠乏がストレプトゾトシン糖尿病マウスの脳におけるコレステロール合成経路の抑制のおもな原因であることを示していた.
4.糖尿病マウスの脳におけるコレステロール合成経路の抑制はシナプトソーム膜のコレステロールの減少をともなう
糖尿病マウスの脳におけるコレステロール合成経路の遺伝子の発現低下が実際のコレステロール合成に影響するかどうかを評価するため,ストレプトゾトシン投与による糖尿病マウスに3H水を腹腔内投与し脳コレステロール画分への3Hの取り込みを測定した.糖尿病マウスの脳は対照マウスの脳と比較して生体内でのコレステロール合成が24%減少していた.ストレプトゾトシン投与後18日後の時点で脳全体のコレステロール含量は対照マウスと差を認めなかったが,代謝的に安定しているミエリン画分を除去してシナプトソーム膜におけるコレステロール含量を測定すると糖尿病マウスにおいて22%の有意な減少を認めた.糖尿病におけるコレステロール合成経路の広範な抑制はコレステロール合成の複数のステップに影響をあたえた.ストレプトゾトシン糖尿病マウスの脳においてコレステロール前駆体であるデスモステロール,ラソステロール,ラノステロールがそれぞれ26%,44%,60%減少していた.すなわち,糖尿病は脳においてコレステロールだけでなくドリコールやユビキノンなどイソプレノイドをはじめとするほかの重要な派生脂質産物の合成も同様に抑制する可能性が考えられた.
5.インスリンは培養ニューロンおよびグリア細胞でコレステロール合成経路を活性化する
コレステロール合成を制御する因子と細胞種を決定するため,胎齢16日マウスの大脳から皮質ニューロン,生後1日齢マウスの大脳皮質からグリア細胞(アストロサイト)の初代培養を行いインスリンおよびグルコースで刺激した.いずれの細胞種においても6時間のインスリン刺激(10~100 nM)によってコレステロール合成経路の遺伝子の発現が30%から270%増加した.3日間の高濃度(25 mM)グルコース培養によってグリア細胞では一部の遺伝子の発現が低下したものの,ニューロンでは有意な変化は認めなかった.この結果は,さきに述べたin vivo実験の結果と合致して,高血糖ではなくインスリンの低下が糖尿病状態の脳におけるコレステロール合成経路の抑制のおもな原因であることを示唆した.
6.SREBP2の発現抑制は海馬ニューロンの前シナプスマーカーおよび後シナプスマーカーを減少させる
コレステロールはシナプスの構造,機能,生成にきわめて重要とされる.脳におけるコレステロール合成経路の遺伝子の発現抑制の影響を調べるため,SREBP2に対するshRNAとGFPをコードする遺伝子とを同時に発現するレンチウイルスベクターを作製した.このベクターを初代培養マウス海馬ニューロンに感染させSREBP2の発現をノックダウンしたところ,対照ベクターと比較して神経突起の後シナプスマーカーであるPSD95陽性部位の密度が40%減少した.同様に,シナプス小胞に存在しエキソサイトーシスに重要な前シナプスマーカーVAMP2の染色輝度が34%減少した.この結果は,ストレプトゾトシン投与による糖尿病マウスの海馬や大脳皮質でシナプスマーカーの減少を認めた報告9) に合致すると同時に,糖尿病とシナプス機能低下とのあいだにSREBP2の発現抑制が介在する可能性を示唆した.
7.視床下部におけるSREBP2の発現抑制は摂食行動と血中ホルモンに影響をあたえる
脳におけるSREBP2の生理的な役割をin vivoで解明することを目的に,脳固定装置を用いてさきに述べたSREBP2に対するshRNAをコードするレンチウイルスベクターをC57Bl/6マウスの視床下部に直接に投与しSREBP2の発現をノックダウンした.対照ベクターと比較して,SREBP2の発現を視床下部で抑制したマウスは暗期の摂食量が14%増え1日の摂食量も有意に増加した.その結果,ベクター投与後21日間で対照群よりも有意に体重が増加した.視床下部の腹内側核ニューロンにおけるグルタミン酸の放出は低血糖時の拮抗ホルモンの分泌制御に重要とされる10).SREBP2の発現を視床下部で抑制したマウスは空腹時の循環血液中のノルアドレナリン濃度が34%減少し空腹時のインスリン値が有意に増加した.
おわりに
以上の結果から,筆者らは,糖尿病状態の脳機能の障害を説明する新たな分子機構としてインスリンによるコレステロール合成制御の破綻を介したモデルを提唱した(図1).糖尿病によるインスリン作用の減弱はニューロンとグリア細胞の両者においてSREBP2の活性低下をもたらす.その結果,コレステロールの合成が低下し,シナプス合成やシナプス小胞のエキソサイトーシスが障害されて,神経の興奮性や機能の異常をひき起こす.
文 献
- Biessels, G. J., Deary, I. J. & Ryan, C. M.: Cognition and diabetes: a lifespan perspective. Lancet Neurol., 7, 184-190 (2008)[PubMed]
- Ali, S., Stone, M. A., Peters, J. L. et al.: The prevalence of co-morbid depression in adults with Type 2 diabetes: a systematic review and meta-analysis. Diabet Med., 23, 1165-1173 (2006)[PubMed]
- Craft, S. & Watson, G. S.: Insulin and neurodegenerative disease: shared and specific mechanisms. Lancet Neurol., 3, 169-178 (2004)[PubMed]
- Bjorkhem, I. & Meaney, S.: Brain cholesterol: long secret life behind a barrier. Arterioscler. Thromb. Vasc. Biol., 24, 806-815 (2004)[PubMed]
- Puglielli, L., Tanzi, R. E. & Kovacs, D. M.: Alzheimer's disease: the cholesterol connection. Nat. Neurosci., 6, 345-351 (2003)[PubMed]
- Thiele, C., Hannah, M. J., Fahrenholz, F. et al.: Cholesterol binds to synaptophysin and is required for biogenesis of synaptic vesicles. Nat. Cell Biol., 2, 42-49 (2000)[PubMed]
- Biessels, G. J. & Gispen, W. H.: The impact of diabetes on cognition: what can be learned from rodent models? Neurobiol. Aging, 26 (Suppl.1), 36-41 (2005)[PubMed]
- Das, P., Parsons, A. D., Scarborough, J. et al.: Electrophysiological and behavioral phenotype of insulin receptor defective mice. Physiol. Behav., 86, 287-296 (2005)[PubMed]
- Francis, G. J., Martinez, J. A., Liu, W. Q. et al.: Intranasal insulin prevents cognitive decline, cerebral atrophy and white matter changes in murine type I diabetic encephalopathy. Brain, 131, 3311-3334 (2008)[PubMed]
- Tong, Q., Ye, C., McCrimmon, R. J. et al.: Synaptic glutamate release by ventromedial hypothalamic neurons is part of the neurocircuitry that prevents hypoglycemia. Cell Metab., 5, 383-393 (2007)[PubMed]
著者プロフィール
略歴:2002年 東京大学大学院医学系研究科博士課程 修了(医学博士),2004年 東京大学医学部附属病院 助手,2005年 米国Harvard Medical Schoolリサーチフェローを経て,2010年より東京大学システム疾患生命科学による先端医療技術開発拠点 特任助教.
研究テーマ:中枢神経系におけるインスリンシグナル伝達経路の役割.糖尿病が中枢神経にあたえる影響.新規の食欲抑制物質の探索.
関心事:慢性全身疾患である糖尿病が患者の何をどう変えていくのか,全人的により深く理解したいと日々考えています.
C. Ronald Kahn
米国Harvard Medical SchoolにてMary K. Iacocca Professor of Medicine.
© 2011 鈴木 亮・C. Ronald Kahn Licensed under CC 表示 2.1 日本