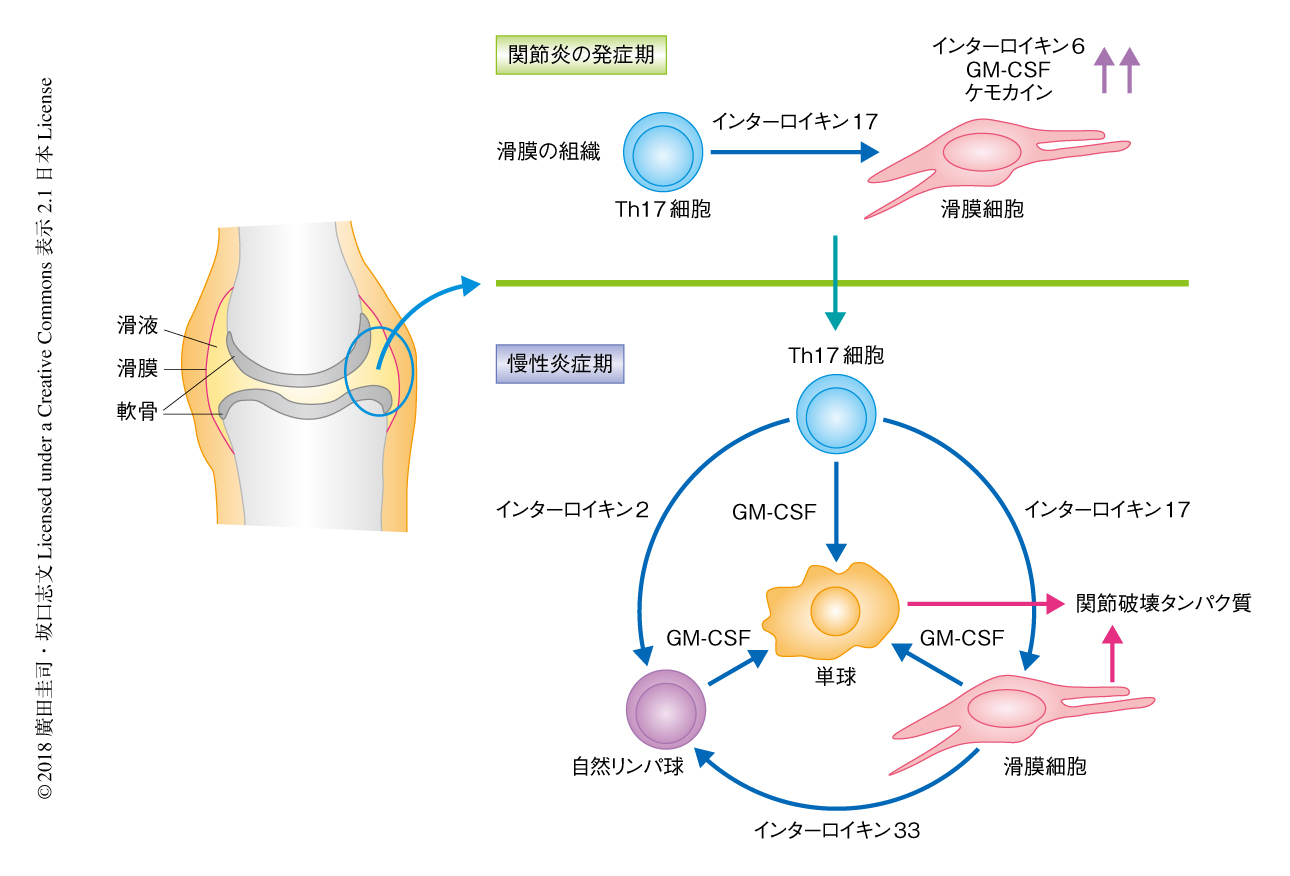
関節炎を惹起するTh17細胞は滑膜細胞および自然リンパ球によるGM-CSFの産生をひき起こし関節炎の発症および増悪を制御する
廣田圭司1・坂口志文2
(1京都大学ウイルス・再生医科学研究所 統合生体プロセス分野,2大阪大学免疫学フロンティア研究センター 実験免疫学)
email:廣田圭司
DOI: 10.7875/first.author.2018.061
Autoimmune Th17 cells induced synovial stromal and innate lymphoid cell secretion of the cytokine GM-CSF to initiate and augment autoimmune arthritis.
Keiji Hirota, Motomu Hashimoto, Yoshinaga Ito, Mayumi Matsuura, Hiromu Ito, Masao Tanaka, Hitomi Watanabe, Gen Kondoh, Atsushi Tanaka, Keiko Yasuda, Manfred Kopf, Alexandre J. Potocnik, Brigitta Stockinger, Noriko Sakaguchi, Shimon Sakaguchi
Immunity, 48, 1220-1232.e5 (2018)
Th17細胞が自己免疫疾患に関与することが明らかにされてきたが,それぞれの自己免疫疾患において標的となる組織をどのように傷害するのか,炎症を起こした組織において炎症に関連するほかの細胞とどのように相互作用するのかについてはくわしくわかっていない.この研究において,筆者らは,自己免疫性の関節炎を自然発症するモデルマウスを用い,関節炎を惹起するTh17細胞が関節の滑膜細胞からのGM-CSFの産生をひき起こし関節炎を惹起すること,炎症を起こした関節において自然リンパ球が活性化し増殖していることを見い出した.活性化した自然リンパ球はインターロイキン2,インターロイキン33,TLR9のリガンドによる刺激によりGM-CSFを多く産生した.滑膜細胞あるいは自然リンパ球によるGM-CSFの産生を選択的に欠損させることにより関節炎の発症は抑制された.また,Th17細胞から産生されるGM-CSFは関節炎の発症には必要なく,関節炎の増悪に関与した.関節リウマチの患者の滑膜液においてもGM-CSFを産生する自然リンパ球が増加していた.したがって,Th17細胞,滑膜細胞,自然リンパ球による炎症性サイトカインの産生による炎症カスケードの形成が自己免疫性の関節炎の発症および増悪において重要であり,これらの経路を標的とする新規の治療法の開発が期待される.
炎症性サイトカインは自己免疫疾患を代表とする炎症性疾患の発症および維持において重要である.関節リウマチは全身性の炎症性疾患であり,TNF,インターロイキン1,インターロイキン6などの炎症性サイトカインが病態および病理の形成に中心的な役割をはたす.自己反応性のT細胞が炎症を起こした滑膜細胞を刺激することが関節の破壊にいたる炎症細胞のあいだの相互作用のひとつである1).臨床的にも,TNF阻害剤,インターロイキン6阻害剤,インターロイキン17阻害剤は関節リウマチや乾癬の治療薬として使われ,非常に高い効果を示す2).最近の自己免疫疾患を対象としたゲノムワイド関連解析においても,さまざまな自己免疫疾患に共通して関連する遺伝子は炎症性サイトカインおよびその受容体をコードする遺伝子であることが明らかにされている3).しかし,炎症性サイトカインが炎症を起こした組織においてどのように免疫細胞および組織の細胞を制御するのか,環境因子や遺伝要因はどのように炎症に関与するのか,自己免疫疾患を治療するにはサイトカインに依存性の炎症経路をどのように標的とすればよいのか,くわしくはわかっていない.この研究において,筆者らは,関節炎を惹起するT細胞が炎症の局所の細胞やサイトカインネットワークをどのように刺激し,組織に炎症を惹起し増悪させるかについて検討した.
GM-CSF(granulocyte macrophage colony-stimulating factor:顆粒球単球コロニー刺激因子)は樹状細胞やマクロファージの活性化に重要な炎症性サイトカインであり4),実験的自己免疫性脳脊髄炎の惹起においてはTh17細胞の産生するGM-CSFが鍵となる5,6).Th17細胞に依存性の関節リウマチのモデルマウスであるSKGマウスを用いて7,8),GM-CSFの自己免疫性の関節炎に対する寄与,産生細胞,その制御機構について検討したところ.これまでの報告と一致して,関節炎の局所のTh17細胞はGM-CSFを多く産生することが確認され,GM-CSFを欠損したSKGマウスはマンナンの投与による関節炎の惹起に対し抵抗性を示した.一方,SKGマウスに由来するCD4陽性T細胞をRAG2ノックアウトマウスに移入することにより関節炎の惹起が可能であるが,GM-CSFを欠損したCD4陽性T細胞の移入によっても同様に関節炎が惹起され,自己免疫性の関節炎のモデルマウスにおいてはTh17細胞の産生するGM-CSFは炎症の強さには関与するが発症にかかわらなかった.これらの結果から,T細胞以外の細胞が産生するGM-CSFが関節炎の発症により強く関与することが示唆された.
実験的自己免疫性脳脊髄炎とは対照的な結果として,GM-CSFを産生するSKGマウスに由来するCD4陽性T細胞をGM-CSFを欠損したRAG2ノックアウトマウスに移入したところ,移入されたT細胞のTh17細胞への分化およびGM-CSFの産生能については正常であったにもかかわらず,関節炎はまったく発症しなかった.したがって,関節炎の発症にはT細胞以外の細胞の産生するGM-CSFがむしろ必須であることが明らかにされた.
炎症を起こした滑膜細胞はGM-CSFを産生する細胞の候補と考えられた.SKGマウスの炎症を起こした関節から滑膜細胞を分離しインターロイキン17により刺激したところ,刺激ののち1~3時間以内に,GM-CSFをコードするCsf2遺伝子のほか,Ccl20遺伝子,Cxcl1遺伝子,Cxcl5遺伝子,Il6遺伝子,Nfkbiz遺伝子,Lif遺伝子,Zc3h12a遺伝子のmRNAについて発現の上昇が認められ,滑膜細胞はGM-CSFを産生する細胞のひとつであることが明らかにされた.
炎症を起こした関節に浸潤した免疫細胞をソーティングし定量的PCR法によりCsf2遺伝子を発現する細胞を探索した.その結果,CD45陽性の血球系細胞のなかでGM-CSFを発現していたのはT細胞および自然リンパ球であった.自然リンパ球は通常は腸管や肺などの粘膜の組織に常在する免疫細胞である.予想に反して,自然リンパ球は炎症を起こすまえの正常な関節に常在しており,関節炎の発症により増殖することが見い出された.さらに,滑膜の自然リンパ球の表現型は2型自然リンパ球に類似していた.これら滑膜の自然リンパ球はインターロイキン13およびGM-CSFを産生し,GM-CSFの発現を誘導する転写因子をコードするBhlhe40遺伝子の発現も認められた.関節炎の惹起にはたす自然リンパ球の役割について調べるため,関節炎をひき起こす際に自然リンパ球を特異的に除去したところ,関節炎の重症度が有意に抑制された.
滑膜細胞および自然リンパ球の産生するGM-CSFが関節炎の発症および増悪に関与するかどうか明らかにするため,滑膜細胞あるいは自然リンパ球によるGM-CSFの産生を特異的に欠損する骨髄キメラマウスを作製し関節炎をひき起こした.その結果,滑膜細胞においてGM-CSFが欠損することにより関節炎の発症そのものが抑制され,自然リンパ球においてGM-CSFが欠損することにより慢性炎症期における増悪が抑制された.したがって,滑膜細胞および自然リンパ球の産生するGM-CSFは関節炎の発症および増悪に相乗的に関与することが明らかにされた.
インターロイキン2,インターロイキン7,インターロイキン33が2型自然リンパ球の機能を制御することが知られていることから9),これらが滑膜の自然リンパ球によるGM-CSFの産生にかかわるかどうか検討した.その結果,インターロイキン33の産生量は健常な関節に比べ炎症を起こした関節において有意に増加しており,インターロイキン2は活性化したTh17細胞から供給されていた.滑膜の自然リンパ球をソーティングし,インターロイキン2,インターロイキン7,インターロイキン33により単独あるいは組合せで刺激したところ,インターロイキン33の刺激によりGM-CSFの産生が起こり,インターロイキン2とインターロイキン33の組合せの刺激によりGM-CSFの産生が相乗的に増加した.
近年,ヒトの自然リンパ球においてToll様受容体(Toll-like receptor:TLR)の発現が報告されていることから10),滑膜の自然リンパ球の発現するToll様受容体を定量的PCR法により評価した.その結果,滑膜の自然リンパ球はTLR2,TLR3,TLR4,TLR9を選択的に発現しており,機能的には,これらTLRのリガンドによる単独の刺激ではGM-CSFを産生しなかった.しかし,インターロイキン33とTLR9のリガンドの組合せの刺激により滑膜の自然リンパ球からのGM-CSFの産生が増加した.これらの結果から,滑膜の自然リンパ球はインターロイキン2,インターロイキン33,TLR9のリガンドに応答してGM-CSFを産生し関節炎の増悪に関与することが示唆された.
関節リウマチの患者および変形性膝関節症の患者の末梢血および滑膜液に存在する自然リンパ球を解析した.関節リウマチの患者の滑膜液における自然リンパ球の存在頻度は,変形性膝関節症の患者の滑膜液および末梢血に比べ有意に高く,サイトカインの産生能についても,GM-CSFを産生する自然リンパ球が有意に増加していた.関節リウマチの患者の滑膜液に含まれるGM-CSFの産生細胞はT細胞,マクロファージ,自然リンパ球であり,おのおのの細胞がそれぞれのGM-CSFの産生機構をはたらかせ関節炎の増悪に寄与するものと考えられた.
この研究において,関節炎を惹起するTh17細胞が滑膜細胞および自然リンパ球と炎症カスケードを形成し関節炎の発症および増悪を制御することが明らかにされた(図1).それぞれの関節炎の局所におけるGM-CSFの産生機構は,Th17細胞による自己抗原の認識,滑膜細胞による炎症性サイトカインの刺激,自然リンパ球によるインターロイキン33および内在性のTLR9のリガンドなどの傷害関連分子パターンの刺激であると考えられる.関節リウマチの患者の滑膜液には多量のGM-CSFが含まれており11),治療の標的として期待されている.現在,関節リウマチの患者に対しGM-CSF阻害剤を使った臨床治験が進んでおり,高い有効性が示されている12).さまざまなステージにおいて組織における炎症を的確に制御するため,将来的には,Th17細胞,滑膜細胞,自然リンパ球などのおのおのの細胞が産生するGM-CSFを特異的に標的とする免疫学的な制御法の開発が必要とされる.
略歴:2012年 大阪大学免疫学フロンティア研究センター 特任准教授を経て,2015年より京都大学ウイルス・再生医科学研究所 准教授.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://exp.immunol.ifrec.osaka-u.ac.jp/
© 2018 廣田圭司・坂口志文 Licensed under CC 表示 2.1 日本
(1京都大学ウイルス・再生医科学研究所 統合生体プロセス分野,2大阪大学免疫学フロンティア研究センター 実験免疫学)
email:廣田圭司
DOI: 10.7875/first.author.2018.061
Autoimmune Th17 cells induced synovial stromal and innate lymphoid cell secretion of the cytokine GM-CSF to initiate and augment autoimmune arthritis.
Keiji Hirota, Motomu Hashimoto, Yoshinaga Ito, Mayumi Matsuura, Hiromu Ito, Masao Tanaka, Hitomi Watanabe, Gen Kondoh, Atsushi Tanaka, Keiko Yasuda, Manfred Kopf, Alexandre J. Potocnik, Brigitta Stockinger, Noriko Sakaguchi, Shimon Sakaguchi
Immunity, 48, 1220-1232.e5 (2018)
要 約
Th17細胞が自己免疫疾患に関与することが明らかにされてきたが,それぞれの自己免疫疾患において標的となる組織をどのように傷害するのか,炎症を起こした組織において炎症に関連するほかの細胞とどのように相互作用するのかについてはくわしくわかっていない.この研究において,筆者らは,自己免疫性の関節炎を自然発症するモデルマウスを用い,関節炎を惹起するTh17細胞が関節の滑膜細胞からのGM-CSFの産生をひき起こし関節炎を惹起すること,炎症を起こした関節において自然リンパ球が活性化し増殖していることを見い出した.活性化した自然リンパ球はインターロイキン2,インターロイキン33,TLR9のリガンドによる刺激によりGM-CSFを多く産生した.滑膜細胞あるいは自然リンパ球によるGM-CSFの産生を選択的に欠損させることにより関節炎の発症は抑制された.また,Th17細胞から産生されるGM-CSFは関節炎の発症には必要なく,関節炎の増悪に関与した.関節リウマチの患者の滑膜液においてもGM-CSFを産生する自然リンパ球が増加していた.したがって,Th17細胞,滑膜細胞,自然リンパ球による炎症性サイトカインの産生による炎症カスケードの形成が自己免疫性の関節炎の発症および増悪において重要であり,これらの経路を標的とする新規の治療法の開発が期待される.
はじめに
炎症性サイトカインは自己免疫疾患を代表とする炎症性疾患の発症および維持において重要である.関節リウマチは全身性の炎症性疾患であり,TNF,インターロイキン1,インターロイキン6などの炎症性サイトカインが病態および病理の形成に中心的な役割をはたす.自己反応性のT細胞が炎症を起こした滑膜細胞を刺激することが関節の破壊にいたる炎症細胞のあいだの相互作用のひとつである1).臨床的にも,TNF阻害剤,インターロイキン6阻害剤,インターロイキン17阻害剤は関節リウマチや乾癬の治療薬として使われ,非常に高い効果を示す2).最近の自己免疫疾患を対象としたゲノムワイド関連解析においても,さまざまな自己免疫疾患に共通して関連する遺伝子は炎症性サイトカインおよびその受容体をコードする遺伝子であることが明らかにされている3).しかし,炎症性サイトカインが炎症を起こした組織においてどのように免疫細胞および組織の細胞を制御するのか,環境因子や遺伝要因はどのように炎症に関与するのか,自己免疫疾患を治療するにはサイトカインに依存性の炎症経路をどのように標的とすればよいのか,くわしくはわかっていない.この研究において,筆者らは,関節炎を惹起するT細胞が炎症の局所の細胞やサイトカインネットワークをどのように刺激し,組織に炎症を惹起し増悪させるかについて検討した.
1.Th17細胞が産生するGM-CSFは関節炎の発症に必要ではない
GM-CSF(granulocyte macrophage colony-stimulating factor:顆粒球単球コロニー刺激因子)は樹状細胞やマクロファージの活性化に重要な炎症性サイトカインであり4),実験的自己免疫性脳脊髄炎の惹起においてはTh17細胞の産生するGM-CSFが鍵となる5,6).Th17細胞に依存性の関節リウマチのモデルマウスであるSKGマウスを用いて7,8),GM-CSFの自己免疫性の関節炎に対する寄与,産生細胞,その制御機構について検討したところ.これまでの報告と一致して,関節炎の局所のTh17細胞はGM-CSFを多く産生することが確認され,GM-CSFを欠損したSKGマウスはマンナンの投与による関節炎の惹起に対し抵抗性を示した.一方,SKGマウスに由来するCD4陽性T細胞をRAG2ノックアウトマウスに移入することにより関節炎の惹起が可能であるが,GM-CSFを欠損したCD4陽性T細胞の移入によっても同様に関節炎が惹起され,自己免疫性の関節炎のモデルマウスにおいてはTh17細胞の産生するGM-CSFは炎症の強さには関与するが発症にかかわらなかった.これらの結果から,T細胞以外の細胞が産生するGM-CSFが関節炎の発症により強く関与することが示唆された.
2.滑膜細胞および自然リンパ球から産生されるGM-CSFが関節炎の発症および増悪に重要である
実験的自己免疫性脳脊髄炎とは対照的な結果として,GM-CSFを産生するSKGマウスに由来するCD4陽性T細胞をGM-CSFを欠損したRAG2ノックアウトマウスに移入したところ,移入されたT細胞のTh17細胞への分化およびGM-CSFの産生能については正常であったにもかかわらず,関節炎はまったく発症しなかった.したがって,関節炎の発症にはT細胞以外の細胞の産生するGM-CSFがむしろ必須であることが明らかにされた.
炎症を起こした滑膜細胞はGM-CSFを産生する細胞の候補と考えられた.SKGマウスの炎症を起こした関節から滑膜細胞を分離しインターロイキン17により刺激したところ,刺激ののち1~3時間以内に,GM-CSFをコードするCsf2遺伝子のほか,Ccl20遺伝子,Cxcl1遺伝子,Cxcl5遺伝子,Il6遺伝子,Nfkbiz遺伝子,Lif遺伝子,Zc3h12a遺伝子のmRNAについて発現の上昇が認められ,滑膜細胞はGM-CSFを産生する細胞のひとつであることが明らかにされた.
炎症を起こした関節に浸潤した免疫細胞をソーティングし定量的PCR法によりCsf2遺伝子を発現する細胞を探索した.その結果,CD45陽性の血球系細胞のなかでGM-CSFを発現していたのはT細胞および自然リンパ球であった.自然リンパ球は通常は腸管や肺などの粘膜の組織に常在する免疫細胞である.予想に反して,自然リンパ球は炎症を起こすまえの正常な関節に常在しており,関節炎の発症により増殖することが見い出された.さらに,滑膜の自然リンパ球の表現型は2型自然リンパ球に類似していた.これら滑膜の自然リンパ球はインターロイキン13およびGM-CSFを産生し,GM-CSFの発現を誘導する転写因子をコードするBhlhe40遺伝子の発現も認められた.関節炎の惹起にはたす自然リンパ球の役割について調べるため,関節炎をひき起こす際に自然リンパ球を特異的に除去したところ,関節炎の重症度が有意に抑制された.
滑膜細胞および自然リンパ球の産生するGM-CSFが関節炎の発症および増悪に関与するかどうか明らかにするため,滑膜細胞あるいは自然リンパ球によるGM-CSFの産生を特異的に欠損する骨髄キメラマウスを作製し関節炎をひき起こした.その結果,滑膜細胞においてGM-CSFが欠損することにより関節炎の発症そのものが抑制され,自然リンパ球においてGM-CSFが欠損することにより慢性炎症期における増悪が抑制された.したがって,滑膜細胞および自然リンパ球の産生するGM-CSFは関節炎の発症および増悪に相乗的に関与することが明らかにされた.
3.滑膜の自然リンパ球によるGM-CSFの産生の制御機構
インターロイキン2,インターロイキン7,インターロイキン33が2型自然リンパ球の機能を制御することが知られていることから9),これらが滑膜の自然リンパ球によるGM-CSFの産生にかかわるかどうか検討した.その結果,インターロイキン33の産生量は健常な関節に比べ炎症を起こした関節において有意に増加しており,インターロイキン2は活性化したTh17細胞から供給されていた.滑膜の自然リンパ球をソーティングし,インターロイキン2,インターロイキン7,インターロイキン33により単独あるいは組合せで刺激したところ,インターロイキン33の刺激によりGM-CSFの産生が起こり,インターロイキン2とインターロイキン33の組合せの刺激によりGM-CSFの産生が相乗的に増加した.
近年,ヒトの自然リンパ球においてToll様受容体(Toll-like receptor:TLR)の発現が報告されていることから10),滑膜の自然リンパ球の発現するToll様受容体を定量的PCR法により評価した.その結果,滑膜の自然リンパ球はTLR2,TLR3,TLR4,TLR9を選択的に発現しており,機能的には,これらTLRのリガンドによる単独の刺激ではGM-CSFを産生しなかった.しかし,インターロイキン33とTLR9のリガンドの組合せの刺激により滑膜の自然リンパ球からのGM-CSFの産生が増加した.これらの結果から,滑膜の自然リンパ球はインターロイキン2,インターロイキン33,TLR9のリガンドに応答してGM-CSFを産生し関節炎の増悪に関与することが示唆された.
4.関節リウマチの患者の滑膜液にもGM-CSFを産生する自然リンパ球が存在する
関節リウマチの患者および変形性膝関節症の患者の末梢血および滑膜液に存在する自然リンパ球を解析した.関節リウマチの患者の滑膜液における自然リンパ球の存在頻度は,変形性膝関節症の患者の滑膜液および末梢血に比べ有意に高く,サイトカインの産生能についても,GM-CSFを産生する自然リンパ球が有意に増加していた.関節リウマチの患者の滑膜液に含まれるGM-CSFの産生細胞はT細胞,マクロファージ,自然リンパ球であり,おのおのの細胞がそれぞれのGM-CSFの産生機構をはたらかせ関節炎の増悪に寄与するものと考えられた.
おわりに
この研究において,関節炎を惹起するTh17細胞が滑膜細胞および自然リンパ球と炎症カスケードを形成し関節炎の発症および増悪を制御することが明らかにされた(図1).それぞれの関節炎の局所におけるGM-CSFの産生機構は,Th17細胞による自己抗原の認識,滑膜細胞による炎症性サイトカインの刺激,自然リンパ球によるインターロイキン33および内在性のTLR9のリガンドなどの傷害関連分子パターンの刺激であると考えられる.関節リウマチの患者の滑膜液には多量のGM-CSFが含まれており11),治療の標的として期待されている.現在,関節リウマチの患者に対しGM-CSF阻害剤を使った臨床治験が進んでおり,高い有効性が示されている12).さまざまなステージにおいて組織における炎症を的確に制御するため,将来的には,Th17細胞,滑膜細胞,自然リンパ球などのおのおのの細胞が産生するGM-CSFを特異的に標的とする免疫学的な制御法の開発が必要とされる.
文 献
- Bartok, B. & Firestein, G. S.: Fibroblast-like synoviocytes: key effector cells in rheumatoid arthritis. Immunol. Rev., 233, 233-255 (2010)[PubMed]
- Cho, J. H. & Feldman, M.: Heterogeneity of autoimmune diseases: pathophysiologic insights from genetics and implications for new therapies. Nat. Med., 21, 730-738 (2015)[PubMed]
- Parkes, M., Cortes, A., van Heel, D. A. et al.: Genetic insights into common pathways and complex relationships among immunemediated diseases. Nat. Rev. Genet., 14, 661-673 (2013)[PubMed]
- Sonderegger, I., Iezzi, G., Maier, R. et al.: GM-CSF mediates autoimmunity by enhancing IL-6-dependent Th17 cell development and survival. J. Exp. Med., 205, 2281-2294 (2008)[PubMed]
- Codarri, L., Gyulveszi, G., Tosevski, V. et al.: RORγt drives production of the cytokine GM-CSF in helper T cells, which is essential for the effector phase of autoimmune neuroinflammation. Nat. Immunol., 12, 560-567 (2011)[PubMed]
- El-Behi, M., Ciric, B., Dai, H. et al.: The encephalitogenicity of TH17 cells is dependent on IL-1- and IL-23-induced production of the cytokine GM-CSF. Nat. Immunol., 12, 568-575 (2011)[PubMed]
- Sakaguchi, N., Takahashi, T., Hata, H. et al.: Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature, 426, 454-460 (2003)[PubMed]
- Hirota, K., Hashimoto, M., Yoshitomi, H. et al.: T cell self-reactivity forms a cytokine milieu for spontaneous development of IL-17+ Th cells that cause autoimmune arthritis. J. Exp. Med., 204, 41-47 (2007)[PubMed]
- Klose, C. S., & Artis, D.: Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis. Nat. Immunol., 17, 765-774 (2016)[PubMed]
- Crellin, N. K., Trifari, S., Kaplan, C. D. et al.: Regulation of cytokine secretion in human CD127+ LTi-like innate lymphoid cells by Toll-like receptor 2. Immunity, 33, 752-764 (2010)[PubMed]
- Alvaro-Gracia, J. M., Zvaifler, N. J. & Firestein, G. S.: Cytokines in chronic inflammatory arthritis. IV. Granulocyte/macrophage colony-stimulating factor-mediated induction of class II MHC antigen on human monocytes: a possible role in rheumatoid arthritis. J. Exp. Med., 170, 865-875 (1989)[PubMed]
- Behrens, F., Tak, P. P., Ostergaard, M. et al.: MOR103, a human monoclonal antibody to granulocyte-macrophage colony-stimulating factor, in the treatment of patients with moderate rheumatoid arthritis: results of a phase Ib/IIa randomised, double-blind, placebo-controlled, dose-escalation trial. Ann. Rheum. Dis., 74, 1058-1064 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 大阪大学免疫学フロンティア研究センター 特任准教授を経て,2015年より京都大学ウイルス・再生医科学研究所 准教授.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://exp.immunol.ifrec.osaka-u.ac.jp/
© 2018 廣田圭司・坂口志文 Licensed under CC 表示 2.1 日本