Hsp70シャペロン系およびHsp90シャペロン系は異なる役割をもちながらも協調してArgonauteを活性のある構造へと変化させる
坪山幸太郎・泊 幸秀
(東京大学定量生命科学研究所 RNA機能研究分野)
email:坪山幸太郎,泊 幸秀
DOI: 10.7875/first.author.2018.058
Conformational activation of Argonaute by distinct yet coordinated actions of the Hsp70 and Hsp90 chaperone systems.
Kotaro Tsuboyama, Hisashi Tadakuma, Yukihide Tomari
Molecular Cell, 70, 722-729.e4 (2018)
RNAサイレンシング機構の中核をなすArgonauteへの小分子RNAの積み込みはHsp70シャペロン系およびHsp90シャペロン系を必要とする.この2つのシャペロン系は数百あるとされる基質タンパク質の活性化にも必要であるが,その際,基質タンパク質の構造にどのような変化が生じるかは不明であった.この研究において,筆者らは,Argonauteの活性化の過程における構造の変化をFRET法を用いた1分子観察により追跡した.単体のArgonauteはさまざまな閉じた構造をとっていたが,Hsp70シャペロン系およびHsp90シャペロン系の両方が存在する場合には活性のある大きく開いた構造へと変化した.Hsp70シャペロン系は単独でAgoを一部が開いた活性のある構造へと変化させたが,Hsp90シャペロン系は単独では構造を変化させなかった.その代わりに,Hsp90シャペロン系は,Hsp70シャペロン系により開いた構造にされたArgonauteを安定化させた.以上のことから,Hsp70シャペロン系が基質タンパク質の構造の多様性を拡張し,Hsp90シャペロン系が活性のある構造を特異的にとらえて安定化させるという,2つのシャペロン系が異なる役割をもちながらも協調して基質タンパク質を活性化するしくみが示唆された.
Hsp70シャペロン系およびHsp90シャペロン系はステロイドホルモン受容体やキナーゼなど数百もの基質タンパク質の機能的な活性化に必須である1).Hsp70およびHsp90はともにATPを加水分解する活性をもち,ATPのエネルギーを使って基質タンパク質の構造変化をひき起こし活性化すると考えられている.
Argonaute(Ago)は小分子RNAによるRNAサイレンシング機構の中核を担うタンパク質であり,小分子RNAとともにRISC(RNA-induced silencing complex)という複合体を形成する.ステロイドホルモンがステロイド受容体に結合する際と同様に,Agoが小分子RNAを積み込む際にはHsp70シャペロン系およびHsp90シャペロン系が必要である2)(新着論文レビュー でも掲載).さらに,以前,筆者らの研究グループは,1分子解析によりHsp70シャペロン系およびHsp90シャペロン系が小分子RNAとAgoとの相互作用の時間を延長させることを報告した3)(新着論文レビュー でも掲載).しかし,Hsp70シャペロン系およびHsp90シャペロン系がAgoを含む基質タンパク質を活性化する際,基質タンパク質に具体的にどのような変化をもたらすのかについてはわかっていなかった.このような問いに答えるため,筆者らは,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)法を用いた1分子観察によりAgoの構造変化を直接おいかけた.
なお,AgoによるRNAサイレンシングの構造基盤については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001 (2012) も参照されたい.
分子シャペロンあるいは小分子RNAの取り込みによりAgoにどのような構造変化が生じるかについてFRET法を用いて1分子観察により明らかにするには,2つの大きな課題があった.1つ目は,小分子RNAを含まない“空の”Agoの調製である.たとえば,ヒトのAgo2を精製した際にはその発現に用いた宿主の内在性の小分子RNAがすでに積み込まれており,空のAgoの画分は少ないことが示されている4,5).この問題を解決し空のAgoを高効率で調製するために,ショウジョウバエのAgo2の特性を利用した.具体的には,ヒトAgo2の小分子RNAの積み込みは分子シャペロンがあれば必要十分であるが6),ショウジョウバエAgo2への小分子RNAの積み込みは分子シャペロンのほか昆虫に特異的なDicer-2-R2D2ヘテロ二量体を必要とする3).この特性を利用して,Dicer-2およびR2D2をもたないヒトHEK293T細胞においてショウジョウバエAgo2を異所的に発現させたところ,空のショウジョウバエAgo2が高効率で調製された.
2つ目は,特異的なアミノ酸残基への蛍光色素の導入である.FRET法を用いた1分子観察には一般にシステイン-マレイミド反応を用いた蛍光色素の導入が用いられるが,この方法を利用するには蛍光色素の導入を意図する部位以外のシステイン残基をすべてほかのアミノ酸残基に置換する必要がある.ショウジョウバエAgo2には16個ものシステイン残基が含まれるため,遺伝暗号の拡張による非天然アミノ酸残基の導入を用いた7).非天然アミノ酸残基の導入にはin vitro翻訳系を用いる方法と細胞などを用いてin vivoにおいて導入する方法の2つがある.in vitro翻訳系を用いる方法は人工的にアミノアシル化されたtRNAを用いる必要があるが,少なくとも試したかぎりではアミノアシル化tRNAの不安定性が問題になった.in vivoにおいて導入する方法においては,終止コドンのひとつアンバーコドンを認識するtRNA,非天然アミノ酸残基およびアンバーコドンtRNAを認識するアミノアシルtRNA合成酵素,非天然アミノ酸残基の導入を意図する位置のコドンをアンバーコドンへと置換した目的タンパク質をコードしたプラスミドを細胞に導入し,非天然アミノ酸の存在下で培養することにより非天然アミノ酸残基が導入された目的タンパク質を合成する.さらに,この非天然アミノ酸残基に対し特異的な反応を起こす官能基のついた蛍光色素を,この非天然アミノ酸残基が導入された目的タンパク質と反応させることにより,アミノ酸残基に特異的に蛍光色素を導入することが可能になる.具体的には,近年,開発されたピロリシニルtRNA合成酵素を用いたが,そのままでは非天然アミノ酸残基の導入の効率が悪かった.そこで,アミノアシルtRNA合成酵素に核外移行シグナルを導入する8),終止コドンを認識する翻訳終結因子のひとつであるeRF1のドミナントネガティブ体を過剰発現する9),などのくふうにより,非天然アミノ酸残基の導入の効率を向上させた.このような検討をつうじて,2箇所の特異的なアミノ酸残基に高効率で蛍光色素を導入する系が構築された.
AgoはNドメイン,PAZドメイン,MIDドメイン,PIWIドメインの4つのドメインからなるおよそ100 kDaのタンパク質である.空のAgoはPAZドメインとMIDドメインのあいだのリンカー領域がプロテアーゼのひとつであるサーモリシンに脆弱である一方,小分子RNAを積み込んだAgoはサーモリシンに耐性であることから4),PAZドメインとMIDドメインとのあいだの構造が変化しやすいと予想し,PAZドメインとMIDドメインのそれぞれに異なる色の蛍光色素を導入した.
この2色の蛍光色素により標識されたAgoを用いて,空のAgoと小分子RNAを積み込んだAgoとでFRET効率の分布を比較した.FRET効率は蛍光色素のあいだの距離が近いほど高くなるが,空のAgoはピークを0.8にもつ幅広いFRET効率の分布を示し,小分子RNAを積み込んだAgoはピークを0.2にもつ鋭いFRET効率の分布を示した.これらの結果から,空のAgoは閉じた多様な構造をとる一方,小分子RNAを積み込んだAgoは比較的開いた均一な構造へと変化することが示唆された.
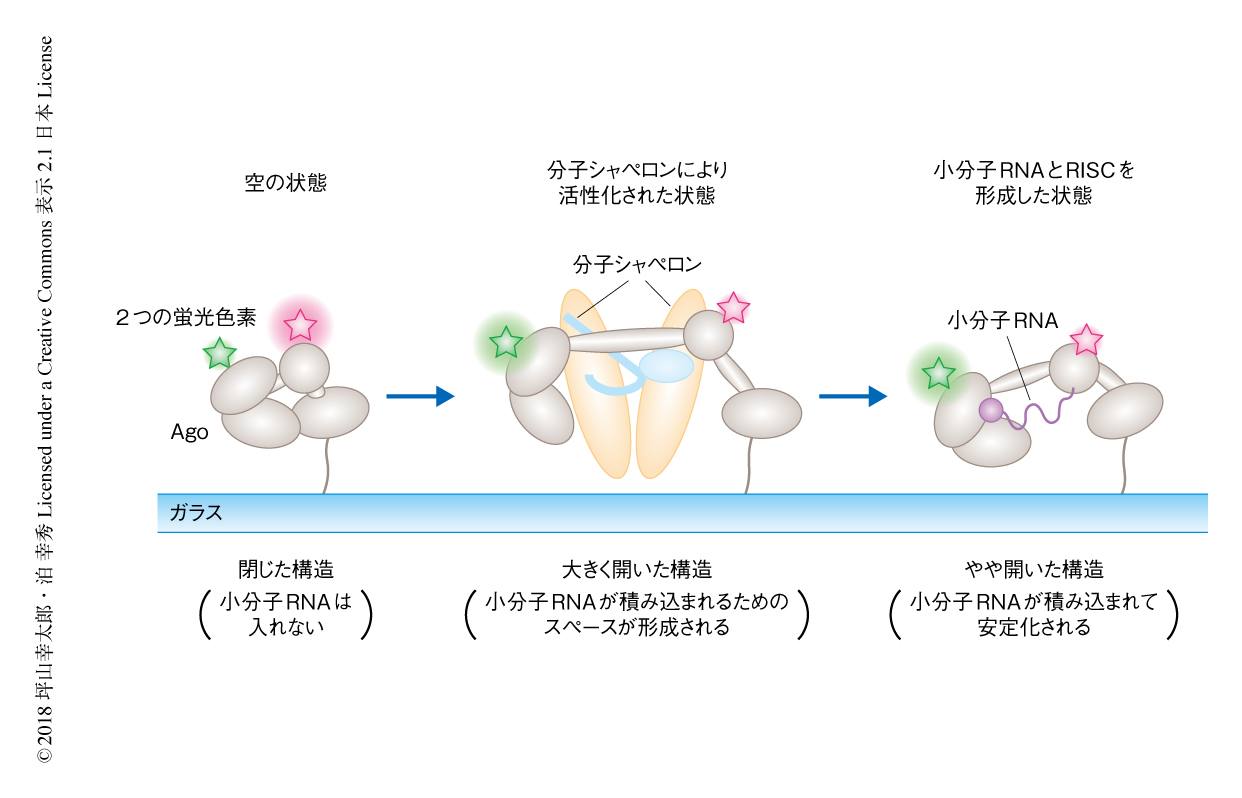
この小分子RNAの積み込みの際の構造変化について調べた.ショウジョウバエS2細胞に由来する粗抽出液には小分子RNAを除くRISCの形成に必要な因子がすべて含まれるため,これを空のAgoに添加してFRET効率を測定した.陰性対照としてGSTタンパク質を添加した場合にはピークを0.8にもつ幅広いFRET効率の分布を示した一方,粗抽出液をくわえた場合にはピークを0にもつ鋭いFRET効率の分布を示した.この結果から,粗抽出液をくわえることにより,Agoは小分子RNAを積み込んだAgoに比べてもさらに開いた構造へと変化すると考えられた.この0にピークをもつ非常に低いFRET効率を示す構造が小分子RNAを取り込むために活性化した構造なのかどうかを調べるため,S2細胞の粗抽出液および小分子RNAを同時にAgoに添加した.その結果,添加の10分後においては0にピークをもつFRET効率の分布を示したが,1時間後には小分子RNAの積み込みを示す0.2へとピークの一部が移動した.一方で,小分子RNAをくわえずに粗抽出液だけを添加して1時間が経過してもこのようなピークの移動はみられなかった.以上の結果から,空のAgoは比較的閉じた構造をとっているが,S2細胞の粗抽出液に含まれるRISCの形成に必要な因子により活性化すると大きく開いた構造へと変化し,かさ高い小分子RNAが積み込まれるためのスペースが形成され,小分子RNAが積み込まれてRISCへと成熟すると,やや開いた構造に落ち着くことがわかった(図1).
以前に,筆者らの研究グループは,ショウジョウバエAgo2のRISCの形成をin vitroにおいて再構成した3).そこで,Agoの構造変化の責任タンパク質を同定するためこの再構成系を用いた.再構成にはDicer-2-R2D2ヘテロ二量体,Hsp70シャペロン系,Hsp90シャペロン系が必要である.これらすべてにより再構成した場合,あるいは,Hsp70シャペロン系およびHsp90シャペロン系だけを添加した場合には,S2細胞の粗抽出液の添加によりみられた0にピークをもつFRET効率の分布が観察された.一方で,Dicer-2-R2D2ヘテロ二量体だけを添加した場合には,陰性対照としてGSTタンパク質を添加した場合と同様のピークを0.8にもつ幅広いFRET効率の分布が観察された.これらの結果から,Hsp70シャペロン系およびHsp90シャペロン系があればAgoを大きく開いた構造にするのに必要十分であることがわかった(図1).
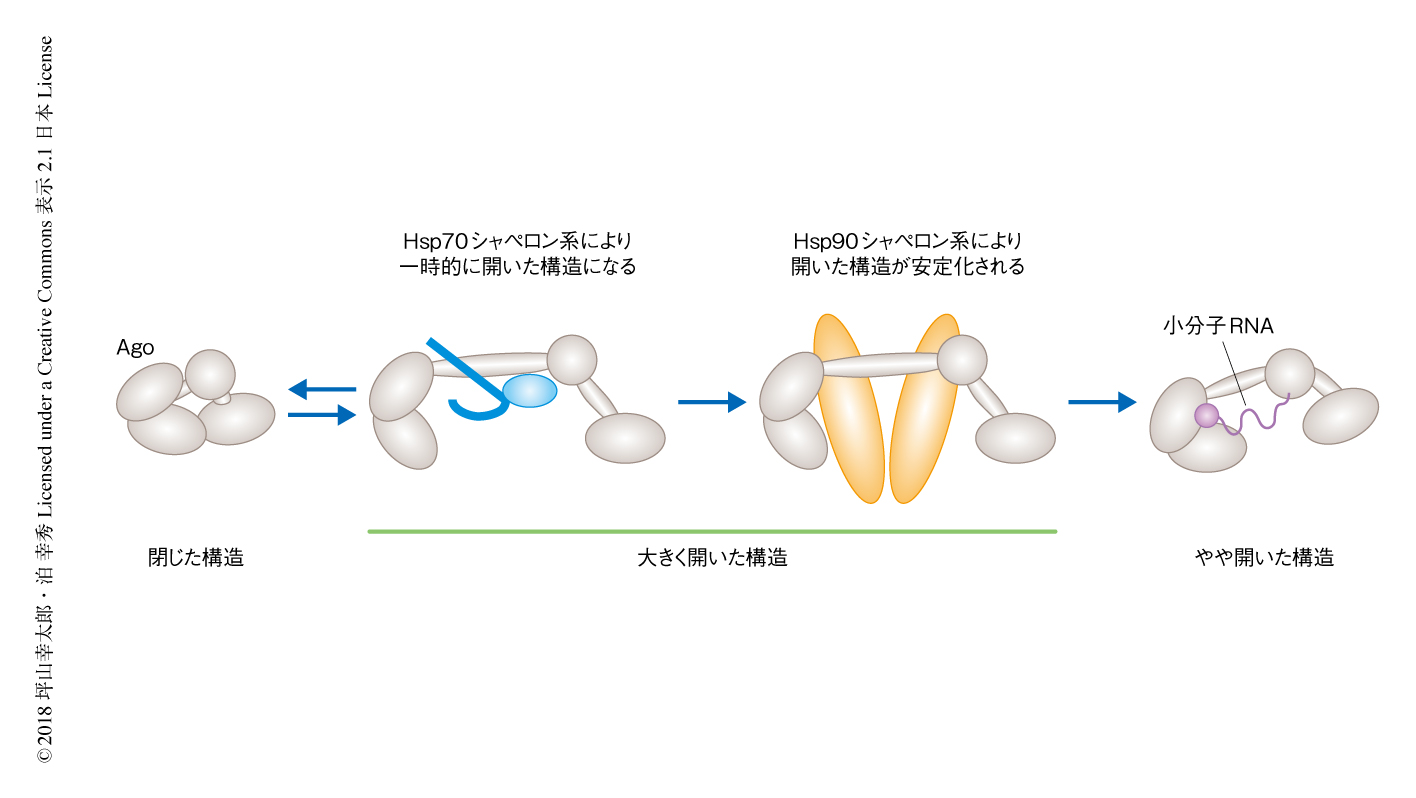
一般に,Hsp70シャペロン系とHsp90シャペロン系は協調してはたらくとされている.基質となるタンパク質には,まずHsp70とそのコシャペロンであるHsp40が結合する.そののち,基質タンパク質は2つのシャペロン系の橋わたしを担うHopを介してHsp90へとうけわたされ,p23によりHsp90と基質タンパク質との複合体が安定化される.このような一連の分子シャペロンのはたらきにより基質タンパク質が活性化する1).そこで,前半ではたらくHsp70シャペロン系と後半ではたらくHsp90シャペロン系とを個別に添加し,この2つのシャペロン系の機能的な相違について調べた.すると,Hsp70シャペロン系だけで若干ではあるが活性化した構造を示すFRET効率が0の割合が上昇した.一方で,Hsp90シャペロン系だけではFRET効率は変化しなかった.さらに,これら2つのシャペロン系の相違点をAgoの生化学的な活性によっても評価したところ,FRET効率の変化と同様に,Hsp90シャペロン系だけではAgoの小分子RNAの取り込み活性にはまったく変化がみられなかった一方,Hsp70シャペロン系だけで,わずかながらしかし有意に小分子RNAの取り込み活性が上昇した.以上の結果から,Hsp90シャペロン系は単独ではAgoに対し影響しない一方,Hsp70シャペロン系は単独でAgoの一部を開いた活性のある構造に変化させることが示唆された.
なぜHsp90シャペロン系はHsp70シャペロン系とともにAgoの完全な活性化に必要なのだろうか? この問いに答えるため,FRET効率の値を4つの区画に分割し,これらの区画のあいだをどのようにFRET効率が遷移するのか,その動的な変化について解析した.その結果,AgoだけのときにはFRET効率の遷移は高いFRET効率の区画において起こっていたが,Hsp70シャペロン系をくわえると,高いFRET効率の区画から低いFRET効率の区画へと遷移するものや,あるいは,その逆の遷移が観察されるなど,FRET効率の遷移に多様性がみられるようになった.さらに,Hsp70シャペロン系にくわえHsp90シャペロン系が存在する場合には,活性化した構造を示す低いFRET効率の区画にFRETの遷移が集中した.一方で,Hsp90シャペロン系だけでは,Agoだけのときと同様に,FRET効率の遷移は高いFRET効率の区画においてしか観察されなかった.
Hsp70シャペロン系の存在のもとにおけるHsp90シャペロン系の機能をより詳細に調べるため,それぞれのFRET効率の区画における滞在時間を測定したところ,Hsp70シャペロン系とHsp90シャペロン系とが共存する際には,活性化した構造を示す,FRET効率が非常に低い区画における滞在時間が選択的に延長した.一方で,このような延長はHsp70シャペロン系あるいはHsp90シャペロン系のどちらか一方,または,両方が欠けた条件では観察されなかった.これらの結果から,Hsp90シャペロン系はHsp70シャペロン系により一時的に開いた構造にされたAgoを,活性化して開いた構造に安定化させることが示唆された(図2).
この研究において,筆者らは,FRET法を用いた1分子観察により基質タンパク質の構造をリアルタイムにて直接的に観察した.その結果,Hsp70シャペロン系とHsp90シャペロン系は互いに異なる役割をもちながらも,協調してAgoを活性のある開いた構造にすることがわかった.また,この開いた構造のAgoに小分子RNAが安定的に結合しRISCを形成するという,一連のRISCの形成過程における分子シャペロンの具体的な役割が明らかにされた.
分子シャペロンの基質タンパク質として解析の進んでいるものとしてグルココルチコイド受容体があげられる.近年の解析により,グルココルチコイド受容体はHsp70によりいったん不活性化されたあと,Hsp90により,より活性のある状態にもどされることが見い出された10).これは,今回の知見と矛盾するかに思われるが,以下のように,両者の違いが分子シャペロンのない状態における活性の違いによるものであると考えると,統一的に説明される.すなわち,Agoは分子シャペロンのないときには不活性化しているが,Hsp70シャペロン系により一部が活性のある構造に変化し,Hsp90シャペロン系により活性化した構造が選択的に安定化される(2018年5月30日 著者からの依頼により一部修正).一方で,グルココルチコイド受容体は分子シャペロンがないときにもある程度の活性があり,Hsp70シャペロン系により一部が不活性化した構造に変化するが,Hsp90シャペロン系により活性化した構造が選択的に安定化される.このように,これら2つの知見をあわせると,Hsp70シャペロン系には基質タンパク質が単独ではとりえない範囲まで構造の多様性を拡張させる役割があり,Hsp90シャペロン系にはHsp70により生じたさまざまな構造のなかから活性化した構造を選択的に安定化させる役割があると考えられる.このような役割の分担により,少なくとも数百ある多様な基質タンパク質をこの2つのシャペロン系だけで効率よく活性化させるのではないかと考察される.しかし,Hsp70がどのように構造の多様性を生じているのか,さらには,Hsp90がどのようにして活性のある構造のみを選択的に安定化させるのか,などは不明なままであり,今後の研究が待たれる.
この研究において,1分子観察系の構築はAgoの不安定性との戦いだった.本来は分子シャペロンなどに保護されているAgoを磁気ビーズにより精製しても,Agoは磁気ビーズから溶液へと溶出されない.凍結した状態から解凍すると互いに凝集する.ガラス基板にAgoを固定し分子シャペロンを除くため洗浄すると,ガラス基板と非特異的に相互作用し安定なFRET効率を示さない,など,数多くの問題があった.細胞の粗抽出液や高分子ポリマーを適所で使用するなど,これらの問題をひとつひとつ丹念に解決することでFRET効率の分布の変化をとらえることが可能になった.逆に,Agoがちょうどよい大きさであり,取り込む小分子RNAについても適度な大きさがあったため,FRET法を用いた1分子観察により構造の変化をとらえるのにまさにうってつけの題材であったことは,この研究を開始した当初はあまり考慮していなかったが,結果的には大きな幸運であった.
略歴:東京大学大学院新領域創成科学研究科博士課程 在籍中.
研究テーマ:1分子観察.
関心事:分子シャペロンをはじめとする縁の下の力持ちのような機構に興味がある.
泊 幸秀(Yukihide Tomari)
東京大学分子定量生命科学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2018 坪山幸太郎・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学定量生命科学研究所 RNA機能研究分野)
email:坪山幸太郎,泊 幸秀
DOI: 10.7875/first.author.2018.058
Conformational activation of Argonaute by distinct yet coordinated actions of the Hsp70 and Hsp90 chaperone systems.
Kotaro Tsuboyama, Hisashi Tadakuma, Yukihide Tomari
Molecular Cell, 70, 722-729.e4 (2018)
要 約
RNAサイレンシング機構の中核をなすArgonauteへの小分子RNAの積み込みはHsp70シャペロン系およびHsp90シャペロン系を必要とする.この2つのシャペロン系は数百あるとされる基質タンパク質の活性化にも必要であるが,その際,基質タンパク質の構造にどのような変化が生じるかは不明であった.この研究において,筆者らは,Argonauteの活性化の過程における構造の変化をFRET法を用いた1分子観察により追跡した.単体のArgonauteはさまざまな閉じた構造をとっていたが,Hsp70シャペロン系およびHsp90シャペロン系の両方が存在する場合には活性のある大きく開いた構造へと変化した.Hsp70シャペロン系は単独でAgoを一部が開いた活性のある構造へと変化させたが,Hsp90シャペロン系は単独では構造を変化させなかった.その代わりに,Hsp90シャペロン系は,Hsp70シャペロン系により開いた構造にされたArgonauteを安定化させた.以上のことから,Hsp70シャペロン系が基質タンパク質の構造の多様性を拡張し,Hsp90シャペロン系が活性のある構造を特異的にとらえて安定化させるという,2つのシャペロン系が異なる役割をもちながらも協調して基質タンパク質を活性化するしくみが示唆された.
はじめに
Hsp70シャペロン系およびHsp90シャペロン系はステロイドホルモン受容体やキナーゼなど数百もの基質タンパク質の機能的な活性化に必須である1).Hsp70およびHsp90はともにATPを加水分解する活性をもち,ATPのエネルギーを使って基質タンパク質の構造変化をひき起こし活性化すると考えられている.
Argonaute(Ago)は小分子RNAによるRNAサイレンシング機構の中核を担うタンパク質であり,小分子RNAとともにRISC(RNA-induced silencing complex)という複合体を形成する.ステロイドホルモンがステロイド受容体に結合する際と同様に,Agoが小分子RNAを積み込む際にはHsp70シャペロン系およびHsp90シャペロン系が必要である2)(新着論文レビュー でも掲載).さらに,以前,筆者らの研究グループは,1分子解析によりHsp70シャペロン系およびHsp90シャペロン系が小分子RNAとAgoとの相互作用の時間を延長させることを報告した3)(新着論文レビュー でも掲載).しかし,Hsp70シャペロン系およびHsp90シャペロン系がAgoを含む基質タンパク質を活性化する際,基質タンパク質に具体的にどのような変化をもたらすのかについてはわかっていなかった.このような問いに答えるため,筆者らは,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)法を用いた1分子観察によりAgoの構造変化を直接おいかけた.
なお,AgoによるRNAサイレンシングの構造基盤については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001 (2012) も参照されたい.
1.特異的なアミノ酸残基への蛍光色素の導入
分子シャペロンあるいは小分子RNAの取り込みによりAgoにどのような構造変化が生じるかについてFRET法を用いて1分子観察により明らかにするには,2つの大きな課題があった.1つ目は,小分子RNAを含まない“空の”Agoの調製である.たとえば,ヒトのAgo2を精製した際にはその発現に用いた宿主の内在性の小分子RNAがすでに積み込まれており,空のAgoの画分は少ないことが示されている4,5).この問題を解決し空のAgoを高効率で調製するために,ショウジョウバエのAgo2の特性を利用した.具体的には,ヒトAgo2の小分子RNAの積み込みは分子シャペロンがあれば必要十分であるが6),ショウジョウバエAgo2への小分子RNAの積み込みは分子シャペロンのほか昆虫に特異的なDicer-2-R2D2ヘテロ二量体を必要とする3).この特性を利用して,Dicer-2およびR2D2をもたないヒトHEK293T細胞においてショウジョウバエAgo2を異所的に発現させたところ,空のショウジョウバエAgo2が高効率で調製された.
2つ目は,特異的なアミノ酸残基への蛍光色素の導入である.FRET法を用いた1分子観察には一般にシステイン-マレイミド反応を用いた蛍光色素の導入が用いられるが,この方法を利用するには蛍光色素の導入を意図する部位以外のシステイン残基をすべてほかのアミノ酸残基に置換する必要がある.ショウジョウバエAgo2には16個ものシステイン残基が含まれるため,遺伝暗号の拡張による非天然アミノ酸残基の導入を用いた7).非天然アミノ酸残基の導入にはin vitro翻訳系を用いる方法と細胞などを用いてin vivoにおいて導入する方法の2つがある.in vitro翻訳系を用いる方法は人工的にアミノアシル化されたtRNAを用いる必要があるが,少なくとも試したかぎりではアミノアシル化tRNAの不安定性が問題になった.in vivoにおいて導入する方法においては,終止コドンのひとつアンバーコドンを認識するtRNA,非天然アミノ酸残基およびアンバーコドンtRNAを認識するアミノアシルtRNA合成酵素,非天然アミノ酸残基の導入を意図する位置のコドンをアンバーコドンへと置換した目的タンパク質をコードしたプラスミドを細胞に導入し,非天然アミノ酸の存在下で培養することにより非天然アミノ酸残基が導入された目的タンパク質を合成する.さらに,この非天然アミノ酸残基に対し特異的な反応を起こす官能基のついた蛍光色素を,この非天然アミノ酸残基が導入された目的タンパク質と反応させることにより,アミノ酸残基に特異的に蛍光色素を導入することが可能になる.具体的には,近年,開発されたピロリシニルtRNA合成酵素を用いたが,そのままでは非天然アミノ酸残基の導入の効率が悪かった.そこで,アミノアシルtRNA合成酵素に核外移行シグナルを導入する8),終止コドンを認識する翻訳終結因子のひとつであるeRF1のドミナントネガティブ体を過剰発現する9),などのくふうにより,非天然アミノ酸残基の導入の効率を向上させた.このような検討をつうじて,2箇所の特異的なアミノ酸残基に高効率で蛍光色素を導入する系が構築された.
2.小分子RNAの取り込みによりAgoはやや開いた構造になる
AgoはNドメイン,PAZドメイン,MIDドメイン,PIWIドメインの4つのドメインからなるおよそ100 kDaのタンパク質である.空のAgoはPAZドメインとMIDドメインのあいだのリンカー領域がプロテアーゼのひとつであるサーモリシンに脆弱である一方,小分子RNAを積み込んだAgoはサーモリシンに耐性であることから4),PAZドメインとMIDドメインとのあいだの構造が変化しやすいと予想し,PAZドメインとMIDドメインのそれぞれに異なる色の蛍光色素を導入した.
この2色の蛍光色素により標識されたAgoを用いて,空のAgoと小分子RNAを積み込んだAgoとでFRET効率の分布を比較した.FRET効率は蛍光色素のあいだの距離が近いほど高くなるが,空のAgoはピークを0.8にもつ幅広いFRET効率の分布を示し,小分子RNAを積み込んだAgoはピークを0.2にもつ鋭いFRET効率の分布を示した.これらの結果から,空のAgoは閉じた多様な構造をとる一方,小分子RNAを積み込んだAgoは比較的開いた均一な構造へと変化することが示唆された.
3.小分子RNAを積み込むために活性化したAgoは大きく開いた構造になる
この小分子RNAの積み込みの際の構造変化について調べた.ショウジョウバエS2細胞に由来する粗抽出液には小分子RNAを除くRISCの形成に必要な因子がすべて含まれるため,これを空のAgoに添加してFRET効率を測定した.陰性対照としてGSTタンパク質を添加した場合にはピークを0.8にもつ幅広いFRET効率の分布を示した一方,粗抽出液をくわえた場合にはピークを0にもつ鋭いFRET効率の分布を示した.この結果から,粗抽出液をくわえることにより,Agoは小分子RNAを積み込んだAgoに比べてもさらに開いた構造へと変化すると考えられた.この0にピークをもつ非常に低いFRET効率を示す構造が小分子RNAを取り込むために活性化した構造なのかどうかを調べるため,S2細胞の粗抽出液および小分子RNAを同時にAgoに添加した.その結果,添加の10分後においては0にピークをもつFRET効率の分布を示したが,1時間後には小分子RNAの積み込みを示す0.2へとピークの一部が移動した.一方で,小分子RNAをくわえずに粗抽出液だけを添加して1時間が経過してもこのようなピークの移動はみられなかった.以上の結果から,空のAgoは比較的閉じた構造をとっているが,S2細胞の粗抽出液に含まれるRISCの形成に必要な因子により活性化すると大きく開いた構造へと変化し,かさ高い小分子RNAが積み込まれるためのスペースが形成され,小分子RNAが積み込まれてRISCへと成熟すると,やや開いた構造に落ち着くことがわかった(図1).
4.Hsp70シャペロン系およびHsp90シャペロン系はAgoを開いた構造にするのに必要十分である
以前に,筆者らの研究グループは,ショウジョウバエAgo2のRISCの形成をin vitroにおいて再構成した3).そこで,Agoの構造変化の責任タンパク質を同定するためこの再構成系を用いた.再構成にはDicer-2-R2D2ヘテロ二量体,Hsp70シャペロン系,Hsp90シャペロン系が必要である.これらすべてにより再構成した場合,あるいは,Hsp70シャペロン系およびHsp90シャペロン系だけを添加した場合には,S2細胞の粗抽出液の添加によりみられた0にピークをもつFRET効率の分布が観察された.一方で,Dicer-2-R2D2ヘテロ二量体だけを添加した場合には,陰性対照としてGSTタンパク質を添加した場合と同様のピークを0.8にもつ幅広いFRET効率の分布が観察された.これらの結果から,Hsp70シャペロン系およびHsp90シャペロン系があればAgoを大きく開いた構造にするのに必要十分であることがわかった(図1).
5.Hsp70シャペロン系だけでもAgoの一部の構造を変化させるがHsp90シャペロン系だけではAgoに影響しない
一般に,Hsp70シャペロン系とHsp90シャペロン系は協調してはたらくとされている.基質となるタンパク質には,まずHsp70とそのコシャペロンであるHsp40が結合する.そののち,基質タンパク質は2つのシャペロン系の橋わたしを担うHopを介してHsp90へとうけわたされ,p23によりHsp90と基質タンパク質との複合体が安定化される.このような一連の分子シャペロンのはたらきにより基質タンパク質が活性化する1).そこで,前半ではたらくHsp70シャペロン系と後半ではたらくHsp90シャペロン系とを個別に添加し,この2つのシャペロン系の機能的な相違について調べた.すると,Hsp70シャペロン系だけで若干ではあるが活性化した構造を示すFRET効率が0の割合が上昇した.一方で,Hsp90シャペロン系だけではFRET効率は変化しなかった.さらに,これら2つのシャペロン系の相違点をAgoの生化学的な活性によっても評価したところ,FRET効率の変化と同様に,Hsp90シャペロン系だけではAgoの小分子RNAの取り込み活性にはまったく変化がみられなかった一方,Hsp70シャペロン系だけで,わずかながらしかし有意に小分子RNAの取り込み活性が上昇した.以上の結果から,Hsp90シャペロン系は単独ではAgoに対し影響しない一方,Hsp70シャペロン系は単独でAgoの一部を開いた活性のある構造に変化させることが示唆された.
6.Hsp90シャペロン系はHsp70シャペロン系により開いた構造にされたAgoを安定化する
なぜHsp90シャペロン系はHsp70シャペロン系とともにAgoの完全な活性化に必要なのだろうか? この問いに答えるため,FRET効率の値を4つの区画に分割し,これらの区画のあいだをどのようにFRET効率が遷移するのか,その動的な変化について解析した.その結果,AgoだけのときにはFRET効率の遷移は高いFRET効率の区画において起こっていたが,Hsp70シャペロン系をくわえると,高いFRET効率の区画から低いFRET効率の区画へと遷移するものや,あるいは,その逆の遷移が観察されるなど,FRET効率の遷移に多様性がみられるようになった.さらに,Hsp70シャペロン系にくわえHsp90シャペロン系が存在する場合には,活性化した構造を示す低いFRET効率の区画にFRETの遷移が集中した.一方で,Hsp90シャペロン系だけでは,Agoだけのときと同様に,FRET効率の遷移は高いFRET効率の区画においてしか観察されなかった.
Hsp70シャペロン系の存在のもとにおけるHsp90シャペロン系の機能をより詳細に調べるため,それぞれのFRET効率の区画における滞在時間を測定したところ,Hsp70シャペロン系とHsp90シャペロン系とが共存する際には,活性化した構造を示す,FRET効率が非常に低い区画における滞在時間が選択的に延長した.一方で,このような延長はHsp70シャペロン系あるいはHsp90シャペロン系のどちらか一方,または,両方が欠けた条件では観察されなかった.これらの結果から,Hsp90シャペロン系はHsp70シャペロン系により一時的に開いた構造にされたAgoを,活性化して開いた構造に安定化させることが示唆された(図2).
おわりに
この研究において,筆者らは,FRET法を用いた1分子観察により基質タンパク質の構造をリアルタイムにて直接的に観察した.その結果,Hsp70シャペロン系とHsp90シャペロン系は互いに異なる役割をもちながらも,協調してAgoを活性のある開いた構造にすることがわかった.また,この開いた構造のAgoに小分子RNAが安定的に結合しRISCを形成するという,一連のRISCの形成過程における分子シャペロンの具体的な役割が明らかにされた.
分子シャペロンの基質タンパク質として解析の進んでいるものとしてグルココルチコイド受容体があげられる.近年の解析により,グルココルチコイド受容体はHsp70によりいったん不活性化されたあと,Hsp90により,より活性のある状態にもどされることが見い出された10).これは,今回の知見と矛盾するかに思われるが,以下のように,両者の違いが分子シャペロンのない状態における活性の違いによるものであると考えると,統一的に説明される.すなわち,Agoは分子シャペロンのないときには不活性化しているが,Hsp70シャペロン系により一部が活性のある構造に変化し,Hsp90シャペロン系により活性化した構造が選択的に安定化される(2018年5月30日 著者からの依頼により一部修正).一方で,グルココルチコイド受容体は分子シャペロンがないときにもある程度の活性があり,Hsp70シャペロン系により一部が不活性化した構造に変化するが,Hsp90シャペロン系により活性化した構造が選択的に安定化される.このように,これら2つの知見をあわせると,Hsp70シャペロン系には基質タンパク質が単独ではとりえない範囲まで構造の多様性を拡張させる役割があり,Hsp90シャペロン系にはHsp70により生じたさまざまな構造のなかから活性化した構造を選択的に安定化させる役割があると考えられる.このような役割の分担により,少なくとも数百ある多様な基質タンパク質をこの2つのシャペロン系だけで効率よく活性化させるのではないかと考察される.しかし,Hsp70がどのように構造の多様性を生じているのか,さらには,Hsp90がどのようにして活性のある構造のみを選択的に安定化させるのか,などは不明なままであり,今後の研究が待たれる.
この研究において,1分子観察系の構築はAgoの不安定性との戦いだった.本来は分子シャペロンなどに保護されているAgoを磁気ビーズにより精製しても,Agoは磁気ビーズから溶液へと溶出されない.凍結した状態から解凍すると互いに凝集する.ガラス基板にAgoを固定し分子シャペロンを除くため洗浄すると,ガラス基板と非特異的に相互作用し安定なFRET効率を示さない,など,数多くの問題があった.細胞の粗抽出液や高分子ポリマーを適所で使用するなど,これらの問題をひとつひとつ丹念に解決することでFRET効率の分布の変化をとらえることが可能になった.逆に,Agoがちょうどよい大きさであり,取り込む小分子RNAについても適度な大きさがあったため,FRET法を用いた1分子観察により構造の変化をとらえるのにまさにうってつけの題材であったことは,この研究を開始した当初はあまり考慮していなかったが,結果的には大きな幸運であった.
文 献
- Schopf, F. H., Biebl, M. M. & Buchner, J.: The HSP90 chaperone machinery. Nat. Rev. Mol. Cell Biol., 18, 345-360 (2017)[PubMed]
- Iwasaki, S., Kobayashi, M., Yoda, M. et al.: Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes. Mol. Cell, 39, 292-299 (2010)[PubMed] [新着論文レビュー]
- Iwasaki, S., Sasaki, H. M., Sakaguchi, Y. et al.: Defining fundamental steps in the assembly of the Drosophila RNAi enzyme complex. Nature 521, 533-536 (2015)[PubMed] [新着論文レビュー]
- Elkayam, E., Kuhn, C. D., Tocilj, A. et al.: The structure of human argonaute-2 in complex with miR-20a. Cell, 150, 100-110 (2012)[PubMed]
- Schirle, N. T. & MacRae, I. J.: The crystal structure of human Argonaute2. Science, 336, 1037-1040 (2012)[PubMed]
- Naruse, K., Matsuura-Suzuki, E., Watanabe, M. et al.: In vitro reconstitution of chaperone-mediated human RISC assembly. RNA, 24, 6-11 (2018)[PubMed]
- Nikic, I., Kang, J. H., Girona, G. E. et al.: Labeling proteins on live mammalian cells using click chemistry. Nat. Protoc., 10, 780-791 (2015)[PubMed]
- Nikic, I., Estrada Girona, G., Kang, J. H. et al.: Debugging eukaryotic genetic code expansion for site-specific click-PAINT super-resolution microscopy. Angew. Chem. Int. Ed. Engl., 55, 16172-16176 (2016)[PubMed]
- Schmied, W. H., Elsasser, S. J., Uttamapinant, C. et al.: Efficient multisite unnatural amino acid incorporation in mammalian cells via optimized pyrrolysyl tRNA synthetase/tRNA expression and engineered eRF1. J. Am. Chem. Soc., 136, 15577-15583 (2014)[PubMed]
- Verba, K. A., Wang, R. Y., Arakawa, A. et al.: Atomic structure of Hsp90-Cdc37-Cdk4 reveals that Hsp90 traps and stabilizes an unfolded kinase. Science, 352, 1542-1547 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科博士課程 在籍中.
研究テーマ:1分子観察.
関心事:分子シャペロンをはじめとする縁の下の力持ちのような機構に興味がある.
泊 幸秀(Yukihide Tomari)
東京大学分子定量生命科学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2018 坪山幸太郎・泊 幸秀 Licensed under CC 表示 2.1 日本