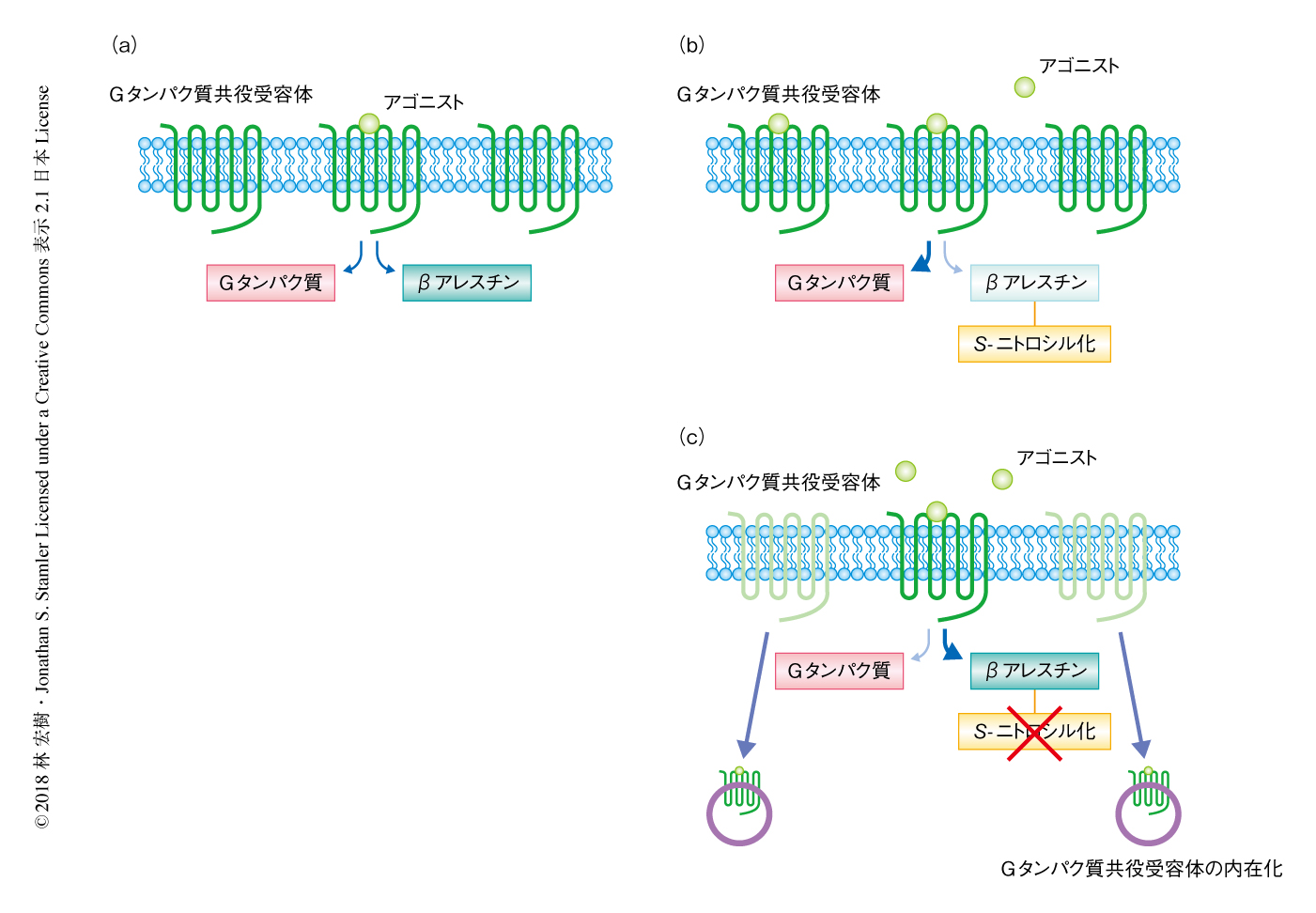
βアレスチンのS-ニトロシル化はGタンパク質共役受容体からのシグナルをかたよらせて伝達させリガンドに非依存的な機能にも影響する
林 宏樹・Jonathan S. Stamler
(米国Case Western Reserve大学Institute for Transformative Molecular Medicine)
email:林 宏樹
DOI: 10.7875/first.author.2018.057
S-nitrosylation of β-arrestins biases receptor signaling and confers ligand independence.
Hiroki Hayashi, Douglas T. Hess, Rongli Zhang, Keiki Sugi, Huiyun Gao, Bea L. Tan, Dawn E. Bowles, Carmelo A. Milano, Mukesh K. Jain, Walter J. Koch, Jonathan S. Stamler
Molecular Cell, 70, 473-487.e6 (2018)
Gタンパク質共役受容体はGタンパク質に依存的なシグナル伝達系およびβアレスチンに依存的なシグナル伝達系にシグナルを伝達する.合成されたリガンドはこの2つのシグナル伝達系への伝達のバランスをかたよらせるが,内因性によるシグナル伝達のかたよりについてはよく知られていない.この研究において,筆者らは,βアレスチンの新規のS-ニトロシル化がGタンパク質共役受容体に対するβアレスチンの機能を抑制することによりシグナルをGタンパク質に依存的なシグナル伝達系へとかたよらせ,リガンドに非依存的にβアレスチンの二量体化やMDM2-p53経路を制御することを見い出した.さらに,心不全モデルマウス,老化したマウス,ヒトの心不全においてβアレスチンのS-ニトロシル化は増加しており,βアレスチンがS-ニトロシル化されないようCysをSerに置換したマウスにおいて圧負荷による心不全モデルを作製したところ,βアレスチンに依存的なシグナル伝達系の増強および心機能において重要なGタンパク質共役受容体であるアドレナリン受容体の減少とともに心機能は悪化した.これらより,心不全においてβアレスチンのS-ニトロシル化はβアレスチンの機能の制御を担い,Gタンパク質共役受容体からのシグナル伝達系の新たな制御機構である可能性が示唆された.
Gタンパク質共役受容体(G protein coupled receptor:GPCR)がリガンドと結合すると,ヘテロ三量体であるGタンパク質によりさまざまなシグナル伝達系が活性化される.βアレスチン1およびβアレスチン2からなるβアレスチンが細胞質よりリクルートされGタンパク質共役受容体と結合するとGタンパク質に依存的なシグナル伝達系は抑制され,Gタンパク質共役受容体は脱感作および内在化する.そして,βアレスチンはGタンパク質に非依存的かつβアレスチンに依存的なシグナル伝達系を活性化する.ほかにも,βアレスチンには細胞質において多くの結合タンパク質を介した多様な機能のあることが知られている1-3).
Gタンパク質共役受容体は多くの薬剤の標的となっており,合成されたリガンドにより,Gタンパク質に依存的なシグナル伝達系への伝達とβアレスチンに依存的なシグナル伝達系への伝達とのバランスがどちらかにかたよる“バイアス化”の起こることが着目され,薬効と関連して精力的に解析されている.これまで,ある種のGタンパク質共役受容体において,Gタンパク質共役受容体に直接に作用することによりシグナル伝達系をアロステリックにかたよらせることは知られていたが,より広い範囲において影響をおよぼすような内因性の機構についてはよく知られていない.
S-ニトロシル化は一酸化窒素による翻訳後修飾であり,多くのタンパク質の機能の制御を介して細胞の生理機能に影響する4,5).Gタンパク質共役受容体の制御にかかわるタンパク質の多くが内皮型一酸化窒素合成酵素によりS-ニトロシル化され,Gタンパク質共役受容体の内在化に影響する6-8).これまで,βアレスチン2はアゴニストに依存して内皮型一酸化窒素合成酵素によりS-ニトロシル化され,Gタンパク質共役受容体の内在化を制御することが明らかにされている.この研究において,筆者らは,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチンの新たなS-ニトロシル化の機能について検討した.
これまでに,βアレスチン2は内皮型一酸化窒素合成酵素によりCys410がS-ニトロシル化されるが,βアレスチン1は内皮型一酸化窒素合成酵素によりS-ニトロシル化されないことがわかっていた6).βアレスチンが神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素と結合するかどうか免疫沈降法により検討したところ,βアレスチン1およびβアレスチン2は神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素と結合することがわかった.さらに,S-ニトロシル化について検討したところ,βアレスチンは神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されることがわかり,βアレスチン1はCys251,βアレスチン2はCys253と,内皮型一酸化窒素合成酵素とは異なるCysがS-ニトロシル化された.
神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されるCysの近傍にはβアレスチンの二量体化に関与するイノシトールヘキサキスリン酸との結合部位9),および,Gタンパク質共役受容体のひとつβ2アドレナリン受容体との結合部位が存在する10).βアレスチンの二量体化について検討するため,異なるタグを付加した野生型のβアレスチンあるいはS-ニトロシル化されるCysをSerに置換したβアレスチンを用いて免疫沈降法により検討したところ,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりひき起こされる二量体化はS-ニトロシル化されない変異体では抑制された.一方,内皮型一酸化窒素合成酵素によるCys410のS-ニトロシル化は二量体化には関与しなかった.リポ多糖により刺激し誘導型一酸化窒素合成酵素の発現を誘導したRAW264.7細胞においても,内因性のβアレスチンの二量体化が確認された.これらの結果から,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチンのS-ニトロシル化はその二量体化に関与することが示唆された.
神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されるβアレスチン2のCys253はβ2アドレナリン受容体との結合部位の近傍にあることから,βアレスチン2とβ2アドレナリン受容体との結合を免疫沈降法により検討した.その結果,アゴニストであるイソプロテレノールにより活性化させたβ2アドレナリン受容体とβアレスチン2との結合は神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素の強制発現のもとにおいては抑制されたが,S-ニトロシル化されないβアレスチン2の変異体においては抑制されなかった.さらに,β2アドレナリン受容体を活性化させたのちのβアレスチン2の細胞膜へのリクルートも抑制された.同様に、β2アドレナリン受容体の内在化も抑制され,βアレスチンに依存性のシグナル伝達系も抑制されていた.しかしながら,アゴニストにより活性化されるGタンパク質に依存的なシグナル伝達系には影響しなかった.ほかのGタンパク質共役受容体として,アンジオテンシン受容体やブラジキニン受容体においても同様な傾向が認められたことから,βアレスチン2のCys253のS-ニトロシル化はGタンパク質共役受容体からのシグナルをGタンパク質に依存的なシグナル伝達系へとかたよらせることが示された.
βアレスチンはシグナルタンパク質から転写因子まで,多くの非受容体タンパク質と結合することが報告されている3).MDM2はがん遺伝子産物として知られ,がん抑制遺伝子産物p53と結合しその活性を抑制する.βアレスチン2はMDM2と結合することが知られているが,S-ニトロシル化によりMDM2との結合は増強された.免疫染色法による検討により,βアレスチン2のS-ニトロシル化によりMDM2の局在は核から細胞質へと変化することがわかったが,p53の核への局在には変化が認められなかった.MDM2とp53との結合を免疫沈降法により確認したところ,βアレスチン2のS-ニトロシル化によりMDM2とp53との結合が抑制された.これより,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチン2のCys253のS-ニトロシル化により,MDM2の局在が核から細胞質へと変化しp53との結合が抑制されることが示唆され,βアレスチン2のCys253のS-ニトロシル化はGタンパク質共役受容体に非依存的にMDM2-p53経路を制御することが示唆された.
疾患や老化との関連性について検討するため,心不全モデルマウスにおいてβアレスチンのS-ニトロシル化について検討した.その結果,心不全モデルマウスにおいては神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素の発現量が増加したが,内皮型一酸化窒素合成酵素の発現量は変化しなかった.S-ニトロシル化について比較したところ,対照と比べ,βアレスチン1およびβアレスチン2においてS-ニトロシル化が増加しており,さらに,二量体化も増加していた.βアレスチン1は内皮型一酸化窒素合成酵素によりS-ニトロシル化されないため6),心不全モデルマウスにおいてみられたS-ニトロシル化の増加は,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるものと示唆された.同様に,ヒトの心不全の試料を用いて検討したところ,誘導型一酸化窒素合成酵素の発現の上昇が認められ,S-ニトロシル化も同様に増加していた.マウスの心臓および肺において,老化とともに神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素の発現は上昇し,内皮型一酸化窒素合成酵素の発現は低下した.βアレスチン1については老化したマウスにおいてS-ニトロシル化および二量体化が増加したが,βアレスチン2についてはS-ニトロシル化は若いマウスと老化したマウスとで差は認められなかったが,二量体化は老化したマウスのほうが増加していた.これは,老化においては神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるS-ニトロシル化は増加するが,内皮型一酸化窒素合成酵素によるS-ニトロシル化は減少したため,総合的なS-ニトロシル化は変化しなかったのではないかと推測された.これらの結果から,心不全や老化においてβアレスチン2のCys253のS-ニトロシル化は増加することが示唆された.
βアレスチンのS-ニトロシル化が心不全の病態におよぼす影響について検討した.βアレスチン2のCys253をSerに置換してS-ニトロシル化されないノックインマウスを作製し,βアレスチン2の発現量には変化のないことを確認した.野生型のマウスおよびこのノックインマウスにおいて圧負荷による心不全モデルを作製しβアレスチン2のS-ニトロシル化および二量体化について検討したところ,ノックインマウスにおいてはS-ニトロシル化および二量体化が減少した.超音波検査により心機能を評価したところ,ノックインマウスは野生型のマウスに比べ増悪していることがわかった.ウェスタンブロット法を用いて,Gタンパク質に依存的なシグナル伝達系としてcAMPの下流のPhospholambanのリン酸化,βアレスチンに依存的なシグナル伝達系としてERKのリン酸化について比較した.その結果,野生型のマウスにおいてはPhospholambanのリン酸化が強くERKのリン酸化が弱いGタンパク質に依存的なシグナルへのかたより,ノックインマウスにおいてはPhospholambanのリン酸化が弱くERKのリン酸化が強いβアレスチンに依存的なシグナルへのかたよりが検出され,心不全の状態においてβアレスチンのS-ニトロシル化がGタンパク質共役受容体からのシグナルの伝達をかたよらせることが示唆された.
イソプロテレノールにより活性化される心機能について超音波検査により評価したところ,S-ニトロシル化されないノックインマウスにおいては野生型のマウスと比較して心拍数および収縮能が上昇しなかった.心臓においてアドレナリン受容体を解析したところ,このノックインマウスにおいてはアドレナリン受容体の減少が認められ,Gタンパク質共役受容体の内在化が促進されている可能性が示唆された.また,ノックインマウスの心臓においてはβアレスチンの発現量が増加していたが,βアレスチンをコードするmRNAの量には変化がみられなかったことから,S-ニトロシル化を介したなんらかの翻訳後の発現制御機構のあることが推測された.さらに,ノックインマウスにおいてはHIF1αおよびpVHLの発現も上昇しており,βアレスチンのS-ニトロシル化がHIF1α-p53経路に影響する可能性も示された.
この研究において,βアレスチンのS-ニトロシル化によりGタンパク質共役受容体からのシグナルが内因性にかたよって伝達され,p53-MDM2経路など受容体に非依存的な機構にも影響をおよぼすことが示唆された.さらに,心不全の病態においてはβアレスチンがGタンパク質共役受容体の機能を制御することにより心保護作用を示すことが示され(図1),Gタンパク質共役受容体の機能が関与しうる多くの病態において,βアレスチンのS-ニトロシル化はこれまで予期されなかった病態の決定素因になりうる可能性が示唆された.
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,米国Case Western Reserve大学 研究員を経て,大阪大学大学院医学系研究科 助教.
研究テーマ:一酸化窒素による病態の制御機構.生活習慣病の治療ワクチンの開発.
Jonathan S. Stamler
米国Case Western Reserve大学Professor.
© 2018 林 宏樹・Jonathan S. Stamler Licensed under CC 表示 2.1 日本
(米国Case Western Reserve大学Institute for Transformative Molecular Medicine)
email:林 宏樹
DOI: 10.7875/first.author.2018.057
S-nitrosylation of β-arrestins biases receptor signaling and confers ligand independence.
Hiroki Hayashi, Douglas T. Hess, Rongli Zhang, Keiki Sugi, Huiyun Gao, Bea L. Tan, Dawn E. Bowles, Carmelo A. Milano, Mukesh K. Jain, Walter J. Koch, Jonathan S. Stamler
Molecular Cell, 70, 473-487.e6 (2018)
要 約
Gタンパク質共役受容体はGタンパク質に依存的なシグナル伝達系およびβアレスチンに依存的なシグナル伝達系にシグナルを伝達する.合成されたリガンドはこの2つのシグナル伝達系への伝達のバランスをかたよらせるが,内因性によるシグナル伝達のかたよりについてはよく知られていない.この研究において,筆者らは,βアレスチンの新規のS-ニトロシル化がGタンパク質共役受容体に対するβアレスチンの機能を抑制することによりシグナルをGタンパク質に依存的なシグナル伝達系へとかたよらせ,リガンドに非依存的にβアレスチンの二量体化やMDM2-p53経路を制御することを見い出した.さらに,心不全モデルマウス,老化したマウス,ヒトの心不全においてβアレスチンのS-ニトロシル化は増加しており,βアレスチンがS-ニトロシル化されないようCysをSerに置換したマウスにおいて圧負荷による心不全モデルを作製したところ,βアレスチンに依存的なシグナル伝達系の増強および心機能において重要なGタンパク質共役受容体であるアドレナリン受容体の減少とともに心機能は悪化した.これらより,心不全においてβアレスチンのS-ニトロシル化はβアレスチンの機能の制御を担い,Gタンパク質共役受容体からのシグナル伝達系の新たな制御機構である可能性が示唆された.
はじめに
Gタンパク質共役受容体(G protein coupled receptor:GPCR)がリガンドと結合すると,ヘテロ三量体であるGタンパク質によりさまざまなシグナル伝達系が活性化される.βアレスチン1およびβアレスチン2からなるβアレスチンが細胞質よりリクルートされGタンパク質共役受容体と結合するとGタンパク質に依存的なシグナル伝達系は抑制され,Gタンパク質共役受容体は脱感作および内在化する.そして,βアレスチンはGタンパク質に非依存的かつβアレスチンに依存的なシグナル伝達系を活性化する.ほかにも,βアレスチンには細胞質において多くの結合タンパク質を介した多様な機能のあることが知られている1-3).
Gタンパク質共役受容体は多くの薬剤の標的となっており,合成されたリガンドにより,Gタンパク質に依存的なシグナル伝達系への伝達とβアレスチンに依存的なシグナル伝達系への伝達とのバランスがどちらかにかたよる“バイアス化”の起こることが着目され,薬効と関連して精力的に解析されている.これまで,ある種のGタンパク質共役受容体において,Gタンパク質共役受容体に直接に作用することによりシグナル伝達系をアロステリックにかたよらせることは知られていたが,より広い範囲において影響をおよぼすような内因性の機構についてはよく知られていない.
S-ニトロシル化は一酸化窒素による翻訳後修飾であり,多くのタンパク質の機能の制御を介して細胞の生理機能に影響する4,5).Gタンパク質共役受容体の制御にかかわるタンパク質の多くが内皮型一酸化窒素合成酵素によりS-ニトロシル化され,Gタンパク質共役受容体の内在化に影響する6-8).これまで,βアレスチン2はアゴニストに依存して内皮型一酸化窒素合成酵素によりS-ニトロシル化され,Gタンパク質共役受容体の内在化を制御することが明らかにされている.この研究において,筆者らは,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチンの新たなS-ニトロシル化の機能について検討した.
1.βアレスチンは神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素によりS-ニトロシル化され二量体化する
これまでに,βアレスチン2は内皮型一酸化窒素合成酵素によりCys410がS-ニトロシル化されるが,βアレスチン1は内皮型一酸化窒素合成酵素によりS-ニトロシル化されないことがわかっていた6).βアレスチンが神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素と結合するかどうか免疫沈降法により検討したところ,βアレスチン1およびβアレスチン2は神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素と結合することがわかった.さらに,S-ニトロシル化について検討したところ,βアレスチンは神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されることがわかり,βアレスチン1はCys251,βアレスチン2はCys253と,内皮型一酸化窒素合成酵素とは異なるCysがS-ニトロシル化された.
神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されるCysの近傍にはβアレスチンの二量体化に関与するイノシトールヘキサキスリン酸との結合部位9),および,Gタンパク質共役受容体のひとつβ2アドレナリン受容体との結合部位が存在する10).βアレスチンの二量体化について検討するため,異なるタグを付加した野生型のβアレスチンあるいはS-ニトロシル化されるCysをSerに置換したβアレスチンを用いて免疫沈降法により検討したところ,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりひき起こされる二量体化はS-ニトロシル化されない変異体では抑制された.一方,内皮型一酸化窒素合成酵素によるCys410のS-ニトロシル化は二量体化には関与しなかった.リポ多糖により刺激し誘導型一酸化窒素合成酵素の発現を誘導したRAW264.7細胞においても,内因性のβアレスチンの二量体化が確認された.これらの結果から,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチンのS-ニトロシル化はその二量体化に関与することが示唆された.
2.βアレスチンのS-ニトロシル化はGタンパク質共役受容体からのシグナルをGタンパク質に依存的なシグナル伝達系へとかたよらせる
神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によりS-ニトロシル化されるβアレスチン2のCys253はβ2アドレナリン受容体との結合部位の近傍にあることから,βアレスチン2とβ2アドレナリン受容体との結合を免疫沈降法により検討した.その結果,アゴニストであるイソプロテレノールにより活性化させたβ2アドレナリン受容体とβアレスチン2との結合は神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素の強制発現のもとにおいては抑制されたが,S-ニトロシル化されないβアレスチン2の変異体においては抑制されなかった.さらに,β2アドレナリン受容体を活性化させたのちのβアレスチン2の細胞膜へのリクルートも抑制された.同様に、β2アドレナリン受容体の内在化も抑制され,βアレスチンに依存性のシグナル伝達系も抑制されていた.しかしながら,アゴニストにより活性化されるGタンパク質に依存的なシグナル伝達系には影響しなかった.ほかのGタンパク質共役受容体として,アンジオテンシン受容体やブラジキニン受容体においても同様な傾向が認められたことから,βアレスチン2のCys253のS-ニトロシル化はGタンパク質共役受容体からのシグナルをGタンパク質に依存的なシグナル伝達系へとかたよらせることが示された.
3.S-ニトロシル化されたβアレスチンはMDM2-p53経路を制御する
βアレスチンはシグナルタンパク質から転写因子まで,多くの非受容体タンパク質と結合することが報告されている3).MDM2はがん遺伝子産物として知られ,がん抑制遺伝子産物p53と結合しその活性を抑制する.βアレスチン2はMDM2と結合することが知られているが,S-ニトロシル化によりMDM2との結合は増強された.免疫染色法による検討により,βアレスチン2のS-ニトロシル化によりMDM2の局在は核から細胞質へと変化することがわかったが,p53の核への局在には変化が認められなかった.MDM2とp53との結合を免疫沈降法により確認したところ,βアレスチン2のS-ニトロシル化によりMDM2とp53との結合が抑制された.これより,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるβアレスチン2のCys253のS-ニトロシル化により,MDM2の局在が核から細胞質へと変化しp53との結合が抑制されることが示唆され,βアレスチン2のCys253のS-ニトロシル化はGタンパク質共役受容体に非依存的にMDM2-p53経路を制御することが示唆された.
4.心不全および老化においてβアレスチンのS-ニトロシル化は増加する
疾患や老化との関連性について検討するため,心不全モデルマウスにおいてβアレスチンのS-ニトロシル化について検討した.その結果,心不全モデルマウスにおいては神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素の発現量が増加したが,内皮型一酸化窒素合成酵素の発現量は変化しなかった.S-ニトロシル化について比較したところ,対照と比べ,βアレスチン1およびβアレスチン2においてS-ニトロシル化が増加しており,さらに,二量体化も増加していた.βアレスチン1は内皮型一酸化窒素合成酵素によりS-ニトロシル化されないため6),心不全モデルマウスにおいてみられたS-ニトロシル化の増加は,神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるものと示唆された.同様に,ヒトの心不全の試料を用いて検討したところ,誘導型一酸化窒素合成酵素の発現の上昇が認められ,S-ニトロシル化も同様に増加していた.マウスの心臓および肺において,老化とともに神経型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素の発現は上昇し,内皮型一酸化窒素合成酵素の発現は低下した.βアレスチン1については老化したマウスにおいてS-ニトロシル化および二量体化が増加したが,βアレスチン2についてはS-ニトロシル化は若いマウスと老化したマウスとで差は認められなかったが,二量体化は老化したマウスのほうが増加していた.これは,老化においては神経型一酸化窒素合成酵素あるいは誘導型一酸化窒素合成酵素によるS-ニトロシル化は増加するが,内皮型一酸化窒素合成酵素によるS-ニトロシル化は減少したため,総合的なS-ニトロシル化は変化しなかったのではないかと推測された.これらの結果から,心不全や老化においてβアレスチン2のCys253のS-ニトロシル化は増加することが示唆された.
5.心不全モデルマウスにおいてS-ニトロシル化されたβアレスチン2は心保護作用を示す
βアレスチンのS-ニトロシル化が心不全の病態におよぼす影響について検討した.βアレスチン2のCys253をSerに置換してS-ニトロシル化されないノックインマウスを作製し,βアレスチン2の発現量には変化のないことを確認した.野生型のマウスおよびこのノックインマウスにおいて圧負荷による心不全モデルを作製しβアレスチン2のS-ニトロシル化および二量体化について検討したところ,ノックインマウスにおいてはS-ニトロシル化および二量体化が減少した.超音波検査により心機能を評価したところ,ノックインマウスは野生型のマウスに比べ増悪していることがわかった.ウェスタンブロット法を用いて,Gタンパク質に依存的なシグナル伝達系としてcAMPの下流のPhospholambanのリン酸化,βアレスチンに依存的なシグナル伝達系としてERKのリン酸化について比較した.その結果,野生型のマウスにおいてはPhospholambanのリン酸化が強くERKのリン酸化が弱いGタンパク質に依存的なシグナルへのかたより,ノックインマウスにおいてはPhospholambanのリン酸化が弱くERKのリン酸化が強いβアレスチンに依存的なシグナルへのかたよりが検出され,心不全の状態においてβアレスチンのS-ニトロシル化がGタンパク質共役受容体からのシグナルの伝達をかたよらせることが示唆された.
イソプロテレノールにより活性化される心機能について超音波検査により評価したところ,S-ニトロシル化されないノックインマウスにおいては野生型のマウスと比較して心拍数および収縮能が上昇しなかった.心臓においてアドレナリン受容体を解析したところ,このノックインマウスにおいてはアドレナリン受容体の減少が認められ,Gタンパク質共役受容体の内在化が促進されている可能性が示唆された.また,ノックインマウスの心臓においてはβアレスチンの発現量が増加していたが,βアレスチンをコードするmRNAの量には変化がみられなかったことから,S-ニトロシル化を介したなんらかの翻訳後の発現制御機構のあることが推測された.さらに,ノックインマウスにおいてはHIF1αおよびpVHLの発現も上昇しており,βアレスチンのS-ニトロシル化がHIF1α-p53経路に影響する可能性も示された.
おわりに
この研究において,βアレスチンのS-ニトロシル化によりGタンパク質共役受容体からのシグナルが内因性にかたよって伝達され,p53-MDM2経路など受容体に非依存的な機構にも影響をおよぼすことが示唆された.さらに,心不全の病態においてはβアレスチンがGタンパク質共役受容体の機能を制御することにより心保護作用を示すことが示され(図1),Gタンパク質共役受容体の機能が関与しうる多くの病態において,βアレスチンのS-ニトロシル化はこれまで予期されなかった病態の決定素因になりうる可能性が示唆された.
文 献
- Ahn, S. J., Nelson, C. D., Garrison, T. R. et al.: Desensitization, internalization, and signaling functions of β-arrestins demonstrated by RNA interference. Proc. Natl. Acad. Sci. USA, 100, 1740-1744 (2003)[PubMed]
- Lefkowitz, R. J. & Shenoy, S. K.: Transduction of receptor signals by β-arrestins. Science, 308, 512-517 (2005)[PubMed]
- Ma, L. & Pei, G.: β-arrestin signaling and regulation of transcription. J. Cell Sci., 120, 213-218 (2007)[PubMed]
- Hess, D. T., Matsumoto, A., Kim, S. O. et al.: Protein S-nitrosylation: purview and parameters. Nat. Rev. Mol. Cell Biol., 6, 150-166 (2005)[PubMed]
- Haldar, S. M. & Stamler, J. S.: S-nitrosylation: integrator of cardiovascular performance and oxygen delivery. J. Clin. Inverst., 123, 101-110 (2013)[PubMed]
- Ozawa, K., Whalen, E. J., Nelson, C. D. et al.: S-nitrosylation of β-arrestin regulates β-adrenergic receptor trafficking. Mol. Cell, 31, 395-405 (2008)[PubMed]
- Wang, G., Moniri, N. H., Ozawa, K. et al.: Nitric oxide regulates endocytosis by S-nitrosylation of dynamin. Proc. Natl. Acad. Sci. USA, 103, 1295-1300 (2006)[PubMed]
- Whalen, E. J., Foster, M. W., Matsumoto, A. et al.: Regulation of β-adrenergic receptor signaling by S-nitrosylation of G-protein-coupled receptor kinase 2. Cell, 129, 511-522 (2007)[PubMed]
- Milano, S. K., Kim, Y. M., Stefano, F. P. et al.: Nonvisual arrestin oligomerization and cellular localization are regulated by inositol hexakisphosphate binding. J. Biol. Chem., 281. 9812-9823 (2006)[PubMed]
- Shukla, A. K., Westfield, G .H., Xiao, K. et al.: Visualization of arrestin recruitment by a G-protein-coupled receptor. Nature, 512, 218-222 (2014)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,米国Case Western Reserve大学 研究員を経て,大阪大学大学院医学系研究科 助教.
研究テーマ:一酸化窒素による病態の制御機構.生活習慣病の治療ワクチンの開発.
Jonathan S. Stamler
米国Case Western Reserve大学Professor.
© 2018 林 宏樹・Jonathan S. Stamler Licensed under CC 表示 2.1 日本