共生細菌の産生するオス殺し毒素
春本 敏之
(スイスEcole Polytechnique Federale de Lausanne,School of Life Sciences,Global Health Institute)
email:春本敏之
DOI: 10.7875/first.author.2018.056
Male-killing toxin in a bacterial symbiont of Drosophila.
Toshiyuki Harumoto, Bruno Lemaitre
Nature, 557, 252-255 (2018)
昆虫の共生細菌のなかには宿主の性を利己的に操作することにより感染を広めようとするものがいる.キイロショウジョウバエの共生細菌であるスピロプラズマは,宿主のオスだけを発生の際に殺す,いわゆるオス殺しとよばれる現象を起こす.スピロプラズマによるオス殺しは半世紀以上にわたり研究されてきたが,その原因となる共生細菌に由来する物質については明らかにされていなかった.この研究において,筆者らは,スピロプラズマの新規のタンパク質Spaidを同定した.キイロショウジョウバエにSpaidを強制発現させると過剰なアポトーシスや神経の発生の異常といったスピロプラズマに感染したオスの胚に観察される異常が再現された.また,Spaidはオスの性染色体に局在するMSL複合体を介してこれらの異常をひき起こすことが示唆された.Spaidはアンキリンリピートおよび脱ユビキチン化を担うOTUドメインをもち,これらの機能ドメインが細胞における局在および活性に重要であった.さらに,オス殺しの能力が低下したスピロプラズマの系統が見い出され,spaid遺伝子座に大きな欠失のあることが確認された.この研究により,ながらく探求されてきたスピロプラズマのオス殺し毒素が同定されただけでなく,宿主を性に特異的に操作する細菌に由来するタンパク質の存在が明らかにされた.
一部の共生細菌は感染の効率をあげるため,宿主の性を操作する能力を進化させてきた.共生細菌はもっぱらメスの卵巣を介して次世代に伝達されるため,宿主の性比をメスにかたよらせる.具体的には,遺伝学的なオスを妊性のあるメスに変換するメス化,メスの単独での生殖を可能にする単為生殖,オスの選択的な除去であるオス殺しといった生殖の操作が知られており,オス殺しは少なくとも6つの異なる細菌分類群において独立に進化したと考えられている.
スピロプラズマ(Spiroplasma poulsonii)によるオス殺しは,1957年にはじめて報告された1).以降の研究により,オス殺しの原因となる因子として分泌性の物質“androcidin”の存在が想定されたが1),その存在は今日にいたるまで不明であった.多くの共生細菌と同様にスピロプラズマも培養が困難であり,分子生物学的な手法が適用できないことが原因のひとつと考えられる.
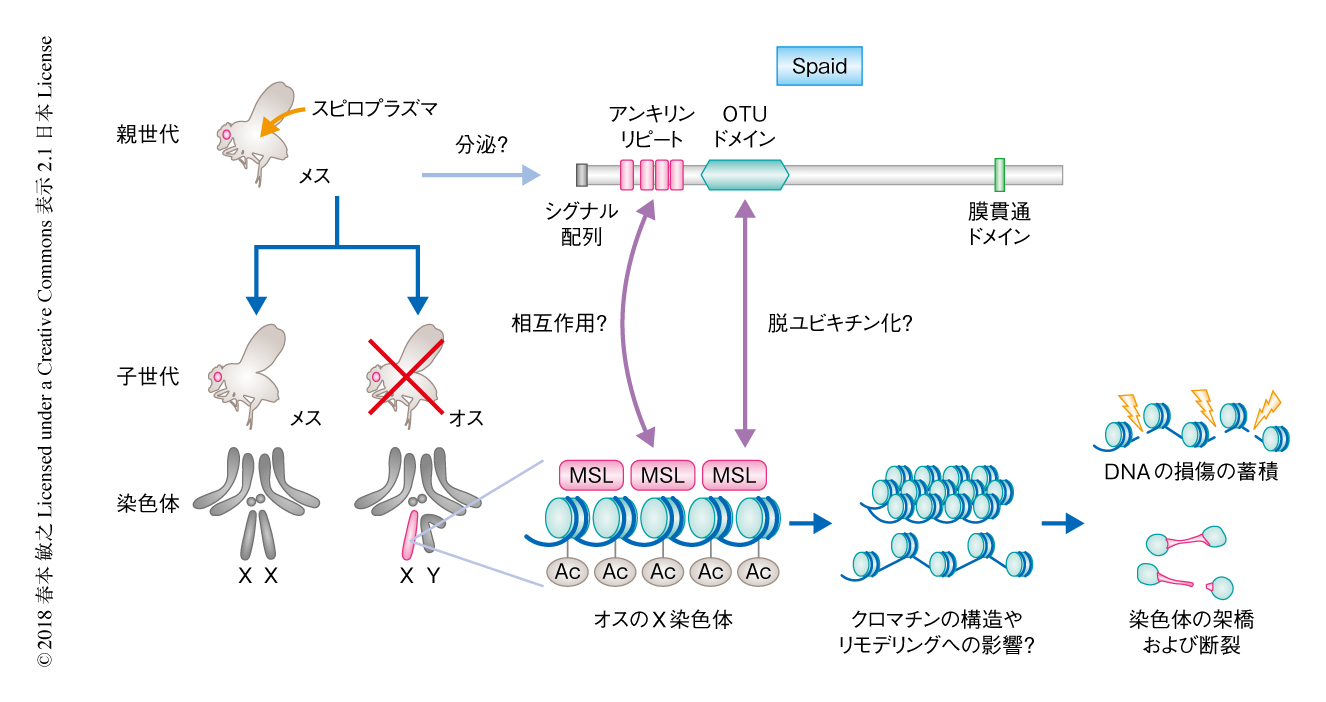
キイロショウジョウバエ(Drosophila melanogaster)にオス殺しを起こすスピロプラズマは宿主の体液に豊富に存在し,体液を移すことにより容易に別の株を感染させることができる.過去に樹立した感染株のなかから,偶然,オス殺しが不完全なスピロプラズマの系統が発見された.この系統のゲノム配列を解読し,オスを完全に殺す系統と比較した結果,とある遺伝子に大きな欠失が見い出された.この遺伝子は1065アミノ酸残基のタンパク質をコードしており,タンパク質間相互作用にかかわるアンキリンリピートおよび脱ユビキチン化を担うOTUドメインをもっていた(図1).アンキリンリピートおよびOTUドメインは真核生物だけでなく細菌にも保存されており,病原細菌が宿主の機構に干渉する際に使用するエフェクタータンパク質にもみられる.また,ほかの細菌のもつ病原性のタンパク質と同様に,プラスミドにコードされていた.このタンパク質をコードする遺伝子は以前に報告されたオス殺しを起こすスピロプラズマのゲノムには記載されておらず2),全長にわたり相同性をもつタンパク質もみつからなかった.この新規のタンパク質をSpaid(S. poulsonii androcidin)と名づけた.
Spaidがオス殺しに関与するのかどうかを確認するため,GAL4/UAS系によりキイロショウジョウバエの全身において強制発現させたところ,オスはすべて致死となり羽化しなかった.一方,メスの生存にはまったく影響がみられなかったことから,Spaidはオスに特異的に作用することが示された.
スピロプラズマに感染したオスの胚は,発生において過剰なアポトーシスおよび神経の発生の異常を起こして致死となる3-5).神経の発生の異常の原因は不明であるが,過剰なアポトーシスとは独立にひき起こされると考えられている4,5).Spaidがオス殺しの原因タンパク質であるとするなら,強制発現によりこれらの表現型が再現されるはずである.実際,胚発生の初期からSpaidを強制発現させたところ,オスの胚においてのみ過剰なアポトーシスおよび異常な神経の発生が観察された.オスの胚におけるアポトーシスは,スピロプラズマに感染した胚と同様に5),発生の経過にともない増加した.Spaidを発現するオスの胚においてアポトーシスは胚の全体にみられたものの,ニューロンは異常なアポトーシスを起こさなかったことから,Spaidの発現はこれら2つの異なる表現型をひき起こすのに十分であると考えられた.
ショウジョウバエのメスはX染色体とよばれる性染色体を2本もつが,オスは1本しかもたない(図1).X染色体にコードされた遺伝子の発現量をメスとオスのあいだで補正するため,オスのX染色体にはMSL複合体とよばれるタンパク質-RNA複合体が結合し,ヒストンの修飾により発現量をほぼ2倍に上昇させる.一方,メスにおいては一部の構成タンパク質が翻訳されないためMSL複合体は形成されない.オスにおけるMSL複合体の形成はスピロプラズマによるオス殺しに関係することが知られており6),このことから,スピロプラズマがこのオスのX染色体に特異的なMSL複合体そのもの,あるいは,下流のヒストンの修飾を標的にすることが示唆されていた7,8).これまでに,筆者らは,スピロプラズマに感染したオスの胚のX染色体においてはDNAに損傷が蓄積しており,細胞分裂の際に染色体の架橋および断裂をともないオスに特異的なアポトーシスをひき起こすことを明らかにしていた8).Spaidを強制発現した胚において,DNAの損傷およびオスのX染色体を抗体染色法により検出したところ,このオスのX染色体に特異的な異常が再現された.
Spaidの細胞における分布について調べるため,サイズが大きく細胞学的な解析が容易な幼虫の唾液腺細胞においてSpaid-GFP融合タンパク質を発現させたところ,性にかかわらず細胞膜,細胞質,そして,核に弱く均一に分布することが観察された.さらに,オスの核においては,SpaidはMSL複合体が検出されたX染色体により強く局在していた.このことから,Spaidはオスのもつ遺伝子量の補償の機構を標的として作用することが示唆された.
Spaidによるオス殺しのしくみをより詳細に理解するため,アンキリンリピートあるいはOTUドメインを欠失したSpaidのコンストラクトを作製した.これらをキイロショウジョウバエの全身に強制発現させたところ,アンキリンリピートを欠失したSpaidはオスを殺さなかったが,OTUドメインを欠失したSpaidはオス殺しをひき起こした.このことから,アンキリンリピートがオス殺しの活性に重要であることが示された.ただし,OTUドメインを欠失したSpaidを発現するオスは,野生型のSpaidを発現する場合と比較して,より発生が進んでから致死となったことから,OTUドメインは完全な毒性の発揮に必要であると考えられた.実際,キイロショウジョウバエの全身に弱い発現を誘導する系を使用した場合には,野生型のSpaidはオス殺しをひき起こした一方,アンキリンリピートを欠失したSpaidおよびOTUドメインを欠失したSpaidはオスを殺さなかった.
唾液腺細胞にこれらを発現させて局在を確認したところ,アンキリンリピートを欠失したSpaidの局在は概して野生型のSpaidと同様であったが,オスのX染色体における強い局在は失われた.一方,OTUドメインを欠失したSpaidの核における分布はオスおよびメスともきわめて弱くなり,オスのX染色体における局在も不明瞭であった.OTUドメインを欠失したSpaidはオス殺しの部分的な活性をもつことが示されたが,これは過剰に発現したSpaidが局在の異常をのりこえた結果として生じたのかもしれない.
以上の結果をまとめると,SpaidはOTUドメインにより宿主の細胞の核へと移行し,アンキリンリピートを介してオスのX染色体に局在するMSL複合体,あるいは,ヒストンの修飾と相互作用することにより染色体に特異的に異常をひき起こすのだろう(図1).OTUドメインが実際に脱ユビキチン化活性をもち,ヒストンをはじめとする核タンパク質のユビキチン化に干渉するとすれば,それによりクロマチンの構造あるいはリモデリングに影響をおよぼす可能性も考えられる(図1).
この研究において,筆者らは,宿主の性に特異的に作用する細菌に由来するタンパク質を同定した.共生細菌による宿主の性の操作はスピロプラズマにかぎらない.たとえば,昆虫に高頻度に共生するボルバキア(Wolbachia)は,感染していないメスが感染していないオスと交配することでしか次世代を残せなくなる,細胞質不和合とよばれる奇妙な現象をひき起こす.近年,この現象の原因タンパク質が同定されたが9,10),これらのタンパク質の一部も脱ユビキチン化にかかわるドメインをもつ.まったく異なるようにみえる生殖の操作が,共通する宿主の機構を標的にするのであれば興味深く,今後の詳細な解析が待たれる.共生細菌はこれらのたくみな手法をどうやって獲得し進化させてきたのだろうか.この問いに答えるには,多彩な共生関係について丹念に調べあげる必要がある.それにより得られた知見は,生命科学における新たな分野の開拓に寄与するだけでなく,感染症を媒介する昆虫や農業における害虫の制御および制圧にも応用されるであろう.
略歴:2011年 京都大学大学院生命科学研究科博士後期課程 修了,2012年 産業技術総合研究所生物プロセス研究部門 博士研究員を経て,2015年よりスイスEcole Polytechnique Federale de Lausanne博士研究員.
研究テーマ:共生細菌による宿主となる昆虫の操作の機構.
© 2018 春本 敏之 Licensed under CC 表示 2.1 日本
(スイスEcole Polytechnique Federale de Lausanne,School of Life Sciences,Global Health Institute)
email:春本敏之
DOI: 10.7875/first.author.2018.056
Male-killing toxin in a bacterial symbiont of Drosophila.
Toshiyuki Harumoto, Bruno Lemaitre
Nature, 557, 252-255 (2018)
要 約
昆虫の共生細菌のなかには宿主の性を利己的に操作することにより感染を広めようとするものがいる.キイロショウジョウバエの共生細菌であるスピロプラズマは,宿主のオスだけを発生の際に殺す,いわゆるオス殺しとよばれる現象を起こす.スピロプラズマによるオス殺しは半世紀以上にわたり研究されてきたが,その原因となる共生細菌に由来する物質については明らかにされていなかった.この研究において,筆者らは,スピロプラズマの新規のタンパク質Spaidを同定した.キイロショウジョウバエにSpaidを強制発現させると過剰なアポトーシスや神経の発生の異常といったスピロプラズマに感染したオスの胚に観察される異常が再現された.また,Spaidはオスの性染色体に局在するMSL複合体を介してこれらの異常をひき起こすことが示唆された.Spaidはアンキリンリピートおよび脱ユビキチン化を担うOTUドメインをもち,これらの機能ドメインが細胞における局在および活性に重要であった.さらに,オス殺しの能力が低下したスピロプラズマの系統が見い出され,spaid遺伝子座に大きな欠失のあることが確認された.この研究により,ながらく探求されてきたスピロプラズマのオス殺し毒素が同定されただけでなく,宿主を性に特異的に操作する細菌に由来するタンパク質の存在が明らかにされた.
はじめに
一部の共生細菌は感染の効率をあげるため,宿主の性を操作する能力を進化させてきた.共生細菌はもっぱらメスの卵巣を介して次世代に伝達されるため,宿主の性比をメスにかたよらせる.具体的には,遺伝学的なオスを妊性のあるメスに変換するメス化,メスの単独での生殖を可能にする単為生殖,オスの選択的な除去であるオス殺しといった生殖の操作が知られており,オス殺しは少なくとも6つの異なる細菌分類群において独立に進化したと考えられている.
スピロプラズマ(Spiroplasma poulsonii)によるオス殺しは,1957年にはじめて報告された1).以降の研究により,オス殺しの原因となる因子として分泌性の物質“androcidin”の存在が想定されたが1),その存在は今日にいたるまで不明であった.多くの共生細菌と同様にスピロプラズマも培養が困難であり,分子生物学的な手法が適用できないことが原因のひとつと考えられる.
1.オス殺し毒素Spaidの発見
キイロショウジョウバエ(Drosophila melanogaster)にオス殺しを起こすスピロプラズマは宿主の体液に豊富に存在し,体液を移すことにより容易に別の株を感染させることができる.過去に樹立した感染株のなかから,偶然,オス殺しが不完全なスピロプラズマの系統が発見された.この系統のゲノム配列を解読し,オスを完全に殺す系統と比較した結果,とある遺伝子に大きな欠失が見い出された.この遺伝子は1065アミノ酸残基のタンパク質をコードしており,タンパク質間相互作用にかかわるアンキリンリピートおよび脱ユビキチン化を担うOTUドメインをもっていた(図1).アンキリンリピートおよびOTUドメインは真核生物だけでなく細菌にも保存されており,病原細菌が宿主の機構に干渉する際に使用するエフェクタータンパク質にもみられる.また,ほかの細菌のもつ病原性のタンパク質と同様に,プラスミドにコードされていた.このタンパク質をコードする遺伝子は以前に報告されたオス殺しを起こすスピロプラズマのゲノムには記載されておらず2),全長にわたり相同性をもつタンパク質もみつからなかった.この新規のタンパク質をSpaid(S. poulsonii androcidin)と名づけた.
2.Spaidの発現によりオス殺しの表現型が再現される
Spaidがオス殺しに関与するのかどうかを確認するため,GAL4/UAS系によりキイロショウジョウバエの全身において強制発現させたところ,オスはすべて致死となり羽化しなかった.一方,メスの生存にはまったく影響がみられなかったことから,Spaidはオスに特異的に作用することが示された.
スピロプラズマに感染したオスの胚は,発生において過剰なアポトーシスおよび神経の発生の異常を起こして致死となる3-5).神経の発生の異常の原因は不明であるが,過剰なアポトーシスとは独立にひき起こされると考えられている4,5).Spaidがオス殺しの原因タンパク質であるとするなら,強制発現によりこれらの表現型が再現されるはずである.実際,胚発生の初期からSpaidを強制発現させたところ,オスの胚においてのみ過剰なアポトーシスおよび異常な神経の発生が観察された.オスの胚におけるアポトーシスは,スピロプラズマに感染した胚と同様に5),発生の経過にともない増加した.Spaidを発現するオスの胚においてアポトーシスは胚の全体にみられたものの,ニューロンは異常なアポトーシスを起こさなかったことから,Spaidの発現はこれら2つの異なる表現型をひき起こすのに十分であると考えられた.
3.Spaidはオスのもつ遺伝子量の補償の機構を標的にする
ショウジョウバエのメスはX染色体とよばれる性染色体を2本もつが,オスは1本しかもたない(図1).X染色体にコードされた遺伝子の発現量をメスとオスのあいだで補正するため,オスのX染色体にはMSL複合体とよばれるタンパク質-RNA複合体が結合し,ヒストンの修飾により発現量をほぼ2倍に上昇させる.一方,メスにおいては一部の構成タンパク質が翻訳されないためMSL複合体は形成されない.オスにおけるMSL複合体の形成はスピロプラズマによるオス殺しに関係することが知られており6),このことから,スピロプラズマがこのオスのX染色体に特異的なMSL複合体そのもの,あるいは,下流のヒストンの修飾を標的にすることが示唆されていた7,8).これまでに,筆者らは,スピロプラズマに感染したオスの胚のX染色体においてはDNAに損傷が蓄積しており,細胞分裂の際に染色体の架橋および断裂をともないオスに特異的なアポトーシスをひき起こすことを明らかにしていた8).Spaidを強制発現した胚において,DNAの損傷およびオスのX染色体を抗体染色法により検出したところ,このオスのX染色体に特異的な異常が再現された.
Spaidの細胞における分布について調べるため,サイズが大きく細胞学的な解析が容易な幼虫の唾液腺細胞においてSpaid-GFP融合タンパク質を発現させたところ,性にかかわらず細胞膜,細胞質,そして,核に弱く均一に分布することが観察された.さらに,オスの核においては,SpaidはMSL複合体が検出されたX染色体により強く局在していた.このことから,Spaidはオスのもつ遺伝子量の補償の機構を標的として作用することが示唆された.
4.Spaidの機能ドメインの役割
Spaidによるオス殺しのしくみをより詳細に理解するため,アンキリンリピートあるいはOTUドメインを欠失したSpaidのコンストラクトを作製した.これらをキイロショウジョウバエの全身に強制発現させたところ,アンキリンリピートを欠失したSpaidはオスを殺さなかったが,OTUドメインを欠失したSpaidはオス殺しをひき起こした.このことから,アンキリンリピートがオス殺しの活性に重要であることが示された.ただし,OTUドメインを欠失したSpaidを発現するオスは,野生型のSpaidを発現する場合と比較して,より発生が進んでから致死となったことから,OTUドメインは完全な毒性の発揮に必要であると考えられた.実際,キイロショウジョウバエの全身に弱い発現を誘導する系を使用した場合には,野生型のSpaidはオス殺しをひき起こした一方,アンキリンリピートを欠失したSpaidおよびOTUドメインを欠失したSpaidはオスを殺さなかった.
唾液腺細胞にこれらを発現させて局在を確認したところ,アンキリンリピートを欠失したSpaidの局在は概して野生型のSpaidと同様であったが,オスのX染色体における強い局在は失われた.一方,OTUドメインを欠失したSpaidの核における分布はオスおよびメスともきわめて弱くなり,オスのX染色体における局在も不明瞭であった.OTUドメインを欠失したSpaidはオス殺しの部分的な活性をもつことが示されたが,これは過剰に発現したSpaidが局在の異常をのりこえた結果として生じたのかもしれない.
以上の結果をまとめると,SpaidはOTUドメインにより宿主の細胞の核へと移行し,アンキリンリピートを介してオスのX染色体に局在するMSL複合体,あるいは,ヒストンの修飾と相互作用することにより染色体に特異的に異常をひき起こすのだろう(図1).OTUドメインが実際に脱ユビキチン化活性をもち,ヒストンをはじめとする核タンパク質のユビキチン化に干渉するとすれば,それによりクロマチンの構造あるいはリモデリングに影響をおよぼす可能性も考えられる(図1).
おわりに
この研究において,筆者らは,宿主の性に特異的に作用する細菌に由来するタンパク質を同定した.共生細菌による宿主の性の操作はスピロプラズマにかぎらない.たとえば,昆虫に高頻度に共生するボルバキア(Wolbachia)は,感染していないメスが感染していないオスと交配することでしか次世代を残せなくなる,細胞質不和合とよばれる奇妙な現象をひき起こす.近年,この現象の原因タンパク質が同定されたが9,10),これらのタンパク質の一部も脱ユビキチン化にかかわるドメインをもつ.まったく異なるようにみえる生殖の操作が,共通する宿主の機構を標的にするのであれば興味深く,今後の詳細な解析が待たれる.共生細菌はこれらのたくみな手法をどうやって獲得し進化させてきたのだろうか.この問いに答えるには,多彩な共生関係について丹念に調べあげる必要がある.それにより得られた知見は,生命科学における新たな分野の開拓に寄与するだけでなく,感染症を媒介する昆虫や農業における害虫の制御および制圧にも応用されるであろう.
文 献
- Williamson, D. L. & Poulson, D. F.: Sex ratio organisms (Spiroplasmas) of Drosophila. in The Mycoplasmas, Volume III: Plant and Insect Mycoplasmas (Whitcomb R. F. & Tully J. G. eds.), pp. 175-208, Academic Press, New York (1979)
- Paredes, J. C., Herren, J. K., Schupfer, F. et al.: Genome sequence of the Drosophila melanogaster male-killing Spiroplasma strain MSRO endosymbiont. MBio, 6, e02437-14 (2015)[PubMed]
- Bentley, J. K., Veneti, Z., Heraty, J. et al.: The pathology of embryo death caused by the male-killing Spiroplasma bacterium in Drosophila nebulosa. BMC Biol., 5, 9 (2007)[PubMed]
- Martin, J., Chong, T. & Ferree, P. M.: Male killing Spiroplasma preferentially disrupts neural development in the Drosophila melanogaster embryo. PLoS One, 8, e79368 (2013)[PubMed]
- Harumoto, T., Anbutsu, H. & Fukatsu, T.: Male-killing Spiroplasma induces sex-specific cell death via host apoptotic pathway. PLoS Pathog., 10, e1003956 (2014)[PubMed]
- Veneti, Z., Bentley, J. K., Koana, T. et al.: A functional dosage compensation complex required for male killing in Drosophila. Science, 307, 1461-1463 (2005)[PubMed]
- Cheng, B., Kuppanda, N., Aldrich, J. C. et al.: Male-killing Spiroplasma alters behavior of the dosage compensation complex during Drosophila melanogaster embryogenesis. Curr. Biol., 26, 1339-1345 (2016)[PubMed]
- Harumoto, T., Anbutsu, H., Lemaitre, B. et al.: Male-killing symbiont damages host’s dosage-compensated sex chromosome to induce embryonic apoptosis. Nat. Commun., 7, 12781 (2016)[PubMed]
- Beckmann, J. F., Ronau, J. A. & Hochstrasser, M.: A Wolbachia deubiquitylating enzyme induces cytoplasmic incompatibility. Nat. Microbiol., 2, 17007 (2017)[PubMed]
- LePage, D. P., Metcalf, J. A., Bordenstein, S. R. et al.: Prophage WO genes recapitulate and enhance Wolbachia-induced cytoplasmic incompatibility. Nature, 543, 243-247 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 京都大学大学院生命科学研究科博士後期課程 修了,2012年 産業技術総合研究所生物プロセス研究部門 博士研究員を経て,2015年よりスイスEcole Polytechnique Federale de Lausanne博士研究員.
研究テーマ:共生細菌による宿主となる昆虫の操作の機構.
© 2018 春本 敏之 Licensed under CC 表示 2.1 日本