Spred1は食餌性のストレスに対し造血幹細胞の恒常性を維持する
田所優子・平尾 敦
(金沢大学がん進展制御研究所 遺伝子・染色体構築研究分野)
email:田所優子,平尾 敦
DOI: 10.7875/first.author.2018.054
Spred1 safeguards hematopoietic homeostasis against diet-induced systemic stress.
Yuko Tadokoro, Takayuki Hoshii, Satoshi Yamazaki, Koji Eto, Hideo Ema, Masahiko Kobayashi, Masaya Ueno, Kumiko Ohta, Yuriko Arai, Eiji Hara, Kenichi Harada, Masanobu Oshima, Hiroko Oshima, Fumio Arai, Akihiko Yoshimura, Hiromitsu Nakauchi, Atsushi Hirao
Cell Stem Cell, 22, 713-725.e8 (2018)
造血幹細胞は一生にわたり血液の恒常性を維持するが,造血幹細胞の制御の破綻は造血の不全や腫瘍化をひき起こす.これまで,造血幹細胞の制御に影響をおよぼすさまざまなストレスが報告されてきたが,食餌が造血幹細胞の自己複製にどのような影響をおよぼすのかについては知られていなかった.この研究において,筆者らは,RAS-MAPKシグナル伝達系を抑制的に制御するSpred1が,高脂肪食を摂取させたマウスにおいて造血幹細胞の恒常性を維持するのに必須であることを明らかにした.定常な状態において,Spred1は,RhoキナーゼのひとつROCKの活性を介して造血幹細胞の自己複製能を抑制的に制御する.Spred1を欠損した造血幹細胞はニッチとの相互作用が強くなり,幹細胞の機能や細胞競合能が亢進し加齢や細菌の感染などのストレスに対し抵抗性を示したが,血液の異常は認められず白血病も発症しなかった.しかし,高脂肪食を摂取させたSpred1ノックアウトマウスは造血幹細胞において異常なERKシグナルの活性化が起こり,幹細胞の機能の低下,重度の貧血,骨髄増殖性腫瘍をひき起こして死亡した.この血液の異常は抗生剤の投与による腸内の除菌により軽減したことから,腸内細菌叢の変化が関与することが示唆された.以上の結果から,高脂肪食の摂取によりひき起こされるストレスはSpred1による造血幹細胞の制御シグナルに作用し,造血幹細胞の恒常性の維持に影響をおよぼすことが示された.
造血幹細胞は骨髄のニッチにおいて自己複製能および多分化能をもつ細胞として存在し,血液の恒常性の維持に寄与する.このような幹細胞の制御機構を解明することは,組織恒常性の維持やさまざまな疾患の原因を理解するうえで重要である.造血幹細胞は加齢などのさまざまなストレスにさらされており,これらのストレスによる造血幹細胞の制御機構の破綻は造血の不全や腫瘍化をひき起こす.しかし,食餌における脂肪の過剰な摂取など,過栄養状態が造血幹細胞の自己複製にどのような影響をおよぼすのかについてはこれまで知られていなかった.
造血幹細胞の維持にはサイトカインであるSCFによるc-Kit受容体からのシグナル伝達系が必須である.Spred1はc-Kit結合ドメインをもち,SCF-c-Kitシグナル伝達系を抑制的に制御するタンパク質として発見された1).また,SPRED1遺伝子はヒトにおけるRAS-MAPK症候群のひとつであるレジウス症候群の原因遺伝子であり2),一般に,ほかのRAS-MAPK症候群においてはがん化のリスクが高くなることが知られていたものの,レジウス症候群は例外的にがんをひき起こす傾向はないとされてきた3).しかし,さまざまな腫瘍においてSPRED1遺伝子の発現の低下が報告されており4-6),Spred1に腫瘍の抑制能があるのかどうかについては明らかにされていなかった.
筆者らは,このようなSCF-c-Kitシグナル伝達系や腫瘍化に関与するSpred1に着目し,さまざまなストレスに対する応答性を解析することにより造血幹細胞の制御機構を理解しようと研究を進めてきた.
血液細胞におけるSpred1の発現について調べたところ,骨髄の長期の再構築能をもつもっとも未分化な造血幹細胞では発現が低く,少し分化した造血幹細胞や前駆細胞において高い発現を示した.しかし,もっとも未分化な造血幹細胞においてはSCFの刺激に対しSpred1がすみやかに応答し,c-Kitシグナルの強さを微調整することがわかった.また,Spred1は加齢,連続移植,細菌の感染を模したリポ多糖の投与など幹細胞の機能を低下させるストレスに対し,造血幹細胞において高い発現を示した.このように,Spred1は定常の状態において幹細胞の機能を抑制することが示唆された.
造血幹細胞におけるSpred1の役割について調べるため,Spred1ノックアウトマウスを解析した.Spred1ノックアウトマウスは骨格や皮膚の色などにおいてレジウス症候群の特徴を示したものの,健康であり加齢しても血液の異常は示さなかった.しかし,Spred1を欠損した造血幹細胞はin vitroにおいて非対称性分裂の亢進により自己複製能が上昇しており,支持細胞との共培養において高いコロニー形成能を示した.このコロニー形成能の亢進は造血幹細胞の単独での培養では認められず,支持細胞との相互作用に依存することが示唆された.また,in vivoにおける骨髄移植の解析により,骨髄の再構築能や細胞競合能の亢進,造血幹細胞の寿命の延長が起こることが明らかにされた.しかし,Spred1を欠損した造血幹細胞が過剰に増殖することはなく,白血病などを発症することはなかった.また,これらの表現型はSpred1のコンディショナルノックアウトを用いた定常な状態の造血幹細胞においても確認された.このように,Spred1の欠損は造血幹細胞の自己複製能を亢進するが,ニッチの制御下において正常な範囲に維持されていることが明らかにされた.
Spred1を欠損した造血幹細胞における自己複製能の亢進の分子機構について理解するため,造血幹細胞および造血前駆細胞における遺伝子の発現およびシグナル伝達系を解析した.その結果,予想に反して,Spred1を欠損した造血幹細胞においてERKシグナル伝達系の活性化はみられず,アクチンの動態の制御にかかわる遺伝子の発現が活性化していた.実際に,Spred1を欠損した造血幹細胞においては,SCFの刺激によりアクチンの重合が亢進し,アクチンの重合を制御するRhoキナーゼであるROCKが活性化した.Spred1を欠損した造血幹細胞における自己複製能の亢進がROCKの活性化によるものであるかどうかを確認するため,ROCK阻害剤の効果について検証した.その結果,ROCK活性の阻害はin vitroおよびin vivoにおいてSpred1を欠損した造血幹細胞における幹細胞の機能の亢進を正常化した.一方,ERK阻害剤などによるほかのシグナル伝達系の阻害では効果は認められなかった.以上の結果から,定常な状態の造血幹細胞におけるSpred1の欠損はERKシグナル伝達系には影響をあたえず,ROCKシグナルが活性化することにより白血病化することなく正常な範囲において自己複製能を亢進することが明らかにされた.
Spred1の欠損は造血幹細胞の自己複製能を亢進するにもかかわらず,なぜ正常に保たれているのだろうか? SpredファミリーはSpred1,Spred2,Spred3から構成され,Spred1およびSpred2がc-Kit結合ドメインをもつ.Spred1を欠損した造血幹細胞においてSpred2遺伝子の発現の上昇が認められたことから,Spred2による相補的な作用が考えられた.Spred2を欠損した造血幹細胞を解析したところ,Spred1を欠損した造血幹細胞のような表現型は認められなかった.しかし,Spred1 Spred2ダブルコンディショナルノックアウトマウスを作製し解析したところ,二重欠損をひき起こしたのち3カ月ほどで,Gr-1陽性Mac-1陽性の骨髄球系細胞の異常な増殖にともなう末梢血における白血球の増加や血小板の増加,重度の貧血,脾腫や肝臓などへの骨髄球系細胞の浸潤が起こり死亡した.末梢血に芽球は認められなかったことから,骨髄増殖性腫瘍様の病態を発症したことが明らかにされた.さらに,この骨髄増殖性腫瘍様の病態を発症したマウスの骨髄細胞は,ほかのマウスへの移植によりふたたび骨髄増殖性腫瘍様の病態を発症させたことから,悪性転換したことがわかった.また,c-Kitシグナルの活性化と関連して,回盲部においてPDGFRα陽性の間質細胞の異常な増殖により腫瘍化が認められた.さらに,骨髄の解析の結果,もっとも未分化な造血幹細胞の画分のみが異常に増殖しており,アクチンの重合の恒常的な亢進,および,ERK,AKT,STAT5の異常な活性化が認められた.この骨髄増殖性腫瘍様の病態の発症におけるROCKの活性化の関与について調べるため,ROCKの阻害剤の効果について検証した.ROCK阻害剤はSpred1およびSpred2を二重欠損した造血幹細胞のin vitroにおけるコロニー形成能の亢進やin vivoにおける脾腫を改善したが,最終的な骨髄増殖性腫瘍様の病態の発症に対しては有意な効果は認められなかった.このことから,Spred1およびSpred2を二重欠損した造血幹細胞の腫瘍化には,ROCKの活性化のほか,ERKなどの活性化が大きく関与することが示唆された.以上の結果から,Spred1およびSpred2は造血幹細胞の異常な自己複製による腫瘍化をふせぐため相補的に機能しており,Spred1は潜在的に腫瘍の抑制能をもつことが明らかにされた.
造血幹細胞の自己複製は造血幹細胞をとりまく微小環境の影響をうける.さきに述べたように,野生型の造血幹細胞において,Spred1は加齢,連続移植,リポ多糖の投与といったさまざまなストレスに応答し発現が上昇する.それにともない,野生型の造血幹細胞においては幹細胞の機能が低下することが確認された.一方,Spred1を欠損した造血幹細胞はこれらのストレスに対し抵抗性を示し,高い幹細胞の機能を保持した.このことから,ストレスに対する造血幹細胞の機能の低下の原因には,一部にSpred1の発現の上昇が関与することが示唆された.
Spred1は造血幹細胞において絶妙な発現量を保ち自己複製能を制御するが,基本的に抑制的なはたらきをする.Spred1はどのようなときに腫瘍の抑制能を発揮するのだろうか,また,造血幹細胞にとりSpred1は本当に必要なのだろうか? 筆者らは,加齢やリポ多糖の投与などによる慢性炎症と造血幹細胞の自己複製との関連を調べる一環として,高脂肪食の摂取による造血幹細胞への影響についても研究しており,高脂肪食を摂取させたSpred1ノックアウトマウスは骨髄増殖性腫瘍様の病態を発症して死亡することを発見した.高脂肪食を摂取させたSpred1ノックアウトマウスは,Spred1 Spred2ダブルノックアウトマウスのようにGr-1陽性Mac-1陽性の骨髄球系細胞の異常な増殖にともなう芽球が認められない末梢血における白血球の増加や血小板の増加,重度の貧血,脾腫をひき起こした.これらの表現型はオスよりもメスにおいて顕著であった.また,Spred1およびSpred2の二重欠損とは異なり,高脂肪食の摂取により骨髄増殖性腫瘍様の病態を発症したSpred1ノックアウトマウスの骨髄細胞は,ほかの野生型のマウスへ移植しても骨髄増殖性腫瘍様の病態を再発させなかった.このことから,環境が正常化することにより可逆的であることが示唆された.
高脂肪食の摂取によりひき起こされるストレスに対するSpred1を欠損した造血幹細胞の変化について解析した.その結果,4週間という短期間の高脂肪食の摂取においては,Spred1を欠損した造血幹細胞は通常食を摂取させたときよりもさらに幹細胞の機能が亢進した.しかし,20週間以上の長期間の高脂肪食の摂取においては,Spred1を欠損した造血幹細胞の機能は大きく低下し造血幹細胞を失う結果となった.Spred1およびSpred2を二重欠損した造血幹細胞についても詳細に解析した結果,異常な自己複製の亢進が起こるものの,最終的に幹細胞の機能を失っており,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞と同様の結果を示した.また,野生型のマウスにSpred1を欠損した骨髄細胞を移植して血液を置き換えたのち高脂肪食を摂取させると,Spred1ノックアウトマウスに比べおだやかな骨髄増殖性腫瘍様の病態を発症した.このことから,造血幹細胞のほかニッチの側のSpred1の欠損の関与も暗示された.
高脂肪食の摂取によりSpred1ノックアウトマウスが骨髄増殖性腫瘍様の病態を発症する分子機構について理解するため,造血幹細胞においてシグナル伝達系を解析した.その結果,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞においては,通常食を摂取させたときと比較して,アクチンの重合のさらなる亢進は認められなかった.この点は,Spred1およびSpred2の二重欠損による悪性転換とは異なった.しかし,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞においては,SCFの刺激により過剰なERKの活性化がひき起こされた.このように,高脂肪食の摂取はSpred1を欠損した造血幹細胞においてERKの異常な活性化をひき起こし,骨髄増殖性腫瘍様の病態を発症させることが明らかにされた.以上の結果をまとめると,高脂肪食の摂取によりひき起こされるストレスは,Spred1による造血幹細胞の制御シグナルを異常に活性化し,腫瘍化を起こす.
高脂肪食の摂取は,腸内細菌叢においてグラム陽性細菌の割合が上昇することによりバランスを変化させ,その結果,産生される代謝産物やサイトカインなどにより腫瘍化のリスクが高まることが報告されている7)(新着論文レビュー でも掲載).そこで,野生型のマウスおよびSpred1ノックアウトマウスの腸内細菌叢を解析した結果,通常食の摂取および高脂肪食の摂取においてSpred1の有無により腸内細菌叢の構成に差はみられなかったが,通常食の摂取に比較して高脂肪食の摂取ではグラム陽性細菌の割合が上昇した.抗生剤の投与により腸内を除菌したところ,高脂肪食を摂取させたSpred1ノックアウトマウスの骨髄増殖性腫瘍様の病態の発症が有意に遅延した.さらに,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞の機能の低下も抗生剤の投与により回避された.
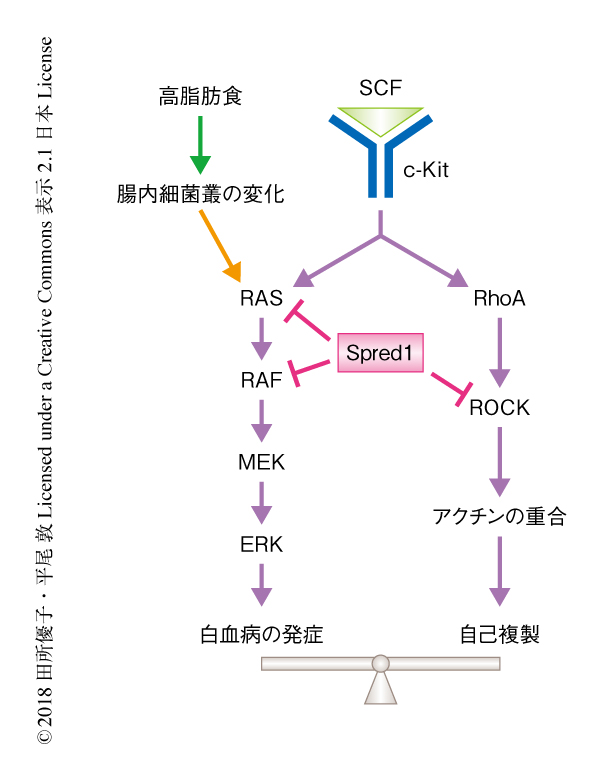
以上の結果から,腸内細菌叢は高脂肪食を摂取させたSpred1ノックアウトマウスにおける血液の異常に大きく関与することが明らかにされた.このように,Spred1は高脂肪食の摂取によりひき起こされるストレスから造血幹細胞の恒常性を維持するために必須の役割をはたすことがわかった(図1).
これまで,BMIなどの肥満指数と白血病の発症との関係について,疫学的な研究からその相関が示唆されていたが,実際に,肥満をひき起こすような食習慣が白血病の発症につながるとは考えられていなかった.今回の研究により,脂肪の過剰な摂取により白血病や造血の不全をひき起こさないよう防御するシステムの存在が明らかにされた.今後は,腸内細菌に由来する何が造血系に影響をおよぼすのか,また,造血幹細胞やニッチ細胞を含め何が起こっているのか,臓器間および細胞間を含め詳細に解析することにより,これまでの微小環境における幹細胞の制御だけでなく,全身における幹細胞の制御機構が明らかにされるのではないかと思われる.
略歴:2004年 大阪大学大学院薬学研究科博士後期課程 修了,同年 東京大学医科学研究所 ポスドクを経て,2007年より金沢大学がん研究所 助教(現 金沢大学がん進展制御研究所 助教).
研究テーマ:幹細胞における自己複製能の制御の機構.
平尾 敦(Atsushi Hirao)
金沢大学がん進展制御研究所 教授.
研究室URL:http://cri-mol-gen.w3.kanazawa-u.ac.jp/
© 2018 田所優子・平尾 敦 Licensed under CC 表示 2.1 日本
(金沢大学がん進展制御研究所 遺伝子・染色体構築研究分野)
email:田所優子,平尾 敦
DOI: 10.7875/first.author.2018.054
Spred1 safeguards hematopoietic homeostasis against diet-induced systemic stress.
Yuko Tadokoro, Takayuki Hoshii, Satoshi Yamazaki, Koji Eto, Hideo Ema, Masahiko Kobayashi, Masaya Ueno, Kumiko Ohta, Yuriko Arai, Eiji Hara, Kenichi Harada, Masanobu Oshima, Hiroko Oshima, Fumio Arai, Akihiko Yoshimura, Hiromitsu Nakauchi, Atsushi Hirao
Cell Stem Cell, 22, 713-725.e8 (2018)
要 約
造血幹細胞は一生にわたり血液の恒常性を維持するが,造血幹細胞の制御の破綻は造血の不全や腫瘍化をひき起こす.これまで,造血幹細胞の制御に影響をおよぼすさまざまなストレスが報告されてきたが,食餌が造血幹細胞の自己複製にどのような影響をおよぼすのかについては知られていなかった.この研究において,筆者らは,RAS-MAPKシグナル伝達系を抑制的に制御するSpred1が,高脂肪食を摂取させたマウスにおいて造血幹細胞の恒常性を維持するのに必須であることを明らかにした.定常な状態において,Spred1は,RhoキナーゼのひとつROCKの活性を介して造血幹細胞の自己複製能を抑制的に制御する.Spred1を欠損した造血幹細胞はニッチとの相互作用が強くなり,幹細胞の機能や細胞競合能が亢進し加齢や細菌の感染などのストレスに対し抵抗性を示したが,血液の異常は認められず白血病も発症しなかった.しかし,高脂肪食を摂取させたSpred1ノックアウトマウスは造血幹細胞において異常なERKシグナルの活性化が起こり,幹細胞の機能の低下,重度の貧血,骨髄増殖性腫瘍をひき起こして死亡した.この血液の異常は抗生剤の投与による腸内の除菌により軽減したことから,腸内細菌叢の変化が関与することが示唆された.以上の結果から,高脂肪食の摂取によりひき起こされるストレスはSpred1による造血幹細胞の制御シグナルに作用し,造血幹細胞の恒常性の維持に影響をおよぼすことが示された.
はじめに
造血幹細胞は骨髄のニッチにおいて自己複製能および多分化能をもつ細胞として存在し,血液の恒常性の維持に寄与する.このような幹細胞の制御機構を解明することは,組織恒常性の維持やさまざまな疾患の原因を理解するうえで重要である.造血幹細胞は加齢などのさまざまなストレスにさらされており,これらのストレスによる造血幹細胞の制御機構の破綻は造血の不全や腫瘍化をひき起こす.しかし,食餌における脂肪の過剰な摂取など,過栄養状態が造血幹細胞の自己複製にどのような影響をおよぼすのかについてはこれまで知られていなかった.
造血幹細胞の維持にはサイトカインであるSCFによるc-Kit受容体からのシグナル伝達系が必須である.Spred1はc-Kit結合ドメインをもち,SCF-c-Kitシグナル伝達系を抑制的に制御するタンパク質として発見された1).また,SPRED1遺伝子はヒトにおけるRAS-MAPK症候群のひとつであるレジウス症候群の原因遺伝子であり2),一般に,ほかのRAS-MAPK症候群においてはがん化のリスクが高くなることが知られていたものの,レジウス症候群は例外的にがんをひき起こす傾向はないとされてきた3).しかし,さまざまな腫瘍においてSPRED1遺伝子の発現の低下が報告されており4-6),Spred1に腫瘍の抑制能があるのかどうかについては明らかにされていなかった.
筆者らは,このようなSCF-c-Kitシグナル伝達系や腫瘍化に関与するSpred1に着目し,さまざまなストレスに対する応答性を解析することにより造血幹細胞の制御機構を理解しようと研究を進めてきた.
1.Spred1は造血幹細胞においてさまざまな刺激に応答する
血液細胞におけるSpred1の発現について調べたところ,骨髄の長期の再構築能をもつもっとも未分化な造血幹細胞では発現が低く,少し分化した造血幹細胞や前駆細胞において高い発現を示した.しかし,もっとも未分化な造血幹細胞においてはSCFの刺激に対しSpred1がすみやかに応答し,c-Kitシグナルの強さを微調整することがわかった.また,Spred1は加齢,連続移植,細菌の感染を模したリポ多糖の投与など幹細胞の機能を低下させるストレスに対し,造血幹細胞において高い発現を示した.このように,Spred1は定常の状態において幹細胞の機能を抑制することが示唆された.
2.Spred1の欠損により造血幹細胞の機能が亢進する
造血幹細胞におけるSpred1の役割について調べるため,Spred1ノックアウトマウスを解析した.Spred1ノックアウトマウスは骨格や皮膚の色などにおいてレジウス症候群の特徴を示したものの,健康であり加齢しても血液の異常は示さなかった.しかし,Spred1を欠損した造血幹細胞はin vitroにおいて非対称性分裂の亢進により自己複製能が上昇しており,支持細胞との共培養において高いコロニー形成能を示した.このコロニー形成能の亢進は造血幹細胞の単独での培養では認められず,支持細胞との相互作用に依存することが示唆された.また,in vivoにおける骨髄移植の解析により,骨髄の再構築能や細胞競合能の亢進,造血幹細胞の寿命の延長が起こることが明らかにされた.しかし,Spred1を欠損した造血幹細胞が過剰に増殖することはなく,白血病などを発症することはなかった.また,これらの表現型はSpred1のコンディショナルノックアウトを用いた定常な状態の造血幹細胞においても確認された.このように,Spred1の欠損は造血幹細胞の自己複製能を亢進するが,ニッチの制御下において正常な範囲に維持されていることが明らかにされた.
3.ROCKの活性化は造血幹細胞の自己複製能を亢進する
Spred1を欠損した造血幹細胞における自己複製能の亢進の分子機構について理解するため,造血幹細胞および造血前駆細胞における遺伝子の発現およびシグナル伝達系を解析した.その結果,予想に反して,Spred1を欠損した造血幹細胞においてERKシグナル伝達系の活性化はみられず,アクチンの動態の制御にかかわる遺伝子の発現が活性化していた.実際に,Spred1を欠損した造血幹細胞においては,SCFの刺激によりアクチンの重合が亢進し,アクチンの重合を制御するRhoキナーゼであるROCKが活性化した.Spred1を欠損した造血幹細胞における自己複製能の亢進がROCKの活性化によるものであるかどうかを確認するため,ROCK阻害剤の効果について検証した.その結果,ROCK活性の阻害はin vitroおよびin vivoにおいてSpred1を欠損した造血幹細胞における幹細胞の機能の亢進を正常化した.一方,ERK阻害剤などによるほかのシグナル伝達系の阻害では効果は認められなかった.以上の結果から,定常な状態の造血幹細胞におけるSpred1の欠損はERKシグナル伝達系には影響をあたえず,ROCKシグナルが活性化することにより白血病化することなく正常な範囲において自己複製能を亢進することが明らかにされた.
4.Spred1およびSpred2は相補的に造血幹細胞における異常な自己複製能の亢進をふせぐ
Spred1の欠損は造血幹細胞の自己複製能を亢進するにもかかわらず,なぜ正常に保たれているのだろうか? SpredファミリーはSpred1,Spred2,Spred3から構成され,Spred1およびSpred2がc-Kit結合ドメインをもつ.Spred1を欠損した造血幹細胞においてSpred2遺伝子の発現の上昇が認められたことから,Spred2による相補的な作用が考えられた.Spred2を欠損した造血幹細胞を解析したところ,Spred1を欠損した造血幹細胞のような表現型は認められなかった.しかし,Spred1 Spred2ダブルコンディショナルノックアウトマウスを作製し解析したところ,二重欠損をひき起こしたのち3カ月ほどで,Gr-1陽性Mac-1陽性の骨髄球系細胞の異常な増殖にともなう末梢血における白血球の増加や血小板の増加,重度の貧血,脾腫や肝臓などへの骨髄球系細胞の浸潤が起こり死亡した.末梢血に芽球は認められなかったことから,骨髄増殖性腫瘍様の病態を発症したことが明らかにされた.さらに,この骨髄増殖性腫瘍様の病態を発症したマウスの骨髄細胞は,ほかのマウスへの移植によりふたたび骨髄増殖性腫瘍様の病態を発症させたことから,悪性転換したことがわかった.また,c-Kitシグナルの活性化と関連して,回盲部においてPDGFRα陽性の間質細胞の異常な増殖により腫瘍化が認められた.さらに,骨髄の解析の結果,もっとも未分化な造血幹細胞の画分のみが異常に増殖しており,アクチンの重合の恒常的な亢進,および,ERK,AKT,STAT5の異常な活性化が認められた.この骨髄増殖性腫瘍様の病態の発症におけるROCKの活性化の関与について調べるため,ROCKの阻害剤の効果について検証した.ROCK阻害剤はSpred1およびSpred2を二重欠損した造血幹細胞のin vitroにおけるコロニー形成能の亢進やin vivoにおける脾腫を改善したが,最終的な骨髄増殖性腫瘍様の病態の発症に対しては有意な効果は認められなかった.このことから,Spred1およびSpred2を二重欠損した造血幹細胞の腫瘍化には,ROCKの活性化のほか,ERKなどの活性化が大きく関与することが示唆された.以上の結果から,Spred1およびSpred2は造血幹細胞の異常な自己複製による腫瘍化をふせぐため相補的に機能しており,Spred1は潜在的に腫瘍の抑制能をもつことが明らかにされた.
5.Spred1を欠損した造血幹細胞はさまざまなストレスに対し抵抗性を示す
造血幹細胞の自己複製は造血幹細胞をとりまく微小環境の影響をうける.さきに述べたように,野生型の造血幹細胞において,Spred1は加齢,連続移植,リポ多糖の投与といったさまざまなストレスに応答し発現が上昇する.それにともない,野生型の造血幹細胞においては幹細胞の機能が低下することが確認された.一方,Spred1を欠損した造血幹細胞はこれらのストレスに対し抵抗性を示し,高い幹細胞の機能を保持した.このことから,ストレスに対する造血幹細胞の機能の低下の原因には,一部にSpred1の発現の上昇が関与することが示唆された.
6.高脂肪食はSpred1を欠損した造血幹細胞において異常な自己複製の亢進および幹細胞の機能の低下をひき起こす
Spred1は造血幹細胞において絶妙な発現量を保ち自己複製能を制御するが,基本的に抑制的なはたらきをする.Spred1はどのようなときに腫瘍の抑制能を発揮するのだろうか,また,造血幹細胞にとりSpred1は本当に必要なのだろうか? 筆者らは,加齢やリポ多糖の投与などによる慢性炎症と造血幹細胞の自己複製との関連を調べる一環として,高脂肪食の摂取による造血幹細胞への影響についても研究しており,高脂肪食を摂取させたSpred1ノックアウトマウスは骨髄増殖性腫瘍様の病態を発症して死亡することを発見した.高脂肪食を摂取させたSpred1ノックアウトマウスは,Spred1 Spred2ダブルノックアウトマウスのようにGr-1陽性Mac-1陽性の骨髄球系細胞の異常な増殖にともなう芽球が認められない末梢血における白血球の増加や血小板の増加,重度の貧血,脾腫をひき起こした.これらの表現型はオスよりもメスにおいて顕著であった.また,Spred1およびSpred2の二重欠損とは異なり,高脂肪食の摂取により骨髄増殖性腫瘍様の病態を発症したSpred1ノックアウトマウスの骨髄細胞は,ほかの野生型のマウスへ移植しても骨髄増殖性腫瘍様の病態を再発させなかった.このことから,環境が正常化することにより可逆的であることが示唆された.
高脂肪食の摂取によりひき起こされるストレスに対するSpred1を欠損した造血幹細胞の変化について解析した.その結果,4週間という短期間の高脂肪食の摂取においては,Spred1を欠損した造血幹細胞は通常食を摂取させたときよりもさらに幹細胞の機能が亢進した.しかし,20週間以上の長期間の高脂肪食の摂取においては,Spred1を欠損した造血幹細胞の機能は大きく低下し造血幹細胞を失う結果となった.Spred1およびSpred2を二重欠損した造血幹細胞についても詳細に解析した結果,異常な自己複製の亢進が起こるものの,最終的に幹細胞の機能を失っており,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞と同様の結果を示した.また,野生型のマウスにSpred1を欠損した骨髄細胞を移植して血液を置き換えたのち高脂肪食を摂取させると,Spred1ノックアウトマウスに比べおだやかな骨髄増殖性腫瘍様の病態を発症した.このことから,造血幹細胞のほかニッチの側のSpred1の欠損の関与も暗示された.
高脂肪食の摂取によりSpred1ノックアウトマウスが骨髄増殖性腫瘍様の病態を発症する分子機構について理解するため,造血幹細胞においてシグナル伝達系を解析した.その結果,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞においては,通常食を摂取させたときと比較して,アクチンの重合のさらなる亢進は認められなかった.この点は,Spred1およびSpred2の二重欠損による悪性転換とは異なった.しかし,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞においては,SCFの刺激により過剰なERKの活性化がひき起こされた.このように,高脂肪食の摂取はSpred1を欠損した造血幹細胞においてERKの異常な活性化をひき起こし,骨髄増殖性腫瘍様の病態を発症させることが明らかにされた.以上の結果をまとめると,高脂肪食の摂取によりひき起こされるストレスは,Spred1による造血幹細胞の制御シグナルを異常に活性化し,腫瘍化を起こす.
7.高脂肪食を摂取させたSpred1ノックアウトマウスにおける血液の異常に腸内細菌叢の変化が関与する
高脂肪食の摂取は,腸内細菌叢においてグラム陽性細菌の割合が上昇することによりバランスを変化させ,その結果,産生される代謝産物やサイトカインなどにより腫瘍化のリスクが高まることが報告されている7)(新着論文レビュー でも掲載).そこで,野生型のマウスおよびSpred1ノックアウトマウスの腸内細菌叢を解析した結果,通常食の摂取および高脂肪食の摂取においてSpred1の有無により腸内細菌叢の構成に差はみられなかったが,通常食の摂取に比較して高脂肪食の摂取ではグラム陽性細菌の割合が上昇した.抗生剤の投与により腸内を除菌したところ,高脂肪食を摂取させたSpred1ノックアウトマウスの骨髄増殖性腫瘍様の病態の発症が有意に遅延した.さらに,高脂肪食を摂取させたSpred1ノックアウトマウスの造血幹細胞の機能の低下も抗生剤の投与により回避された.
以上の結果から,腸内細菌叢は高脂肪食を摂取させたSpred1ノックアウトマウスにおける血液の異常に大きく関与することが明らかにされた.このように,Spred1は高脂肪食の摂取によりひき起こされるストレスから造血幹細胞の恒常性を維持するために必須の役割をはたすことがわかった(図1).
おわりに
これまで,BMIなどの肥満指数と白血病の発症との関係について,疫学的な研究からその相関が示唆されていたが,実際に,肥満をひき起こすような食習慣が白血病の発症につながるとは考えられていなかった.今回の研究により,脂肪の過剰な摂取により白血病や造血の不全をひき起こさないよう防御するシステムの存在が明らかにされた.今後は,腸内細菌に由来する何が造血系に影響をおよぼすのか,また,造血幹細胞やニッチ細胞を含め何が起こっているのか,臓器間および細胞間を含め詳細に解析することにより,これまでの微小環境における幹細胞の制御だけでなく,全身における幹細胞の制御機構が明らかにされるのではないかと思われる.
文 献
- Wakioka, T., Sasaki, A., Kato, R. et al.: Spred is a Sprouty-related suppressor of Ras signalling. Nature, 412, 647-651 (2001)[PubMed]
- Brems, H., Chmara, M., Sahbatou, M. et al.: Germline loss-of-function mutations in SPRED1 cause a neurofibromatosis 1-like phenotype. Nat. Genet., 39, 1120-1126 (2007)[PubMed]
- Rauen, K. A.: The RASopathies. Annu. Rev. Genomics Hum. Genet., 14, 355-369 (2013)[PubMed]
- Olsson, L., Castor, A., Behrendtz, M. et al.: Deletions of IKZF1 and SPRED1 are associated with poor prognosis in a population-based series of pediatric B-cell precursor acute lymphoblastic leukemia diagnosed between 1992 and 2011. Leukemia, 28, 302-310 (2014)[PubMed]
- Li, Z., Chen, P., Su, R. et al.: Overexpression and knockout of miR-126 both promote leukemogenesis. Blood, 126, 2005-2015 (2015)[PubMed]
- Pasmant, E., Gilbert-Dussardier, B., Petit, A. et al.: SPRED1, a RAS MAPK pathway inhibitor that causes Legius syndrome, is a tumour suppressor downregulated in paediatric acute myeloblastic leukaemia. Oncogene, 34, 631-638 (2015)[PubMed]
- Yoshimoto, S., Loo, T. M., Atarashi, K. et al.: Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome. Nature, 499, 97-101 (2013)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 大阪大学大学院薬学研究科博士後期課程 修了,同年 東京大学医科学研究所 ポスドクを経て,2007年より金沢大学がん研究所 助教(現 金沢大学がん進展制御研究所 助教).
研究テーマ:幹細胞における自己複製能の制御の機構.
平尾 敦(Atsushi Hirao)
金沢大学がん進展制御研究所 教授.
研究室URL:http://cri-mol-gen.w3.kanazawa-u.ac.jp/
© 2018 田所優子・平尾 敦 Licensed under CC 表示 2.1 日本