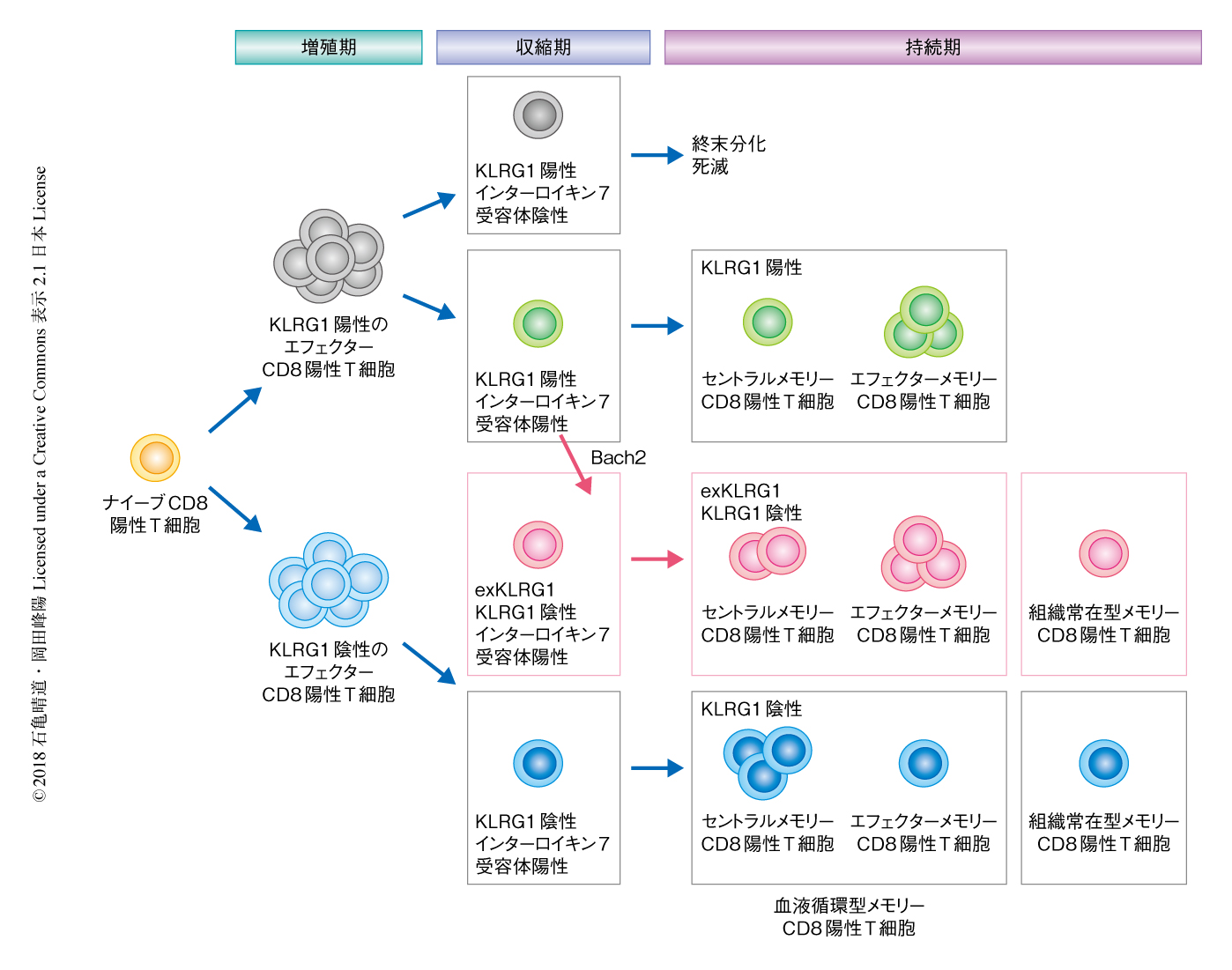
エフェクターCD8陽性T細胞の分化の可塑性によりメモリーCD8陽性T細胞の多様性が形成される
石亀晴道・岡田峰陽
(理化学研究所生命医科学研究センター 組織動態研究チーム)
email:石亀晴道,岡田峰陽
DOI: 10.7875/first.author.2018.049
KLRG1+ effector CD8+ T cells lose KLRG1, differentiate into all memory T cell lineages, and convey enhanced protective immunity.
Dietmar Herndler-Brandstetter, Harumichi Ishigame, Ryo Shinnakasu, Valerie Plajer, Carmen Stecher, Jun Zhao, Melanie Lietzenmayer, Lina Kroehling, Akiko Takumi, Kohei Kometani, Takeshi Inoue, Yuval Kluger, Susan M. Kaech, Tomohiro Kurosaki, Takaharu Okada, Richard A. Flavell
Immunity, 48, 716-729.e8 (2018)
メモリーCD8陽性T細胞は病原体の感染やがんに対する生体防御において必須の役割をはたす.近年,メモリーCD8陽性T細胞には局在,遊走能,機能の異なる細胞が多く存在し,きわめて不均一な集団であることが明らかにされたが,その分化の機構についてはいまだ不明な点が多く残されている.これまで,非常に強い抗原の刺激をうけたエフェクターCD8陽性T細胞はKLRG1を発現し,かぎられたメモリーCD8陽性T細胞への分化能しかもたないと考えられていた.この研究において,筆者らは,一部のKLRG1陽性のエフェクターCD8陽性T細胞はKLRG1を一時的に発現したのち消失し,高い細胞障害活性および増殖能をもつさまざまな種類のメモリーCD8陽性T細胞へと分化することを見い出し,KLRG1を発現した経験はあるがその発現を消失した細胞をexKLRG1細胞と名づけた.exKLRG1細胞の分化は転写因子Bach2に依存し,肺におけるインフルエンザの感染や皮膚がんに対し高い生体防御能をもつ多彩な機能を兼ね備えた細胞の集団であることが明らかにされた.以上の結果,エフェクターCD8陽性T細胞はこれまで考えられていた以上に高い分化の可塑性をもち,この可塑性がメモリーCD8陽性T細胞の多様性や長期的な生体防御応答の形成に貢献することが明らかにされた.
メモリーCD8陽性T細胞は非常に不均一で多様性のある細胞の集団であり,その局在,遊走能,機能により大きく3つに分類されると考えられている1).血液循環型であるメモリーCD8陽性T細胞は,T細胞の活性化のおもな場であるリンパ節への遊走能をもつセントラルメモリーCD8陽性T細胞と,リンパ節への遊走能をもたず末梢組織を循環するエフェクターメモリーCD8陽性T細胞とに分けられ,体内の異なる部位を循環することにより異物の侵入をたえず監視する.最近,ケモカイン受容体であるCX3CR1を中程度に発現するメモリーCD8陽性T細胞はセントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞の特徴をあわせもつことがわかり,末梢メモリーCD8陽性T細胞と命名された2).一方,非循環型のメモリーCD8陽性T細胞は組織常在型メモリーCD8陽性T細胞とよばれ,粘膜組織の上皮や皮膚に局在し,再感染の際に感染部位において迅速な免疫応答をひき起こす3).しかし,それぞれのメモリーCD8陽性T細胞の集団もけして均一ではなく,メモリーCD8陽性T細胞の起源や多様性がどのように形成されるかについては明らかにされていなかった.
これまでの研究において,非常に強い抗原の刺激をうけたエフェクターCD8陽性T細胞は,終末分化のマーカーとして知られるKLRG1を発現し高い細胞障害活性を獲得するが,その大部分はメモリーCD8陽性T細胞へと分化せずに死滅することが報告されていた4-6).また,生き残ったKLRG1陽性のエフェクターCD8陽性T細胞はエフェクターメモリーCD8陽性T細胞にしか分化できず,終末分化に近い状態にあると考えられていた7-9).一方,KLRG1陰性のエフェクターCD8陽性T細胞はインターロイキン7受容体を強く発現し,すべての種類のメモリーCD8陽性T細胞へと分化する前駆細胞であると考えられていた.しかし,このモデルは非常に単純化されたものであり,KLRG1陰性のエフェクターCD8陽性T細胞も不均一な細胞の集団であることから,異なる機能をもつメモリーCD8陽性T細胞が同一の前駆細胞に由来するかどうかはわかっていなかった.この研究において,筆者らは,KLRG1の発現の有無とメモリーCD8陽性T細胞への分化との関係を解析する細胞系譜の追跡法を確立することにより,エフェクターCD8陽性T細胞の分化の可塑性がメモリーCD8陽性T細胞の多様性の形成におよぼす影響について解析した.
KLRG1の発現の有無とメモリーCD8陽性T細胞への分化との関係を解析する細胞系譜の追跡法を確立するため,Klrg1遺伝子の発現制御のもとCre遺伝子を発現する遺伝子改変マウスを作製した.このKLRG1-Creマウスと部位特異的な組換え酵素Creの活性に依存して赤色蛍光タンパク質tdTomatoを発現するマウスとを交配することにより,KLRG1をいちどでも発現した細胞をtdTomatoにより不可逆的に標識することができる.さらに,抗KLRG1抗体による染色と組み合わせることにより,KLRG1をいちども発現していないKLRG1陰性細胞,KLRG1を発現しつづけているKLRG1陽性細胞,KLRG1を発現した経験はあるがその発現を消失した細胞を区別することができる.この手法により同定された,KLRG1を発現した経験はあるがその発現を消失した細胞をexKLRG1細胞と名づけ,その特徴や機能を解析した.
KLRG1を用いた細胞系譜の追跡法により,リステリア菌に感染したのち菌体が排除され炎症応答が終息にむかう時期には,KLRG1陰性細胞やKLRG1陽性細胞にくわえ,exKLRG1細胞も出現することが見い出された.このexKLRG1細胞は持続期においても確認され,血液循環型のメモリーCD8陽性T細胞に約20~30%の割合で存在した.KLRG1を発現した経験の有無と血液循環型のメモリーCD8陽性T細胞の分化との関係性についてさらに解析した結果,exKLRG1細胞はセントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞から構成される不均一な細胞の集団であることがわかった.一方,KLRG1陰性細胞の多くはセントラルメモリーCD8陽性T細胞であり,KLRG1陽性細胞の大部分はエフェクターメモリーCD8陽性T細胞から構成されていた.さらに,exKLRG1細胞はケモカイン受容体CX3CR1を中程度に発現しており,大部分の末梢メモリーCD8陽性T細胞はexKLRG1細胞であることも明らかにされた.組織常在型メモリーCD8陽性T細胞はすべてKLRG1陰性であり,このうち,exKLRG1細胞は約40~50%という非常に高い割合で存在した.この結果より,KLRG1陽性のエフェクターCD8陽性T細胞は高い分化の可塑性をもち,KLRG1の発現を消失してさまざまなメモリーCD8陽性T細胞へと分化することが明らかにされた.
どのようなエフェクターCD8陽性T細胞がexKLRG1細胞へと分化するのかを明らかにするため,遺伝子の発現を解析した.その結果,KLRG1陽性細胞においては細胞障害活性に関連する遺伝子が高く発現しており,KLRG1陰性細胞においてはメモリーCD8陽性T細胞の分化の促進に関連する遺伝子が強く発現していた.一方,exKLRG1細胞はこれらの遺伝子を中程度に発現していた.とくに,exKLRG1メモリーT細胞への分化能はエフェクターCD8陽性T細胞におけるIl7r遺伝子の発現と正の相関を示した.さらに,exKLRG1エフェクターT細胞においては,細胞障害活性に関連する遺伝子の領域およびメモリーCD8陽性T細胞の分化に関連する遺伝子の領域が開いたクロマチン構造をとることがATACシークエンスによる解析により明らかにされ,抗原の刺激を中程度にうけたエフェクターCD8陽性T細胞はexKLRG1細胞へと分化することが示唆された.
血液循環型のexKLRG1メモリーT細胞の機能を解析するため,ex vivoにおいて炎症性サイトカインによる刺激ののちのインターフェロンγの産生能について解析した.その結果,KLRG1陽性のエフェクターメモリーCD8陽性T細胞が炎症性サイトカインによる刺激ののちのインターフェロンγの産生能がもっとも高いことがわかった.さらに,exKLRG1メモリーT細胞はKLRG1陰性のメモリーT細胞と比較して,セントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞のどちらの画分においても高いインターフェロンγの産生能をもっていた.このことより,血液循環型のexKLRG1メモリーT細胞はKLRG1陽性のエフェクターT細胞の特性を維持しており,KLRG1陽性のエフェクターT細胞の分化の可塑性が,セントラルメモリーCD8陽性T細胞やエフェクターメモリーCD8陽性T細胞の機能的な不均一性に貢献することが明らかにされた.
セントラルメモリーCD8陽性T細胞やエフェクターメモリーCD8陽性T細胞と同様に,組織常在型メモリーCD8陽性T細胞においてもexKLRG1細胞はKLRG1陽性のエフェクターT細胞の特性を維持しているかどうかについて検討した.その結果,組織常在型メモリーCD8陽性T細胞において,exKLRG1細胞はKLRG1陰性細胞に比べ細胞障害活性の指標となるグランザイムBの発現が亢進していた.このことより,組織常在型メモリーCD8陽性T細胞においても,KLRG1陽性のエフェクターT細胞の分化の可塑性が機能的な不均一性に貢献することが明らかにされた.
生体におけるexKLRG1細胞の機能について解析するため,移入実験による肺におけるインフルエンザの感染,および,皮膚がんに対するexKLRG1メモリーCD8陽性T細胞の生体防御能について検討した.その結果,KLRG1陽性のメモリーCD8陽性T細胞はインフルエンザの感染のみに,KLRG1陰性のメモリーCD8陽性T細胞は皮膚がんのみに,効率のよい免疫応答をひき起こしたのに対し,exKLRG1メモリーCD8陽性T細胞はどちらの実験モデルにおいても高い生体防御能を発揮した.以上の結果から,exKLRG1メモリーCD8陽性T細胞は多彩な機能を兼ね備えた細胞の集団であることが明らかにされた.
exKLRG1エフェクターCD8陽性T細胞の分化の機構について検討した.Bach2はメモリーT細胞やメモリーB細胞の分化に必須の役割をはたす抑制性の転写因子である.Bach2の発現がKLRG1陽性のエフェクターCD8陽性T細胞に比べexKLRG1エフェクターCD8陽性T細胞において高く発現していることに注目し,KLRG1-Creマウスを用いてKLRG1陽性のエフェクターCD8陽性T細胞においてBach2遺伝子を特異的に欠損させたところ,血液循環型のexKLRG1メモリーCD8陽性T細胞への分化が障害された.一方,KLRG1-Creマウスを用いてBach2遺伝子の発現が誘導される実験系を構築したところ,Bach2は血液循環型のexKLRG1メモリーCD8陽性T細胞への分化を促進することがわかった.この結果より,Bach2の発現の強度がexKLRG1エフェクターCD8陽性T細胞の分化の制御に重要であることが明らかにされた.
この研究により,メモリーCD8陽性T細胞の多様性の形成には抗原の刺激の強度が重要な役割をはたすことが明らかにされた.とくに,中程度の抗原の刺激をうけたエフェクターCD8陽性T細胞は高い分化の可塑性をもち,KLRG1を一時的に発現し,高い細胞障害活性および増殖能をもつさまざまなメモリーCD8陽性T細胞へと分化することにより,メモリーCD8陽性T細胞の多様性の形成や生体防御に貢献することがわかった(図1).今後,exKLRG1細胞の特異的なマーカーや分化の機構を詳細に解析することにより,感染症やがんに対するメモリーCD8陽性T細胞の生体防御能を反映する新たなバイオマーカーの探索に貢献することが期待される.
略歴:2007年 東京大学大学院医学系研究科 修了,同年 東京大学医科学研究所 特任研究員,2009年 米国Yale大学 研究員を経て,2014年より理化学研究所生命医科学研究センター 研究員.
岡田 峰陽(Takaharu Okada)
理化学研究所生命医科学研究センター チームリーダー.
研究室URL:http://www.ims.riken.jp/labo/35/index.html
© 2018 石亀晴道・岡田峰陽 Licensed under CC 表示 2.1 日本
(理化学研究所生命医科学研究センター 組織動態研究チーム)
email:石亀晴道,岡田峰陽
DOI: 10.7875/first.author.2018.049
KLRG1+ effector CD8+ T cells lose KLRG1, differentiate into all memory T cell lineages, and convey enhanced protective immunity.
Dietmar Herndler-Brandstetter, Harumichi Ishigame, Ryo Shinnakasu, Valerie Plajer, Carmen Stecher, Jun Zhao, Melanie Lietzenmayer, Lina Kroehling, Akiko Takumi, Kohei Kometani, Takeshi Inoue, Yuval Kluger, Susan M. Kaech, Tomohiro Kurosaki, Takaharu Okada, Richard A. Flavell
Immunity, 48, 716-729.e8 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
CD8, KLRG1(O88713), Bach2(P97303), ケモカイン受容体, CX3CR1(Q9Z0D9), インターロイキン7受容体, Klrg1(O88713), ケモカイン受容体CX3CR1(Q9Z0D9), Il7r(P16872), 炎症性サイトカイン, インターフェロンγ(P01580), グランザイムB(P04187)
要 約
メモリーCD8陽性T細胞は病原体の感染やがんに対する生体防御において必須の役割をはたす.近年,メモリーCD8陽性T細胞には局在,遊走能,機能の異なる細胞が多く存在し,きわめて不均一な集団であることが明らかにされたが,その分化の機構についてはいまだ不明な点が多く残されている.これまで,非常に強い抗原の刺激をうけたエフェクターCD8陽性T細胞はKLRG1を発現し,かぎられたメモリーCD8陽性T細胞への分化能しかもたないと考えられていた.この研究において,筆者らは,一部のKLRG1陽性のエフェクターCD8陽性T細胞はKLRG1を一時的に発現したのち消失し,高い細胞障害活性および増殖能をもつさまざまな種類のメモリーCD8陽性T細胞へと分化することを見い出し,KLRG1を発現した経験はあるがその発現を消失した細胞をexKLRG1細胞と名づけた.exKLRG1細胞の分化は転写因子Bach2に依存し,肺におけるインフルエンザの感染や皮膚がんに対し高い生体防御能をもつ多彩な機能を兼ね備えた細胞の集団であることが明らかにされた.以上の結果,エフェクターCD8陽性T細胞はこれまで考えられていた以上に高い分化の可塑性をもち,この可塑性がメモリーCD8陽性T細胞の多様性や長期的な生体防御応答の形成に貢献することが明らかにされた.
はじめに
メモリーCD8陽性T細胞は非常に不均一で多様性のある細胞の集団であり,その局在,遊走能,機能により大きく3つに分類されると考えられている1).血液循環型であるメモリーCD8陽性T細胞は,T細胞の活性化のおもな場であるリンパ節への遊走能をもつセントラルメモリーCD8陽性T細胞と,リンパ節への遊走能をもたず末梢組織を循環するエフェクターメモリーCD8陽性T細胞とに分けられ,体内の異なる部位を循環することにより異物の侵入をたえず監視する.最近,ケモカイン受容体であるCX3CR1を中程度に発現するメモリーCD8陽性T細胞はセントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞の特徴をあわせもつことがわかり,末梢メモリーCD8陽性T細胞と命名された2).一方,非循環型のメモリーCD8陽性T細胞は組織常在型メモリーCD8陽性T細胞とよばれ,粘膜組織の上皮や皮膚に局在し,再感染の際に感染部位において迅速な免疫応答をひき起こす3).しかし,それぞれのメモリーCD8陽性T細胞の集団もけして均一ではなく,メモリーCD8陽性T細胞の起源や多様性がどのように形成されるかについては明らかにされていなかった.
これまでの研究において,非常に強い抗原の刺激をうけたエフェクターCD8陽性T細胞は,終末分化のマーカーとして知られるKLRG1を発現し高い細胞障害活性を獲得するが,その大部分はメモリーCD8陽性T細胞へと分化せずに死滅することが報告されていた4-6).また,生き残ったKLRG1陽性のエフェクターCD8陽性T細胞はエフェクターメモリーCD8陽性T細胞にしか分化できず,終末分化に近い状態にあると考えられていた7-9).一方,KLRG1陰性のエフェクターCD8陽性T細胞はインターロイキン7受容体を強く発現し,すべての種類のメモリーCD8陽性T細胞へと分化する前駆細胞であると考えられていた.しかし,このモデルは非常に単純化されたものであり,KLRG1陰性のエフェクターCD8陽性T細胞も不均一な細胞の集団であることから,異なる機能をもつメモリーCD8陽性T細胞が同一の前駆細胞に由来するかどうかはわかっていなかった.この研究において,筆者らは,KLRG1の発現の有無とメモリーCD8陽性T細胞への分化との関係を解析する細胞系譜の追跡法を確立することにより,エフェクターCD8陽性T細胞の分化の可塑性がメモリーCD8陽性T細胞の多様性の形成におよぼす影響について解析した.
1.KLRG1-Creマウスを用いた細胞系譜の追跡法の確立
KLRG1の発現の有無とメモリーCD8陽性T細胞への分化との関係を解析する細胞系譜の追跡法を確立するため,Klrg1遺伝子の発現制御のもとCre遺伝子を発現する遺伝子改変マウスを作製した.このKLRG1-Creマウスと部位特異的な組換え酵素Creの活性に依存して赤色蛍光タンパク質tdTomatoを発現するマウスとを交配することにより,KLRG1をいちどでも発現した細胞をtdTomatoにより不可逆的に標識することができる.さらに,抗KLRG1抗体による染色と組み合わせることにより,KLRG1をいちども発現していないKLRG1陰性細胞,KLRG1を発現しつづけているKLRG1陽性細胞,KLRG1を発現した経験はあるがその発現を消失した細胞を区別することができる.この手法により同定された,KLRG1を発現した経験はあるがその発現を消失した細胞をexKLRG1細胞と名づけ,その特徴や機能を解析した.
2.KLRG1陽性のエフェクターCD8陽性T細胞はKLRG1の発現を消失しさまざまなメモリーCD8陽性T細胞へと分化する
KLRG1を用いた細胞系譜の追跡法により,リステリア菌に感染したのち菌体が排除され炎症応答が終息にむかう時期には,KLRG1陰性細胞やKLRG1陽性細胞にくわえ,exKLRG1細胞も出現することが見い出された.このexKLRG1細胞は持続期においても確認され,血液循環型のメモリーCD8陽性T細胞に約20~30%の割合で存在した.KLRG1を発現した経験の有無と血液循環型のメモリーCD8陽性T細胞の分化との関係性についてさらに解析した結果,exKLRG1細胞はセントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞から構成される不均一な細胞の集団であることがわかった.一方,KLRG1陰性細胞の多くはセントラルメモリーCD8陽性T細胞であり,KLRG1陽性細胞の大部分はエフェクターメモリーCD8陽性T細胞から構成されていた.さらに,exKLRG1細胞はケモカイン受容体CX3CR1を中程度に発現しており,大部分の末梢メモリーCD8陽性T細胞はexKLRG1細胞であることも明らかにされた.組織常在型メモリーCD8陽性T細胞はすべてKLRG1陰性であり,このうち,exKLRG1細胞は約40~50%という非常に高い割合で存在した.この結果より,KLRG1陽性のエフェクターCD8陽性T細胞は高い分化の可塑性をもち,KLRG1の発現を消失してさまざまなメモリーCD8陽性T細胞へと分化することが明らかにされた.
3.中程度の抗原の刺激をうけたエフェクターCD8陽性T細胞はexKLRG1細胞へと分化する
どのようなエフェクターCD8陽性T細胞がexKLRG1細胞へと分化するのかを明らかにするため,遺伝子の発現を解析した.その結果,KLRG1陽性細胞においては細胞障害活性に関連する遺伝子が高く発現しており,KLRG1陰性細胞においてはメモリーCD8陽性T細胞の分化の促進に関連する遺伝子が強く発現していた.一方,exKLRG1細胞はこれらの遺伝子を中程度に発現していた.とくに,exKLRG1メモリーT細胞への分化能はエフェクターCD8陽性T細胞におけるIl7r遺伝子の発現と正の相関を示した.さらに,exKLRG1エフェクターT細胞においては,細胞障害活性に関連する遺伝子の領域およびメモリーCD8陽性T細胞の分化に関連する遺伝子の領域が開いたクロマチン構造をとることがATACシークエンスによる解析により明らかにされ,抗原の刺激を中程度にうけたエフェクターCD8陽性T細胞はexKLRG1細胞へと分化することが示唆された.
4.血液循環型のexKLRG1メモリーT細胞はKLRG1陽性のエフェクターT細胞の特性を維持する
血液循環型のexKLRG1メモリーT細胞の機能を解析するため,ex vivoにおいて炎症性サイトカインによる刺激ののちのインターフェロンγの産生能について解析した.その結果,KLRG1陽性のエフェクターメモリーCD8陽性T細胞が炎症性サイトカインによる刺激ののちのインターフェロンγの産生能がもっとも高いことがわかった.さらに,exKLRG1メモリーT細胞はKLRG1陰性のメモリーT細胞と比較して,セントラルメモリーCD8陽性T細胞およびエフェクターメモリーCD8陽性T細胞のどちらの画分においても高いインターフェロンγの産生能をもっていた.このことより,血液循環型のexKLRG1メモリーT細胞はKLRG1陽性のエフェクターT細胞の特性を維持しており,KLRG1陽性のエフェクターT細胞の分化の可塑性が,セントラルメモリーCD8陽性T細胞やエフェクターメモリーCD8陽性T細胞の機能的な不均一性に貢献することが明らかにされた.
5.組織常在型exKLRG1メモリーT細胞は高い細胞障害活性をもつ
セントラルメモリーCD8陽性T細胞やエフェクターメモリーCD8陽性T細胞と同様に,組織常在型メモリーCD8陽性T細胞においてもexKLRG1細胞はKLRG1陽性のエフェクターT細胞の特性を維持しているかどうかについて検討した.その結果,組織常在型メモリーCD8陽性T細胞において,exKLRG1細胞はKLRG1陰性細胞に比べ細胞障害活性の指標となるグランザイムBの発現が亢進していた.このことより,組織常在型メモリーCD8陽性T細胞においても,KLRG1陽性のエフェクターT細胞の分化の可塑性が機能的な不均一性に貢献することが明らかにされた.
6.exKLRG1メモリーCD8陽性T細胞は高い抗がん作用および抗ウイルス作用をもつ
生体におけるexKLRG1細胞の機能について解析するため,移入実験による肺におけるインフルエンザの感染,および,皮膚がんに対するexKLRG1メモリーCD8陽性T細胞の生体防御能について検討した.その結果,KLRG1陽性のメモリーCD8陽性T細胞はインフルエンザの感染のみに,KLRG1陰性のメモリーCD8陽性T細胞は皮膚がんのみに,効率のよい免疫応答をひき起こしたのに対し,exKLRG1メモリーCD8陽性T細胞はどちらの実験モデルにおいても高い生体防御能を発揮した.以上の結果から,exKLRG1メモリーCD8陽性T細胞は多彩な機能を兼ね備えた細胞の集団であることが明らかにされた.
7.転写因子Bach2はexKLRG1エフェクターCD8陽性T細胞の分化を促進する
exKLRG1エフェクターCD8陽性T細胞の分化の機構について検討した.Bach2はメモリーT細胞やメモリーB細胞の分化に必須の役割をはたす抑制性の転写因子である.Bach2の発現がKLRG1陽性のエフェクターCD8陽性T細胞に比べexKLRG1エフェクターCD8陽性T細胞において高く発現していることに注目し,KLRG1-Creマウスを用いてKLRG1陽性のエフェクターCD8陽性T細胞においてBach2遺伝子を特異的に欠損させたところ,血液循環型のexKLRG1メモリーCD8陽性T細胞への分化が障害された.一方,KLRG1-Creマウスを用いてBach2遺伝子の発現が誘導される実験系を構築したところ,Bach2は血液循環型のexKLRG1メモリーCD8陽性T細胞への分化を促進することがわかった.この結果より,Bach2の発現の強度がexKLRG1エフェクターCD8陽性T細胞の分化の制御に重要であることが明らかにされた.
おわりに
この研究により,メモリーCD8陽性T細胞の多様性の形成には抗原の刺激の強度が重要な役割をはたすことが明らかにされた.とくに,中程度の抗原の刺激をうけたエフェクターCD8陽性T細胞は高い分化の可塑性をもち,KLRG1を一時的に発現し,高い細胞障害活性および増殖能をもつさまざまなメモリーCD8陽性T細胞へと分化することにより,メモリーCD8陽性T細胞の多様性の形成や生体防御に貢献することがわかった(図1).今後,exKLRG1細胞の特異的なマーカーや分化の機構を詳細に解析することにより,感染症やがんに対するメモリーCD8陽性T細胞の生体防御能を反映する新たなバイオマーカーの探索に貢献することが期待される.
文 献
- Jameson, S.C. & Masopust, D.: Understanding subset diversity in T cell memory. Immunity, 48, 214-226 (2018)[PubMed]
- Gerlach, C., Moseman, E. A., Loughhead, S. M. et al.: The chemokine receptor CX3CR1 defines three antigen-experienced CD8 T cell subsets with distinct roles in immune surveillance and homeostasis. Immunity, 45, 1270-1284 (2016)[PubMed]
- Mueller, S. N. & Mackay, L. K.: Tissue-resident memory T cells: local specialists in immune defence. Nat. Rev. Immunol., 16, 79-89 (2015)[PubMed]
- Joshi, N. S., Cui, W., Chandele, A. et al.: Inflammation directs memory precursor and short-lived effector CD8+ T cell fates via the graded expression of T-bet transcription factor. Immunity, 27, 281-295 (2007)[PubMed]
- Sarkar, S., Kalia, V., Haining, W. N. et al.: Functional and genomic profiling of effector CD8 T cell subsets with distinct memory fates. J. Exp. Med., 205, 625-640 (2008)[PubMed]
- Kaech, S. M. & Cui, W.: Transcriptional control of effector and memory CD8+ T cell differentiation. Nat. Rev. Immunol., 12, 749-761 (2012)[PubMed]
- Mackay, L. K., Rahimpour, A., Ma, J. Z. et al.: The developmental pathway for CD103+CD8+ tissue-resident memory T cells of skin. Nat. Immunol., 14, 1294-1301 (2013)[PubMed]
- Obar, J. J. & Lefrancois, L.: Early signals during CD8 T cell priming regulate the generation of central memory cells. J. Immunol., 185, 263-272 (2010)[PubMed]
- Sheridan, B. S., Pham, Q. M., Lee, Y. T. et al.: Oral infection drives a distinct population of intestinal resident memory CD8+ T cells with enhanced protective function. Immunity, 40, 747-757 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 東京大学大学院医学系研究科 修了,同年 東京大学医科学研究所 特任研究員,2009年 米国Yale大学 研究員を経て,2014年より理化学研究所生命医科学研究センター 研究員.
岡田 峰陽(Takaharu Okada)
理化学研究所生命医科学研究センター チームリーダー.
研究室URL:http://www.ims.riken.jp/labo/35/index.html
© 2018 石亀晴道・岡田峰陽 Licensed under CC 表示 2.1 日本