大腸がんにおいて1細胞のレベルで明らかにされた単一の腫瘍における不均一性
佐々木伸雄・Hans Clevers
(オランダHubrecht Institute)
email:佐々木伸雄
DOI: 10.7875/first.author.2018.048
Intra-tumour diversification in colorectal cancer at the single-cell level.
Sophie F. Roerink, Nobuo Sasaki, Henry Lee-Six, Matthew D. Young, Ludmil B. Alexandrov, Sam Behjati, Thomas J. Mitchell, Sebastian Grossmann, Howard Lightfoot, David A. Egan, Apollo Pronk, Niels Smakman, Joost van Gorp, Elizabeth Anderson, Stephen J. Gamble, Chris Alder, Marc van de Wetering, Peter J. Campbell, Michael R. Stratton, Hans Clevers
Nature, 556, 457-462 (2018)
すべてのがんはひとつの体細胞から発生する.がん細胞が増殖する際には,個々の細胞にさまざまな変異が生じることにより互いに異なる遺伝的な違いおよび表現型の違いを獲得する.この研究において,筆者らは,単一の腫瘍における不均一性の本質および規模について調べるため,3人の大腸がんの患者から得たがん組織および隣接した正常な上皮組織について,単一の細胞からクローン化したオルガノイドを作製しその特性について解析した.その結果,大腸がん細胞には多様性をもつ変異が蓄積しており,正常な上皮細胞より数倍も多く変異の生じていることが確認された.ほとんどの変異は,がん化する最終段階で発生した優性なクローンが増殖するあいだに獲得されたものであり,正常な上皮細胞には存在しない過程に由来するものであった.また,DNAメチル化解析およびRNAシークエンス解析においても,単一の腫瘍における不均一性が観察された.クローン化したオルガノイドにおいて観察されたこれらの変化は,生体における周囲の微小環境とは関係なく細胞自律的に安定しており,おのおののがん細胞の変異の情報をもとに作製した分子系統樹にそったものであった.同一の腫瘍における非常に近い領域に注目しても,がん細胞の不均一性は多岐にわたり,抗がん剤の感受性についても顕著な差異が認められた.以上の結果から,大腸がん細胞においては,正常な上皮細胞と比較して変異が大幅に増加しており,それぞれのがんの遺伝的な多様性は,個々のがん細胞の生物学的な性質に広くみられる安定した遺伝的な差異をともなうことが示唆された.
シークエンス技術の進展にともない1細胞のレベルにおけるDNAシークエンスおよびRNAシークエンスが可能になったため,腫瘍において個々の細胞のレベルで変異を理解する単一の腫瘍における不均一性に関する研究がさかんになっている.しかし,これらの技術は急速に進歩しているものの,がん組織から単一の細胞を取り出す際には正常な細胞,血液,周辺の間充織細胞などが混入するリスクがある.さらに,1細胞から得られるゲノムDNAは微量なので,全ゲノムシークエンス解析をするには試料を増幅する必要があり,アーチファクトな変異が挿入される可能性や,シークエンスの深度が十分ではないといった精度に関する問題点がいまだ解決されていない1).また,たとえ技術が進歩して高精度にシークエンスできるようになったとしても,細胞からゲノムを抽出する際にはその細胞を破壊する必要があり,のちのがん細胞の機能の解析や各種の抗がん剤の効果の検証などを“同時に”実施することは原理的に不可能である.
これらの問題を解決するため,筆者らの研究室において開発された大腸がん細胞の長期培養法であるオルガノイド培養技術を用いることにより2),シークエンスのレベルと細胞のレベルの両方において単一の腫瘍における不均一性につき包括的に理解しようと試みた.患者のがん組織から抗体を用いない蛍光セルソーター法により単一の細胞を無作為に採取し,それぞれの大腸がん細胞の性質にあわせて培地の組成を調整することにより,5~33%の割合でクローン化したオルガノイドを樹立することに成功した.これら複数のクローン化したオルガノイドを用いて,多層オミックス解析および抗がん剤に対する感受性試験を実施することにより,大腸がんにおいて単一の腫瘍における不均一性を単一の細胞のレベルで明らかにした.
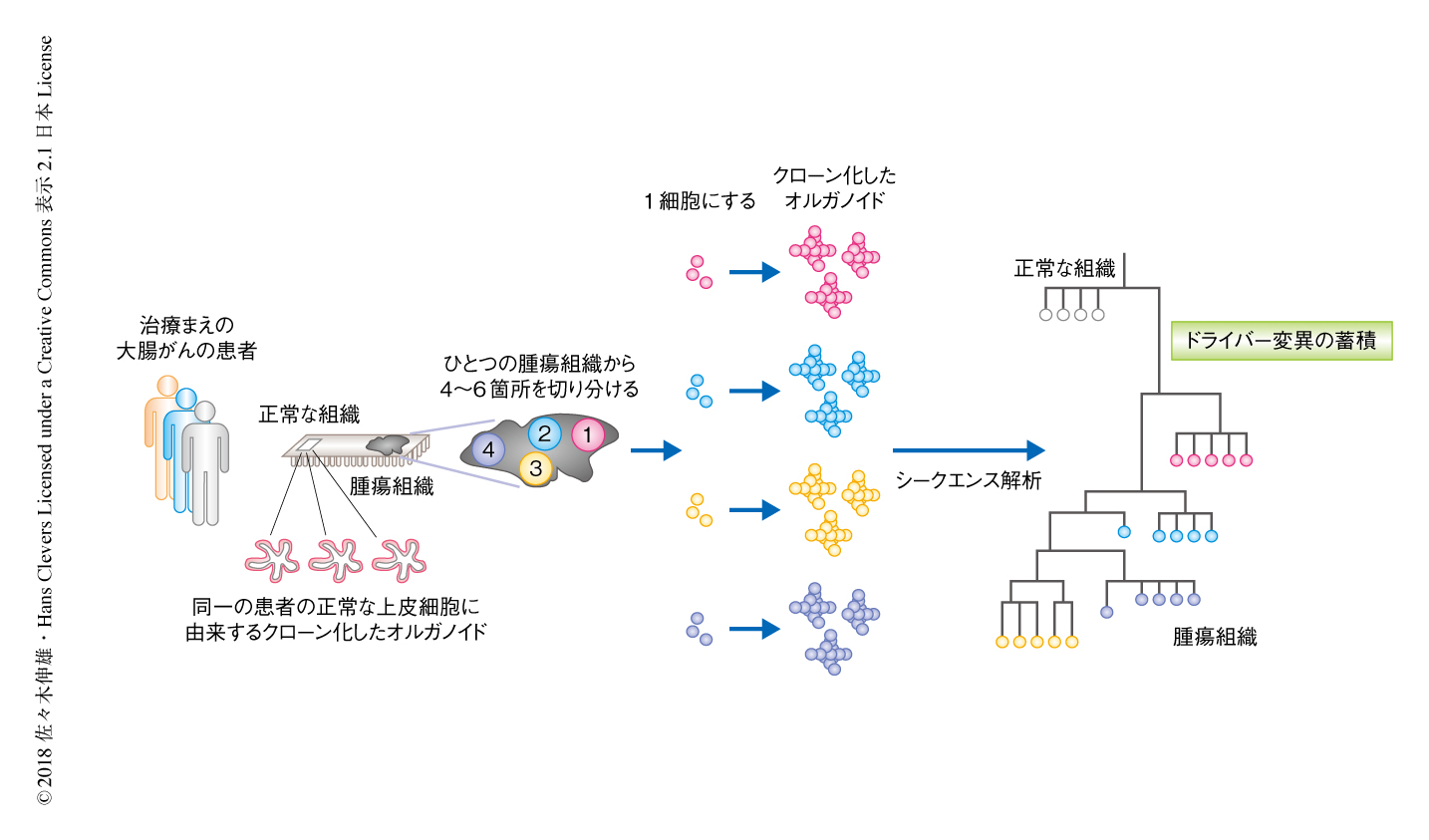
3人の治療まえの大腸がんの患者それぞれから,大腸がん組織とその周辺の正常な組織の検体を得て,それらを4~6個に小さく断片化し,それぞれの断片から抗体を用いない蛍光セルソーター法を用いて単一の細胞を採取した(図1).これらを従来のオルガノイド培養技術と同様に,1細胞ずつマトリゲルに包埋し,培地の適正化を図りながら,正常な上皮細胞およびがん細胞からクローン化したオルガノイドを作製した.正常な上皮細胞に由来するオルガノイドの形態は均一であったのに対し,がん細胞に由来するオルガノイドは同一の患者に由来したものであっても試料ごとに形態や増殖速度が異なっていた.
樹立したクローン化したオルガノイドにおいて全ゲノムシークエンス解析やがん関連遺伝子を標的としたシークエンス解析を実施し,変異のパターンのカタログを作製した.これらの変異の情報をもとに分子系統樹を作製したところ,観察された変異のある程度のかたよりのパターン(末端枝の集合)は大腸がん組織の空間にそったまとまりをみせ,それぞれのクローン化したオルガノイドが得られた場所を反映していた(図1).小さな領域に着目して詳細に観察すると,すべてのクローン化したオルガノイドにおいて変異のパターンが異なっていたことから,単一の大腸がん組織において多様性は非常に高いものであることが明らかにされた.これらのエキソンにみられる変異が培養中に新しく導入されたものでないことは実験的に確かめられた.
オルガノイド培養技術は正常な上皮細胞に対しても適用が可能であるため,同一の患者の正常な上皮細胞を直接的なリファレンスとして使用した,全ゲノムシークエンスの高精度な比較が可能である.実際に,クローナルに増幅させた正常な上皮細胞およびがん細胞から得た十分量のゲノムDNAを用いた高精度な全ゲノムシークエンス解析の結果,いずれの患者の正常な上皮細胞においても約3000個の塩基置換変異が観察されたが,マイクロサテライト不安定型がんである患者1のがん細胞においては約24倍,マイクロサテライト安定型がんである患者2および患者3のがん細胞においては4~7倍も多くの変異が検出された.とくに,患者2および患者3のがん細胞においては,DNAミスマッチ修復に関する遺伝子には変異が観察されなかったにもかかわらず,正常な上皮細胞と比べ多様な変異のパターンが観察された.これらの変異をもとに作製した分子系統樹を調べると,がん細胞においてみられる変異のほとんどは共通幹の部分にはあまり観察されず,末端枝において多様性に富んだパターンが多く観察された.この結果は,がん化した細胞が増殖する際に一気に変異を獲得し,それぞれが独自に増殖するという“ビッグバンモデル”を支持するものであった3).
これまでの研究により,単一の腫瘍において不均一性の生じるひとつの要因として,エピジェネティックな変化が示唆されていた4).そこで,正常な上皮細胞あるいはがん細胞に由来するクローン化したオルガノイドを用いて,470,000箇所のCpG部位においてDNAメチル化を調べ,主成分分析を実施した.その結果,正常な上皮細胞におけるDNAメチル化は,同一の患者に由来するクローン化したオルガノイドのあいだだけでなく,異なる患者に由来するクローン化したオルガノイドのあいだにおいてもすべて類似していた.それとは対照的に,がん細胞におけるDNAメチル化は異なる患者のあいだにおいても多様性を示した.また,患者1および患者2のがん細胞に由来するクローン化したオルガノイドは患者ごとに類似したDNAメチル化を示したが,患者3のがん細胞に由来するクローン化したオルガノイドとのあいだには明確なばらつきが観察された.全ゲノムシークエンス解析により,患者3のがん組織においてはTP53遺伝子が正常な細胞と変異をもつ細胞とが混在することが明らかにされ,DNAメチル化のパターンの多様性はTP53遺伝子の変異に依存的であることがわかった.いずれにせよ,これら3人の患者に由来するクローン化したオルガノイドの解析において.正常な上皮細胞におけるDNAメチル化のパターンはほぼ共通であったのに対し,がん細胞におけるDNAメチル化のパターンは患者ごとに大きく異なっていたことから,大腸がん細胞は多様なDNAメチル化修飾をうけて発生することが明らかにされた.
さらに,オルガノイド培養技術によりクローンは無限に増幅できるため,ゲノムDNAだけでなく,十分量のRNAも抽出することが可能である.作製したすべての正常な上皮細胞および大腸がん細胞に由来するクローン化したオルガノイドについてRNAシークエンスを実施し,遺伝子発現のパターンを解析することにより遺伝子発現に依存的な単一の腫瘍における不均一性について解析した.患者ごとに遺伝子発現のパターンをもとに分子系統樹を作製したところ,DNAメチル化のパターンをもとに作製した分子系統樹と類似していた.DNAメチル化のパターンあるいは遺伝子発現のパターンにもとづく分子系統樹は変異にもとづく分子系統樹とよく似ていたことから,がん細胞にみられるDNAメチル化あるいは遺伝子発現のパターンの多様性は,まわりの微小環境に影響されることなく,がん細胞それ自体のもつ変異のパターンにより規定されることが示唆された.
作製したすべてのクローン化したオルガノイドを用いた,分子標的薬や殺細胞性の抗がん剤に対するハイスループットな感受性試験の系を構築した.その結果,TP53の分解を誘導するMDM2を標的にするnutlin-3aや,がん細胞の生存に重要なWntシグナルのリガンド活性を阻害するIWP2のがん細胞への感受性について,TP53遺伝子やWntシグナルの負の制御タンパク質をコードするRNF43遺伝子の変異に依存的な差がみられた.また,非標的型の殺細胞性の抗がん剤である5-フルオロウラシルやシスプラチンなどについても同様に,単一の腫瘍に由来するクローン化したオルガノイドのすべてを殺傷するものはみつからず,非標的型の抗がん剤による効果のみられた(あるいは,みられなかった)クローン化したオルガノイドのあいだに共通する変異のパターンや遺伝子発現のパターンは観察されなかった.いずれにせよ,多様な単一の腫瘍における不均一性の存在する大腸がんは,1種類の抗がん剤による治療により完全に制圧できる可能性は低いことが示唆された.
国内外の多くの研究室が精力的にがんの研究を推進してきたことにより,がん細胞の生物学的な特性や発生の機構などの理解は進んできた.しかし,近年の1細胞のレベルでのシークエンスに代表される新技術により,がんは想像していた以上に複雑性をもつことがわかった.これまでも,単一の腫瘍における不均一性に関する遺伝子発現のパターンの解析,DNAコピー数の解析,薬剤に対する感受性試験など実施されてきたが,これらはすべて個別に実施されたものであった5-7).この研究において,筆者らは,オルガノイド培養技術を用いることにより,正常な上皮細胞およびがん細胞に由来するクローン化したオルガノイドを作製し,世界ではじめて,単一の細胞のレベルにおけるDNAシークエンスおよびRNAシークエンスによるゲノミクス,エピジェネネティクス,また,抗がん剤の感受性試験の統合的な解析を実施した.これらの結果から,1)マイクロサテライト不安定型だけではなく,古典的なマイクロサテライト安定型の大腸がんにおいても大きな単一の腫瘍における不均一性の存在が確認された.2)これまで,単一の腫瘍において不均一性の生じる機構としてはビッグバンモデルとクローン増殖モデルの2つの説があったが3,8,9),今回のゲノミクス解析はビッグバンモデルを支持する結果となった.3)これまでの遺伝子発現をもとにした単一の腫瘍における不均一性の解析は,血管,間質細胞,免疫細胞など細胞外の環境に依存して単一の腫瘍における不均一性が生じることを示唆していたが,遺伝子発現はクローンごとに多様性が維持されていた.4)抗がん剤による治療において耐性を示した選択圧のかかった残存するがん幹細胞がふたたび増殖する際に新たに変異を獲得することにより単一の腫瘍における不均一性が生じるという説もあったが,今回,試料を得た患者3人は抗がん剤や放射線による治療歴がないため,単一の腫瘍における不均一性は原発性の腫瘍にすでに存在することになる,という重要な知見が得られた.
この研究においては,単一の細胞からの培養を可能にするオルガノイド培養技術の利点を用いてクローンを作製したことにより,単一の腫瘍における不均一性が高精度に解析された.しかし,今回はひとつの腫瘍から20~30のクローンしか作製しなかったため,腫瘍の全体のヘテロな不均一性は網羅しきれていないと考えられる.腫瘍のなかには,オルガノイド培養技術により増幅されない,増殖速度の極端に遅いがん細胞や,低酸素の条件でのみ生育の可能ながん細胞も存在するはずである.そのため,腫瘍の全体を網羅的に理解するには,今後のシークエンス技術および培養技術のさらなる発展が必須になるだろう.しかしながら,今回のクローン化したオルガノイドを用いた単一細胞のレベルでの高精度な解析は,ほかの臓器の固形がんへも応用が可能であるだけでなく,炎症性腸疾患や代謝経路の異常などほかの疾患の研究へ応用することも可能である.
略歴:2007年 東京理科大学大学院基礎工学研究科にて博士号取得,国立遺伝学研究所 ポスドク,2011年 オランダHubrecht Instituteポスドクを経て,2016年より慶應義塾大学医学部 特任助教.
研究テーマ:生物のからだづくりにおける基本原理の探求.オルガノイド培養技術を利用した発展的な研究.
Hans Clevers
オランダHubrecht InstituteにてGroup Leader.
研究室URL:https://www.hubrecht.eu/research-groups/clevers-group/
© 2018 佐々木伸雄・Hans Clevers Licensed under CC 表示 2.1 日本
(オランダHubrecht Institute)
email:佐々木伸雄
DOI: 10.7875/first.author.2018.048
Intra-tumour diversification in colorectal cancer at the single-cell level.
Sophie F. Roerink, Nobuo Sasaki, Henry Lee-Six, Matthew D. Young, Ludmil B. Alexandrov, Sam Behjati, Thomas J. Mitchell, Sebastian Grossmann, Howard Lightfoot, David A. Egan, Apollo Pronk, Niels Smakman, Joost van Gorp, Elizabeth Anderson, Stephen J. Gamble, Chris Alder, Marc van de Wetering, Peter J. Campbell, Michael R. Stratton, Hans Clevers
Nature, 556, 457-462 (2018)
要 約
すべてのがんはひとつの体細胞から発生する.がん細胞が増殖する際には,個々の細胞にさまざまな変異が生じることにより互いに異なる遺伝的な違いおよび表現型の違いを獲得する.この研究において,筆者らは,単一の腫瘍における不均一性の本質および規模について調べるため,3人の大腸がんの患者から得たがん組織および隣接した正常な上皮組織について,単一の細胞からクローン化したオルガノイドを作製しその特性について解析した.その結果,大腸がん細胞には多様性をもつ変異が蓄積しており,正常な上皮細胞より数倍も多く変異の生じていることが確認された.ほとんどの変異は,がん化する最終段階で発生した優性なクローンが増殖するあいだに獲得されたものであり,正常な上皮細胞には存在しない過程に由来するものであった.また,DNAメチル化解析およびRNAシークエンス解析においても,単一の腫瘍における不均一性が観察された.クローン化したオルガノイドにおいて観察されたこれらの変化は,生体における周囲の微小環境とは関係なく細胞自律的に安定しており,おのおののがん細胞の変異の情報をもとに作製した分子系統樹にそったものであった.同一の腫瘍における非常に近い領域に注目しても,がん細胞の不均一性は多岐にわたり,抗がん剤の感受性についても顕著な差異が認められた.以上の結果から,大腸がん細胞においては,正常な上皮細胞と比較して変異が大幅に増加しており,それぞれのがんの遺伝的な多様性は,個々のがん細胞の生物学的な性質に広くみられる安定した遺伝的な差異をともなうことが示唆された.
はじめに
シークエンス技術の進展にともない1細胞のレベルにおけるDNAシークエンスおよびRNAシークエンスが可能になったため,腫瘍において個々の細胞のレベルで変異を理解する単一の腫瘍における不均一性に関する研究がさかんになっている.しかし,これらの技術は急速に進歩しているものの,がん組織から単一の細胞を取り出す際には正常な細胞,血液,周辺の間充織細胞などが混入するリスクがある.さらに,1細胞から得られるゲノムDNAは微量なので,全ゲノムシークエンス解析をするには試料を増幅する必要があり,アーチファクトな変異が挿入される可能性や,シークエンスの深度が十分ではないといった精度に関する問題点がいまだ解決されていない1).また,たとえ技術が進歩して高精度にシークエンスできるようになったとしても,細胞からゲノムを抽出する際にはその細胞を破壊する必要があり,のちのがん細胞の機能の解析や各種の抗がん剤の効果の検証などを“同時に”実施することは原理的に不可能である.
これらの問題を解決するため,筆者らの研究室において開発された大腸がん細胞の長期培養法であるオルガノイド培養技術を用いることにより2),シークエンスのレベルと細胞のレベルの両方において単一の腫瘍における不均一性につき包括的に理解しようと試みた.患者のがん組織から抗体を用いない蛍光セルソーター法により単一の細胞を無作為に採取し,それぞれの大腸がん細胞の性質にあわせて培地の組成を調整することにより,5~33%の割合でクローン化したオルガノイドを樹立することに成功した.これら複数のクローン化したオルガノイドを用いて,多層オミックス解析および抗がん剤に対する感受性試験を実施することにより,大腸がんにおいて単一の腫瘍における不均一性を単一の細胞のレベルで明らかにした.
1.大腸がんの患者からのクローン化したオルガノイドの樹立
3人の治療まえの大腸がんの患者それぞれから,大腸がん組織とその周辺の正常な組織の検体を得て,それらを4~6個に小さく断片化し,それぞれの断片から抗体を用いない蛍光セルソーター法を用いて単一の細胞を採取した(図1).これらを従来のオルガノイド培養技術と同様に,1細胞ずつマトリゲルに包埋し,培地の適正化を図りながら,正常な上皮細胞およびがん細胞からクローン化したオルガノイドを作製した.正常な上皮細胞に由来するオルガノイドの形態は均一であったのに対し,がん細胞に由来するオルガノイドは同一の患者に由来したものであっても試料ごとに形態や増殖速度が異なっていた.
2.がん細胞の変異のパターンを基盤とした分子系統樹による単一の腫瘍における不均一性の解析
樹立したクローン化したオルガノイドにおいて全ゲノムシークエンス解析やがん関連遺伝子を標的としたシークエンス解析を実施し,変異のパターンのカタログを作製した.これらの変異の情報をもとに分子系統樹を作製したところ,観察された変異のある程度のかたよりのパターン(末端枝の集合)は大腸がん組織の空間にそったまとまりをみせ,それぞれのクローン化したオルガノイドが得られた場所を反映していた(図1).小さな領域に着目して詳細に観察すると,すべてのクローン化したオルガノイドにおいて変異のパターンが異なっていたことから,単一の大腸がん組織において多様性は非常に高いものであることが明らかにされた.これらのエキソンにみられる変異が培養中に新しく導入されたものでないことは実験的に確かめられた.
オルガノイド培養技術は正常な上皮細胞に対しても適用が可能であるため,同一の患者の正常な上皮細胞を直接的なリファレンスとして使用した,全ゲノムシークエンスの高精度な比較が可能である.実際に,クローナルに増幅させた正常な上皮細胞およびがん細胞から得た十分量のゲノムDNAを用いた高精度な全ゲノムシークエンス解析の結果,いずれの患者の正常な上皮細胞においても約3000個の塩基置換変異が観察されたが,マイクロサテライト不安定型がんである患者1のがん細胞においては約24倍,マイクロサテライト安定型がんである患者2および患者3のがん細胞においては4~7倍も多くの変異が検出された.とくに,患者2および患者3のがん細胞においては,DNAミスマッチ修復に関する遺伝子には変異が観察されなかったにもかかわらず,正常な上皮細胞と比べ多様な変異のパターンが観察された.これらの変異をもとに作製した分子系統樹を調べると,がん細胞においてみられる変異のほとんどは共通幹の部分にはあまり観察されず,末端枝において多様性に富んだパターンが多く観察された.この結果は,がん化した細胞が増殖する際に一気に変異を獲得し,それぞれが独自に増殖するという“ビッグバンモデル”を支持するものであった3).
3.単一の腫瘍におけるDNAメチル化および遺伝子発現のパターンの多様性
これまでの研究により,単一の腫瘍において不均一性の生じるひとつの要因として,エピジェネティックな変化が示唆されていた4).そこで,正常な上皮細胞あるいはがん細胞に由来するクローン化したオルガノイドを用いて,470,000箇所のCpG部位においてDNAメチル化を調べ,主成分分析を実施した.その結果,正常な上皮細胞におけるDNAメチル化は,同一の患者に由来するクローン化したオルガノイドのあいだだけでなく,異なる患者に由来するクローン化したオルガノイドのあいだにおいてもすべて類似していた.それとは対照的に,がん細胞におけるDNAメチル化は異なる患者のあいだにおいても多様性を示した.また,患者1および患者2のがん細胞に由来するクローン化したオルガノイドは患者ごとに類似したDNAメチル化を示したが,患者3のがん細胞に由来するクローン化したオルガノイドとのあいだには明確なばらつきが観察された.全ゲノムシークエンス解析により,患者3のがん組織においてはTP53遺伝子が正常な細胞と変異をもつ細胞とが混在することが明らかにされ,DNAメチル化のパターンの多様性はTP53遺伝子の変異に依存的であることがわかった.いずれにせよ,これら3人の患者に由来するクローン化したオルガノイドの解析において.正常な上皮細胞におけるDNAメチル化のパターンはほぼ共通であったのに対し,がん細胞におけるDNAメチル化のパターンは患者ごとに大きく異なっていたことから,大腸がん細胞は多様なDNAメチル化修飾をうけて発生することが明らかにされた.
さらに,オルガノイド培養技術によりクローンは無限に増幅できるため,ゲノムDNAだけでなく,十分量のRNAも抽出することが可能である.作製したすべての正常な上皮細胞および大腸がん細胞に由来するクローン化したオルガノイドについてRNAシークエンスを実施し,遺伝子発現のパターンを解析することにより遺伝子発現に依存的な単一の腫瘍における不均一性について解析した.患者ごとに遺伝子発現のパターンをもとに分子系統樹を作製したところ,DNAメチル化のパターンをもとに作製した分子系統樹と類似していた.DNAメチル化のパターンあるいは遺伝子発現のパターンにもとづく分子系統樹は変異にもとづく分子系統樹とよく似ていたことから,がん細胞にみられるDNAメチル化あるいは遺伝子発現のパターンの多様性は,まわりの微小環境に影響されることなく,がん細胞それ自体のもつ変異のパターンにより規定されることが示唆された.
4.抗がん剤の効果の多様性
作製したすべてのクローン化したオルガノイドを用いた,分子標的薬や殺細胞性の抗がん剤に対するハイスループットな感受性試験の系を構築した.その結果,TP53の分解を誘導するMDM2を標的にするnutlin-3aや,がん細胞の生存に重要なWntシグナルのリガンド活性を阻害するIWP2のがん細胞への感受性について,TP53遺伝子やWntシグナルの負の制御タンパク質をコードするRNF43遺伝子の変異に依存的な差がみられた.また,非標的型の殺細胞性の抗がん剤である5-フルオロウラシルやシスプラチンなどについても同様に,単一の腫瘍に由来するクローン化したオルガノイドのすべてを殺傷するものはみつからず,非標的型の抗がん剤による効果のみられた(あるいは,みられなかった)クローン化したオルガノイドのあいだに共通する変異のパターンや遺伝子発現のパターンは観察されなかった.いずれにせよ,多様な単一の腫瘍における不均一性の存在する大腸がんは,1種類の抗がん剤による治療により完全に制圧できる可能性は低いことが示唆された.
おわりに
国内外の多くの研究室が精力的にがんの研究を推進してきたことにより,がん細胞の生物学的な特性や発生の機構などの理解は進んできた.しかし,近年の1細胞のレベルでのシークエンスに代表される新技術により,がんは想像していた以上に複雑性をもつことがわかった.これまでも,単一の腫瘍における不均一性に関する遺伝子発現のパターンの解析,DNAコピー数の解析,薬剤に対する感受性試験など実施されてきたが,これらはすべて個別に実施されたものであった5-7).この研究において,筆者らは,オルガノイド培養技術を用いることにより,正常な上皮細胞およびがん細胞に由来するクローン化したオルガノイドを作製し,世界ではじめて,単一の細胞のレベルにおけるDNAシークエンスおよびRNAシークエンスによるゲノミクス,エピジェネネティクス,また,抗がん剤の感受性試験の統合的な解析を実施した.これらの結果から,1)マイクロサテライト不安定型だけではなく,古典的なマイクロサテライト安定型の大腸がんにおいても大きな単一の腫瘍における不均一性の存在が確認された.2)これまで,単一の腫瘍において不均一性の生じる機構としてはビッグバンモデルとクローン増殖モデルの2つの説があったが3,8,9),今回のゲノミクス解析はビッグバンモデルを支持する結果となった.3)これまでの遺伝子発現をもとにした単一の腫瘍における不均一性の解析は,血管,間質細胞,免疫細胞など細胞外の環境に依存して単一の腫瘍における不均一性が生じることを示唆していたが,遺伝子発現はクローンごとに多様性が維持されていた.4)抗がん剤による治療において耐性を示した選択圧のかかった残存するがん幹細胞がふたたび増殖する際に新たに変異を獲得することにより単一の腫瘍における不均一性が生じるという説もあったが,今回,試料を得た患者3人は抗がん剤や放射線による治療歴がないため,単一の腫瘍における不均一性は原発性の腫瘍にすでに存在することになる,という重要な知見が得られた.
この研究においては,単一の細胞からの培養を可能にするオルガノイド培養技術の利点を用いてクローンを作製したことにより,単一の腫瘍における不均一性が高精度に解析された.しかし,今回はひとつの腫瘍から20~30のクローンしか作製しなかったため,腫瘍の全体のヘテロな不均一性は網羅しきれていないと考えられる.腫瘍のなかには,オルガノイド培養技術により増幅されない,増殖速度の極端に遅いがん細胞や,低酸素の条件でのみ生育の可能ながん細胞も存在するはずである.そのため,腫瘍の全体を網羅的に理解するには,今後のシークエンス技術および培養技術のさらなる発展が必須になるだろう.しかしながら,今回のクローン化したオルガノイドを用いた単一細胞のレベルでの高精度な解析は,ほかの臓器の固形がんへも応用が可能であるだけでなく,炎症性腸疾患や代謝経路の異常などほかの疾患の研究へ応用することも可能である.
文 献
- Leung, M. L., Davis, A., Gao, R. et al.: Single-cell DNA sequencing reveals a late-dissemination model in metastatic colorectal cancer. Genome Res., 27, 1287-1299 (2017)[PubMed]
- Sato, T., Stange, D. E., Ferrante, M. et al.: Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology, 141, 1762-1772 (2011)[PubMed]
- Sottoriva, A., Kang, H., Ma, Z. et al.: A big bang model of human colorectal tumor growth. Nat. Genet., 47, 209-216 (2015)[PubMed]
- Angermueller, C., Clark, S. J., Lee, H. J. et al.: Parallel single-cell sequencing links transcriptional and epigenetic heterogeneity. Nat. Methods, 13, 229-232 (2016)[PubMed]
- de Bruin, E. C., McGranahan, N., Mitter, R. et al.: Spatial and temporal diversity in genomic instability processes defines lung cancer evolution. Science, 346, 251-256 (2014)[PubMed]
- Gerlinger, M., Rowan, A. J., Horswell, S. et al.: Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N. Engl. J. Med., 366, 883-892 (2012)[PubMed]
- Zhang, J., Fujimoto, J., Zhang, J. et al.: Intratumor heterogeneity in localized lung adenocarcinomas delineated by multiregion sequencing. Science, 346, 256-259 (2014)[PubMed]
- Sun, R., Hu, Z., Sottoriva, A. et al.: Between-region genetic divergence reflects the mode and tempo of tumor evolution. Nat. Genet., 49, 1015-1024 (2017)[PubMed]
- Vogelstein, B., Papadopoulos, N., Velculescu, V. E. et al.: Cancer genome landscapes. Science, 339, 1546-1558 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 東京理科大学大学院基礎工学研究科にて博士号取得,国立遺伝学研究所 ポスドク,2011年 オランダHubrecht Instituteポスドクを経て,2016年より慶應義塾大学医学部 特任助教.
研究テーマ:生物のからだづくりにおける基本原理の探求.オルガノイド培養技術を利用した発展的な研究.
Hans Clevers
オランダHubrecht InstituteにてGroup Leader.
研究室URL:https://www.hubrecht.eu/research-groups/clevers-group/
© 2018 佐々木伸雄・Hans Clevers Licensed under CC 表示 2.1 日本