SororinはWaplのはたらきに拮抗して姉妹染色分体間の接着を確立する
西山 朋子
(オーストリアResearch Institute of Molecular Pathology:IMP)
email:西山朋子
DOI: 10.7875/first.author.2011.002
Sororin mediates sister chromatid cohesion by antagonizing Wapl.
Tomoko Nishiyama, Rene Ladurner, Julia Schmitz, Emanuel Kreidl, Alexander Schleiffer, Venugopal Bhaskara, Masashige Bando, Katsuhiko Shirahige, Anthony A. Hyman, Karl Mechtler, Jan-Michael Peters
Cell, 143, 737-749 (2010)
細胞分裂期において姉妹染色分体を正確に分配するためのひとつの重要なマシナリーが姉妹染色分体間の接着である.この接着を担うコヒーシンは複数のサブユニットからなる複合体で,この複合体がクロマチンに安定して結合することが姉妹染色分体間の接着に重要だと考えられている.コヒーシン結合タンパク質であるSororinは姉妹染色分体間の接着に必要であることが知られているがその分子機構は不明であった.今回,筆者らは,コヒーシンの不安定化タンパク質であるWaplの非存在下ではSororinは姉妹染色分体間の接着に必要なくなること,SororinがWaplをその結合タンパク質であるPds5からはずすことを見い出し,SororinがWaplのコヒーシン不安定化機能を阻害することで姉妹染色分体間の接着を確立しているというモデルを提唱した.また,これまで脊椎動物でしかみつかっていなかったSororinが複数の無脊椎動物においても存在したことから,Sororinによる姉妹染色分体間の接着機構が無脊椎動物のあいだでも保存されている可能性が示唆された.
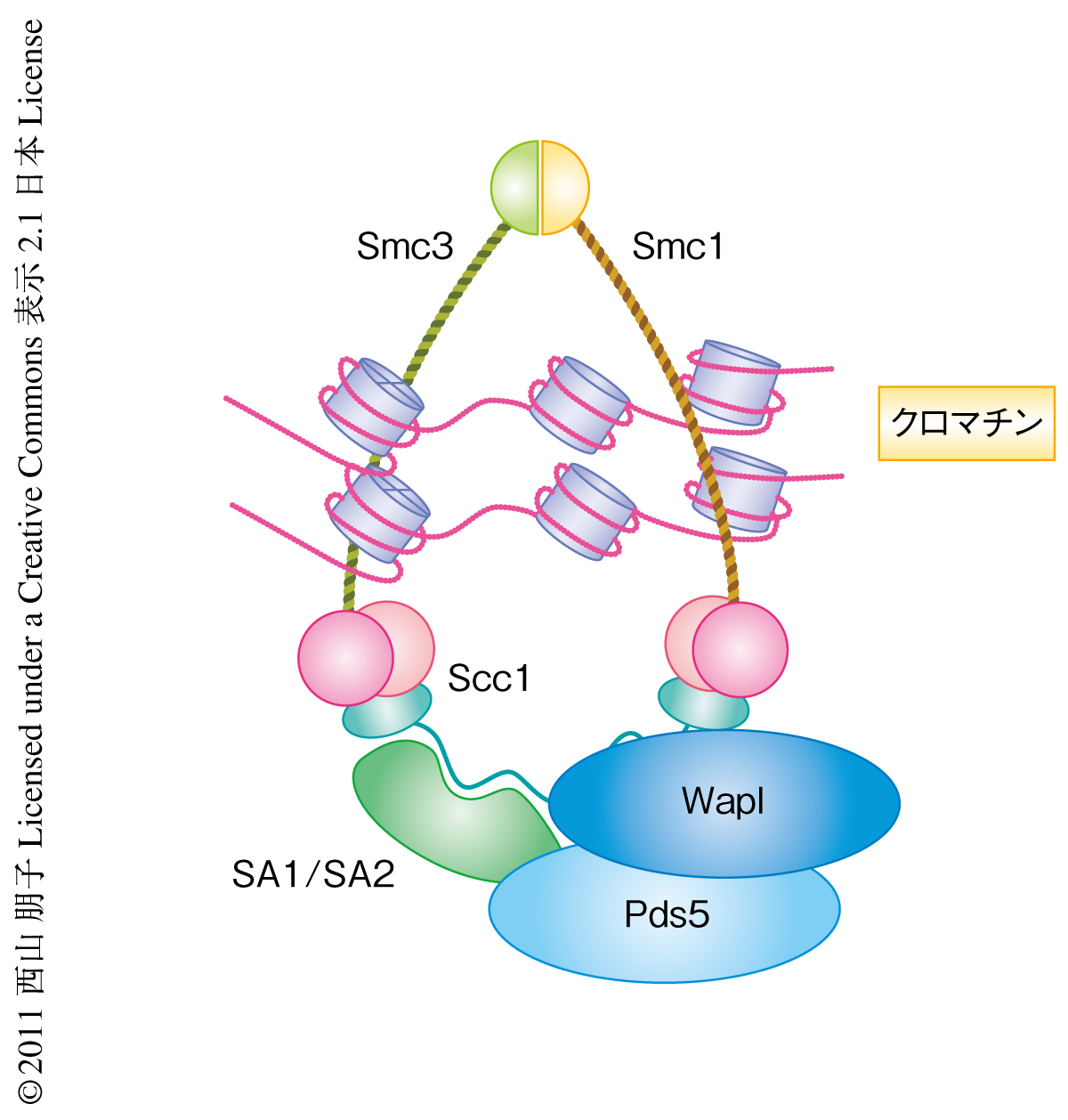
コヒーシンはSmc1,Smc3,Scc1,SA1あるいはSA2の4つのサブユニットからなるリング状の複合体である.これにくわえ,WaplとPds5からなるヘテロ2量体がScc1およびSA1あるいはSA2に結合している1)(図1).このリングがどのようにして姉妹染色分体をつなぎとめているのか,その解答はいまだでてはいないが,コヒーシンが2本の姉妹染色分体をいちどに抱え込んでいるという“リングモデル”(図1)は,これまでの構造学的および生化学的な知見に合致するようである2).
コヒーシンはDNA複製よりまえからすでにクロマチンに結合しているが,この時期の結合は非常に不安定で,S期におけるDNA複製をへてはじめて,なんらかの機構により結合が安定化されることが光退色後蛍光回復(FRAP)法によって示されている3).S期からG2期をつうじて安定してクロマチンに結合していたコヒーシンは,その大半が分裂前期に染色体腕部から解離する.Waplはこのコヒーシンの解離に必要な“コヒーシン不安定化タンパク質”で,Waplを欠損した細胞では,通常は分裂前期で解離するはずの染色体腕部が密に接着したままになってしまうため分裂期の進行に支障をきたす4,5).セントロメア領域のコヒーシンはこの解離をまぬがれ分裂中期まで存在しつづけるが,分裂中期から後期への移行にともなってセパラーゼによる切断により完全に除去されることで正確な染色体分配が達成される.
DNA複製まえにおけるコヒーシンの不安定性もまたWaplに依存していると考えられるが5),DNA複製のあいだに何がコヒーシンの安定化をもたらしているのか,その分子機構は不明であった.近年,出芽酵母およびヒトの培養細胞において,Smc3がDNA複製のあいだにアセチルトランスフェラーゼEco1(出芽酵母)あるいはEsco1/Esco2(ヒト)によってアセチル化されること,そして,このアセチル化が姉妹染色分体間の接着に必須であることが報告された6-8).興味深いことに,出芽酵母において致死であるEco1破壊株は,Rad61(出芽酵母のWaplオーソログ)やPds5に変異が導入された場合には生育可能となることから,WaplおよびPds5はSmc3のアセチル化に依存した姉妹染色分体間の接着に拮抗するような作用をもつ可能性が示唆されている6,7,9,10).
脊椎動物においてコヒーシンの安定した結合を制御するもうひとつの重要なタンパク質がSororinである.SororinはユビキチンリガーゼであるAPCCdh1の基質として同定されたタンパク質で,ヒト培養細胞において姉妹染色分体間の接着に必須であることが報告されている11).SororinはG2期におけるコヒーシンとクロマチンとの安定した結合に必要であることから12),接着の確立に必要であることが示唆されているがその詳細な分子機構は不明であった.今回,筆者らは,脊椎動物においてSororinが姉妹染色分体間の接着を確立する分子機構の解明をめざすと同時に,その無脊椎動物における保存性を明らかにすることを試みた.
まず,Sororinが細胞周期をつうじ,いつ,どこに局在するのか,その詳細をヒト体細胞において解析した.ヒト体細胞に蛍光タグを付加したSororinを内在性のSororinと同等のレベルで発現させその局在を解析したところ,SororinはS期初期からG2期にかけてクロマチン上に徐々に蓄積したが,分裂前期においてほとんどのSororinはクロマチンからはずされ,わずかな量のSororinだけが分裂中期にいたるまでセントロメア領域に存在することがわかった.セントロメア領域のSororinは分裂中期から後期に移行するときに完全に除去され,再びS期にクロマチン上に蓄積してきた.Sororinの局在はコヒーシンの除去によって消失するためコヒーシンに依存していることは明らかだが,DNA複製まえの早い時期(分裂終期)からすでにクロマチンに結合しているコヒーシンとは異なり,SororinはS期においてクロマチン上への蓄積を開始した.このS期から分裂中期にいたるSororinの局在は,まさしく姉妹染色分体間の接着が実際に起こっている時期および場所に一致していた.このことは,Sororinが“接着確立因子”のひとつであることを強く示唆していた.
つぎに,Sororinのクロマチンへの結合がS期においてどのような制御をうけているのかに着目した.Sororinのクロマチンへの結合がDNA複製と同じ時期に起こっていることから,はじめにDNA複製との関連を調べた.この目的のため,アフリカツメガエルの卵抽出液を用いた.アフリカツメガエル卵抽出液は,分裂期における染色体の凝縮,間期における核の形成やDNA複製といった,細胞周期のさまざまなイベントを試験管内で同調性よく再現できる便利な系である.筆者らは,アフリカツメガエル卵抽出液においてもSororinがコヒーシンに依存してS期においてクロマチンに結合すること,分裂期においてクロマチンからはずされることを確認しており,Sororinはヒト体細胞の系と同様のクロマチン結合様式を示すと考えられた.アフリカツメガエル卵抽出液にDNAポリメラーゼ阻害剤であるアフィディコリンを添加するとDNA複製を効率よく阻害することができるが,このとき,Sororinのクロマチンへの結合が大きく減少することがわかった.同様に,ヒト体細胞でもチミジンでS期初期に細胞周期を停止させることでSororinのクロマチンへの結合が減少したことから,SororinはDNA複製の進行に依存してクロマチンに結合する可能性が示唆された.
つぎに,S期におけるもうひとつの重要なイベント,Smc3のアセチル化との関連に着目した.Smc3のアセチル化は姉妹染色分体間の接着に必要であることからSororinともなんらかの関係があるのではないかと予想された.しかしながら,Sororinはヒト体細胞においてもアフリカツメガエル卵抽出液においてもSmc3のアセチル化には必要なかったことから,つぎに,Smc3のアセチル化がSororinのクロマチンへの結合に及ぼす影響を調べた.その結果,ヒト体細胞においてSmc3のアセチル化に必要なEsco1/Esco2の発現を抑制するとSororinのクロマチンへの結合が顕著に減少し,コヒーシンへの結合も大きく減少することがわかった.過去の報告から,Esco1/Esco2の発現を抑制するとDNA複製フォークの進行速度が低下することが知られていたが,Esco1/Esco2の発現を抑制した細胞においてDNA複製に遅れのない細胞だけを選び出して解析した場合でもSororinのクロマチンへの結合が有意に減少していたことから,Smc3のアセチル化はDNA複製とは独立してSororinのクロマチンへの結合を促進していることが判明した.以上の結果より,SororinはS期のあいだにDNA複製とSmc3のアセチル化に依存してクロマチンに結合していることが明らかになった.
Sororinがどのようにして姉妹染色分体間の接着を確立しているのか,その分子機構にせまるため,まず,脊椎動物におけるコヒーシンの不安定化タンパク質Waplとの機能的な関連に着目した.Waplの発現を抑制した細胞ではクロマチンに結合したコヒーシンが過度に安定化されるため,姉妹染色分体どうしが密に接着した分裂期染色体が観察される.もしSororinが姉妹染色分体間の接着に必須であるならば,Waplの発現を抑制したときにみられる過度の接着はSororinの発現抑制によって解消されるはずである.この仮説を検証するため,SororinとWaplの発現を同時に抑制する実験を行った.すると驚くべきことに,SororinとWaplの発現をともに抑制した場合でも,Waplの発現を単独で抑制した場合と同様に,姉妹染色分体どうしは密に接着したままであった.このことは,SororinはWaplの非存在下では姉妹染色分体間の接着には必要でないことを示しており,SororinがWaplの機能に拮抗するようなはたらきをもっている可能性を示唆していた.
SororinがどのようにWaplの機能に拮抗しうるのか,その分子機構を明らかにするため,つぎに,Waplの結合タンパク質であるPds5に着目した.Pds5はWaplとヘテロ2量体を形成するだけでなくin vitroでSororinと結合できること,また,Sororinのクロマチンへの結合にはPds5が必要であることがわかっていた.つまり,Pds5はSororinとWaplとの機能をつなぐなんらかの重要な役割をはたしているのではないかと予想された.SororinとPds5の結合部位を解析した結果,Sororinに存在するPhe-Gly-Pheというアミノ酸配列(FGF配列)がPds5との結合に重要であることがわかった.興味深いことに,このFGF配列はWaplにおいて同定されていたPds5との結合配列と相同で,Waplの機能にはFGF配列を介したWaplとPds5との結合が必要であることが報告されていた13).さらに興味深いことに,in vitroでWapl-Pds5ヘテロ2量体と野生型Sororinとを混ぜ合わせると,SororinがPds5に結合すると同時にWaplがPds5からはずされることが観察された.一方,FGF配列に変異をもつSororinはPds5に結合できないうえ,WaplもPds5からはずされないことがわかった.このことは,SororinがFGF配列を介してPds5に結合し,この結合がWaplをPds5からはずしていることを示していた.
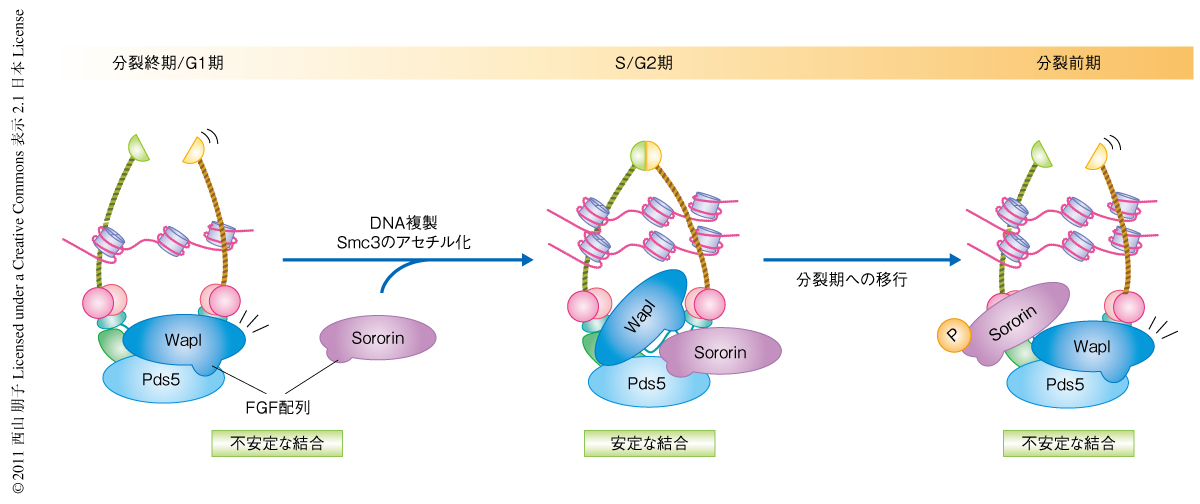
つぎに,このFGF配列を介したSororinとPds5との結合が姉妹染色分体間の接着に重要かどうかをアフリカツメガエル卵抽出液において解析した.アフリカツメガエル卵抽出液においてもSororinは姉妹染色分体間の接着に重要なので,Sororinを除くと姉妹染色分体間の距離が広がってしまう.ここに野生型Sororinを添加すると姉妹染色分体間の距離はもとどおりに回復するが,FGF配列に変異をもつSororinを同じ濃度で添加しても距離は回復しなかった.このことから,FGF配列を介したSororinとPds5との結合は姉妹染色分体間の接着にも必要であることがわかった.以上のことから,SororinはS期においてクロマチン上に存在するコヒーシンに結合し,Pds5とFGF配列を介して結合することでWaplをPds5からはずし,S期およびG2期のあいだにWaplの機能を阻害している可能性が示唆された(図2).興味深いことに,分裂期においてはSororinがなんらかのキナーゼによってリン酸化されることでPds5と結合できなくなり,WaplをPds5からはずせなくなることがわかった(図2).S期からG2期においてSororinによって阻害されていたWaplが分裂前期においてコヒーシンを不安定化させるための機能を発揮できるのは,Sororinのリン酸化によるのかもしれない.
SororinによるWaplの機能阻害が姉妹染色分体間の接着の重要な分子機構であるならば,これは進化の過程でどのくらい保存されているのだろうか? Waplが酵母からヒトまで保存されていることを考えると,酵母にもSororinが存在しWaplに拮抗するようなはたらきをしているのだろうか? 残念ながら,酵母のSororinオーソログはいまだ同定されていないが,筆者らは,多くの無脊椎動物においてSororinに似た配列をもつタンパク質が存在することを見い出した.そのなかのひとつ,ショウジョウバエのクロマチン結合タンパク質Dalmatian(Dmt)は,脊椎動物Sororinとの相同性は低いものの,非常によく保存されているC末端領域(Sororinドメイン)と,APCCdh1の認識配列であるKENボックス,さらには,複数のFGF配列をもっていた.ショウジョウバエの培養細胞においてDmtの発現を抑制すると,分裂期における時期尚早な姉妹染色分体の解離と,それによってひき起こされる分裂期の停止が観察された.このことから,DmtはショウジョウバエにおけるSororinのオーソログである可能性が強く示唆された.DmtにもFGF配列が保存されていることから,ショウジョウバエにおいてもSororinによるWapl拮抗モデルが保存されている可能性がある.
今回の研究によって,SororinがS期のあいだに姉妹染色分体間の接着を確立する分子機構の一端が明らかになった.いままで,それぞれ独立に必要性が論じられていたSororin,Wapl,Pds5といったコヒーシン結合タンパク質やSmc3のアセチル化がSororinを中心としたネットワークのなかに存在することが明らかになった.しかしながら,いまだにこのSororinネットワークには多くの疑問が残されており,DNA複製に依存してどのようにSororinがクロマチンに結合するのか,Smc3のアセチル化がいかにしてSororinのコヒーシンへの結合を促進するのか,あるいは,分裂期におけるSororinのリン酸化はWaplの活性化に必要なのか,など,その詳細な分子機構については今後の解析が期待される.そして,今回の研究で,無脊椎動物におけるSororinオーソログの存在が明らかになったことは,このSororinネットワークが無脊椎動物においても保存されている可能性を示唆しており,無脊椎動物におけるその重要性を明らかにすることも今後の重要な課題である.
略歴:2007年 東京工業大学大学院生命理工学研究科博士課程 修了,2008年よりオーストリアResearch Institute of Molecular Pathology(IMP)博士研究員(Jan-Michael Peters lab).
研究テーマ:染色体接着の分子機構.
関心事:コヒーシンという不思議なリングの“つかみ,はずされ,切られ,またつかむ”というダイナミックなふるまいに魅了されている.間期と分裂期をつうじたこの大胆なふるまいが染色体の動態と機能に密接しているからこそ,なおさら魅力的である.
© 2011 西山 朋子 Licensed under CC 表示 2.1 日本
(オーストリアResearch Institute of Molecular Pathology:IMP)
email:西山朋子
DOI: 10.7875/first.author.2011.002
Sororin mediates sister chromatid cohesion by antagonizing Wapl.
Tomoko Nishiyama, Rene Ladurner, Julia Schmitz, Emanuel Kreidl, Alexander Schleiffer, Venugopal Bhaskara, Masashige Bando, Katsuhiko Shirahige, Anthony A. Hyman, Karl Mechtler, Jan-Michael Peters
Cell, 143, 737-749 (2010)
要 約
細胞分裂期において姉妹染色分体を正確に分配するためのひとつの重要なマシナリーが姉妹染色分体間の接着である.この接着を担うコヒーシンは複数のサブユニットからなる複合体で,この複合体がクロマチンに安定して結合することが姉妹染色分体間の接着に重要だと考えられている.コヒーシン結合タンパク質であるSororinは姉妹染色分体間の接着に必要であることが知られているがその分子機構は不明であった.今回,筆者らは,コヒーシンの不安定化タンパク質であるWaplの非存在下ではSororinは姉妹染色分体間の接着に必要なくなること,SororinがWaplをその結合タンパク質であるPds5からはずすことを見い出し,SororinがWaplのコヒーシン不安定化機能を阻害することで姉妹染色分体間の接着を確立しているというモデルを提唱した.また,これまで脊椎動物でしかみつかっていなかったSororinが複数の無脊椎動物においても存在したことから,Sororinによる姉妹染色分体間の接着機構が無脊椎動物のあいだでも保存されている可能性が示唆された.
はじめに
コヒーシンはSmc1,Smc3,Scc1,SA1あるいはSA2の4つのサブユニットからなるリング状の複合体である.これにくわえ,WaplとPds5からなるヘテロ2量体がScc1およびSA1あるいはSA2に結合している1)(図1).このリングがどのようにして姉妹染色分体をつなぎとめているのか,その解答はいまだでてはいないが,コヒーシンが2本の姉妹染色分体をいちどに抱え込んでいるという“リングモデル”(図1)は,これまでの構造学的および生化学的な知見に合致するようである2).
コヒーシンはDNA複製よりまえからすでにクロマチンに結合しているが,この時期の結合は非常に不安定で,S期におけるDNA複製をへてはじめて,なんらかの機構により結合が安定化されることが光退色後蛍光回復(FRAP)法によって示されている3).S期からG2期をつうじて安定してクロマチンに結合していたコヒーシンは,その大半が分裂前期に染色体腕部から解離する.Waplはこのコヒーシンの解離に必要な“コヒーシン不安定化タンパク質”で,Waplを欠損した細胞では,通常は分裂前期で解離するはずの染色体腕部が密に接着したままになってしまうため分裂期の進行に支障をきたす4,5).セントロメア領域のコヒーシンはこの解離をまぬがれ分裂中期まで存在しつづけるが,分裂中期から後期への移行にともなってセパラーゼによる切断により完全に除去されることで正確な染色体分配が達成される.
DNA複製まえにおけるコヒーシンの不安定性もまたWaplに依存していると考えられるが5),DNA複製のあいだに何がコヒーシンの安定化をもたらしているのか,その分子機構は不明であった.近年,出芽酵母およびヒトの培養細胞において,Smc3がDNA複製のあいだにアセチルトランスフェラーゼEco1(出芽酵母)あるいはEsco1/Esco2(ヒト)によってアセチル化されること,そして,このアセチル化が姉妹染色分体間の接着に必須であることが報告された6-8).興味深いことに,出芽酵母において致死であるEco1破壊株は,Rad61(出芽酵母のWaplオーソログ)やPds5に変異が導入された場合には生育可能となることから,WaplおよびPds5はSmc3のアセチル化に依存した姉妹染色分体間の接着に拮抗するような作用をもつ可能性が示唆されている6,7,9,10).
脊椎動物においてコヒーシンの安定した結合を制御するもうひとつの重要なタンパク質がSororinである.SororinはユビキチンリガーゼであるAPCCdh1の基質として同定されたタンパク質で,ヒト培養細胞において姉妹染色分体間の接着に必須であることが報告されている11).SororinはG2期におけるコヒーシンとクロマチンとの安定した結合に必要であることから12),接着の確立に必要であることが示唆されているがその詳細な分子機構は不明であった.今回,筆者らは,脊椎動物においてSororinが姉妹染色分体間の接着を確立する分子機構の解明をめざすと同時に,その無脊椎動物における保存性を明らかにすることを試みた.
1.Sororinのクロマチンへの結合は姉妹染色分体間の接着の時期および場所に一致する
まず,Sororinが細胞周期をつうじ,いつ,どこに局在するのか,その詳細をヒト体細胞において解析した.ヒト体細胞に蛍光タグを付加したSororinを内在性のSororinと同等のレベルで発現させその局在を解析したところ,SororinはS期初期からG2期にかけてクロマチン上に徐々に蓄積したが,分裂前期においてほとんどのSororinはクロマチンからはずされ,わずかな量のSororinだけが分裂中期にいたるまでセントロメア領域に存在することがわかった.セントロメア領域のSororinは分裂中期から後期に移行するときに完全に除去され,再びS期にクロマチン上に蓄積してきた.Sororinの局在はコヒーシンの除去によって消失するためコヒーシンに依存していることは明らかだが,DNA複製まえの早い時期(分裂終期)からすでにクロマチンに結合しているコヒーシンとは異なり,SororinはS期においてクロマチン上への蓄積を開始した.このS期から分裂中期にいたるSororinの局在は,まさしく姉妹染色分体間の接着が実際に起こっている時期および場所に一致していた.このことは,Sororinが“接着確立因子”のひとつであることを強く示唆していた.
2.Sororinのクロマチンへの結合はDNA複製とSmc3のアセチル化に依存する
つぎに,Sororinのクロマチンへの結合がS期においてどのような制御をうけているのかに着目した.Sororinのクロマチンへの結合がDNA複製と同じ時期に起こっていることから,はじめにDNA複製との関連を調べた.この目的のため,アフリカツメガエルの卵抽出液を用いた.アフリカツメガエル卵抽出液は,分裂期における染色体の凝縮,間期における核の形成やDNA複製といった,細胞周期のさまざまなイベントを試験管内で同調性よく再現できる便利な系である.筆者らは,アフリカツメガエル卵抽出液においてもSororinがコヒーシンに依存してS期においてクロマチンに結合すること,分裂期においてクロマチンからはずされることを確認しており,Sororinはヒト体細胞の系と同様のクロマチン結合様式を示すと考えられた.アフリカツメガエル卵抽出液にDNAポリメラーゼ阻害剤であるアフィディコリンを添加するとDNA複製を効率よく阻害することができるが,このとき,Sororinのクロマチンへの結合が大きく減少することがわかった.同様に,ヒト体細胞でもチミジンでS期初期に細胞周期を停止させることでSororinのクロマチンへの結合が減少したことから,SororinはDNA複製の進行に依存してクロマチンに結合する可能性が示唆された.
つぎに,S期におけるもうひとつの重要なイベント,Smc3のアセチル化との関連に着目した.Smc3のアセチル化は姉妹染色分体間の接着に必要であることからSororinともなんらかの関係があるのではないかと予想された.しかしながら,Sororinはヒト体細胞においてもアフリカツメガエル卵抽出液においてもSmc3のアセチル化には必要なかったことから,つぎに,Smc3のアセチル化がSororinのクロマチンへの結合に及ぼす影響を調べた.その結果,ヒト体細胞においてSmc3のアセチル化に必要なEsco1/Esco2の発現を抑制するとSororinのクロマチンへの結合が顕著に減少し,コヒーシンへの結合も大きく減少することがわかった.過去の報告から,Esco1/Esco2の発現を抑制するとDNA複製フォークの進行速度が低下することが知られていたが,Esco1/Esco2の発現を抑制した細胞においてDNA複製に遅れのない細胞だけを選び出して解析した場合でもSororinのクロマチンへの結合が有意に減少していたことから,Smc3のアセチル化はDNA複製とは独立してSororinのクロマチンへの結合を促進していることが判明した.以上の結果より,SororinはS期のあいだにDNA複製とSmc3のアセチル化に依存してクロマチンに結合していることが明らかになった.
3.SororinはWaplの機能に拮抗することで姉妹染色分体間の接着を可能にする
Sororinがどのようにして姉妹染色分体間の接着を確立しているのか,その分子機構にせまるため,まず,脊椎動物におけるコヒーシンの不安定化タンパク質Waplとの機能的な関連に着目した.Waplの発現を抑制した細胞ではクロマチンに結合したコヒーシンが過度に安定化されるため,姉妹染色分体どうしが密に接着した分裂期染色体が観察される.もしSororinが姉妹染色分体間の接着に必須であるならば,Waplの発現を抑制したときにみられる過度の接着はSororinの発現抑制によって解消されるはずである.この仮説を検証するため,SororinとWaplの発現を同時に抑制する実験を行った.すると驚くべきことに,SororinとWaplの発現をともに抑制した場合でも,Waplの発現を単独で抑制した場合と同様に,姉妹染色分体どうしは密に接着したままであった.このことは,SororinはWaplの非存在下では姉妹染色分体間の接着には必要でないことを示しており,SororinがWaplの機能に拮抗するようなはたらきをもっている可能性を示唆していた.
SororinがどのようにWaplの機能に拮抗しうるのか,その分子機構を明らかにするため,つぎに,Waplの結合タンパク質であるPds5に着目した.Pds5はWaplとヘテロ2量体を形成するだけでなくin vitroでSororinと結合できること,また,Sororinのクロマチンへの結合にはPds5が必要であることがわかっていた.つまり,Pds5はSororinとWaplとの機能をつなぐなんらかの重要な役割をはたしているのではないかと予想された.SororinとPds5の結合部位を解析した結果,Sororinに存在するPhe-Gly-Pheというアミノ酸配列(FGF配列)がPds5との結合に重要であることがわかった.興味深いことに,このFGF配列はWaplにおいて同定されていたPds5との結合配列と相同で,Waplの機能にはFGF配列を介したWaplとPds5との結合が必要であることが報告されていた13).さらに興味深いことに,in vitroでWapl-Pds5ヘテロ2量体と野生型Sororinとを混ぜ合わせると,SororinがPds5に結合すると同時にWaplがPds5からはずされることが観察された.一方,FGF配列に変異をもつSororinはPds5に結合できないうえ,WaplもPds5からはずされないことがわかった.このことは,SororinがFGF配列を介してPds5に結合し,この結合がWaplをPds5からはずしていることを示していた.
つぎに,このFGF配列を介したSororinとPds5との結合が姉妹染色分体間の接着に重要かどうかをアフリカツメガエル卵抽出液において解析した.アフリカツメガエル卵抽出液においてもSororinは姉妹染色分体間の接着に重要なので,Sororinを除くと姉妹染色分体間の距離が広がってしまう.ここに野生型Sororinを添加すると姉妹染色分体間の距離はもとどおりに回復するが,FGF配列に変異をもつSororinを同じ濃度で添加しても距離は回復しなかった.このことから,FGF配列を介したSororinとPds5との結合は姉妹染色分体間の接着にも必要であることがわかった.以上のことから,SororinはS期においてクロマチン上に存在するコヒーシンに結合し,Pds5とFGF配列を介して結合することでWaplをPds5からはずし,S期およびG2期のあいだにWaplの機能を阻害している可能性が示唆された(図2).興味深いことに,分裂期においてはSororinがなんらかのキナーゼによってリン酸化されることでPds5と結合できなくなり,WaplをPds5からはずせなくなることがわかった(図2).S期からG2期においてSororinによって阻害されていたWaplが分裂前期においてコヒーシンを不安定化させるための機能を発揮できるのは,Sororinのリン酸化によるのかもしれない.
4.ショウジョウバエDalmatianはSororinのオーソログである
SororinによるWaplの機能阻害が姉妹染色分体間の接着の重要な分子機構であるならば,これは進化の過程でどのくらい保存されているのだろうか? Waplが酵母からヒトまで保存されていることを考えると,酵母にもSororinが存在しWaplに拮抗するようなはたらきをしているのだろうか? 残念ながら,酵母のSororinオーソログはいまだ同定されていないが,筆者らは,多くの無脊椎動物においてSororinに似た配列をもつタンパク質が存在することを見い出した.そのなかのひとつ,ショウジョウバエのクロマチン結合タンパク質Dalmatian(Dmt)は,脊椎動物Sororinとの相同性は低いものの,非常によく保存されているC末端領域(Sororinドメイン)と,APCCdh1の認識配列であるKENボックス,さらには,複数のFGF配列をもっていた.ショウジョウバエの培養細胞においてDmtの発現を抑制すると,分裂期における時期尚早な姉妹染色分体の解離と,それによってひき起こされる分裂期の停止が観察された.このことから,DmtはショウジョウバエにおけるSororinのオーソログである可能性が強く示唆された.DmtにもFGF配列が保存されていることから,ショウジョウバエにおいてもSororinによるWapl拮抗モデルが保存されている可能性がある.
おわりに
今回の研究によって,SororinがS期のあいだに姉妹染色分体間の接着を確立する分子機構の一端が明らかになった.いままで,それぞれ独立に必要性が論じられていたSororin,Wapl,Pds5といったコヒーシン結合タンパク質やSmc3のアセチル化がSororinを中心としたネットワークのなかに存在することが明らかになった.しかしながら,いまだにこのSororinネットワークには多くの疑問が残されており,DNA複製に依存してどのようにSororinがクロマチンに結合するのか,Smc3のアセチル化がいかにしてSororinのコヒーシンへの結合を促進するのか,あるいは,分裂期におけるSororinのリン酸化はWaplの活性化に必要なのか,など,その詳細な分子機構については今後の解析が期待される.そして,今回の研究で,無脊椎動物におけるSororinオーソログの存在が明らかになったことは,このSororinネットワークが無脊椎動物においても保存されている可能性を示唆しており,無脊椎動物におけるその重要性を明らかにすることも今後の重要な課題である.
文 献
- Peters, J. M., Tedeschi, A. & Schmitz, J.: The cohesin complex and its roles in chromosome biology. Genes Dev., 22, 3089-3114 (2008)[PubMed]
- Nasmyth, K. & Haering, C. H.: Cohesin: its roles and mechanisms. Annu. Rev. Genet., 43, 525-558 (2009)[PubMed]
- Gerlich, D., Koch, B., Dupeux, F. et al.: Live-cell imaging reveals a stable cohesin-chromatin interaction after but not before DNA replication. Curr. Biol., 16, 1571-1578 (2006)[PubMed]
- Gandhi, R., Gillespie, P. J., & Hirano, T.: Human Wapl is a cohesin-binding protein that promotes sister-chromatid resolution in mitotic prophase. Curr. Biol., 16, 2406-2417 (2006)[PubMed]
- Kueng, S., Hegemann, B., Peters, B. H. et al.: Wapl controls the dynamic association of cohesin with chromatin. Cell, 127, 955-967 (2006)[PubMed]
- Rolef Ben-Shahar, T., Heeger, S., Lehane, C. et al.: Eco1-dependent cohesin acetylation during establishment of sister chromatid cohesion. Science, 321, 563-566 (2008)[PubMed]
- Unal, E., Heidinger-Pauli, J. M., Kim, W. et al.: A molecular determinant for the establishment of sister chromatid cohesion. Science, 321, 566-569 (2008)[PubMed]
- Zhang, J., Shi, X., Li, Y., et al.: Acetylation of Smc3 by Eco1 is required for S phase sister chromatid cohesion in both human and yeast. Mol. Cell, 31, 143-151 (2008)[PubMed]
- Rowland, B. D., Roig, M. B., Nishino, T. et al.: Building sister chromatid cohesion: smc3 acetylation counteracts an antiestablishment activity. Mol. Cell, 33, 763-774 (2009)[PubMed]
- Sutani, T., Kawaguchi, T., Kanno, R. et al.: Budding yeast Wpl1(Rad61)-Pds5 complex counteracts sister chromatid cohesion-establishing reaction. Curr. Biol., 19, 492-497 (2009)[PubMed]
- Rankin, S., Ayad, N. G. & Kirschner, M. W.: Sororin, a substrate of the anaphase-promoting complex, is required for sister chromatid cohesion in vertebrates. Mol. Cell, 18, 185-200 (2005)[PubMed]
- Schmitz, J., Watrin, E., Lenart, P. et al.: Sororin is required for stable binding of cohesin to chromatin and for sister chromatid cohesion in interphase. Curr. Biol., 17, 630-636 (2007)[PubMed]
- Shintomi, K. & Hirano, T.: Releasing cohesin from chromosome arms in early mitosis: opposing actions of Wapl-Pds5 and Sgo1. Genes Dev., 23, 2224-2236 (2009)[PubMed]
著者プロフィール
略歴:2007年 東京工業大学大学院生命理工学研究科博士課程 修了,2008年よりオーストリアResearch Institute of Molecular Pathology(IMP)博士研究員(Jan-Michael Peters lab).
研究テーマ:染色体接着の分子機構.
関心事:コヒーシンという不思議なリングの“つかみ,はずされ,切られ,またつかむ”というダイナミックなふるまいに魅了されている.間期と分裂期をつうじたこの大胆なふるまいが染色体の動態と機能に密接しているからこそ,なおさら魅力的である.
© 2011 西山 朋子 Licensed under CC 表示 2.1 日本