制御性T細胞およびTh17細胞の分化誘導にともなうId3の役割
丸山貴司・Chen WanJun
(米国NIH National Institute of Dental and Craniofacial Research, Oral Infection and Immunity Branch,Mucosal Immunology Unit)
email:丸山貴司
DOI: 10.7875/first.author.2011.005
Control of the differentiation of regulatory T cells and TH17 cells by the DNA-binding inhibitor Id3.
Takashi Maruyama, Jun Li, Jose P. Vaque, Joanne E. Konkel, Weifeng Wang, Baojun Zhang, Pin Zhang, Brian F. Zamarron, Dongyang Yu, Yuntao Wu, Yuan Zhuang, J. Silvio Gutkind, WanJun Chen
Nature Immunology, 12, 86-95 (2011)
免疫制御をつかさどる制御性T細胞はTGF-βによって分化誘導されることが知られているものの,その分子機構にはいまだ明らかでない部分が多い.この研究では,TGF-βによる刺激によりEタンパク質がFoxp3遺伝子のプロモーターに結合すること,さらに,Gata3の発現およびFoxp3遺伝子のプロモーターへの結合を抑制することで制御性T細胞の分化誘導の進むことが明らかになった.また,Id3とよばれるタンパク質を欠損したT細胞ではTGF-βによる刺激をくわえても制御性T細胞の分化誘導が認められず,むしろ,Th17細胞への分化誘導が認められた.
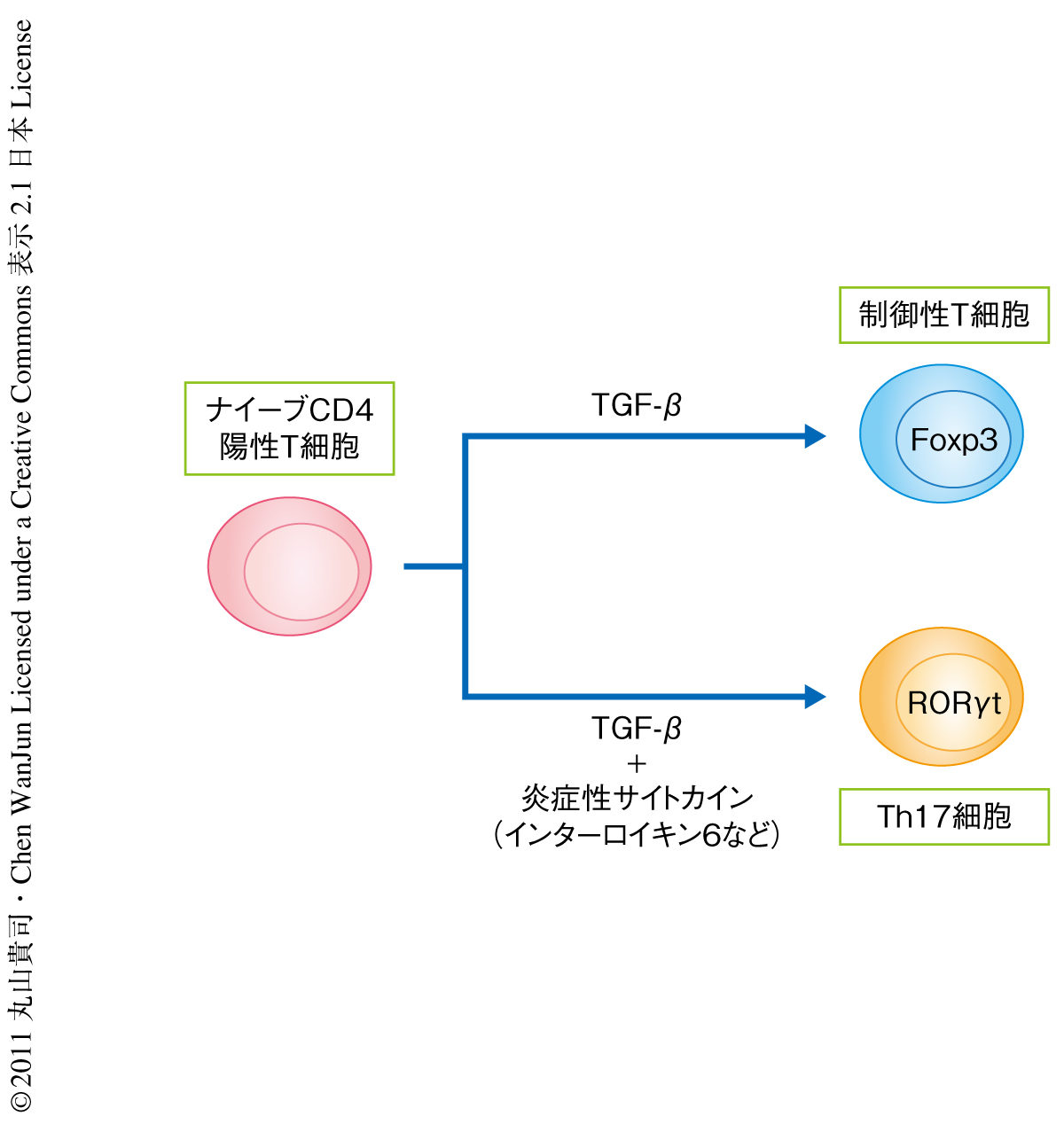
制御性T細胞(regulatory T cell:Treg)は免疫制御をつかさどる重要なT細胞のひとつで,転写因子Foxp3(Forkhead box p3)を特異的に発現している1).また,制御性T細胞はTGF-β(transforming growth factor-β)とよばれるサイトカインによってナイーブCD4陽性T細胞から分化誘導される2).T細胞特異的にTGF-β受容体を欠損したマウスは末梢リンパ節において制御性T細胞がほとんど認められず,生まれてまもなく全身に強い炎症が認められ死にいたることからも,TGF-βは制御性T細胞の分化誘導をつうじた生体の免疫制御に重要であることが明らかになっている.近年,TGF-βによる制御性T細胞の分化誘導はインターロイキン6など炎症性サイトカインにより抑制されるとともに,インターロイキン17とよばれる炎症促進性サイトカインを産生するTh17細胞へと分化誘導されることが報告されている3)(図1).このTh17細胞は多発性硬化症や慢性関節リウマチなどの自己免疫疾患の増悪にも寄与していることが明らかになってきた.そこで,この研究では,TGF-βがどのように制御性T細胞およびTh17細胞の分化誘導を制御しているのか,Id(inhibitor DNA binding protein)とよばれるタンパク質に着目しその分子機構の解析を行った.
Idタンパク質ファミリー(Id1,Id2,Id3,Id4)はDNA結合領域をもたず転写活性能もないが,E2A,HEB,E2-2などのEタンパク質(E-protein)とよばれる転写因子と2量体を形成してその転写活性を阻害する(図2a).Idタンパク質ファミリーおよびEタンパク質はともにヘリックス-ループ-ヘリックス構造をもつ.Eタンパク質はIdタンパク質ファミリーとの2量体の形成をのがれて新たにEタンパク質どうしで2量体(ヘテロ2量体およびホモ2量体)を形成することで転写活性をもち,CANNTG配列に結合することで遺伝子の発現制御を行う4)(図2b).この研究にて使用したId3ノックアウトマウスは自己免疫疾患のひとつであるSjogren症候群のモデルマウスとしても知られているものの,そのくわしい分子機構は明らかになっていない5).さらに,Id3ノックアウトマウスでは末梢リンパ節においてγδT細胞が多く認められること,また,およそ24週齢以上のマウスではγδT細胞のがん化が認められるとの報告もされている6).
Id3ノックアウトマウスの末梢リンパ節における制御性T細胞の割合および絶対数を調べたところ,野生型マウスに比べて有意に減少していることが明らかになった.さらに,Id3ノックアウトマウスに由来する制御性T細胞の増殖抑制能は野生型マウスに由来する制御性T細胞に比べて有意に減少していることも明らかになった.Id3ノックアウトマウスの脾臓より精製したナイーブCD4陽性T細胞に対しTGF-βによる刺激をくわえたところ制御性T細胞の分化誘導は認められなかった.また,野生型マウスに由来するナイーブCD4陽性T細胞では,TGF-βによる刺激によりId3の発現上昇が一過的に認められるものの(数時間),24時間後には発現の顕著な減少が認められた.以上より,Id3は制御性T細胞の分化誘導および制御能に必須のタンパク質であり,TGF-βによる刺激によりその発現が制御されていることが明らかになった.
Id3ノックアウトマウスに由来するT細胞では細胞質および核において転写活性をもつEタンパク質2量体が過剰に存在することが考えられる.また,Foxp3遺伝子の転写開始点から1 kb上流までの領域(Foxp3プロモーター)にはEタンパク質の結合部位であるCANNTG配列が多く存在することが認められた.以上より,とくにId3ノックアウトマウスにおいてEタンパク質がFoxp3の発現制御になんらかの影響をあたえていることが推測された.野生型マウスの脾臓より精製したナイーブCD4陽性T細胞をTGF-βにより刺激しクロマチン免疫沈降法により解析したところ,Eタンパク質のFoxp3プロモーターへの結合(または,凝集)が認められた.また,ナイーブCD4陽性T細胞のEタンパク質をsiRNAによりノックダウンすると,TGF-βによる刺激によりひき起こされる制御性T細胞への分化誘導が阻害された.さらに,Foxp3プロモーターのCANNTG配列に変異を導入したところプロモーター活性は顕著に減少した.以上より,TGF-βにより誘導されるFoxp3プロモーターへのEタンパク質の凝集はFoxp3の発現を正に制御することが明らかになった.しかし,Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞ではTGF-β刺激によるEタンパク質のFoxp3プロモーターへの凝集は認められなかった.
TGF-βにより誘導される制御性T細胞は非常に不安定なポピュレーションであり,さまざまな炎症性サイトカインによって制御性T細胞への分化誘導の阻害されることが知られている.Id3ノックアウトマウスに由来するCD4陽性T細胞からは,T細胞受容体からの刺激後24時間でインターロイキン4の過剰な産生が認められた.このインターロイキン4は自らのインターロイキン4受容体で受け取られ,Gata3とよばれる転写因子の発現を誘導する.Id3ノックアウトマウスに由来するCD4陽性T細胞においては,Gata3の発現が強く誘導され,また,Gata3がFoxp3プロモーターに過剰に凝集することが明らかになった.このFoxp3プロモーターに凝集したGata3はFoxp3の発現を負に制御することが知られている7).Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞をTGF-βにより刺激するとインターロイキン4の産生およびGata3の発現の一部は抑えられたものの依然として高いレベルにあり,また,Foxp3の発現の上昇は認められなかった.
インターロイキン4中和抗体とTGF-βを用いてId3ノックアウトマウスに由来するナイーブCD4陽性T細胞を刺激したところ,Gata3の発現が完全に抑えられFoxp3の強い発現上昇が認められた.以上より,Id3ノックアウトマウスに由来するCD4陽性T細胞からの過剰なインターロイキン4の産生が転写因子Gata3の過剰な発現およびプロモーターへの過剰な凝集を誘導することで,TGF-βによる制御性T細胞の分化誘導(Foxp3の発現)を阻害していることが明らかになった.また,インターロイキン4中和抗体とTGF-βを用いて野生型マウスおよびId3ノックアウトマウスに由来するCD4陽性T細胞を刺激したところ,その両方でEタンパク質のFoxp3プロモーターにおける凝集が認められた.
インターロイキン4の転写開始点より0.4 kb上流まで(種間高保存領域)には少なくとも4つのEタンパク質結合部位が認められた.ナイーブCD4陽性T細胞においてEタンパク質をノックダウンするとT細胞受容体による刺激によるインターロイキン4の産生は有意に減少した.以上より,Id3ノックアウトマウスに由来するCD4陽性T細胞はT細胞受容体による刺激をくわえることで,転写活性をもつEタンパク質2量体がインターロイキン4遺伝子のプロモーターに優位に結合し過度にインターロイキン4を産生することが推察された(図3).
Th17細胞は多発性硬化症などの疾病の増悪に関与することが知られている.また,体内ではとくに腸管リンパ節において認められ,細菌感染に対する腸管の免疫制御などに重要な役割を担う.Id3ノックアウトマウスの腸管リンパ節を調べたところ,野生型マウスに比べ非常に多くのTh17細胞が認められた.また,Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞は,TGF-βによる刺激のみでインターロイキン17を産生するTh17細胞に分化することが認められた.Eタンパク質をノックダウンしたナイーブCD4陽性T細胞では,TGF-βおよびインターロイキン6により刺激した際のインターロイキン17,および,Th17細胞に特異的に発現する転写因子RORγtの発現が顕著に減少した.Eタンパク質はRORγt遺伝子のプロモーターに凝集し発現を正に制御することも報告されている8).Id3ノックアウトマウスにおいて,なぜTh17細胞の分化誘導が優位に進むのか,Eタンパク質がその制御の一端を担っていることを明らかにしたものの,詳細はいまだ明らかになっていない(図3).
この研究では,TGF-βによるId3の発現制御を介した制御性T細胞およびTh17細胞の分化のバランスを明らかにするともに,複数の転写因子のクロストークおよびプロモーターのかかわる新しい概念を提唱するものである.Th17細胞の分化誘導におけるTGF-βの役割および分子機構については,TGF-βのシグナルタンパク質であるSmad2およびSmad3がTh17細胞の分化誘導に影響をあたえるものの,Th17細胞の誘導に必須の転写因子RORγtの発現制御には関与しないことが報告されている9).また近年,TGF-βに非依存的に誘導されるTh17細胞の存在も報告されている10).今後,さらなるTh17細胞および制御性T細胞の分化機構を明らかにし,TGF-βによる免疫制御機構の全容を解明する必要がある.
略歴:2007年 静岡県立大学薬学研究科博士課程 修了,同年 米国Pennsylvania大学 ポスドクを経て,2008年より米国NIH National Institute of Dental and Craniofacial Researchポスドク.
研究テーマ:TGF-βにより誘導される制御性T細胞およびTh17細胞の分化制御機構の解明.
抱負:若い研究員や学生の目標になれるようがんばります.
Chen WanJun
米国NIH National Institute of Dental and Craniofacial ResearchにてUnit Chief.
© 2011 丸山貴司・Chen WanJun Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Dental and Craniofacial Research, Oral Infection and Immunity Branch,Mucosal Immunology Unit)
email:丸山貴司
DOI: 10.7875/first.author.2011.005
Control of the differentiation of regulatory T cells and TH17 cells by the DNA-binding inhibitor Id3.
Takashi Maruyama, Jun Li, Jose P. Vaque, Joanne E. Konkel, Weifeng Wang, Baojun Zhang, Pin Zhang, Brian F. Zamarron, Dongyang Yu, Yuntao Wu, Yuan Zhuang, J. Silvio Gutkind, WanJun Chen
Nature Immunology, 12, 86-95 (2011)
要 約
免疫制御をつかさどる制御性T細胞はTGF-βによって分化誘導されることが知られているものの,その分子機構にはいまだ明らかでない部分が多い.この研究では,TGF-βによる刺激によりEタンパク質がFoxp3遺伝子のプロモーターに結合すること,さらに,Gata3の発現およびFoxp3遺伝子のプロモーターへの結合を抑制することで制御性T細胞の分化誘導の進むことが明らかになった.また,Id3とよばれるタンパク質を欠損したT細胞ではTGF-βによる刺激をくわえても制御性T細胞の分化誘導が認められず,むしろ,Th17細胞への分化誘導が認められた.
はじめに
制御性T細胞(regulatory T cell:Treg)は免疫制御をつかさどる重要なT細胞のひとつで,転写因子Foxp3(Forkhead box p3)を特異的に発現している1).また,制御性T細胞はTGF-β(transforming growth factor-β)とよばれるサイトカインによってナイーブCD4陽性T細胞から分化誘導される2).T細胞特異的にTGF-β受容体を欠損したマウスは末梢リンパ節において制御性T細胞がほとんど認められず,生まれてまもなく全身に強い炎症が認められ死にいたることからも,TGF-βは制御性T細胞の分化誘導をつうじた生体の免疫制御に重要であることが明らかになっている.近年,TGF-βによる制御性T細胞の分化誘導はインターロイキン6など炎症性サイトカインにより抑制されるとともに,インターロイキン17とよばれる炎症促進性サイトカインを産生するTh17細胞へと分化誘導されることが報告されている3)(図1).このTh17細胞は多発性硬化症や慢性関節リウマチなどの自己免疫疾患の増悪にも寄与していることが明らかになってきた.そこで,この研究では,TGF-βがどのように制御性T細胞およびTh17細胞の分化誘導を制御しているのか,Id(inhibitor DNA binding protein)とよばれるタンパク質に着目しその分子機構の解析を行った.
Idタンパク質ファミリー(Id1,Id2,Id3,Id4)はDNA結合領域をもたず転写活性能もないが,E2A,HEB,E2-2などのEタンパク質(E-protein)とよばれる転写因子と2量体を形成してその転写活性を阻害する(図2a).Idタンパク質ファミリーおよびEタンパク質はともにヘリックス-ループ-ヘリックス構造をもつ.Eタンパク質はIdタンパク質ファミリーとの2量体の形成をのがれて新たにEタンパク質どうしで2量体(ヘテロ2量体およびホモ2量体)を形成することで転写活性をもち,CANNTG配列に結合することで遺伝子の発現制御を行う4)(図2b).この研究にて使用したId3ノックアウトマウスは自己免疫疾患のひとつであるSjogren症候群のモデルマウスとしても知られているものの,そのくわしい分子機構は明らかになっていない5).さらに,Id3ノックアウトマウスでは末梢リンパ節においてγδT細胞が多く認められること,また,およそ24週齢以上のマウスではγδT細胞のがん化が認められるとの報告もされている6).
1.Id3ノックアウトマウスにおける制御性T細胞の動態
Id3ノックアウトマウスの末梢リンパ節における制御性T細胞の割合および絶対数を調べたところ,野生型マウスに比べて有意に減少していることが明らかになった.さらに,Id3ノックアウトマウスに由来する制御性T細胞の増殖抑制能は野生型マウスに由来する制御性T細胞に比べて有意に減少していることも明らかになった.Id3ノックアウトマウスの脾臓より精製したナイーブCD4陽性T細胞に対しTGF-βによる刺激をくわえたところ制御性T細胞の分化誘導は認められなかった.また,野生型マウスに由来するナイーブCD4陽性T細胞では,TGF-βによる刺激によりId3の発現上昇が一過的に認められるものの(数時間),24時間後には発現の顕著な減少が認められた.以上より,Id3は制御性T細胞の分化誘導および制御能に必須のタンパク質であり,TGF-βによる刺激によりその発現が制御されていることが明らかになった.
2.Eタンパク質の制御性T細胞の分化誘導に対する役割
Id3ノックアウトマウスに由来するT細胞では細胞質および核において転写活性をもつEタンパク質2量体が過剰に存在することが考えられる.また,Foxp3遺伝子の転写開始点から1 kb上流までの領域(Foxp3プロモーター)にはEタンパク質の結合部位であるCANNTG配列が多く存在することが認められた.以上より,とくにId3ノックアウトマウスにおいてEタンパク質がFoxp3の発現制御になんらかの影響をあたえていることが推測された.野生型マウスの脾臓より精製したナイーブCD4陽性T細胞をTGF-βにより刺激しクロマチン免疫沈降法により解析したところ,Eタンパク質のFoxp3プロモーターへの結合(または,凝集)が認められた.また,ナイーブCD4陽性T細胞のEタンパク質をsiRNAによりノックダウンすると,TGF-βによる刺激によりひき起こされる制御性T細胞への分化誘導が阻害された.さらに,Foxp3プロモーターのCANNTG配列に変異を導入したところプロモーター活性は顕著に減少した.以上より,TGF-βにより誘導されるFoxp3プロモーターへのEタンパク質の凝集はFoxp3の発現を正に制御することが明らかになった.しかし,Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞ではTGF-β刺激によるEタンパク質のFoxp3プロモーターへの凝集は認められなかった.
3.Id3ノックアウトマウスに由来するT細胞のからのサイトカインの産生およびFoxp3遺伝子の転写制御
TGF-βにより誘導される制御性T細胞は非常に不安定なポピュレーションであり,さまざまな炎症性サイトカインによって制御性T細胞への分化誘導の阻害されることが知られている.Id3ノックアウトマウスに由来するCD4陽性T細胞からは,T細胞受容体からの刺激後24時間でインターロイキン4の過剰な産生が認められた.このインターロイキン4は自らのインターロイキン4受容体で受け取られ,Gata3とよばれる転写因子の発現を誘導する.Id3ノックアウトマウスに由来するCD4陽性T細胞においては,Gata3の発現が強く誘導され,また,Gata3がFoxp3プロモーターに過剰に凝集することが明らかになった.このFoxp3プロモーターに凝集したGata3はFoxp3の発現を負に制御することが知られている7).Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞をTGF-βにより刺激するとインターロイキン4の産生およびGata3の発現の一部は抑えられたものの依然として高いレベルにあり,また,Foxp3の発現の上昇は認められなかった.
インターロイキン4中和抗体とTGF-βを用いてId3ノックアウトマウスに由来するナイーブCD4陽性T細胞を刺激したところ,Gata3の発現が完全に抑えられFoxp3の強い発現上昇が認められた.以上より,Id3ノックアウトマウスに由来するCD4陽性T細胞からの過剰なインターロイキン4の産生が転写因子Gata3の過剰な発現およびプロモーターへの過剰な凝集を誘導することで,TGF-βによる制御性T細胞の分化誘導(Foxp3の発現)を阻害していることが明らかになった.また,インターロイキン4中和抗体とTGF-βを用いて野生型マウスおよびId3ノックアウトマウスに由来するCD4陽性T細胞を刺激したところ,その両方でEタンパク質のFoxp3プロモーターにおける凝集が認められた.
インターロイキン4の転写開始点より0.4 kb上流まで(種間高保存領域)には少なくとも4つのEタンパク質結合部位が認められた.ナイーブCD4陽性T細胞においてEタンパク質をノックダウンするとT細胞受容体による刺激によるインターロイキン4の産生は有意に減少した.以上より,Id3ノックアウトマウスに由来するCD4陽性T細胞はT細胞受容体による刺激をくわえることで,転写活性をもつEタンパク質2量体がインターロイキン4遺伝子のプロモーターに優位に結合し過度にインターロイキン4を産生することが推察された(図3).
4.Th17細胞の分化誘導にともなうId3の役割
Th17細胞は多発性硬化症などの疾病の増悪に関与することが知られている.また,体内ではとくに腸管リンパ節において認められ,細菌感染に対する腸管の免疫制御などに重要な役割を担う.Id3ノックアウトマウスの腸管リンパ節を調べたところ,野生型マウスに比べ非常に多くのTh17細胞が認められた.また,Id3ノックアウトマウスに由来するナイーブCD4陽性T細胞は,TGF-βによる刺激のみでインターロイキン17を産生するTh17細胞に分化することが認められた.Eタンパク質をノックダウンしたナイーブCD4陽性T細胞では,TGF-βおよびインターロイキン6により刺激した際のインターロイキン17,および,Th17細胞に特異的に発現する転写因子RORγtの発現が顕著に減少した.Eタンパク質はRORγt遺伝子のプロモーターに凝集し発現を正に制御することも報告されている8).Id3ノックアウトマウスにおいて,なぜTh17細胞の分化誘導が優位に進むのか,Eタンパク質がその制御の一端を担っていることを明らかにしたものの,詳細はいまだ明らかになっていない(図3).
おわりに
この研究では,TGF-βによるId3の発現制御を介した制御性T細胞およびTh17細胞の分化のバランスを明らかにするともに,複数の転写因子のクロストークおよびプロモーターのかかわる新しい概念を提唱するものである.Th17細胞の分化誘導におけるTGF-βの役割および分子機構については,TGF-βのシグナルタンパク質であるSmad2およびSmad3がTh17細胞の分化誘導に影響をあたえるものの,Th17細胞の誘導に必須の転写因子RORγtの発現制御には関与しないことが報告されている9).また近年,TGF-βに非依存的に誘導されるTh17細胞の存在も報告されている10).今後,さらなるTh17細胞および制御性T細胞の分化機構を明らかにし,TGF-βによる免疫制御機構の全容を解明する必要がある.
文 献
- Hori, S., Nomura, S. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Chen, W., Jin, W., Hardegen, N. et al.: Conversion of peripheral CD4+ CD25- naive T cells to CD4+ CD25+ regulatory T cells by TGF-β induction of transcription factor Foxp3. J. Exp. Med., 198, 1875-1886 (2003)[PubMed]
- Bettelli, E., Carrier, Y., Gao, W. et al.: Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature, 441, 235-238 (2006)[PubMed]
- Kee, B. L.: E and ID proteins branch out. Nat. Rev. Immunol., 9, 175-184 (2009)[PubMed]
- Li, H., Dai, M. & Zhuang, Y.: A T cell intrinsic role of Id3 in a mouse model for primary Sjogren's syndrome. Immunity, 21, 551-560 (2004)[PubMed]
- Li, J., Maruyama, T., Zhang, P. et al.: Mutation of inhibitory helix-loop-helix protein Id3 causes γδ T-cell lymphoma in mice. Blood, 116, 5615-5621 (2010)[PubMed]
- Mantel, P. Y., Kuipers, H., Boyman, O. et al.: GATA3-driven Th2 responses inhibit TGF-β1-induced FOXP3 expression and the formation of regulatory T cells. PLoS Biol., 5, e329 (2007)[PubMed]
- Xi, H., Schwartz, R., Engel, I. et al.: Interplay between RORγt, Egr3, and E proteins controls proliferation in response to pre-TCR signals. Immunity, 24, 813-826 (2006)[PubMed]
- Takimoto, T., Wakabayashi, Y., Sekiya, T. et al.: Smad2 and Smad3 are redundantly essential for the TGF-β-mediated regulation of regulatory T plasticity and Th1 development. J. Immunol., 185, 842-855 (2010)[PubMed]
- Ghoreschi, K., Laurence, A., Yang, X. P. et al.: Generation of pathogenic TH17 cells in the absence of TGF-βsignalling. Nature, 467, 961-971 (2010)[PubMed]
著者プロフィール
略歴:2007年 静岡県立大学薬学研究科博士課程 修了,同年 米国Pennsylvania大学 ポスドクを経て,2008年より米国NIH National Institute of Dental and Craniofacial Researchポスドク.
研究テーマ:TGF-βにより誘導される制御性T細胞およびTh17細胞の分化制御機構の解明.
抱負:若い研究員や学生の目標になれるようがんばります.
Chen WanJun
米国NIH National Institute of Dental and Craniofacial ResearchにてUnit Chief.
© 2011 丸山貴司・Chen WanJun Licensed under CC 表示 2.1 日本