血管の恒常性の維持および再生に貢献する血管内皮幹細胞の同定
若林 卓・内藤尚道・高倉伸幸
(大阪大学微生物病研究所 情報伝達分野)
email:若林 卓,内藤尚道,高倉伸幸
DOI: 10.7875/first.author.2018.031
CD157 marks tissue-resident endothelial stem cells with homeostatic and regenerative properties.
Taku Wakabayashi, Hisamichi Naito, Jun-ichi Suehiro, Yang Lin, Hideya Kawaji, Tomohiro Iba, Tsukasa Kouno, Sachi Ishikawa-Kato, Masaaki Furuno, Kazuhiro Takara, Fumitaka Muramatsu, Jia Weizhen, Hiroyasu Kidoya, Katsuhiko Ishihara, Yoshihide Hayashizaki, Kohji Nishida, Mervin C. Yoder, Nobuyuki Takakura
Cell Stem Cell, 22, 384-397.e6 (2018)
全身にはりめぐらされている血管は,血液を輸送するだけでなくさまざまな生理活性物質を分泌して組織や臓器の恒常性を維持する.多くの組織には幹細胞が存在し組織が障害されたときその修復に機能することが知られているが,血管には幹細胞が存在するかどうか不明であった.この研究において,筆者らは,血管内皮細胞に対する網羅的な遺伝子発現の解析により,マウスにおいてCD157を発現する血管内皮細胞が全身の太い血管の血管内皮細胞のなかに存在し,血管内皮幹細胞として血管の再生および恒常性の維持に貢献することを明らかにした.肝臓において,CD157陽性細胞はおもに門脈とその太い分枝の血管内皮細胞のなかに存在した.肝臓の血管障害モデルに対し血管内皮細胞を移植すると,たった1個のCD157陽性の血管内皮細胞から門脈,類洞血管,中心静脈からなる3次元的な血管が再生された.肝臓にてCD157陽性の血管内皮細胞の細胞系譜を追跡したところ,血管障害モデルにおいてはCD157陽性の血管内皮細胞から血管が新生され,障害された血管は約3週間で再生された.また,生理的な条件においてはCD157陽性の血管内皮細胞から新たな血管内皮細胞が供給され,1年以上の長期にわたり類洞血管内皮細胞の恒常性の維持に貢献した.以上の結果から,CD157陽性の血管内皮細胞は,多数の血管を産生し血管の再生において中心的な役割をはたす血管内皮幹細胞の特徴をもつことが判明した.血管内皮幹細胞の同定により,虚血性疾患や血友病など病態に血管内皮細胞が関与する多くの疾患に対する新たな治療法の開発につながる可能性が期待される.
血管は臓器の恒常性の維持や組織の再生に不可欠である.血管は内腔をおおう血管内皮細胞と,その周囲をとりかこむ壁細胞から構成される.血管内皮細胞は,成体においては多くが休止期にありまれにしか分裂しないものの,虚血におちいり低酸素状態となった組織においては血管内皮細胞の増殖を刺激する血管新生促進因子が産生され,血管の修復および再生が起こるとされてきた.多くの組織には幹細胞が存在し組織が障害されたときその修復を担うことが知られている.従来,骨髄には血管内皮前駆細胞とよばれる細胞が存在し,血管の再生が必要な領域において血管内皮細胞に分化し血管の再構築に貢献するといわれてきた1).しかし近年,血管内皮前駆細胞の血管への貢献は一過性であることが示唆され,長期にわたり血管を構築しうる血管の幹細胞は発見されていない.血管の再生の過程においては,発芽した血管の先頭を移動してガイダンスとして機能するtip細胞,その背後から増殖して血管の伸長にかかわるstalk細胞,最後に壁細胞をともなう成熟した血管に分化させるphalanx細胞,という少なくとも3種類の血管内皮細胞が存在し,血管内皮細胞には一過性の多様性および不均一性の存在することが明らかにされている2).このような種々の血管内皮細胞からなる血管の再生が,成熟した血管内皮細胞の単純な分裂により担われるのか,あるいは,幹細胞により担われるのかについては不明であった.この研究において,筆者らは,血管の再生および維持において中心的な役割をはたす幹細胞が血管内皮細胞のなかに存在するという仮説をたて,血管内皮幹細胞を探索した.
これまで筆者らは,幹細胞の同定法として知られているSP法を用いて,既存の血管のなかにわずかに存在するHoechst33342染色に陰性の特殊な血管内皮細胞の集団(血管内皮SP細胞)が,多数の血管内皮細胞を産生する能力をもつことを報告してきた3).血管内皮SP細胞は,血管内皮前駆細胞とは異なり骨髄に由来するのではなく,マウスのおのおのの臓器において既存の血管の血管内皮細胞に数%の割合で存在し,低酸素の刺激によりその割合および増殖活性が上昇し機能的な血管を構築することから,血管の再生に中心的な役割をはたす幹細胞としての特徴をもつ可能性があった.
そこで,肝臓の血管から血管内皮SP細胞を分離し,マイクロアレイ法により遺伝子発現を解析した.具体的には,血管内皮細胞に特異的にEGFPを発現するマウス4) の肝臓から,フローサイトメトリーを用いて血管内皮SP細胞およびそれ以外の細胞の大部分をしめHoechst33342染色に陽性を示す血管内皮MP細胞を分取し,遺伝子発現のプロファイルを網羅的に解析した.その結果,血管内皮SP細胞に特異的に発現する遺伝子の産物としてCD157およびCD200が同定された.肝臓の血管内皮細胞の画分をフローサイトメトリーによりCD157およびCD200で展開すると,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の3つの画分に分かれた.CD157陽性CD200陽性の血管内皮細胞は血管内皮細胞の全体の約4%,CD157陰性CD200陽性の血管内皮細胞は約14%,CD157陰性CD200陰性の血管内皮細胞は約79%をしめた.なお,CD157陽性の血管内皮細胞はすべてCD200陽性であり,CD157陽性CD200陰性の画分は存在しなかった.血管内皮SP細胞はCD157陽性CD200陽性の画分に濃縮して存在したが,CD157陰性CD200陰性の画分にはほとんど存在しなかった.また,70%以上の血管内皮SP細胞はCD157陽性CD200陽性であった.CD157陽性CD200陽性の血管内皮細胞が実際に血管内皮細胞であり,ほかの細胞の画分の混入のないことを確認するため,1細胞解析を実施したところ,それぞれのCD157陽性CD200陽性の血管内皮細胞は血管内皮細胞のマーカーを発現し,血球のマーカーや間葉系細胞のマーカーは発現しなかった.以上より,CD157およびCD200を特異的に発現する血管内皮細胞が存在すること,この血管内皮細胞は血管内皮SP細胞の特徴をもつことから血管内皮幹細胞の候補となることが明らかにされた.
肝臓には門脈および肝動脈が流入し,毛細血管として類洞をとおったのち中心静脈をへて肝静脈となり下大静脈に流出する.マウスの肝臓の切片をCD157により免疫染色したところ,CD157はおもに門脈の一部に強く発現し,また,肝動脈や肝静脈の一部にもわずかに発現していた.マウスの肝臓の切片をCD200により免疫染色したところ,CD157陽性の血管はすべてCD200陽性であり,CD200は門脈および中心静脈の多くの血管内皮細胞に発現していた.類洞血管はCD157あるいはCD200のいずれも発現していなかった.血球に特異的にEGFPを発現するマウス,あるいは,間葉系細胞に特異的にEGFPを発現するマウス5) において,CD157陽性CD200陽性の血管内皮細胞の局在はEGFPの発現とは一致しなかったことから,CD157陽性CD200陽性の血管内皮細胞は血球あるいは間葉系細胞には由来しないことが明らかにされた.
CD157陽性の血管内皮細胞の潜在的な増殖活性について検討するため,肝臓からフローサイトメトリーによりCD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の血管内皮細胞をそれぞれ分取し,フィーダー細胞のうえで培養した.その結果,CD157陽性CD200陽性の血管内皮細胞は多数の血管内皮細胞のコロニーを形成し,1個のCD157陽性CD200陽性の血管内皮細胞から2000個以上の血管内皮細胞が形成される場合もあった.コロニー形成能は,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性,の順に高く,CD157陰性CD200陰性の血管内皮細胞からはコロニーはほとんど形成されなかった.種々の転写因子の発現についてマイクロアレイ法により解析したところ,CD157陽性CD200陽性の血管内皮細胞においては細胞の増殖に関連する転写因子が有意に高く発現していた.以上の結果から,CD157陽性CD200陽性の血管内皮細胞は種々の転写因子の発現の増強を介し血管内皮細胞の高い産生能をもつことが明らかにされた.
CD157陽性CD200陽性の血管内皮細胞のin vivoにおける血管の構築能について検討するため,モノクロタリンを用いて薬剤により血管の障害を起こしたマウスの肝臓に対し,全身でEGFPを発現するマウスから採取した1個のCD157陽性CD200陽性の血管内皮細胞を移植した.その結果,約1カ月後には1個の血管内皮細胞から門脈,類洞,中心静脈からなる3次元的な血管が構築された.フローサイトメトリーによりEGFP陽性の血管を再解析したところ,CD157陽性CD200陽性の血管内皮細胞から500個以上の血管内皮細胞が産生されていることがわかり,これらの血管内皮細胞はCD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の3つの画分を含んでいた.一方,CD157陰性CD200陽性の血管内皮細胞を移植するとCD157陰性CD200陽性およびCD157陰性CD200陰性の2つの画分の血管内皮細胞に分化し,CD157陰性CD200陰性の血管内皮細胞を移植するとCD157陰性CD200陰性の血管内皮細胞のみがわずかに認められた.以上の結果から,血管内皮細胞にはヒエラルキーの存在することが示唆され,このヒエラルキーの最上位にCD157陽性CD200陽性の血管内皮細胞が位置すると考えられた.
マウスの肝臓においてCD157陽性CD200陽性の血管内皮細胞を標識しその細胞系譜を追跡するため,タモキシフェンの投与によりBmx遺伝子のプロモーターに依存してEGFPを発現するマウスを作製し解析した6).Bmx遺伝子は通常は動脈のマーカーとして知られているが,肝臓においてはCD157陽性CD200陽性の血管内皮細胞において高く発現することがリアルタイムPCR法により確認された.2週齢のこのトランスジェニックマウスにタモキシフェンを投与すると,門脈においてCD157陽性CD200陽性の血管内皮細胞が選択的に標識された.そのうえで,モノクロタリンを用いて肝臓において血管の障害を起こすと,1週間後には標識されたCD157陽性CD200陽性の血管内皮細胞から血管の新生が開始され,3週間後には大部分の門脈,類洞血管,中心静脈がCD157陽性CD200陽性の血管内皮細胞に由来する血管により再生された.また,CD157陽性CD200陽性の血管内皮細胞に由来する血管は,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の血管内皮細胞を含んでいた.
定常の状態においてCD157陽性CD200陽性の血管内皮細胞の運命を解析するため,8週齢のこのトランスジェニックマウスにタモキシフェンを投与してCD157陽性CD200陽性の血管内皮細胞を標識し,血管の障害を起こすことなく経過を観察した.その結果,1年間を経過すると標識されたCD157陽性CD200陽性の血管内皮細胞が類洞血管や中心静脈を再構築することがわかった.以上の結果から,CD157陽性CD200陽性の血管内皮細胞は,血管が障害されたときにその再生に貢献するとともに,定常の状態においても血管の恒常性の維持に関与することが明らかにされた.
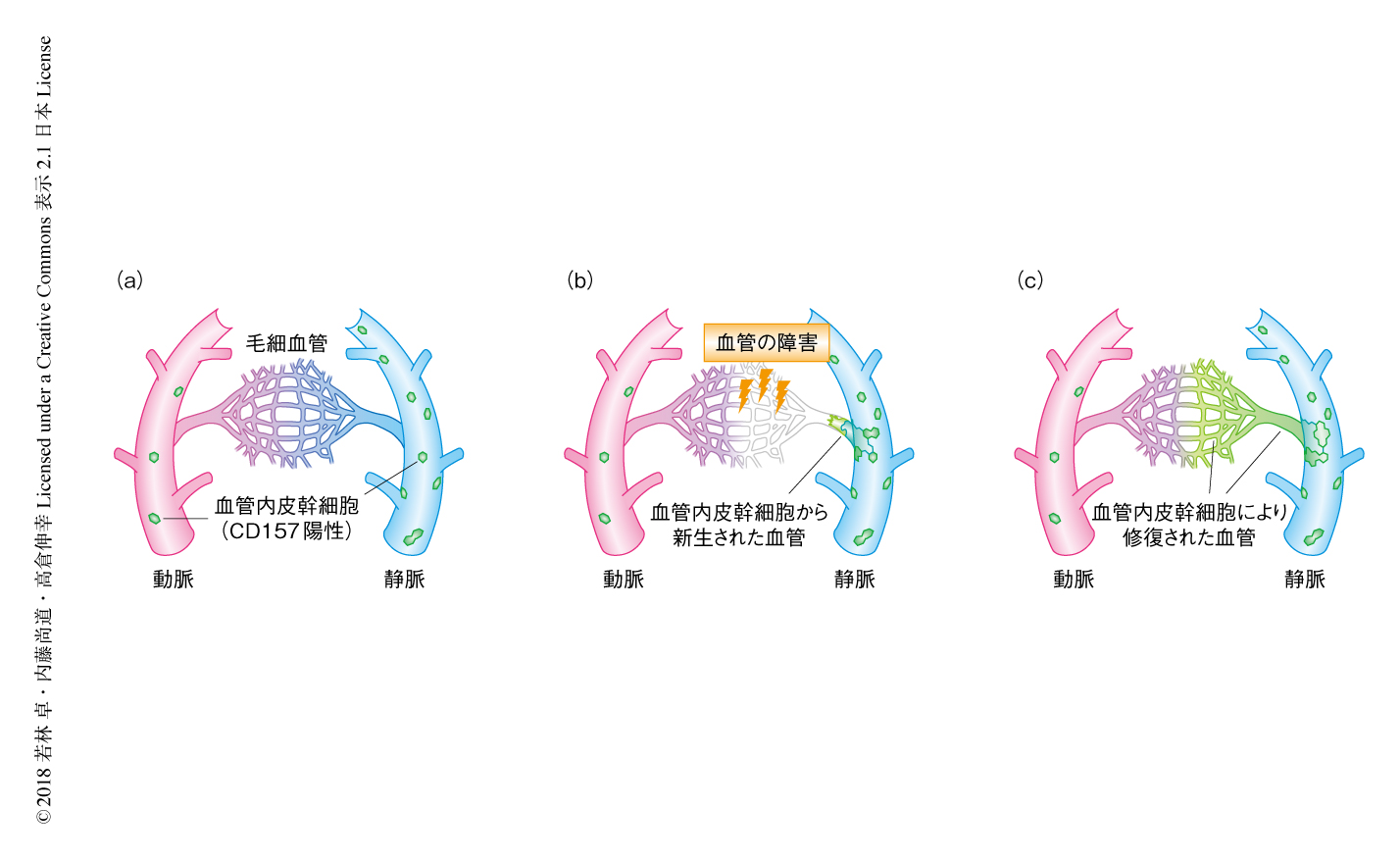
幹細胞は,分裂して自己と同じ幹細胞をつくりだす自己複製能と,さまざまな細胞に分化する多分化能という2つの性質により,組織を再生することのできる細胞と定義される7).1個のCD157陽性の血管内皮細胞の移植により複数のCD157陽性の血管内皮細胞が産生されたことから,CD157陽性細胞は自己複製能をもつと考えられた.門脈に存在するCD157陽性の血管内皮細胞は間葉系細胞や血球には分化しなかったが,構造的および機能的に異なり遺伝子の発現パターンも異なる類洞血管や中心静脈の血管内皮細胞には分化した.つまり,CD157陽性の血管内皮細胞は,血管内皮細胞にしか分化しないという点からは単能性ではあるものの,多様な血管内皮細胞に分化するという意味では多分化能をもつ幹細胞であると考えられた(図1).
CD157陽性の血管内皮細胞は,肝臓のほかにも肺,心臓,下肢筋肉,皮膚,網膜,脳などマウスの全身の臓器の一部の血管内皮に発現していた.肺および心臓の免疫染色において,CD157は太い血管の一部に局在しており,毛細血管には発現していなかった.また,大動脈および大静脈の血管壁の内層のフラットマウント標本を作製して観察すると,CD157陽性の血管内皮細胞が明瞭に確認された.肝臓以外の臓器においては,CD200はほぼすべての血管内皮細胞に発現していた.
CD157陽性の血管内皮細胞が幹細胞の特徴をもつことがわかったことから,今後は,血友病や虚血性疾患など血管内皮細胞の機能の障害を原因として生じるさまざまな疾患に対する新たな治療法の開発が期待される.血友病Aにおいては,血液凝固第VIII因子が低下または欠乏している.血液凝固第VIII因子は肝臓の血管内皮細胞において産生され,クッパー細胞,肝細胞,肝星細胞からは産生されないことを確認したうえで,2万個のCD157陽性の血管内皮細胞を血友病Aモデルマウスに移植した.その結果,血友病Aモデルマウスの尻尾を切開すると自然には止血せずに60分以上も出血がつづくが,CD157陽性の血管内皮細胞を移植した血友病Aモデルマウスは約5分間で出血が停止した.さらに,CD157陽性の血管内皮細胞を移植した血友病Aモデルマウスにおいては,血清中の血液凝固第VIII因子の活性が正常な血清の約60%にまで回復していた.つまり,血友病AモデルマウスにおいてCD157陽性の血管内皮細胞から構築された血管内皮は長期間にわたり血液凝固第VIII因子を産生し,止血の異常が改善された.また,下肢虚血モデルマウスに対し下肢筋肉に由来するCD157陽性の血管内皮細胞を移植したところ,太い血管および毛細血管に分化し血流の回復に貢献した.
血管生物学の分野においては,血管内皮幹細胞が存在するか否かについて長いあいだ議論がなされてきたが,解明にはいたっていなかった.この研究におけるCD157血管内皮幹細胞の同定は,血管の形成や臓器の恒常性の維持を理解するうえで新たな概念を提示し,血管生物学にパラダイムシフトをもたらす契機になることが期待される.今後の課題として,たとえば,肝臓における類洞構造や酸素と二酸化炭素のガス交換をする肺の毛細血管など,臓器に特異的な血管網の維持において臓器に特異的な血管内皮幹細胞がどのような役割をはたすかを解明することが重要であると考えている.ある臓器における血管内皮幹細胞が,ほかの臓器の血管網の構築にも貢献するか,なども興味深い.腫瘍における血管の新生の際の血管内皮幹細胞の役割に関しても解明が必要である.また,CD157がなぜわずかに存在する血管内皮幹細胞に強く発現するかについても明らかにする必要がある.CD157ノックアウトマウスは血管の異常をきたさないことから8),血管内皮幹細胞による血管の再生能はCD157以外の分子に依存すると推測される.これらの分子機序を探求することにより,血管内皮幹細胞の全容を解明し,虚血性疾患に対する新たな治療法の開発をめざしたい.
略歴:2014年 大阪大学大学院医学系研究科博士課程 修了,2017年より同 助教.
研究テーマ:血管の形成の機構.
抱負:虚血性疾患に対する新たな治療法の開発をめざして研究を進めたい.
内藤 尚道(Hisamichi Naito)
大阪大学微生物病研究所 助教.
高倉 伸幸(Nobuyuki Takakura)
大阪大学微生物病研究所 教授.
研究室URL:http://st.biken.osaka-u.ac.jp/
© 2018 若林 卓・内藤尚道・高倉伸幸 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 情報伝達分野)
email:若林 卓,内藤尚道,高倉伸幸
DOI: 10.7875/first.author.2018.031
CD157 marks tissue-resident endothelial stem cells with homeostatic and regenerative properties.
Taku Wakabayashi, Hisamichi Naito, Jun-ichi Suehiro, Yang Lin, Hideya Kawaji, Tomohiro Iba, Tsukasa Kouno, Sachi Ishikawa-Kato, Masaaki Furuno, Kazuhiro Takara, Fumitaka Muramatsu, Jia Weizhen, Hiroyasu Kidoya, Katsuhiko Ishihara, Yoshihide Hayashizaki, Kohji Nishida, Mervin C. Yoder, Nobuyuki Takakura
Cell Stem Cell, 22, 384-397.e6 (2018)
要 約
全身にはりめぐらされている血管は,血液を輸送するだけでなくさまざまな生理活性物質を分泌して組織や臓器の恒常性を維持する.多くの組織には幹細胞が存在し組織が障害されたときその修復に機能することが知られているが,血管には幹細胞が存在するかどうか不明であった.この研究において,筆者らは,血管内皮細胞に対する網羅的な遺伝子発現の解析により,マウスにおいてCD157を発現する血管内皮細胞が全身の太い血管の血管内皮細胞のなかに存在し,血管内皮幹細胞として血管の再生および恒常性の維持に貢献することを明らかにした.肝臓において,CD157陽性細胞はおもに門脈とその太い分枝の血管内皮細胞のなかに存在した.肝臓の血管障害モデルに対し血管内皮細胞を移植すると,たった1個のCD157陽性の血管内皮細胞から門脈,類洞血管,中心静脈からなる3次元的な血管が再生された.肝臓にてCD157陽性の血管内皮細胞の細胞系譜を追跡したところ,血管障害モデルにおいてはCD157陽性の血管内皮細胞から血管が新生され,障害された血管は約3週間で再生された.また,生理的な条件においてはCD157陽性の血管内皮細胞から新たな血管内皮細胞が供給され,1年以上の長期にわたり類洞血管内皮細胞の恒常性の維持に貢献した.以上の結果から,CD157陽性の血管内皮細胞は,多数の血管を産生し血管の再生において中心的な役割をはたす血管内皮幹細胞の特徴をもつことが判明した.血管内皮幹細胞の同定により,虚血性疾患や血友病など病態に血管内皮細胞が関与する多くの疾患に対する新たな治療法の開発につながる可能性が期待される.
はじめに
血管は臓器の恒常性の維持や組織の再生に不可欠である.血管は内腔をおおう血管内皮細胞と,その周囲をとりかこむ壁細胞から構成される.血管内皮細胞は,成体においては多くが休止期にありまれにしか分裂しないものの,虚血におちいり低酸素状態となった組織においては血管内皮細胞の増殖を刺激する血管新生促進因子が産生され,血管の修復および再生が起こるとされてきた.多くの組織には幹細胞が存在し組織が障害されたときその修復を担うことが知られている.従来,骨髄には血管内皮前駆細胞とよばれる細胞が存在し,血管の再生が必要な領域において血管内皮細胞に分化し血管の再構築に貢献するといわれてきた1).しかし近年,血管内皮前駆細胞の血管への貢献は一過性であることが示唆され,長期にわたり血管を構築しうる血管の幹細胞は発見されていない.血管の再生の過程においては,発芽した血管の先頭を移動してガイダンスとして機能するtip細胞,その背後から増殖して血管の伸長にかかわるstalk細胞,最後に壁細胞をともなう成熟した血管に分化させるphalanx細胞,という少なくとも3種類の血管内皮細胞が存在し,血管内皮細胞には一過性の多様性および不均一性の存在することが明らかにされている2).このような種々の血管内皮細胞からなる血管の再生が,成熟した血管内皮細胞の単純な分裂により担われるのか,あるいは,幹細胞により担われるのかについては不明であった.この研究において,筆者らは,血管の再生および維持において中心的な役割をはたす幹細胞が血管内皮細胞のなかに存在するという仮説をたて,血管内皮幹細胞を探索した.
1.血管内皮幹細胞に特異的に発現する遺伝子のスクリーニング
これまで筆者らは,幹細胞の同定法として知られているSP法を用いて,既存の血管のなかにわずかに存在するHoechst33342染色に陰性の特殊な血管内皮細胞の集団(血管内皮SP細胞)が,多数の血管内皮細胞を産生する能力をもつことを報告してきた3).血管内皮SP細胞は,血管内皮前駆細胞とは異なり骨髄に由来するのではなく,マウスのおのおのの臓器において既存の血管の血管内皮細胞に数%の割合で存在し,低酸素の刺激によりその割合および増殖活性が上昇し機能的な血管を構築することから,血管の再生に中心的な役割をはたす幹細胞としての特徴をもつ可能性があった.
そこで,肝臓の血管から血管内皮SP細胞を分離し,マイクロアレイ法により遺伝子発現を解析した.具体的には,血管内皮細胞に特異的にEGFPを発現するマウス4) の肝臓から,フローサイトメトリーを用いて血管内皮SP細胞およびそれ以外の細胞の大部分をしめHoechst33342染色に陽性を示す血管内皮MP細胞を分取し,遺伝子発現のプロファイルを網羅的に解析した.その結果,血管内皮SP細胞に特異的に発現する遺伝子の産物としてCD157およびCD200が同定された.肝臓の血管内皮細胞の画分をフローサイトメトリーによりCD157およびCD200で展開すると,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の3つの画分に分かれた.CD157陽性CD200陽性の血管内皮細胞は血管内皮細胞の全体の約4%,CD157陰性CD200陽性の血管内皮細胞は約14%,CD157陰性CD200陰性の血管内皮細胞は約79%をしめた.なお,CD157陽性の血管内皮細胞はすべてCD200陽性であり,CD157陽性CD200陰性の画分は存在しなかった.血管内皮SP細胞はCD157陽性CD200陽性の画分に濃縮して存在したが,CD157陰性CD200陰性の画分にはほとんど存在しなかった.また,70%以上の血管内皮SP細胞はCD157陽性CD200陽性であった.CD157陽性CD200陽性の血管内皮細胞が実際に血管内皮細胞であり,ほかの細胞の画分の混入のないことを確認するため,1細胞解析を実施したところ,それぞれのCD157陽性CD200陽性の血管内皮細胞は血管内皮細胞のマーカーを発現し,血球のマーカーや間葉系細胞のマーカーは発現しなかった.以上より,CD157およびCD200を特異的に発現する血管内皮細胞が存在すること,この血管内皮細胞は血管内皮SP細胞の特徴をもつことから血管内皮幹細胞の候補となることが明らかにされた.
2.CD157陽性の血管内皮細胞の局在
肝臓には門脈および肝動脈が流入し,毛細血管として類洞をとおったのち中心静脈をへて肝静脈となり下大静脈に流出する.マウスの肝臓の切片をCD157により免疫染色したところ,CD157はおもに門脈の一部に強く発現し,また,肝動脈や肝静脈の一部にもわずかに発現していた.マウスの肝臓の切片をCD200により免疫染色したところ,CD157陽性の血管はすべてCD200陽性であり,CD200は門脈および中心静脈の多くの血管内皮細胞に発現していた.類洞血管はCD157あるいはCD200のいずれも発現していなかった.血球に特異的にEGFPを発現するマウス,あるいは,間葉系細胞に特異的にEGFPを発現するマウス5) において,CD157陽性CD200陽性の血管内皮細胞の局在はEGFPの発現とは一致しなかったことから,CD157陽性CD200陽性の血管内皮細胞は血球あるいは間葉系細胞には由来しないことが明らかにされた.
3.CD157陽性の血管内皮細胞はin vitroにおいて多数の血管内皮細胞を産生する
CD157陽性の血管内皮細胞の潜在的な増殖活性について検討するため,肝臓からフローサイトメトリーによりCD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の血管内皮細胞をそれぞれ分取し,フィーダー細胞のうえで培養した.その結果,CD157陽性CD200陽性の血管内皮細胞は多数の血管内皮細胞のコロニーを形成し,1個のCD157陽性CD200陽性の血管内皮細胞から2000個以上の血管内皮細胞が形成される場合もあった.コロニー形成能は,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性,の順に高く,CD157陰性CD200陰性の血管内皮細胞からはコロニーはほとんど形成されなかった.種々の転写因子の発現についてマイクロアレイ法により解析したところ,CD157陽性CD200陽性の血管内皮細胞においては細胞の増殖に関連する転写因子が有意に高く発現していた.以上の結果から,CD157陽性CD200陽性の血管内皮細胞は種々の転写因子の発現の増強を介し血管内皮細胞の高い産生能をもつことが明らかにされた.
4.1個のCD157陽性の血管内皮細胞から血管の3次元的な構造が構築される
CD157陽性CD200陽性の血管内皮細胞のin vivoにおける血管の構築能について検討するため,モノクロタリンを用いて薬剤により血管の障害を起こしたマウスの肝臓に対し,全身でEGFPを発現するマウスから採取した1個のCD157陽性CD200陽性の血管内皮細胞を移植した.その結果,約1カ月後には1個の血管内皮細胞から門脈,類洞,中心静脈からなる3次元的な血管が構築された.フローサイトメトリーによりEGFP陽性の血管を再解析したところ,CD157陽性CD200陽性の血管内皮細胞から500個以上の血管内皮細胞が産生されていることがわかり,これらの血管内皮細胞はCD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の3つの画分を含んでいた.一方,CD157陰性CD200陽性の血管内皮細胞を移植するとCD157陰性CD200陽性およびCD157陰性CD200陰性の2つの画分の血管内皮細胞に分化し,CD157陰性CD200陰性の血管内皮細胞を移植するとCD157陰性CD200陰性の血管内皮細胞のみがわずかに認められた.以上の結果から,血管内皮細胞にはヒエラルキーの存在することが示唆され,このヒエラルキーの最上位にCD157陽性CD200陽性の血管内皮細胞が位置すると考えられた.
5.CD157陽性の血管内皮細胞における細胞系譜の追跡
マウスの肝臓においてCD157陽性CD200陽性の血管内皮細胞を標識しその細胞系譜を追跡するため,タモキシフェンの投与によりBmx遺伝子のプロモーターに依存してEGFPを発現するマウスを作製し解析した6).Bmx遺伝子は通常は動脈のマーカーとして知られているが,肝臓においてはCD157陽性CD200陽性の血管内皮細胞において高く発現することがリアルタイムPCR法により確認された.2週齢のこのトランスジェニックマウスにタモキシフェンを投与すると,門脈においてCD157陽性CD200陽性の血管内皮細胞が選択的に標識された.そのうえで,モノクロタリンを用いて肝臓において血管の障害を起こすと,1週間後には標識されたCD157陽性CD200陽性の血管内皮細胞から血管の新生が開始され,3週間後には大部分の門脈,類洞血管,中心静脈がCD157陽性CD200陽性の血管内皮細胞に由来する血管により再生された.また,CD157陽性CD200陽性の血管内皮細胞に由来する血管は,CD157陽性CD200陽性,CD157陰性CD200陽性,CD157陰性CD200陰性の血管内皮細胞を含んでいた.
定常の状態においてCD157陽性CD200陽性の血管内皮細胞の運命を解析するため,8週齢のこのトランスジェニックマウスにタモキシフェンを投与してCD157陽性CD200陽性の血管内皮細胞を標識し,血管の障害を起こすことなく経過を観察した.その結果,1年間を経過すると標識されたCD157陽性CD200陽性の血管内皮細胞が類洞血管や中心静脈を再構築することがわかった.以上の結果から,CD157陽性CD200陽性の血管内皮細胞は,血管が障害されたときにその再生に貢献するとともに,定常の状態においても血管の恒常性の維持に関与することが明らかにされた.
6.CD157陽性の血管内皮細胞は幹細胞である
幹細胞は,分裂して自己と同じ幹細胞をつくりだす自己複製能と,さまざまな細胞に分化する多分化能という2つの性質により,組織を再生することのできる細胞と定義される7).1個のCD157陽性の血管内皮細胞の移植により複数のCD157陽性の血管内皮細胞が産生されたことから,CD157陽性細胞は自己複製能をもつと考えられた.門脈に存在するCD157陽性の血管内皮細胞は間葉系細胞や血球には分化しなかったが,構造的および機能的に異なり遺伝子の発現パターンも異なる類洞血管や中心静脈の血管内皮細胞には分化した.つまり,CD157陽性の血管内皮細胞は,血管内皮細胞にしか分化しないという点からは単能性ではあるものの,多様な血管内皮細胞に分化するという意味では多分化能をもつ幹細胞であると考えられた(図1).
7.マウスのおのおのの臓器におけるCD157陽性の血管内皮細胞
CD157陽性の血管内皮細胞は,肝臓のほかにも肺,心臓,下肢筋肉,皮膚,網膜,脳などマウスの全身の臓器の一部の血管内皮に発現していた.肺および心臓の免疫染色において,CD157は太い血管の一部に局在しており,毛細血管には発現していなかった.また,大動脈および大静脈の血管壁の内層のフラットマウント標本を作製して観察すると,CD157陽性の血管内皮細胞が明瞭に確認された.肝臓以外の臓器においては,CD200はほぼすべての血管内皮細胞に発現していた.
8.CD157陽性の血管内皮細胞を用いた新たな治療法の可能性
CD157陽性の血管内皮細胞が幹細胞の特徴をもつことがわかったことから,今後は,血友病や虚血性疾患など血管内皮細胞の機能の障害を原因として生じるさまざまな疾患に対する新たな治療法の開発が期待される.血友病Aにおいては,血液凝固第VIII因子が低下または欠乏している.血液凝固第VIII因子は肝臓の血管内皮細胞において産生され,クッパー細胞,肝細胞,肝星細胞からは産生されないことを確認したうえで,2万個のCD157陽性の血管内皮細胞を血友病Aモデルマウスに移植した.その結果,血友病Aモデルマウスの尻尾を切開すると自然には止血せずに60分以上も出血がつづくが,CD157陽性の血管内皮細胞を移植した血友病Aモデルマウスは約5分間で出血が停止した.さらに,CD157陽性の血管内皮細胞を移植した血友病Aモデルマウスにおいては,血清中の血液凝固第VIII因子の活性が正常な血清の約60%にまで回復していた.つまり,血友病AモデルマウスにおいてCD157陽性の血管内皮細胞から構築された血管内皮は長期間にわたり血液凝固第VIII因子を産生し,止血の異常が改善された.また,下肢虚血モデルマウスに対し下肢筋肉に由来するCD157陽性の血管内皮細胞を移植したところ,太い血管および毛細血管に分化し血流の回復に貢献した.
おわりに
血管生物学の分野においては,血管内皮幹細胞が存在するか否かについて長いあいだ議論がなされてきたが,解明にはいたっていなかった.この研究におけるCD157血管内皮幹細胞の同定は,血管の形成や臓器の恒常性の維持を理解するうえで新たな概念を提示し,血管生物学にパラダイムシフトをもたらす契機になることが期待される.今後の課題として,たとえば,肝臓における類洞構造や酸素と二酸化炭素のガス交換をする肺の毛細血管など,臓器に特異的な血管網の維持において臓器に特異的な血管内皮幹細胞がどのような役割をはたすかを解明することが重要であると考えている.ある臓器における血管内皮幹細胞が,ほかの臓器の血管網の構築にも貢献するか,なども興味深い.腫瘍における血管の新生の際の血管内皮幹細胞の役割に関しても解明が必要である.また,CD157がなぜわずかに存在する血管内皮幹細胞に強く発現するかについても明らかにする必要がある.CD157ノックアウトマウスは血管の異常をきたさないことから8),血管内皮幹細胞による血管の再生能はCD157以外の分子に依存すると推測される.これらの分子機序を探求することにより,血管内皮幹細胞の全容を解明し,虚血性疾患に対する新たな治療法の開発をめざしたい.
文 献
- Asahara, T., Murohara, T., Sullivan, A. et al.: Isolation of putative progenitor endothelial cells for angiogenesis. Science, 275, 964-967 (1997)[PubMed]
- Potente, M., Gerhardt, H. & Carmeliet, P.: Basic and therapeutic aspects of angiogenesis. Cell, 146, 873-887 (2011)[PubMed]
- Naito, H., Kidoya, H., Sakimoto, S. et al.: Identification and characterization of a resident vascular stem/progenitor cell population in preexisting blood vessels. EMBO J., 31, 842-855 (2012)[PubMed]
- Okabe, K., Kobayashi, S., Yamada, T. et al.: Neurons limit angiogenesis by titrating VEGF in retina. Cell, 159, 584-596 (2014)[PubMed] [新着論文レビュー]
- Sheikh, A. Q., Misra, A., Rosas, I. O. et al.: Smooth muscle cell progenitors are primed to muscularize in pulmonary hypertension. Sci. Transl. Med., 7, 308ra159 (2015)[PubMed]
- Ehling, M., Adams, S., Benedito, R. et al.: Notch controls retinal blood vessel maturation and quiescence. Development, 140, 3051-3061 (2013)[PubMed]
- Reya, T., Morrison, S. J., Clarke, M. F. et al.: Stem cells, cancer, and cancer stem cells. Nature, 414, 105-111 (2001)[PubMed]
- Itoh, M., Ishihara, K., Hiroi, T. et al.: Deletion of bone marrow stromal cell antigen-1 (CD157) gene impaired systemic thymus independent-2 antigen induced IgG3 and mucosal TD antigen-elicited IgA responses. J. Immunol., 161, 3974-3983 (1998)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 大阪大学大学院医学系研究科博士課程 修了,2017年より同 助教.
研究テーマ:血管の形成の機構.
抱負:虚血性疾患に対する新たな治療法の開発をめざして研究を進めたい.
内藤 尚道(Hisamichi Naito)
大阪大学微生物病研究所 助教.
高倉 伸幸(Nobuyuki Takakura)
大阪大学微生物病研究所 教授.
研究室URL:http://st.biken.osaka-u.ac.jp/
© 2018 若林 卓・内藤尚道・高倉伸幸 Licensed under CC 表示 2.1 日本