水素酸化硫黄還元好熱細菌における可逆的なクエン酸回路の発見
布浦拓郎1・力石嘉人2・跡見晴幸3
(1海洋研究開発機構海洋生命理工学研究開発センター,2北海道大学低温科学研究所 同位体物質循環分野,3京都大学大学院工学研究科 合成・生物化学専攻生物化学工学分野)
email:布浦拓郎
DOI: 10.7875/first.author.2018.027
A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile.
Takuro Nunoura, Yoshito Chikaraishi, Rikihisa Izaki, Takashi Suwa, Takaaki Sato, Takeshi Harada, Koji Mori, Yumiko Kato, Masayuki Miyazaki, Shigeru Shimamura, Katsunori Yanagawa, Aya Shuto, Naohiko Ohkouchi, Nobuyuki Fujita, Yoshihiro Takaki, Haruyuki Atomi, Ken Takai
Science, 359, 559-563 (2018)
ミトコンドリアにおけるエネルギー代謝経路として知られる酸化的クエン酸回路がクエン酸回路の典型例として知られているが,微生物におけるクエン酸回路の反応の方向には多様性があり,すべての生物に共通するクエン酸回路の役割はアミノ酸や核酸などの生合成に必須な中間代謝物の合成にある.なかでも,炭素固定に機能する還元的クエン酸回路はもっとも始原的な炭素固定経路のひとつであると考えられている.一方,クエン酸回路において,クエン酸シンターゼによるクエン酸の合成は生体においては不可逆であり,還元的クエン酸回路が機能するためには,クエン酸シンターゼが逆反応するのではなく,ATPのエネルギーを利用したATPクエン酸リアーゼあるいはその代替となる機構が不可欠であるとされてきた.この研究において,筆者らは,始原的な系統に属する水素酸化硫黄還元好熱細菌Thermosulfidibacter takaiiが,独立栄養条件あるいは混合栄養条件においてクエン酸シンターゼを含むまったく同じ酵素を用い,利用可能な炭素源に応じて反応の方向を柔軟に変化させる可逆的なクエン酸回路を保持することをマルチオミクス解析により明らかにした.このことから,クエン酸回路は基質の濃度の変化に対応して,これまで考えられてきたよりはるかに柔軟かつダイナミックに適応しうるシステムであることが示された.また,クエン酸回路は生命が誕生したときにはすでに存在したと考えられているが,可逆的なクエン酸回路が機能することにより,地球上に誕生した生命は従属栄養あるいは独立栄養に特化した存在ではなく,環境に柔軟に対応する通性混合栄養生物でありえたことが強く示唆された.
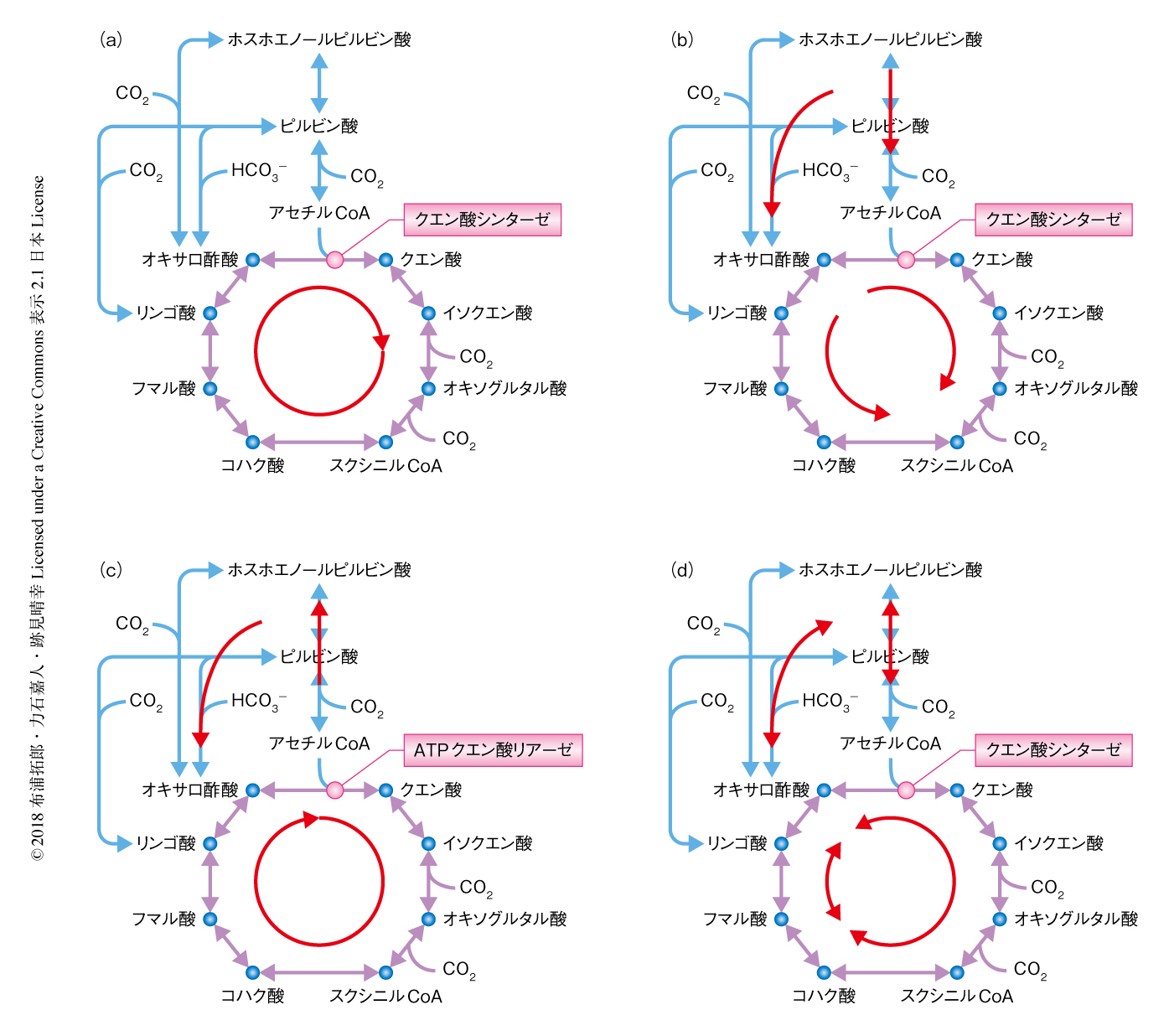
ミトコンドリアや好気性微生物に分布する,有機化合物を分解してエネルギーを取り出しCO2を排出する酸化的クエン酸回路は,典型的なクエン酸回路として理解されている.しかし,生物界の全体をみわたした場合,酸化的クエン酸回路のほか,嫌気性細菌における分岐型のクエン酸回路や,炭酸固定に機能するCO2を取り込んで有機化合物を合成する還元的クエン酸回路が知られており(図1),そのうち,吸エルゴン反応を含まないのは分岐型のクエン酸回路のみである.なお,還元的クエン酸回路においてはピルビン酸フェレドキシンオキシドレダクターゼおよびオキソグルタル酸フェレドキシンオキシドレダクターゼが吸エルゴン反応を触媒し,酸化的クエン酸回路においてもリンゴ酸デヒドロゲナーゼが吸エルゴン反応を担う1).また,クエン酸回路を担うさまざまな反応のほとんどには起源の異なる複数の酵素が存在するほか,一部が欠損する不完全な経路やバイパス経路も存在しており,全体としての高い保存性をもつ半面,相反するような多様性や柔軟性も存在する.そして,すべての生物に共通するクエン酸回路の機能は,核酸,アミノ酸,ピロール,脂質,糖などの生合成に必須な中間代謝物を合成することであり,その起源は生命の誕生よりまえの化学進化の時代にさかのぼると考えられている2,3).
一方,現世の生物につながる最初の生命は従属栄養生物であったのか独立栄養生物であったのかについては絶えることのない論争がつづいているが,いずれにせよ,持続可能な生態系が確立するには炭酸固定が不可欠であり,生命活動に不可欠な物質の生合成に必要な還元的クエン酸回路は,メタン菌や酢酸菌などに分布するWood-Ljungdahl経路とならびもっとも始原的な炭酸固定経路であると考えられている3,4).しかし,従来の知見では,還元的クエン酸回路に不可欠とされるATPクエン酸リアーゼあるいはその代替の機構となるシトニルCoAシンテターゼ/シトニルCoAリアーゼがクエン酸シンターゼとスクシニルCoAシンテターゼのキメラ構造であることから,生命が誕生した当時は還元的クエン酸回路は存在しなかった可能性も指摘されている5).なお,還元的クエン酸回路におけるATPクエン酸リアーゼあるいはその代替の機構が触媒する化学反応の必然性については1),酸化的クエン酸回路におけるクエン酸シンターゼによるクエン酸の合成が発エルゴン反応であることから6),これまで,生体においては生じえないと指摘されてきた.
Thermosulfidibacter takaiiは嫌気的な環境において炭素源を問わず水素酸化硫黄還元によるエネルギーの獲得を必須とする好熱菌であり,Bacteriaにおける始原的な系統であるAquificae門に近縁である.Aquificae門と同様に独立栄養条件において増殖するが,炭素源として酢酸やコハク酸などの有機酸,あるいは,酵母エキスを利用することもでき,酵母エキスや有機酸の存在する混合栄養条件においてもっとも良好な増殖を示す.ゲノムの大きさは約1.8 Mbpと,近縁の系統と同様にコンパクトである.Aquificae門に属する既知の細菌はすべて還元的クエン酸回路をもつことから,T. takaiiも同様であると予想されていたが,ゲノム解析からは炭素固定経路を確定することができなかった.完全なクエン酸回路に関する遺伝子は見い出されたが,還元的クエン酸回路に不可欠とされるATPクエン酸リアーゼあるいはその代替の機構にかかわる遺伝子が欠けていたのである.また,Aquificae門に近縁なThermodesulfobacteria門のもつWood-Ljungdahl経路,また,そのほかのBacteriaあるいはArchaeaに分布する既知の炭酸固定経路を担う遺伝子も見い出されなかった.
細胞抽出液を用いた酵素活性の測定,トランスクリプトーム解析,プロテオーム解析により,T. takaiiのクエン酸回路およびその補充経路にかかわる遺伝子は独立栄養条件においても混合栄養条件においても恒常的に発現することが明らかにされた.とくに,細胞抽出液からはクエン酸シンターゼによるCoA産生の非常に高い活性が検出され,また,クエン酸シンターゼによるクエン酸開裂反応も,還元的クエン酸回路をもつAquificae門に属する細菌のATPクエン酸リアーゼ活性とほぼ同等の活性を示した.クエン酸シンターゼによるCoAの産生,つまり,アセチルCoAの消費が酸化的クエン酸回路において高いレベルで機能するならば,アセチルCoAを中間代謝物に含む既知の炭酸固定経路が機能することは基質の競合によりむずかしいと考えられた.さらに,ATPクエン酸リアーゼの活性は検出されなかった.これらのことから,従来の常識をつくがえし,T. takaiiは独立栄養条件においてクエン酸シンターゼの逆反応に依存する還元的クエン酸回路を利用する可能性が高いと判断された.
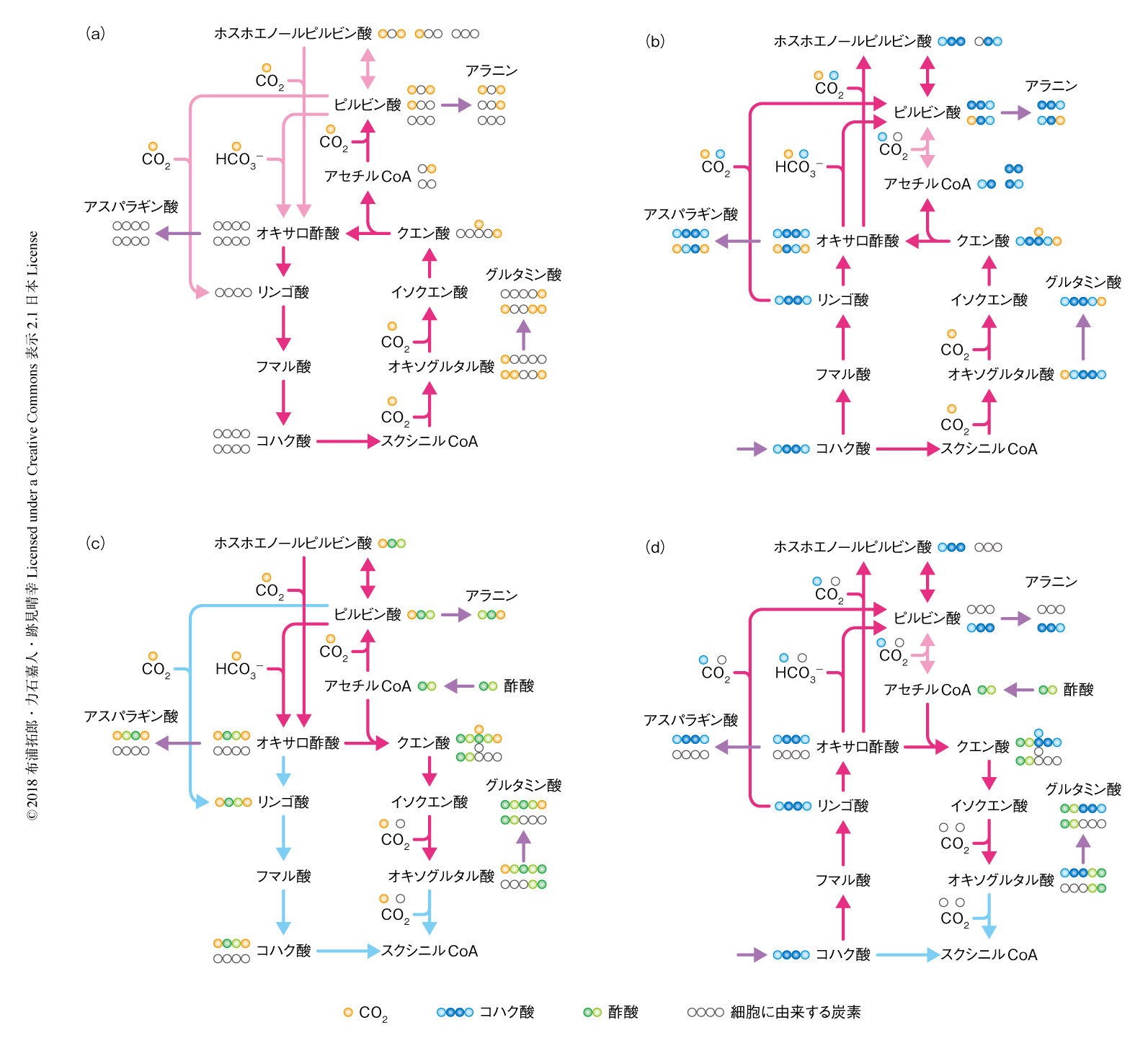
代謝経路,そして,その反応の方向を確定するには,遺伝子破壊実験あるいは代謝解析が不可欠である.しかし,T. takaiiには遺伝子操作系がなく,また,増殖の効率が低いため,液体クロマトグラフィー-質量分析法あるいはNMR法による代謝産物の解析を実施するのに十分な細胞を得ることは困難であった.そこで,筆者らにより開発された高感度な代謝解析の手法を応用することにより,T. takaiiにおいて代謝解析を実施した.この新規の手法においては,従来のNMR法による解析と同様に,安定同位体の標識のもと培養し,クエン酸回路により産生された中間代謝物を前駆体として生合成されたアミノ酸の分子内標識を識別することにより,クエン酸回路の反応の方向を確定させる.具体的には,1)安定同位体により標識された重炭酸あるいは有機酸を基質とした培養,2)全菌体タンパク質の加水分解およびアミノ酸の誘導体化,3)ガスクロマトグラフィー-質量分析法による分析,4)ソフトウェアMassWorksによる同位体標識率の算出,5)クエン酸回路の反応の方向の確定,という手順で解析を実施した.ピルビン酸,オキサロ酢酸,オキソグルタル酸の安定同位体による分子内標識を解析するため,T. takaiiのゲノム情報から同定されたアミノ酸の生合成経路にもとづき,それぞれ,アラニン,アスパラギン酸,グルタミン酸の同位体標識率を解析した.その結果,独立培養条件においては実際に還元的クエン酸回路が機能していること,コハク酸あるいは酢酸を添加した混合栄養条件においてはそれぞれの基質に特異的な分岐型のクエン酸回路が機能すること,コハク酸および酢酸を添加した条件においては補充経路を含めクエン酸回路が酸化的な方向に機能すること,が明らかにされた(図2).
T. takaiiのクエン酸シンターゼを大腸菌において発現させ,酵素学的な性状について検討した.その結果,T. takaiiのクエン酸シンターゼは単独あるいはオキサロ酢酸を消費するリンゴ酸デヒドロゲナーゼの存在下においてクエン酸開裂反応を触媒することが確認された.また,クエン酸開裂反応において,既報のATPクエン酸リアーゼに比べ明らかに低いKm値を示すこと,さらに,クエン酸に対し比較的高いkcat/Km値を示すことが明らかにされた.つまり,T. takaiiにおいてクエン酸シンターゼはクエン酸回路が還元的な方向に反応するために十分に高い触媒効率をもつことが示された.
クエン酸シンターゼとATPクエン酸リアーゼあるいはシトニルCoAリアーゼの関係について検討するため,クエン酸シンターゼドメインを対象として系統解析を実施した.その結果,ATPクエン酸リアーゼおよびシトニルCoAリアーゼはクエン酸シンターゼの一群から進化したこと,また,T. takaiiと同様にクエン酸シンターゼによるクエン酸開裂により還元的クエン酸回路が機能すると報告されたDesulfurella acetivorans 7) のクエン酸シンターゼはT. takaiiと同じクラスターに含まれることが明らかにされた.
一連の解析の結果,T. takaiiにはクエン酸シンターゼを含むまったく同じ酵素を用いるにもかかわらず,回路に取り込み可能な基質の種類および量に応じて反応の方向を自在に変動できるクエン酸回路の存在することが明らかにされた.このクエン酸回路はコハク酸からオキサロ酢酸まで還元的な方向に機能すると,系として吸エルゴン反応になる.この反応を進めるには,リンゴ酸デヒドロゲナーゼによりオキサロ酢酸の濃度を低く抑えることはもちろん,吸エルゴン反応を触媒するオキソグルタル酸フェレドキシンオキシドレダクターゼやピルビン酸フェレドキシンオキシドレダクターゼを機能させることによりクエン酸の濃度を高く,かつ,アセチルCoAの濃度を低く維持することが必要である.そして,これらの吸エルゴン反応の促進には,おそらく,水素酸化硫黄還元によるエネルギーの獲得の機構に含まれるなんらかの発エルゴン反応と共役する電子分岐8)(electron bifurcation)による,十分な量の還元型フェレドキシンの供給が不可欠であると考えられる.
T. takaiiおよび同時に発表されたD. acetivorans 7) から見い出されたクエン酸シンターゼを含む可逆的なクエン酸回路の存在から,従来の生化学あるいは微生物学がみおとしてきたクエン酸回路が本質的にもつ柔軟性が明らかにされた.また,この結果から,メタゲノム解析などでは検出することができない炭素固定能をもつ微生物が幅広く存在する可能性も示唆された.一方,クエン酸回路の成立が化学進化の時代にさかのぼるとするならば,クエン酸回路の柔軟性は,従属栄養か独立栄養かのいずれかで考えられてきた生命の誕生の論争に新たな視点をあたえる.すなわち,生命は通性混合栄養として誕生した可能性である.偏性の従属栄養として誕生した生命は自らの有機物の消費により絶える可能性が指摘され,また,独立栄養としての生命の誕生については,生命の誕生に不可欠な有機物の濃集した条件において独立栄養生物が生じる不可思議さが指摘されてきた.しかし,あたえられた環境条件において,無機物からエネルギーを獲得する一方,炭素源については有機物同化と炭酸同化とを柔軟に使い分ける通性混合栄養生物としての生命の誕生は,2つの説に対する批判を克服しうる新たな仮説となるだろう.
また,この研究において用いられた代謝解析の手法は,これまで,増殖の効率が悪いため代謝解析を実施することのできなかった環境微生物を対象とした基礎および応用の両面での研究の展開を可能にする.この手法において必要な細胞は,108細胞/ml程度しか増殖しない環境微生物であってもわずか数mlから数十mlの培養により得ることができる.これらの環境微生物を対象とした新たなポストゲノム研究の展開が期待される.
略歴:2002年 京都大学大学院農学研究科博士課程 修了,同年 海洋科学技術センター極限環境フロンティア 研究員,2004年 海洋研究開発機構極限環境生物圏研究センター 研究員,2009年 同 海洋・極限環境生物圏領域 主任研究員を経て,2014年より同 海洋生命理工学研究開発センター 主任研究員.
研究テーマ:海洋微生物の生態,環境微生物の炭素代謝および窒素代謝,微生物およびウイルスのゲノムの動態および進化.
力石 嘉人(Yoshito Chikaraishi)
北海道大学低温科学研究所 教授.
跡見 晴幸(Haruyuki Atomi)
京都大学大学院工学研究科 教授.
© 2018 布浦拓郎・力石嘉人・跡見晴幸 Licensed under CC 表示 2.1 日本
(1海洋研究開発機構海洋生命理工学研究開発センター,2北海道大学低温科学研究所 同位体物質循環分野,3京都大学大学院工学研究科 合成・生物化学専攻生物化学工学分野)
email:布浦拓郎
DOI: 10.7875/first.author.2018.027
A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile.
Takuro Nunoura, Yoshito Chikaraishi, Rikihisa Izaki, Takashi Suwa, Takaaki Sato, Takeshi Harada, Koji Mori, Yumiko Kato, Masayuki Miyazaki, Shigeru Shimamura, Katsunori Yanagawa, Aya Shuto, Naohiko Ohkouchi, Nobuyuki Fujita, Yoshihiro Takaki, Haruyuki Atomi, Ken Takai
Science, 359, 559-563 (2018)
要 約
ミトコンドリアにおけるエネルギー代謝経路として知られる酸化的クエン酸回路がクエン酸回路の典型例として知られているが,微生物におけるクエン酸回路の反応の方向には多様性があり,すべての生物に共通するクエン酸回路の役割はアミノ酸や核酸などの生合成に必須な中間代謝物の合成にある.なかでも,炭素固定に機能する還元的クエン酸回路はもっとも始原的な炭素固定経路のひとつであると考えられている.一方,クエン酸回路において,クエン酸シンターゼによるクエン酸の合成は生体においては不可逆であり,還元的クエン酸回路が機能するためには,クエン酸シンターゼが逆反応するのではなく,ATPのエネルギーを利用したATPクエン酸リアーゼあるいはその代替となる機構が不可欠であるとされてきた.この研究において,筆者らは,始原的な系統に属する水素酸化硫黄還元好熱細菌Thermosulfidibacter takaiiが,独立栄養条件あるいは混合栄養条件においてクエン酸シンターゼを含むまったく同じ酵素を用い,利用可能な炭素源に応じて反応の方向を柔軟に変化させる可逆的なクエン酸回路を保持することをマルチオミクス解析により明らかにした.このことから,クエン酸回路は基質の濃度の変化に対応して,これまで考えられてきたよりはるかに柔軟かつダイナミックに適応しうるシステムであることが示された.また,クエン酸回路は生命が誕生したときにはすでに存在したと考えられているが,可逆的なクエン酸回路が機能することにより,地球上に誕生した生命は従属栄養あるいは独立栄養に特化した存在ではなく,環境に柔軟に対応する通性混合栄養生物でありえたことが強く示唆された.
はじめに
ミトコンドリアや好気性微生物に分布する,有機化合物を分解してエネルギーを取り出しCO2を排出する酸化的クエン酸回路は,典型的なクエン酸回路として理解されている.しかし,生物界の全体をみわたした場合,酸化的クエン酸回路のほか,嫌気性細菌における分岐型のクエン酸回路や,炭酸固定に機能するCO2を取り込んで有機化合物を合成する還元的クエン酸回路が知られており(図1),そのうち,吸エルゴン反応を含まないのは分岐型のクエン酸回路のみである.なお,還元的クエン酸回路においてはピルビン酸フェレドキシンオキシドレダクターゼおよびオキソグルタル酸フェレドキシンオキシドレダクターゼが吸エルゴン反応を触媒し,酸化的クエン酸回路においてもリンゴ酸デヒドロゲナーゼが吸エルゴン反応を担う1).また,クエン酸回路を担うさまざまな反応のほとんどには起源の異なる複数の酵素が存在するほか,一部が欠損する不完全な経路やバイパス経路も存在しており,全体としての高い保存性をもつ半面,相反するような多様性や柔軟性も存在する.そして,すべての生物に共通するクエン酸回路の機能は,核酸,アミノ酸,ピロール,脂質,糖などの生合成に必須な中間代謝物を合成することであり,その起源は生命の誕生よりまえの化学進化の時代にさかのぼると考えられている2,3).
一方,現世の生物につながる最初の生命は従属栄養生物であったのか独立栄養生物であったのかについては絶えることのない論争がつづいているが,いずれにせよ,持続可能な生態系が確立するには炭酸固定が不可欠であり,生命活動に不可欠な物質の生合成に必要な還元的クエン酸回路は,メタン菌や酢酸菌などに分布するWood-Ljungdahl経路とならびもっとも始原的な炭酸固定経路であると考えられている3,4).しかし,従来の知見では,還元的クエン酸回路に不可欠とされるATPクエン酸リアーゼあるいはその代替の機構となるシトニルCoAシンテターゼ/シトニルCoAリアーゼがクエン酸シンターゼとスクシニルCoAシンテターゼのキメラ構造であることから,生命が誕生した当時は還元的クエン酸回路は存在しなかった可能性も指摘されている5).なお,還元的クエン酸回路におけるATPクエン酸リアーゼあるいはその代替の機構が触媒する化学反応の必然性については1),酸化的クエン酸回路におけるクエン酸シンターゼによるクエン酸の合成が発エルゴン反応であることから6),これまで,生体においては生じえないと指摘されてきた.
1.Thermosulfidibacter takaiiの性質およびゲノム解析
Thermosulfidibacter takaiiは嫌気的な環境において炭素源を問わず水素酸化硫黄還元によるエネルギーの獲得を必須とする好熱菌であり,Bacteriaにおける始原的な系統であるAquificae門に近縁である.Aquificae門と同様に独立栄養条件において増殖するが,炭素源として酢酸やコハク酸などの有機酸,あるいは,酵母エキスを利用することもでき,酵母エキスや有機酸の存在する混合栄養条件においてもっとも良好な増殖を示す.ゲノムの大きさは約1.8 Mbpと,近縁の系統と同様にコンパクトである.Aquificae門に属する既知の細菌はすべて還元的クエン酸回路をもつことから,T. takaiiも同様であると予想されていたが,ゲノム解析からは炭素固定経路を確定することができなかった.完全なクエン酸回路に関する遺伝子は見い出されたが,還元的クエン酸回路に不可欠とされるATPクエン酸リアーゼあるいはその代替の機構にかかわる遺伝子が欠けていたのである.また,Aquificae門に近縁なThermodesulfobacteria門のもつWood-Ljungdahl経路,また,そのほかのBacteriaあるいはArchaeaに分布する既知の炭酸固定経路を担う遺伝子も見い出されなかった.
2.T. takaiiにおけるクエン酸回路にかかわる遺伝子の発現
細胞抽出液を用いた酵素活性の測定,トランスクリプトーム解析,プロテオーム解析により,T. takaiiのクエン酸回路およびその補充経路にかかわる遺伝子は独立栄養条件においても混合栄養条件においても恒常的に発現することが明らかにされた.とくに,細胞抽出液からはクエン酸シンターゼによるCoA産生の非常に高い活性が検出され,また,クエン酸シンターゼによるクエン酸開裂反応も,還元的クエン酸回路をもつAquificae門に属する細菌のATPクエン酸リアーゼ活性とほぼ同等の活性を示した.クエン酸シンターゼによるCoAの産生,つまり,アセチルCoAの消費が酸化的クエン酸回路において高いレベルで機能するならば,アセチルCoAを中間代謝物に含む既知の炭酸固定経路が機能することは基質の競合によりむずかしいと考えられた.さらに,ATPクエン酸リアーゼの活性は検出されなかった.これらのことから,従来の常識をつくがえし,T. takaiiは独立栄養条件においてクエン酸シンターゼの逆反応に依存する還元的クエン酸回路を利用する可能性が高いと判断された.
3.代謝解析によるクエン酸回路の反応の方向の決定
代謝経路,そして,その反応の方向を確定するには,遺伝子破壊実験あるいは代謝解析が不可欠である.しかし,T. takaiiには遺伝子操作系がなく,また,増殖の効率が低いため,液体クロマトグラフィー-質量分析法あるいはNMR法による代謝産物の解析を実施するのに十分な細胞を得ることは困難であった.そこで,筆者らにより開発された高感度な代謝解析の手法を応用することにより,T. takaiiにおいて代謝解析を実施した.この新規の手法においては,従来のNMR法による解析と同様に,安定同位体の標識のもと培養し,クエン酸回路により産生された中間代謝物を前駆体として生合成されたアミノ酸の分子内標識を識別することにより,クエン酸回路の反応の方向を確定させる.具体的には,1)安定同位体により標識された重炭酸あるいは有機酸を基質とした培養,2)全菌体タンパク質の加水分解およびアミノ酸の誘導体化,3)ガスクロマトグラフィー-質量分析法による分析,4)ソフトウェアMassWorksによる同位体標識率の算出,5)クエン酸回路の反応の方向の確定,という手順で解析を実施した.ピルビン酸,オキサロ酢酸,オキソグルタル酸の安定同位体による分子内標識を解析するため,T. takaiiのゲノム情報から同定されたアミノ酸の生合成経路にもとづき,それぞれ,アラニン,アスパラギン酸,グルタミン酸の同位体標識率を解析した.その結果,独立培養条件においては実際に還元的クエン酸回路が機能していること,コハク酸あるいは酢酸を添加した混合栄養条件においてはそれぞれの基質に特異的な分岐型のクエン酸回路が機能すること,コハク酸および酢酸を添加した条件においては補充経路を含めクエン酸回路が酸化的な方向に機能すること,が明らかにされた(図2).
4.T. takaiiのクエン酸シンターゼの性質および系統解析
T. takaiiのクエン酸シンターゼを大腸菌において発現させ,酵素学的な性状について検討した.その結果,T. takaiiのクエン酸シンターゼは単独あるいはオキサロ酢酸を消費するリンゴ酸デヒドロゲナーゼの存在下においてクエン酸開裂反応を触媒することが確認された.また,クエン酸開裂反応において,既報のATPクエン酸リアーゼに比べ明らかに低いKm値を示すこと,さらに,クエン酸に対し比較的高いkcat/Km値を示すことが明らかにされた.つまり,T. takaiiにおいてクエン酸シンターゼはクエン酸回路が還元的な方向に反応するために十分に高い触媒効率をもつことが示された.
クエン酸シンターゼとATPクエン酸リアーゼあるいはシトニルCoAリアーゼの関係について検討するため,クエン酸シンターゼドメインを対象として系統解析を実施した.その結果,ATPクエン酸リアーゼおよびシトニルCoAリアーゼはクエン酸シンターゼの一群から進化したこと,また,T. takaiiと同様にクエン酸シンターゼによるクエン酸開裂により還元的クエン酸回路が機能すると報告されたDesulfurella acetivorans 7) のクエン酸シンターゼはT. takaiiと同じクラスターに含まれることが明らかにされた.
5.可逆的なクエン酸回路をささえるしくみ
一連の解析の結果,T. takaiiにはクエン酸シンターゼを含むまったく同じ酵素を用いるにもかかわらず,回路に取り込み可能な基質の種類および量に応じて反応の方向を自在に変動できるクエン酸回路の存在することが明らかにされた.このクエン酸回路はコハク酸からオキサロ酢酸まで還元的な方向に機能すると,系として吸エルゴン反応になる.この反応を進めるには,リンゴ酸デヒドロゲナーゼによりオキサロ酢酸の濃度を低く抑えることはもちろん,吸エルゴン反応を触媒するオキソグルタル酸フェレドキシンオキシドレダクターゼやピルビン酸フェレドキシンオキシドレダクターゼを機能させることによりクエン酸の濃度を高く,かつ,アセチルCoAの濃度を低く維持することが必要である.そして,これらの吸エルゴン反応の促進には,おそらく,水素酸化硫黄還元によるエネルギーの獲得の機構に含まれるなんらかの発エルゴン反応と共役する電子分岐8)(electron bifurcation)による,十分な量の還元型フェレドキシンの供給が不可欠であると考えられる.
おわりに
T. takaiiおよび同時に発表されたD. acetivorans 7) から見い出されたクエン酸シンターゼを含む可逆的なクエン酸回路の存在から,従来の生化学あるいは微生物学がみおとしてきたクエン酸回路が本質的にもつ柔軟性が明らかにされた.また,この結果から,メタゲノム解析などでは検出することができない炭素固定能をもつ微生物が幅広く存在する可能性も示唆された.一方,クエン酸回路の成立が化学進化の時代にさかのぼるとするならば,クエン酸回路の柔軟性は,従属栄養か独立栄養かのいずれかで考えられてきた生命の誕生の論争に新たな視点をあたえる.すなわち,生命は通性混合栄養として誕生した可能性である.偏性の従属栄養として誕生した生命は自らの有機物の消費により絶える可能性が指摘され,また,独立栄養としての生命の誕生については,生命の誕生に不可欠な有機物の濃集した条件において独立栄養生物が生じる不可思議さが指摘されてきた.しかし,あたえられた環境条件において,無機物からエネルギーを獲得する一方,炭素源については有機物同化と炭酸同化とを柔軟に使い分ける通性混合栄養生物としての生命の誕生は,2つの説に対する批判を克服しうる新たな仮説となるだろう.
また,この研究において用いられた代謝解析の手法は,これまで,増殖の効率が悪いため代謝解析を実施することのできなかった環境微生物を対象とした基礎および応用の両面での研究の展開を可能にする.この手法において必要な細胞は,108細胞/ml程度しか増殖しない環境微生物であってもわずか数mlから数十mlの培養により得ることができる.これらの環境微生物を対象とした新たなポストゲノム研究の展開が期待される.
文 献
- Fuchs, G.: Alternative pathways of carbon dioxide fixation: insights into the early evolution of life? Annu. Rev. Microbiol., 65, 631-658 (2011)[PubMed]
- Wachtershauser, G.: Evolution of the first metabolic cycles. Proc. Natl. Acad. Sci. USA, 87, 200-204 (1990)[PubMed]
- Smith, E. & Morowitz, H. J.: Universality in intermediary metabolism. Proc. Natl. Acad. Sci. USA, 101, 13168-13173 (2004)[PubMed]
- Braakman, R. & Smith, E.: The emergence and early evolution of biological carbon-fixation. PLoS Comput. Biol., 8, e1002455 (2012)[PubMed]
- Aoshima, M., Ishii, M. & Igarashi, Y.: A novel enzyme, citryl-CoA lyase, catalysing the second step of the citrate cleavage reaction in Hydrogenobacter thermophilus TK-6. Mol. Microbiol., 52, 763-770 (2004)[PubMed]
- Guynn, R. W., Gelberg, H. J. & Veech, R. L.: Equilibrium constants of the malate dehydrogenase, citrate synthase, citrate lyase, and acetyl coenzyme A hydrolysis reactions under physiological conditions. J. Biol. Chem., 248, 6957-6965 (1973)[PubMed]
- Mall, A., Sobotta, J., Huber, C. et al.: Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium. Science, 359, 563-567 (2018)[PubMed]
- Buckel, W. & Thauer, R. K.: Energy conservation via electron bifurcating ferredoxin reduction and proton/Na+ translocating ferredoxin oxidation. Biochim. Biophys. Acta, 1827, 94-113 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2002年 京都大学大学院農学研究科博士課程 修了,同年 海洋科学技術センター極限環境フロンティア 研究員,2004年 海洋研究開発機構極限環境生物圏研究センター 研究員,2009年 同 海洋・極限環境生物圏領域 主任研究員を経て,2014年より同 海洋生命理工学研究開発センター 主任研究員.
研究テーマ:海洋微生物の生態,環境微生物の炭素代謝および窒素代謝,微生物およびウイルスのゲノムの動態および進化.
力石 嘉人(Yoshito Chikaraishi)
北海道大学低温科学研究所 教授.
跡見 晴幸(Haruyuki Atomi)
京都大学大学院工学研究科 教授.
© 2018 布浦拓郎・力石嘉人・跡見晴幸 Licensed under CC 表示 2.1 日本