抗原の刺激に依存してサイトカインシグナルを活性化する新規のキメラ抗原受容体の開発
籠谷勇紀・平野直人
(カナダPrincess Margaret Cancer Centre,Tumor Immunotherapy Program)
email:平野直人
DOI: 10.7875/first.author.2018.026
A novel chimeric antigen receptor containing a JAK-STAT signaling domain mediates superior antitumor effects.
Yuki Kagoya, Shinya Tanaka, Tingxi Guo, Mark Anczurowski, Chung-Hsi Wang, Kayoko Saso, Marcus O. Butler, Mark D. Minden, Naoto Hirano
Nature Medicine, 24, 352-359 (2018)
CD19を標的としたキメラ抗原受容体を導入したT細胞が再発性かつ難治性のB細胞性腫瘍に対しいちじるしい効果を示すことが注目されている.一方で,そのほかの悪性腫瘍に対するキメラ抗原受容体発現T細胞療法は現在までに臨床において十分な効果が得られておらず,さらなる改良を必要とするのが現状である.この研究において,筆者らは,T細胞の機能において重要なサイトカインシグナルを活性化するドメインを組み込んだ新たなキメラ抗原受容体を開発した.この新規のキメラ抗原受容体を導入したT細胞においては,抗原の刺激に依存してJAK-STATシグナル伝達経路が活性化し,複数のB細胞性腫瘍のモデルにおいて既存のキメラ抗原受容体を導入したT細胞と比較してすぐれた抗腫瘍効果を示すことが確認された.この新規のキメラ抗原受容体のデザインはあらゆる抗原に対するキメラ抗原受容体において応用が可能であり,固形がんに対するキメラ抗原受容体発現T細胞療法の成績を向上させられる可能性がある.
養子免疫療法は体外において腫瘍細胞を認識するT細胞を準備し,これを培養により増幅させたうえで患者に注入することにより腫瘍細胞を特異的に攻撃する免疫療法のひとつであり,進行期の悪性腫瘍において治癒をめざすことのできる有望な治療法である1).抗腫瘍性のT細胞については,もともと体内に存在するものを増幅させる手法もあるが,近年の遺伝子改変技術の進歩にともない,腫瘍のもつ抗原を特異的に認識するT細胞受容体あるいはキメラ抗原受容体(chimeric antigen receptor:CAR)をT細胞に導入する手法が普及している.とりわけ近年,B細胞性腫瘍に発現するCD19を標的とするキメラ抗原受容体を導入したT細胞による治療において非常に有望な成績が報告され,2017年には,一部のB細胞性腫瘍に対する治療法として米国食品医薬品局に認可されるにいたった2).一方,CD19以外のさまざまな抗原を認識するキメラ抗原受容体もあいついで開発されたが,これらはin vitroにおいては十分なエフェクター機能が得られたものの,実際の臨床試験においては良好な治療効果が得られていないのが現状である.一般に,養子免疫療法において治療の成否を決めるのは,注入されたT細胞の単発のエフェクター機能ではなく,患者の体内においてT細胞が増殖し持続できるかどうかであることがわかっている.CD19以外を標的とするキメラ抗原受容体を導入したT細胞ではin vivoにおける十分な増殖はみられておらず,これが不十分な治療成績の原因と考えられる.この研究において,筆者らは,T細胞の長期の生存に重要なサイトカインシグナルを活性化するドメインを組み込んだ新規のキメラ抗原受容体が,既存のキメラ抗原受容体と比べ,in vivoにおける長期の生存および抗腫瘍効果においてすぐれていることを示した.
なお,がんに対するキメラ抗原受容体発現T細胞療法については,保仙 直毅, 領域融合レビュー, 6, e005 (2017) も参照されたい.
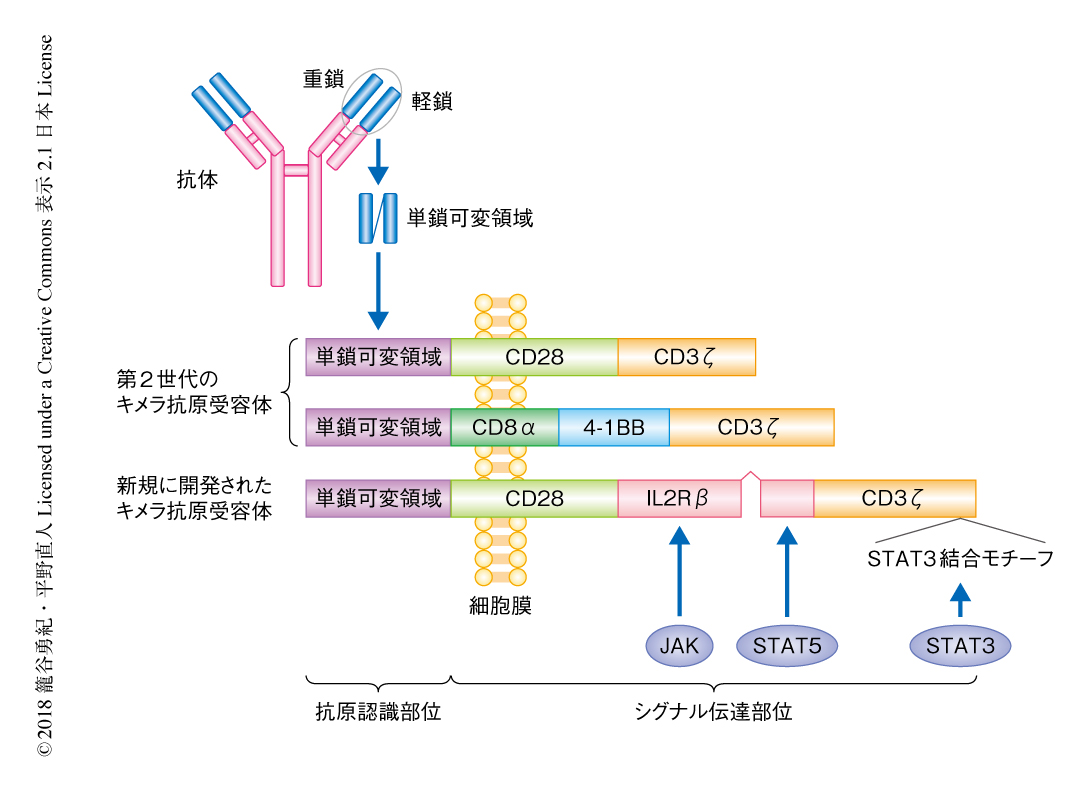
キメラ抗原受容体は,細胞の表面にある抗原認識部位と,細胞内にあるT細胞の活性化をひき起こすシグナル伝達部位の2つの部分に分けられる(図1).これにより腫瘍細胞に存在する抗原を特異的に認識し,T細胞の活性化およびエフェクター機能の誘導を1分子で行うことができる.ほとんどの場合,抗原の認識はモノクローナル抗体に由来する単鎖可変領域を組み込むことによりなされる.これは,抗体の軽鎖および重鎖の可変領域を数十アミノ酸残基のリンカーにより連結することで1本鎖にしたもので,通常のT細胞受容体とは異なり抗原をMHCの型によらず直接に認識できる.また,腫瘍細胞によっては免疫反応をのがれる機構のひとつとしてHLA分子の発現および抗原提示能の低下が起こることがあるため,これらの免疫逃避機構に関係なく用いられるという利点ももつ.
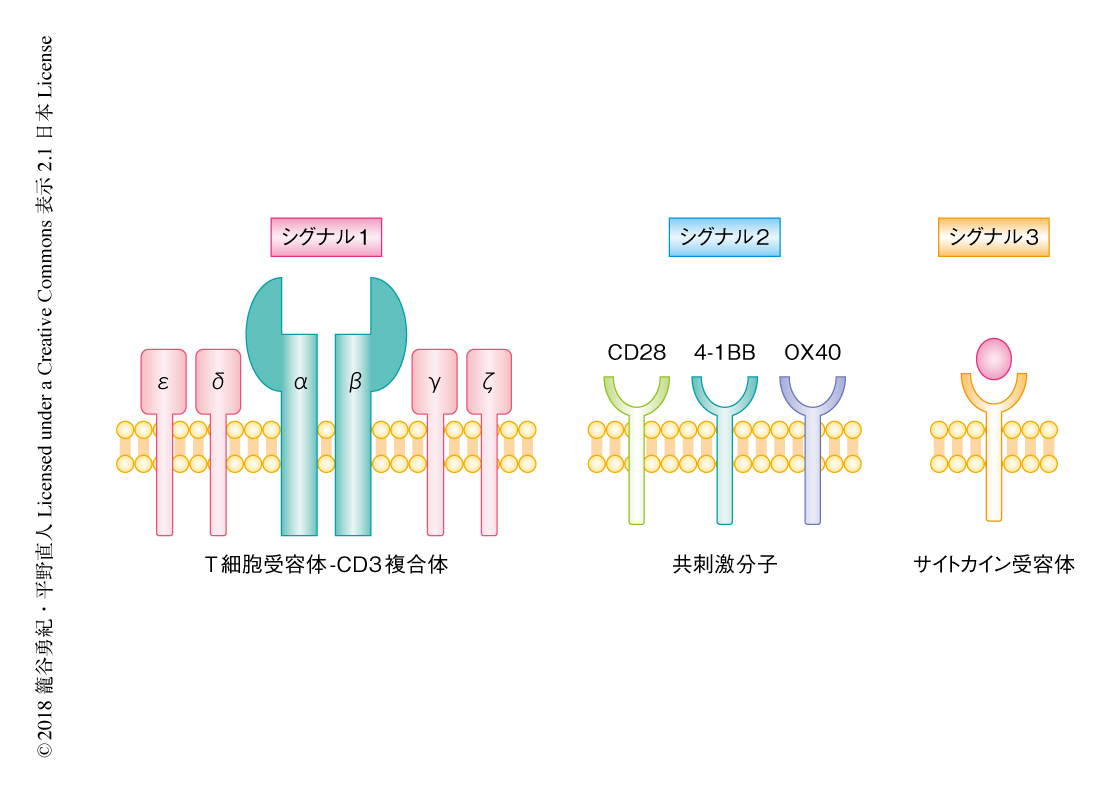
シグナル伝達にかかわる細胞内ドメインは,T細胞の活性化に重要な3つのシグナルと関連づけて考えることができる(図2).シグナル1は,MHCおよび抗原ペプチドがT細胞受容体と結合することにより活性化され,T細胞受容体-CD3複合体のサブユニットであるCD3ζなどがもつモチーフITAMを介してさまざまなリン酸化シグナルを惹起する.シグナル2は,CD28や4-1BBに代表される種々の共刺激分子と抗原提示細胞のリガンドとの結合により活性化され,T細胞の増殖およびエフェクター機能の増強に必要である.シグナル3はサイトカインにより活性化される.当初,設計されたキメラ抗原受容体においては,シグナル1を得るためCD3ζの細胞内ドメインを組み込んでいた.この第1世代のキメラ抗原受容体においては,in vitroにおいては抗原の認識にともなうエフェクター機能が十分に発揮されたものの,in vivoにおける持続的な抗腫瘍効果は得られなかった.この点を克服するため,共刺激分子によるシグナル2を組み込んだものが第2世代のキメラ抗原受容体である3,4).シグナル1とシグナル2にくわえ,T細胞の活性化,増殖,長期の生存に重要な役割をはたすのがサイトカインによるシグナル3である.とくにインターロイキン7,インターロイキン15,インターロイキン21のようにメモリーT細胞の分化にかかわるサイトカインのほか,エフェクター機能の活性化において重要なインターロイキン12を同時に発現させる試みがすでになされている5,6).しかしながら,この手法ではサイトカインシグナルを恒常的にT細胞に付与してしまうため,毒性の増幅が懸念される.
そこで,抗原の刺激に依存してサイトカインシグナルを活性化させる目的で,キメラ抗原受容体にインターロイキン2受容体β鎖を組み込んだ.多くの場合,サイトカイン受容体は複数のサブユニットからなる複合体であるが,これまでの研究により,インターロイキン2受容体β鎖は単独でもホモ二量体を形成しJAK-STATシグナル伝達経路を活性化することがわかっている.第2世代のキメラ抗原受容体のCD28ドメインとCD3ζドメインのあいだに,インターロイキン2受容体β鎖の細胞内ドメインのうちT細胞の増殖および生存に重要なシグナルであるJAK-STAT5シグナルの活性化に必要十分とされる部位7) を導入した(図1).これにくわえて,サイトカインのなかでもおもにインターロイキン21により活性化され,T細胞の長期の生存およびメモリーT細胞の分化に必要なSTAT3シグナルも同時に活性化する目的で,CD3ζドメインの末端にSTAT3結合モチーフ8) を導入した.この新規に開発されたキメラ抗原受容体をヒトの末梢血に由来するT細胞に導入し,CD19陽性白血病細胞株であるNALM-6細胞により刺激したところ,STAT3およびSTAT5のリン酸化がみられた.このJAK-STATシグナル伝達経路の活性化はCD19陰性の白血病細胞株であるK562細胞により刺激した際にはみられなかったことから,JAK-STATシグナル伝達経路の活性化は抗原の刺激に依存することが確認された.
この新規に開発されたキメラ抗原受容体を導入したT細胞をNALM-6細胞により刺激したところ,第2世代のキメラ抗原受容体を導入したT細胞と比較して,増殖能にすぐれており,これは細胞分裂の亢進および刺激にともなう細胞死の低下の両方に起因していた.STAT3あるいはSTAT5の特異的な阻害剤を投与すると増殖能が有意に低下したことから,これらのシグナル伝達経路の活性化が増殖の促進に寄与することがわかった.また,新規のキメラ抗原受容体を導入したT細胞を増殖させたのち細胞表面マーカーを解析したところ,第2世代のキメラ抗原受容体を導入したT細胞と比較して,メモリーT細胞のなかでもより未分化な画分9) が維持されていた.これらは,インターロイキン7やインターロイキン21などメモリーT細胞の分化に重要なサイトカインを投与することにより得られる性質と類似しており,この画分のT細胞はより分化が進んだT細胞と比較して長期の生存能にすぐれていることが知られている.
新規のキメラ抗原受容体を導入したT細胞をNALM-6細胞により刺激したのち遺伝子の発現プロファイルを解析したところ,インターロイキン21あるいはSTAT3の活性化により誘導される遺伝子の発現の上昇がみられた.発現レベルが上昇している遺伝子には,メモリーT細胞の分化に必要な転写因子をコードする遺伝子にくわえ,エフェクター分子をコードする複数の遺伝子も含まれていた.腫瘍細胞に対する細胞傷害活性については,第2世代のキメラ抗原受容体を導入したT細胞と比較して有意な差は認められなかったが,腫瘍細胞をキメラ抗原受容体発現T細胞に連続的に曝露させると,第2世代のキメラ抗原受容体を導入したT細胞においては徐々に細胞傷害活性が低下したのに対し,新規のキメラ抗原受容体を導入したT細胞においてはほぼ同等の細胞傷害活性が維持されていた.
以上のことから,新規に開発されたキメラ抗原受容体を導入したT細胞は,抗原の刺激に対するJAK-STATシグナル伝達経路の活性化により,増殖能および未分化なメモリーT細胞の画分の維持においてすぐれており,また,これらの性質にともない,連続的な抗原の刺激に対しても良好なエフェクター機能を維持することがわかった.
免疫機能を欠損するためヒトの細胞が生着できるNSGマウスにNALM-6細胞を移植したのち,キメラ抗原受容体発現T細胞により治療するモデルを用いた.このNALM-6細胞にはルシフェラーゼ遺伝子が導入されており,腫瘍の局在および量をイメージング装置により定量的に可視化できる.5×106個のNALM-6細胞を移植し,2週間後にキメラ抗原受容体発現T細胞による治療をはじめた.NALM-6細胞を移植したマウスは3~4週間で白血病細胞が全身に広がり死亡することを考えると,初期の腫瘍量の非常に多いモデルであるといえる.このプロトコールにおいて,第2世代のキメラ抗原受容体を導入したT細胞による治療では多くのマウスにおいて白血病の進展を十分に制御できなかったのに対し,新規のキメラ抗原受容体を導入したT細胞は再発を起こすことなく腫瘍細胞を良好に制御した.増殖の持続性について観察したところ,新規のキメラ抗原受容体を導入したT細胞は第2世代のキメラ抗原受容体を導入したT細胞と比較して末梢血に有意に多く認められ,このことがすぐれた抗腫瘍効果につながったと考えられた.同様の結果は,患者に由来するB細胞性白血病細胞,および,メラノーマ細胞株であるA375細胞にCD19を導入した固形がんのモデルにおいても確認された.これらのことから,新規に開発されたキメラ抗原受容体を導入したT細胞はin vivoにおいて既存のキメラ抗原受容体発現T細胞と比較してより有効に機能することが示された.一方で,キメラ抗原受容体発現T細胞の増殖にともないマウスの血清に分泌されるインターフェロンγなどのサイトカインの量も増加しており,キメラ抗原受容体発現T細胞療法においてもっとも重篤な副作用のひとつであるサイトカイン放出症候群の発症については注意が必要であろう10).
この研究において新規に開発されたキメラ抗原受容体のデザインは,単鎖可変領域の部分を変えることによりほかの抗原を標的としたキメラ抗原受容体にも応用することができる.おもに固形がんに対するCD19以外の抗原を標的としたキメラ抗原受容体発現T細胞においては有望な成績が得られていないため,この新規のキメラ抗原受容体が治療効果の改善につながるかどうか,今後,さらに検証する予定である.
略歴:2013年 東京大学大学院医学系研究科博士課程 修了,同年 同 助教を経て,2014年よりカナダPrincess Margaret Cancer Centre博士研究員.
研究テーマ:T細胞によるがんの免疫療法.
抱負:がんの治療への応用を意識した免疫学の研究にたずさわりたい.
平野 直人(Naoto Hirano)
カナダPrincess Margaret Cancer CentreにてSenior Scientist.
研究室URL:https://www.uhnresearch.ca/researcher/naoto-hirano
© 2018 籠谷勇紀・平野直人 Licensed under CC 表示 2.1 日本
(カナダPrincess Margaret Cancer Centre,Tumor Immunotherapy Program)
email:平野直人
DOI: 10.7875/first.author.2018.026
A novel chimeric antigen receptor containing a JAK-STAT signaling domain mediates superior antitumor effects.
Yuki Kagoya, Shinya Tanaka, Tingxi Guo, Mark Anczurowski, Chung-Hsi Wang, Kayoko Saso, Marcus O. Butler, Mark D. Minden, Naoto Hirano
Nature Medicine, 24, 352-359 (2018)
要 約
CD19を標的としたキメラ抗原受容体を導入したT細胞が再発性かつ難治性のB細胞性腫瘍に対しいちじるしい効果を示すことが注目されている.一方で,そのほかの悪性腫瘍に対するキメラ抗原受容体発現T細胞療法は現在までに臨床において十分な効果が得られておらず,さらなる改良を必要とするのが現状である.この研究において,筆者らは,T細胞の機能において重要なサイトカインシグナルを活性化するドメインを組み込んだ新たなキメラ抗原受容体を開発した.この新規のキメラ抗原受容体を導入したT細胞においては,抗原の刺激に依存してJAK-STATシグナル伝達経路が活性化し,複数のB細胞性腫瘍のモデルにおいて既存のキメラ抗原受容体を導入したT細胞と比較してすぐれた抗腫瘍効果を示すことが確認された.この新規のキメラ抗原受容体のデザインはあらゆる抗原に対するキメラ抗原受容体において応用が可能であり,固形がんに対するキメラ抗原受容体発現T細胞療法の成績を向上させられる可能性がある.
はじめに
養子免疫療法は体外において腫瘍細胞を認識するT細胞を準備し,これを培養により増幅させたうえで患者に注入することにより腫瘍細胞を特異的に攻撃する免疫療法のひとつであり,進行期の悪性腫瘍において治癒をめざすことのできる有望な治療法である1).抗腫瘍性のT細胞については,もともと体内に存在するものを増幅させる手法もあるが,近年の遺伝子改変技術の進歩にともない,腫瘍のもつ抗原を特異的に認識するT細胞受容体あるいはキメラ抗原受容体(chimeric antigen receptor:CAR)をT細胞に導入する手法が普及している.とりわけ近年,B細胞性腫瘍に発現するCD19を標的とするキメラ抗原受容体を導入したT細胞による治療において非常に有望な成績が報告され,2017年には,一部のB細胞性腫瘍に対する治療法として米国食品医薬品局に認可されるにいたった2).一方,CD19以外のさまざまな抗原を認識するキメラ抗原受容体もあいついで開発されたが,これらはin vitroにおいては十分なエフェクター機能が得られたものの,実際の臨床試験においては良好な治療効果が得られていないのが現状である.一般に,養子免疫療法において治療の成否を決めるのは,注入されたT細胞の単発のエフェクター機能ではなく,患者の体内においてT細胞が増殖し持続できるかどうかであることがわかっている.CD19以外を標的とするキメラ抗原受容体を導入したT細胞ではin vivoにおける十分な増殖はみられておらず,これが不十分な治療成績の原因と考えられる.この研究において,筆者らは,T細胞の長期の生存に重要なサイトカインシグナルを活性化するドメインを組み込んだ新規のキメラ抗原受容体が,既存のキメラ抗原受容体と比べ,in vivoにおける長期の生存および抗腫瘍効果においてすぐれていることを示した.
なお,がんに対するキメラ抗原受容体発現T細胞療法については,保仙 直毅, 領域融合レビュー, 6, e005 (2017) も参照されたい.
1.JAK-STATシグナル伝達経路を活性化する新規のキメラ抗原受容体の開発
キメラ抗原受容体は,細胞の表面にある抗原認識部位と,細胞内にあるT細胞の活性化をひき起こすシグナル伝達部位の2つの部分に分けられる(図1).これにより腫瘍細胞に存在する抗原を特異的に認識し,T細胞の活性化およびエフェクター機能の誘導を1分子で行うことができる.ほとんどの場合,抗原の認識はモノクローナル抗体に由来する単鎖可変領域を組み込むことによりなされる.これは,抗体の軽鎖および重鎖の可変領域を数十アミノ酸残基のリンカーにより連結することで1本鎖にしたもので,通常のT細胞受容体とは異なり抗原をMHCの型によらず直接に認識できる.また,腫瘍細胞によっては免疫反応をのがれる機構のひとつとしてHLA分子の発現および抗原提示能の低下が起こることがあるため,これらの免疫逃避機構に関係なく用いられるという利点ももつ.
シグナル伝達にかかわる細胞内ドメインは,T細胞の活性化に重要な3つのシグナルと関連づけて考えることができる(図2).シグナル1は,MHCおよび抗原ペプチドがT細胞受容体と結合することにより活性化され,T細胞受容体-CD3複合体のサブユニットであるCD3ζなどがもつモチーフITAMを介してさまざまなリン酸化シグナルを惹起する.シグナル2は,CD28や4-1BBに代表される種々の共刺激分子と抗原提示細胞のリガンドとの結合により活性化され,T細胞の増殖およびエフェクター機能の増強に必要である.シグナル3はサイトカインにより活性化される.当初,設計されたキメラ抗原受容体においては,シグナル1を得るためCD3ζの細胞内ドメインを組み込んでいた.この第1世代のキメラ抗原受容体においては,in vitroにおいては抗原の認識にともなうエフェクター機能が十分に発揮されたものの,in vivoにおける持続的な抗腫瘍効果は得られなかった.この点を克服するため,共刺激分子によるシグナル2を組み込んだものが第2世代のキメラ抗原受容体である3,4).シグナル1とシグナル2にくわえ,T細胞の活性化,増殖,長期の生存に重要な役割をはたすのがサイトカインによるシグナル3である.とくにインターロイキン7,インターロイキン15,インターロイキン21のようにメモリーT細胞の分化にかかわるサイトカインのほか,エフェクター機能の活性化において重要なインターロイキン12を同時に発現させる試みがすでになされている5,6).しかしながら,この手法ではサイトカインシグナルを恒常的にT細胞に付与してしまうため,毒性の増幅が懸念される.
そこで,抗原の刺激に依存してサイトカインシグナルを活性化させる目的で,キメラ抗原受容体にインターロイキン2受容体β鎖を組み込んだ.多くの場合,サイトカイン受容体は複数のサブユニットからなる複合体であるが,これまでの研究により,インターロイキン2受容体β鎖は単独でもホモ二量体を形成しJAK-STATシグナル伝達経路を活性化することがわかっている.第2世代のキメラ抗原受容体のCD28ドメインとCD3ζドメインのあいだに,インターロイキン2受容体β鎖の細胞内ドメインのうちT細胞の増殖および生存に重要なシグナルであるJAK-STAT5シグナルの活性化に必要十分とされる部位7) を導入した(図1).これにくわえて,サイトカインのなかでもおもにインターロイキン21により活性化され,T細胞の長期の生存およびメモリーT細胞の分化に必要なSTAT3シグナルも同時に活性化する目的で,CD3ζドメインの末端にSTAT3結合モチーフ8) を導入した.この新規に開発されたキメラ抗原受容体をヒトの末梢血に由来するT細胞に導入し,CD19陽性白血病細胞株であるNALM-6細胞により刺激したところ,STAT3およびSTAT5のリン酸化がみられた.このJAK-STATシグナル伝達経路の活性化はCD19陰性の白血病細胞株であるK562細胞により刺激した際にはみられなかったことから,JAK-STATシグナル伝達経路の活性化は抗原の刺激に依存することが確認された.
2.新規のキメラ抗原受容体を導入したT細胞のin vitroにおける機能の解析
この新規に開発されたキメラ抗原受容体を導入したT細胞をNALM-6細胞により刺激したところ,第2世代のキメラ抗原受容体を導入したT細胞と比較して,増殖能にすぐれており,これは細胞分裂の亢進および刺激にともなう細胞死の低下の両方に起因していた.STAT3あるいはSTAT5の特異的な阻害剤を投与すると増殖能が有意に低下したことから,これらのシグナル伝達経路の活性化が増殖の促進に寄与することがわかった.また,新規のキメラ抗原受容体を導入したT細胞を増殖させたのち細胞表面マーカーを解析したところ,第2世代のキメラ抗原受容体を導入したT細胞と比較して,メモリーT細胞のなかでもより未分化な画分9) が維持されていた.これらは,インターロイキン7やインターロイキン21などメモリーT細胞の分化に重要なサイトカインを投与することにより得られる性質と類似しており,この画分のT細胞はより分化が進んだT細胞と比較して長期の生存能にすぐれていることが知られている.
新規のキメラ抗原受容体を導入したT細胞をNALM-6細胞により刺激したのち遺伝子の発現プロファイルを解析したところ,インターロイキン21あるいはSTAT3の活性化により誘導される遺伝子の発現の上昇がみられた.発現レベルが上昇している遺伝子には,メモリーT細胞の分化に必要な転写因子をコードする遺伝子にくわえ,エフェクター分子をコードする複数の遺伝子も含まれていた.腫瘍細胞に対する細胞傷害活性については,第2世代のキメラ抗原受容体を導入したT細胞と比較して有意な差は認められなかったが,腫瘍細胞をキメラ抗原受容体発現T細胞に連続的に曝露させると,第2世代のキメラ抗原受容体を導入したT細胞においては徐々に細胞傷害活性が低下したのに対し,新規のキメラ抗原受容体を導入したT細胞においてはほぼ同等の細胞傷害活性が維持されていた.
以上のことから,新規に開発されたキメラ抗原受容体を導入したT細胞は,抗原の刺激に対するJAK-STATシグナル伝達経路の活性化により,増殖能および未分化なメモリーT細胞の画分の維持においてすぐれており,また,これらの性質にともない,連続的な抗原の刺激に対しても良好なエフェクター機能を維持することがわかった.
3.新規のキメラ抗原受容体を導入したT細胞のin vivoにおける抗腫瘍効果の解析
免疫機能を欠損するためヒトの細胞が生着できるNSGマウスにNALM-6細胞を移植したのち,キメラ抗原受容体発現T細胞により治療するモデルを用いた.このNALM-6細胞にはルシフェラーゼ遺伝子が導入されており,腫瘍の局在および量をイメージング装置により定量的に可視化できる.5×106個のNALM-6細胞を移植し,2週間後にキメラ抗原受容体発現T細胞による治療をはじめた.NALM-6細胞を移植したマウスは3~4週間で白血病細胞が全身に広がり死亡することを考えると,初期の腫瘍量の非常に多いモデルであるといえる.このプロトコールにおいて,第2世代のキメラ抗原受容体を導入したT細胞による治療では多くのマウスにおいて白血病の進展を十分に制御できなかったのに対し,新規のキメラ抗原受容体を導入したT細胞は再発を起こすことなく腫瘍細胞を良好に制御した.増殖の持続性について観察したところ,新規のキメラ抗原受容体を導入したT細胞は第2世代のキメラ抗原受容体を導入したT細胞と比較して末梢血に有意に多く認められ,このことがすぐれた抗腫瘍効果につながったと考えられた.同様の結果は,患者に由来するB細胞性白血病細胞,および,メラノーマ細胞株であるA375細胞にCD19を導入した固形がんのモデルにおいても確認された.これらのことから,新規に開発されたキメラ抗原受容体を導入したT細胞はin vivoにおいて既存のキメラ抗原受容体発現T細胞と比較してより有効に機能することが示された.一方で,キメラ抗原受容体発現T細胞の増殖にともないマウスの血清に分泌されるインターフェロンγなどのサイトカインの量も増加しており,キメラ抗原受容体発現T細胞療法においてもっとも重篤な副作用のひとつであるサイトカイン放出症候群の発症については注意が必要であろう10).
おわりに
この研究において新規に開発されたキメラ抗原受容体のデザインは,単鎖可変領域の部分を変えることによりほかの抗原を標的としたキメラ抗原受容体にも応用することができる.おもに固形がんに対するCD19以外の抗原を標的としたキメラ抗原受容体発現T細胞においては有望な成績が得られていないため,この新規のキメラ抗原受容体が治療効果の改善につながるかどうか,今後,さらに検証する予定である.
文 献
- Restifo, N. P., Dudley, M. E. & Rosenberg, S. A.: Adoptive immunotherapy for cancer: harnessing the T cell response. Nat. Rev. Immunol., 12, 269-281 (2012)[PubMed]
- Schuster, S. J., Svoboda, J., Chong, E .A. et al.: Chimeric antigen receptor T cells in refractory B-cell lymphomas. N. Engl. J. Med., 377, 2545-2554 (2017)[PubMed]
- Maher, J., Brentjens, R. J., Gunset, G. et al.: Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRζ/CD28 receptor. Nat. Biotechnol., 20, 70-75 (2002)[PubMed]
- Milone, M. C., Fish, J. D., Carpenito, C. et al.: Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo. Mol. Ther., 17, 1453-1464 (2009)[PubMed]
- Markley, J. C. & Sadelain, M.: IL-7 and IL-21 are superior to IL-2 and IL-15 in promoting human T cell-mediated rejection of systemic lymphoma in immunodeficient mice. Blood, 115, 3508-3519 (2010)[PubMed]
- Pegram, H. J., Lee, J. C., Hayman, E. G. et al.: Tumor-targeted T cells modified to secrete IL-12 eradicate systemic tumors without need for prior conditioning. Blood, 119, 4133-4141 (2012)[PubMed]
- Delespine-Carmagnat, M., Bouvier, G., Bertoglio, J.: Association of STAT1, STAT3 and STAT5 proteins with the IL-2 receptor involves different subdomains of the IL-2 receptor beta chain. Eur. J. Immunol., 30, 59-68 (2000)[PubMed]
- Stahl, N., Farruggella, T. J., Boulton, T. G. et al.: Choice of STATs and other substrates specified by modular tyrosine-based motifs in cytokine receptors. Science, 267, 1349-1353 (1995)[PubMed]
- Gattinoni, L., Lugli, E., Ji, Y. et al.: A human memory T cell subset with stem cell-like properties. Nat. Med., 17, 1290-1297 (2011)[PubMed]
- Teachey, D. T., Lacey, S. F., Shaw, P. A. et al.: Identification of predictive biomarkers for cytokine release syndrome after chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Cancer Discov., 6, 664-679 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2013年 東京大学大学院医学系研究科博士課程 修了,同年 同 助教を経て,2014年よりカナダPrincess Margaret Cancer Centre博士研究員.
研究テーマ:T細胞によるがんの免疫療法.
抱負:がんの治療への応用を意識した免疫学の研究にたずさわりたい.
平野 直人(Naoto Hirano)
カナダPrincess Margaret Cancer CentreにてSenior Scientist.
研究室URL:https://www.uhnresearch.ca/researcher/naoto-hirano
© 2018 籠谷勇紀・平野直人 Licensed under CC 表示 2.1 日本