間期のクロマチンから棒状の分裂期染色体に構造が変換されるしくみ
鮫島 久美子
(英国Edinburgh大学Wellcome Centre for Cell Biology,Chromosome Structure Laboratory)
email:鮫島久美子
DOI: 10.7875/first.author.2018.021
A pathway for mitotic chromosome formation.
Johan H. Gibcus, Kumiko Samejima, Anton Goloborodko, Itaru Samejima, Natalia Naumova, Johannes Nuebler, Masato T. Kanemaki, Linfeng Xie, James R. Paulson, William C. Earnshaw, Leonid A. Mirny, Job Dekker
Science, 359, eaao6135 (2018)
細胞が分裂する際にはクロマチンは凝縮し棒状の染色体を形成する.この研究において,筆者らは,このダイナミックな構造の変化のしくみについて明らかにするため,同調培養したニワトリのDT40細胞を用い,分裂期染色体の構造の形成の過程を分単位でとらえ,顕微鏡による観察,Hi-C法,シミュレーションとモデリングを組み合わせた解析により,以下のことを明らかにした.コンパートメントやトポロジカルドメインといった間期に特有のクロマチンの構造は分裂期前期に消失するとともに,60 kbの長さのクロマチンのループが数珠つなぎに形成された.この2つの構造の変化にはコンデンシンが必要であった.分裂期前中期において,クロマチンは400 kbの長さの大ループおよび大ループの内側の80 kbの長さの小ループの2層からなる構造をとった.ループの根元にあるコンデンシンが染色体の長軸にそってらせん状にならぶことにより,クロマチンのループはらせん軸のまわりに階段状に配置された.コンデンシンIは大ループを分割する小ループの形成に,コンデンシンIIは大ループの根元にあってらせん軸の形成に必須であり,コンデンシンIとコンデンシンIIはおのおの異なる役割をはたしていた.分裂期前中期の進行にともない,らせん1周あたりのループの数および長さが増加することにより,らせん1周あたりのクロマチンの長さも3 Mbpから12 Mbpへと増加した.このことから,時間の経過につれて染色体の幅が太く長軸が短くなる現象が説明された.このように,この“らせん階段モデル”により,染色体の高次構造のみならず形状の変化のしくみも説明された.
細胞が分裂する際の染色体の凝縮および姉妹染色分体の分離の過程は,19世紀末にはじめて詳細に記載された1).以降,分裂期染色体をかたちづくるクロマチンの構造については,階層的折りたたみモデル2),放射状ループモデル3) など,さまざまなモデルが提唱されてきた.しかし,クロマチンは高度に凝縮しているため,顕微鏡による解析だけでは染色体の高次構造を確定することはむずかしかった.近年,開発された3C(chromosome conformation capture)法およびその発展型であるHi-C法により,ゲノム配列においては離れていても空間的には近接するクロマチンの領域をゲノムワイドに決定することが可能になった4).そして,動物細胞の間期の核において,クロマチンは染色体テリトリー,コンパートメント,トポロジカルドメインなどの階層的な高次構造をとることが明らかにされた.一方,分裂期染色体においてそのような高次構造は存在せず,ゲノム配列に非特異的に形成されたクロマチンのループがコンデンシンなどからなる中心軸のまわりに連続して存在することにより棒状の染色体が形成されると提唱された5).しかし,間期におけるクロマチンの高次構造が分裂期染色体の構造に変化する過程は謎のままであった.また,分裂期染色体の構造に関しては,1970年代より,形態の保持にコンデンシンをはじめとした不溶性の非ヒストンタンパク質が必須なことが知られていたが,おのおののタンパク質の役割については不明な点が多かった6).この研究において,筆者らは,学際的な共同研究により,130年以上にわたり多くの科学者たちが取り組んできた分裂期染色体の構造の形成の謎に答える“らせん階段モデル”を提唱し,また,コンデンシンIとコンデンシンIIのおのおの異なる役割について明らかにした.
分裂期染色体の形成の機構を解明するためには,G2期,分裂期前期,分裂期前中期の前半および後半と移り変わるおのおのの時期においてクロマチンの構造を解析する必要があった.Hi-C法は1検体につき最低でも80%の細胞の細胞周期が同調している107個の細胞を必要とする.動物細胞を用いた実験では微小管脱重合剤であるノコダゾールなどを用いて細胞を分裂期に同調させることが多い.しかし,この方法で得られる細胞は分裂期前中期に集積したものが多く,分裂期前期に同調させることはできない.さらに,ノコダゾールを長期間にわたり処理した細胞は染色体の過凝縮を示すため,染色体の本来の構造とは異なっている可能性もあった.また,エルトリエーション法やチミジンブロック法では80%の細胞を分裂期前期あるいは分裂期前中期に同調させることはむずかしい.そこで,細胞が分裂期に移行するにはサイクリン依存性キナーゼ1の活性が必須であることに注目し,内在性のサイクリン依存性キナーゼ1をATPアナログにより特異的に阻害できる変異体と置換した細胞を利用した7).この細胞を細胞周期の1周期にあたる10時間にわたりATPアナログにより処理することですべての細胞をG2期後期に同調させ,ATPアナログを除きサイクリン依存性キナーゼ1を活性化したのち2.5分ごとに細胞を回収することにより,G2期から分裂期前中期の後半までのおのおののステージの細胞が得られた.ニワトリのDT40細胞は,この方法により非常によく同調して分裂期に移行した.また,サイクリン依存性キナーゼ1の変異体の導入および内在性のサイクリン依存性キナーゼ1のノックアウトにおいては,CRISPR-Cas9系によるゲノム編集および2Aペプチドが有効であった.
ヒトおよびニワトリの細胞はコンデンシンIおよびコンデンシンIIを発現する.分裂期染色体の構造の形成においては,コンデンシンIおよびコンデンシンIIは重複する機能をもつだけでなく,独自の機能ももつことが知られている.しかし,そのしくみあるいは関係についてはよくわからないことが多い.高等真核生物において,必須の遺伝子あるいはタンパク質の機能解析のためにはコンディショナルノックアウトやsiRNAを用いたノックダウンを利用することが多い.しかし,これらの方法では標的となるタンパク質は細胞周期の1周期より長い時間をへて徐々に細胞から失われるため,表現型を適確に解析することは困難であり,たとえば,標的となるタンパク質の減少にともなう一次的な表現型と二次的な表現型とを区別することや,細胞分裂のある時期に特有の機能を特定することはむずかしい.そこで,コンデンシンのサブユニットを短時間で除去するため,オーキシン誘導デグロン法を用いた8).コンデンシンIとコンデンシンIIの共通のサブユニットであるSMC2,コンデンシンIに特有のサブユニットであるCAP-H,コンデンシンIIに特有のサブユニットであるCAP-H2に,AIDタグおよびGFPタグを付加した細胞を作製し,さらに,サイクリン依存性キナーゼ1変異体を用いた細胞同調の系をも導入した.オーキシンの添加ののち1~2時間でAIDタグを付加したタンパク質はプロテアソームにより分解された.残存したSMC2の量は両者ともほぼ同じであったが,オーキシン誘導デグロン法によりSMC2を除去した細胞はSMC2をコンディショナルノックアウトした細胞に比べて,より強い表現型を示した9).同様に,CAP-HおよびCAP-H2についても,オーキシン誘導デグロン法により除去した細胞のほうがコンディショナルノックアウトした細胞より強い表現型を示した.
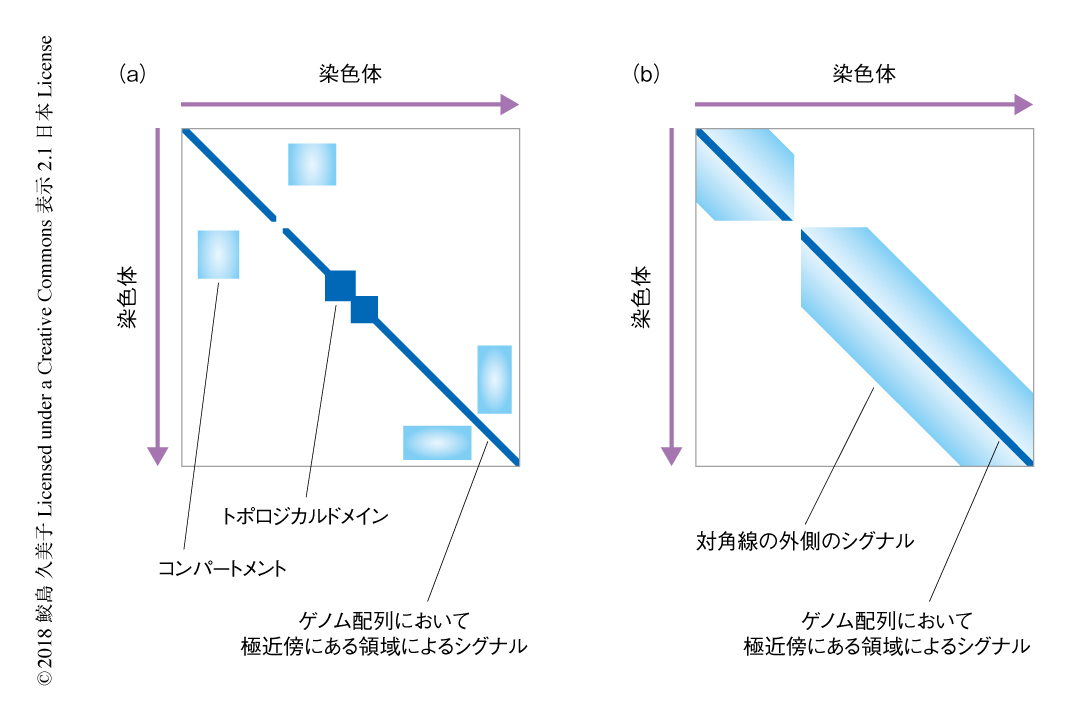
Hi-C法により得られるコンタクトマップにおいて,ゲノムの2つの領域が近接する確率が高い場合は濃いシグナルとして示される.ゲノム配列において極近傍にある領域は空間的に近接することが多いので,コンタクトマップの対角線上には濃いシグナルが生じる.間期の細胞のコンタクトマップにおいては,全体に網目状のシグナルがみられた(図1a).これらのシグナルは,コンパートメントやトポロジカルドメインなど,ゲノム配列においては離れていても空間的には近接している確率の高い部位を示す.この間期に特有の網目状のシグナルは,分裂期前期のおわりごろにはほぼ消失した(図1b).さらに,同じ時期に染色体の全体に単層のループが出現することが示唆された.このループの長さは40~50 kbから60~70 kbと徐々に大きくなった.そして,シミュレーションにより,このループの空間配置はランダムではなく規則的な関係にあることが示された.
コンデンシンを除去した細胞において,分裂期前期に移行しても顕微鏡による観察ではクロマチンは間期と同様に核に分散するようにみえることが知られている.さらに,G2期に同調した細胞においてコンデンシンIおよびコンデンシンIIを除去した場合,分裂期前中期においてクロマチンは凝縮し全体の容積は縮小したが,棒状の染色体は形成されなかった9).さらに,分裂期前期だけでなく分裂期前中期に移行しても,Hi-C法による解析では間期に特有の染色体の構造はほぼ保持されていた.染色体に結合するコヒーシンやCTCFの量は分裂期に入ると減少するが,コンデンシンIおよびコンデンシンIIを除去した場合,その減少の割合は低下した.コンデンシンをもたない染色体においてコヒーシンやCTCFの量が多いことは,分裂期に移行したのちにも間期に特有の構造を維持するのに役だつと考えられた.以上により,コンデンシンは分裂期染色体の構造および棒状の染色体の形成に必要なだけでなく,間期に特有の構造からの脱却に必要なことが示唆された.
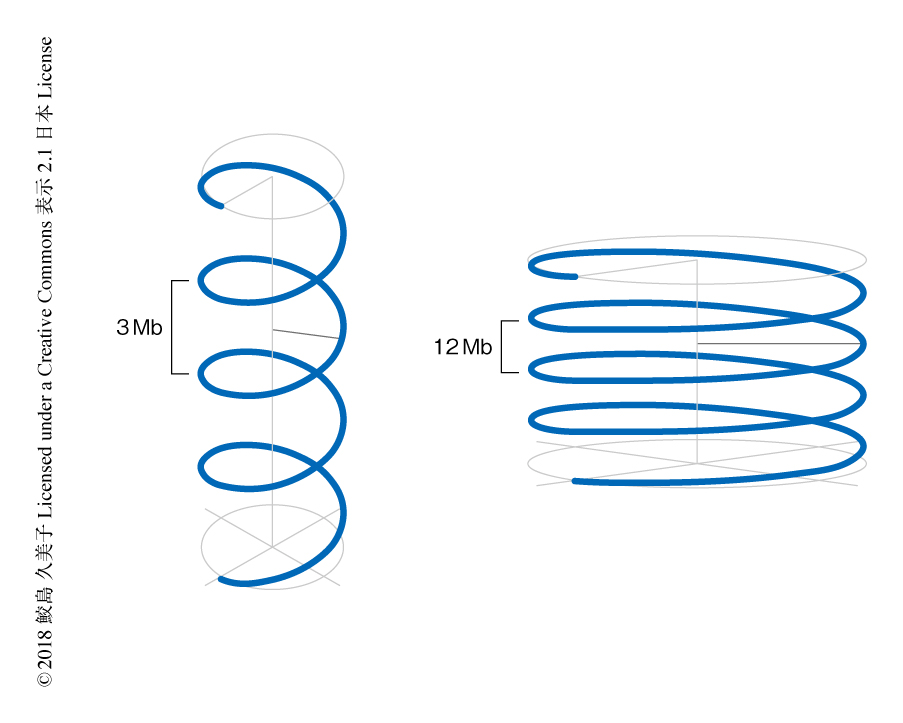
分裂期前中期に移行した細胞のコンタクトマップには,対角線上の濃いシグナルの外側に,新たに対角線と平行のシグナルが現われた(図1b).これは,ゲノム配列において一定の距離にあるクロマチンが空間的に近接する確率が高いこと,そして,この構造は塩基配列に非特異的であることを示す.時間の経過につれて,対角線の外側のシグナルは対角線から離れたことから,空間的に隣接するゲノム配列における距離が3 Mbpから12 Mbpと大きくなったことが示された.この現象は,クロマチンが全体としてらせん構造をとること,時間の経過とともにらせん1周あたりのDNAの量が増加してらせんの半径が大きくなることにより説明された(図2).
クロマチンがらせん構造をとる場合,全体がソレノイド状の形状をとるタイプ(ソレノイドモデル,あるいは,外側らせんモデル),および,ループの根元にある中心軸それ自体がらせん状になりそのまわりをクロマチンのループが階段状に位置するタイプ(らせん階段モデル,あるいは,内側らせんモデル)の2つの可能性があった.Hi-C法により得られたデータにもとづくシミュレーションによるモデリング,および,顕微鏡による観察によるDNAおよびコンデンシンの形状の解析は,らせん階段モデルとよく一致した.さらに,分裂期前中期においてクロマチンは400 kbの長さの大ループおよび大ループを分割する80 kbの長さの小ループの2層からなる構造をとること,ループの根元にあるコンデンシンは染色体の長軸にそってらせん状にならび,クロマチンのループはらせん軸のまわりに階段状に配置されることが示唆された.
コンデンシンIのみ,あるいは,コンデンシンIIのみを除去した場合,棒状に近い染色体は形成されたものの,それぞれ,異なる形状を示すとともに,コンタクトマップにおいても特徴的な違いがみられた.コンデンシンIを除去した場合,顕微鏡による観察およびHi-C法による解析により,分裂期前期におけるクロマチンの変化は野生型と同様に起こったことが明らかにされた.しかし,分裂期前中期においては染色体の幅が通常より太くなり,コンタクトマップの対角線の外側のシグナルは対角線からより離れて現われた.これは,コンデンシンIが60~80 kbの小さいループには必須であるが200~400 kbの大きいループおよびらせん階段状の構造には不要であることにより説明された.一方,コンデンシンIIを除去した場合,分裂期前中期において通常より細長い染色体が観察された.コンタクトマップは分裂期前期と変わらず,対角線の外側のシグナルは現われなかった.このことから,コンデンシンIIを除去した場合,染色体は分裂期前中期になっても分裂期前期のように単層のループが密集した状態を維持し,らせん階段状の構造は形成しないことが示唆された.
分裂期染色体の構造が形成されるモデルを示す動画(リンク)が公開されているので,参照されたい.
筆者にとり,専門分野の異なる科学者たちとの議論は得がたい経験であった.間期のクロマチンから分裂期染色体にいたるまでその刻々と変わる形状の変化のしくみが説明されたのは,細胞周期を分単位で分裂期に同調させた細胞を,顕微鏡による観察,Hi-C法,シミュレーションとモデリング,といったさまざまな手法を組み合わせて解析したからであろう.一方,筆者らが提唱した分裂期染色体の“らせん階段モデル”は,先人たちによる多くの研究をベースにし,また,放射状ループモデルやらせん状モデルなどを統合したものであるといえる.このらせん階段モデルは,コンデンシンIとコンデンシンIIの個別の役割を明らかにするのに役だったように,今後,染色体の構造の形成におけるコンデンシン,トポイソメラーゼIIα,KIF4などの分子機構を解明していくうえで基礎になると思われる.クロマチンのループが形成される機構や分裂期後期における構造の変化の機構などさまざまな疑問が残されており,今後もホットな研究のつづくことが期待される.
略歴:2000年 英国Edinburgh大学にてPh.D取得,同年より同 博士研究員.
研究テーマ:細胞分裂の際の染色体の形成および分配の機構.
抱負:ゲノム編集技術を使ってユニークな研究をしたい.
© 2018 鮫島 久美子 Licensed under CC 表示 2.1 日本
(英国Edinburgh大学Wellcome Centre for Cell Biology,Chromosome Structure Laboratory)
email:鮫島久美子
DOI: 10.7875/first.author.2018.021
A pathway for mitotic chromosome formation.
Johan H. Gibcus, Kumiko Samejima, Anton Goloborodko, Itaru Samejima, Natalia Naumova, Johannes Nuebler, Masato T. Kanemaki, Linfeng Xie, James R. Paulson, William C. Earnshaw, Leonid A. Mirny, Job Dekker
Science, 359, eaao6135 (2018)
要 約
細胞が分裂する際にはクロマチンは凝縮し棒状の染色体を形成する.この研究において,筆者らは,このダイナミックな構造の変化のしくみについて明らかにするため,同調培養したニワトリのDT40細胞を用い,分裂期染色体の構造の形成の過程を分単位でとらえ,顕微鏡による観察,Hi-C法,シミュレーションとモデリングを組み合わせた解析により,以下のことを明らかにした.コンパートメントやトポロジカルドメインといった間期に特有のクロマチンの構造は分裂期前期に消失するとともに,60 kbの長さのクロマチンのループが数珠つなぎに形成された.この2つの構造の変化にはコンデンシンが必要であった.分裂期前中期において,クロマチンは400 kbの長さの大ループおよび大ループの内側の80 kbの長さの小ループの2層からなる構造をとった.ループの根元にあるコンデンシンが染色体の長軸にそってらせん状にならぶことにより,クロマチンのループはらせん軸のまわりに階段状に配置された.コンデンシンIは大ループを分割する小ループの形成に,コンデンシンIIは大ループの根元にあってらせん軸の形成に必須であり,コンデンシンIとコンデンシンIIはおのおの異なる役割をはたしていた.分裂期前中期の進行にともない,らせん1周あたりのループの数および長さが増加することにより,らせん1周あたりのクロマチンの長さも3 Mbpから12 Mbpへと増加した.このことから,時間の経過につれて染色体の幅が太く長軸が短くなる現象が説明された.このように,この“らせん階段モデル”により,染色体の高次構造のみならず形状の変化のしくみも説明された.
はじめに
細胞が分裂する際の染色体の凝縮および姉妹染色分体の分離の過程は,19世紀末にはじめて詳細に記載された1).以降,分裂期染色体をかたちづくるクロマチンの構造については,階層的折りたたみモデル2),放射状ループモデル3) など,さまざまなモデルが提唱されてきた.しかし,クロマチンは高度に凝縮しているため,顕微鏡による解析だけでは染色体の高次構造を確定することはむずかしかった.近年,開発された3C(chromosome conformation capture)法およびその発展型であるHi-C法により,ゲノム配列においては離れていても空間的には近接するクロマチンの領域をゲノムワイドに決定することが可能になった4).そして,動物細胞の間期の核において,クロマチンは染色体テリトリー,コンパートメント,トポロジカルドメインなどの階層的な高次構造をとることが明らかにされた.一方,分裂期染色体においてそのような高次構造は存在せず,ゲノム配列に非特異的に形成されたクロマチンのループがコンデンシンなどからなる中心軸のまわりに連続して存在することにより棒状の染色体が形成されると提唱された5).しかし,間期におけるクロマチンの高次構造が分裂期染色体の構造に変化する過程は謎のままであった.また,分裂期染色体の構造に関しては,1970年代より,形態の保持にコンデンシンをはじめとした不溶性の非ヒストンタンパク質が必須なことが知られていたが,おのおののタンパク質の役割については不明な点が多かった6).この研究において,筆者らは,学際的な共同研究により,130年以上にわたり多くの科学者たちが取り組んできた分裂期染色体の構造の形成の謎に答える“らせん階段モデル”を提唱し,また,コンデンシンIとコンデンシンIIのおのおの異なる役割について明らかにした.
1.分裂期の開始を同調させる系の構築
分裂期染色体の形成の機構を解明するためには,G2期,分裂期前期,分裂期前中期の前半および後半と移り変わるおのおのの時期においてクロマチンの構造を解析する必要があった.Hi-C法は1検体につき最低でも80%の細胞の細胞周期が同調している107個の細胞を必要とする.動物細胞を用いた実験では微小管脱重合剤であるノコダゾールなどを用いて細胞を分裂期に同調させることが多い.しかし,この方法で得られる細胞は分裂期前中期に集積したものが多く,分裂期前期に同調させることはできない.さらに,ノコダゾールを長期間にわたり処理した細胞は染色体の過凝縮を示すため,染色体の本来の構造とは異なっている可能性もあった.また,エルトリエーション法やチミジンブロック法では80%の細胞を分裂期前期あるいは分裂期前中期に同調させることはむずかしい.そこで,細胞が分裂期に移行するにはサイクリン依存性キナーゼ1の活性が必須であることに注目し,内在性のサイクリン依存性キナーゼ1をATPアナログにより特異的に阻害できる変異体と置換した細胞を利用した7).この細胞を細胞周期の1周期にあたる10時間にわたりATPアナログにより処理することですべての細胞をG2期後期に同調させ,ATPアナログを除きサイクリン依存性キナーゼ1を活性化したのち2.5分ごとに細胞を回収することにより,G2期から分裂期前中期の後半までのおのおののステージの細胞が得られた.ニワトリのDT40細胞は,この方法により非常によく同調して分裂期に移行した.また,サイクリン依存性キナーゼ1の変異体の導入および内在性のサイクリン依存性キナーゼ1のノックアウトにおいては,CRISPR-Cas9系によるゲノム編集および2Aペプチドが有効であった.
2.オーキシン誘導デグロン法によりコンデンシンを短時間で除去する系の構築
ヒトおよびニワトリの細胞はコンデンシンIおよびコンデンシンIIを発現する.分裂期染色体の構造の形成においては,コンデンシンIおよびコンデンシンIIは重複する機能をもつだけでなく,独自の機能ももつことが知られている.しかし,そのしくみあるいは関係についてはよくわからないことが多い.高等真核生物において,必須の遺伝子あるいはタンパク質の機能解析のためにはコンディショナルノックアウトやsiRNAを用いたノックダウンを利用することが多い.しかし,これらの方法では標的となるタンパク質は細胞周期の1周期より長い時間をへて徐々に細胞から失われるため,表現型を適確に解析することは困難であり,たとえば,標的となるタンパク質の減少にともなう一次的な表現型と二次的な表現型とを区別することや,細胞分裂のある時期に特有の機能を特定することはむずかしい.そこで,コンデンシンのサブユニットを短時間で除去するため,オーキシン誘導デグロン法を用いた8).コンデンシンIとコンデンシンIIの共通のサブユニットであるSMC2,コンデンシンIに特有のサブユニットであるCAP-H,コンデンシンIIに特有のサブユニットであるCAP-H2に,AIDタグおよびGFPタグを付加した細胞を作製し,さらに,サイクリン依存性キナーゼ1変異体を用いた細胞同調の系をも導入した.オーキシンの添加ののち1~2時間でAIDタグを付加したタンパク質はプロテアソームにより分解された.残存したSMC2の量は両者ともほぼ同じであったが,オーキシン誘導デグロン法によりSMC2を除去した細胞はSMC2をコンディショナルノックアウトした細胞に比べて,より強い表現型を示した9).同様に,CAP-HおよびCAP-H2についても,オーキシン誘導デグロン法により除去した細胞のほうがコンディショナルノックアウトした細胞より強い表現型を示した.
3.分裂期前期において間期に特有の構造はコンデンシンに依存的に消失する
Hi-C法により得られるコンタクトマップにおいて,ゲノムの2つの領域が近接する確率が高い場合は濃いシグナルとして示される.ゲノム配列において極近傍にある領域は空間的に近接することが多いので,コンタクトマップの対角線上には濃いシグナルが生じる.間期の細胞のコンタクトマップにおいては,全体に網目状のシグナルがみられた(図1a).これらのシグナルは,コンパートメントやトポロジカルドメインなど,ゲノム配列においては離れていても空間的には近接している確率の高い部位を示す.この間期に特有の網目状のシグナルは,分裂期前期のおわりごろにはほぼ消失した(図1b).さらに,同じ時期に染色体の全体に単層のループが出現することが示唆された.このループの長さは40~50 kbから60~70 kbと徐々に大きくなった.そして,シミュレーションにより,このループの空間配置はランダムではなく規則的な関係にあることが示された.
コンデンシンを除去した細胞において,分裂期前期に移行しても顕微鏡による観察ではクロマチンは間期と同様に核に分散するようにみえることが知られている.さらに,G2期に同調した細胞においてコンデンシンIおよびコンデンシンIIを除去した場合,分裂期前中期においてクロマチンは凝縮し全体の容積は縮小したが,棒状の染色体は形成されなかった9).さらに,分裂期前期だけでなく分裂期前中期に移行しても,Hi-C法による解析では間期に特有の染色体の構造はほぼ保持されていた.染色体に結合するコヒーシンやCTCFの量は分裂期に入ると減少するが,コンデンシンIおよびコンデンシンIIを除去した場合,その減少の割合は低下した.コンデンシンをもたない染色体においてコヒーシンやCTCFの量が多いことは,分裂期に移行したのちにも間期に特有の構造を維持するのに役だつと考えられた.以上により,コンデンシンは分裂期染色体の構造および棒状の染色体の形成に必要なだけでなく,間期に特有の構造からの脱却に必要なことが示唆された.
4.分裂期中期における染色体の構造
分裂期前中期に移行した細胞のコンタクトマップには,対角線上の濃いシグナルの外側に,新たに対角線と平行のシグナルが現われた(図1b).これは,ゲノム配列において一定の距離にあるクロマチンが空間的に近接する確率が高いこと,そして,この構造は塩基配列に非特異的であることを示す.時間の経過につれて,対角線の外側のシグナルは対角線から離れたことから,空間的に隣接するゲノム配列における距離が3 Mbpから12 Mbpと大きくなったことが示された.この現象は,クロマチンが全体としてらせん構造をとること,時間の経過とともにらせん1周あたりのDNAの量が増加してらせんの半径が大きくなることにより説明された(図2).
クロマチンがらせん構造をとる場合,全体がソレノイド状の形状をとるタイプ(ソレノイドモデル,あるいは,外側らせんモデル),および,ループの根元にある中心軸それ自体がらせん状になりそのまわりをクロマチンのループが階段状に位置するタイプ(らせん階段モデル,あるいは,内側らせんモデル)の2つの可能性があった.Hi-C法により得られたデータにもとづくシミュレーションによるモデリング,および,顕微鏡による観察によるDNAおよびコンデンシンの形状の解析は,らせん階段モデルとよく一致した.さらに,分裂期前中期においてクロマチンは400 kbの長さの大ループおよび大ループを分割する80 kbの長さの小ループの2層からなる構造をとること,ループの根元にあるコンデンシンは染色体の長軸にそってらせん状にならび,クロマチンのループはらせん軸のまわりに階段状に配置されることが示唆された.
5.コンデンシンIとコンデンシンIIの役割の違い
コンデンシンIのみ,あるいは,コンデンシンIIのみを除去した場合,棒状に近い染色体は形成されたものの,それぞれ,異なる形状を示すとともに,コンタクトマップにおいても特徴的な違いがみられた.コンデンシンIを除去した場合,顕微鏡による観察およびHi-C法による解析により,分裂期前期におけるクロマチンの変化は野生型と同様に起こったことが明らかにされた.しかし,分裂期前中期においては染色体の幅が通常より太くなり,コンタクトマップの対角線の外側のシグナルは対角線からより離れて現われた.これは,コンデンシンIが60~80 kbの小さいループには必須であるが200~400 kbの大きいループおよびらせん階段状の構造には不要であることにより説明された.一方,コンデンシンIIを除去した場合,分裂期前中期において通常より細長い染色体が観察された.コンタクトマップは分裂期前期と変わらず,対角線の外側のシグナルは現われなかった.このことから,コンデンシンIIを除去した場合,染色体は分裂期前中期になっても分裂期前期のように単層のループが密集した状態を維持し,らせん階段状の構造は形成しないことが示唆された.
分裂期染色体の構造が形成されるモデルを示す動画(リンク)が公開されているので,参照されたい.
おわりに
筆者にとり,専門分野の異なる科学者たちとの議論は得がたい経験であった.間期のクロマチンから分裂期染色体にいたるまでその刻々と変わる形状の変化のしくみが説明されたのは,細胞周期を分単位で分裂期に同調させた細胞を,顕微鏡による観察,Hi-C法,シミュレーションとモデリング,といったさまざまな手法を組み合わせて解析したからであろう.一方,筆者らが提唱した分裂期染色体の“らせん階段モデル”は,先人たちによる多くの研究をベースにし,また,放射状ループモデルやらせん状モデルなどを統合したものであるといえる.このらせん階段モデルは,コンデンシンIとコンデンシンIIの個別の役割を明らかにするのに役だったように,今後,染色体の構造の形成におけるコンデンシン,トポイソメラーゼIIα,KIF4などの分子機構を解明していくうえで基礎になると思われる.クロマチンのループが形成される機構や分裂期後期における構造の変化の機構などさまざまな疑問が残されており,今後もホットな研究のつづくことが期待される.
文 献
- Flemming, W.: Zellsubstantz, Kern und Zelltheilung. F. C. W. Vogel, Leipzig (1882)
- Sedat, J. & Manuelidis, L.: A direct approach to the structure of eukaryotic chromosomes. Cold Spring Harb. Symp. Quant. Biol., 42, 331-350 (1978)[PubMed]
- Paulson, J. R. & Laemmli, U. K.: The structure of histone-depleted metaphase chromosomes. Cell, 12, 817-828 (1977)[PubMed]
- Lieberman-Aiden, E., van Berkum, N. L., Williams, L. et al.: Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science, 326, 289-293 (2009)[PubMed]
- Naumova, N., Imakaev, M., Fudenberg, G. et al.: Organization of the mitotic chromosome. Science, 342, 948-953 (2013)[PubMed]
- Samejima, K., Samejima, I., Vagnarelli, P. et al.: Mitotic chromosomes are compacted laterally by KIF4 and condensin and axially by topoisomerase IIα. J. Cell Biol., 199, 755-770 (2012)[PubMed]
- Hochegger, H., Dejsuphong, D., Sonoda, E. et al.: An essential role for Cdk1 in S phase control is revealed via chemical genetics in vertebrate cells. J. Cell Biol., 178, 257-268 (2007)[PubMed]
- Nishimura, K., Fukagawa, T., Takisawa, H. et al.: An auxin-based degron system for the rapid depletion of proteins in nonplant cells. Nat. Methods, 6, 917-922 (2009)[PubMed]
- Samejima, K., Booth, D. G., Ogawa, H. et al.: Rapid degradation of condensins and 3D-EM reveal chromatin volume is uncoupled from chromosome architecture in mitosis. J. Cell Sci., 131, jcs.210187 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2000年 英国Edinburgh大学にてPh.D取得,同年より同 博士研究員.
研究テーマ:細胞分裂の際の染色体の形成および分配の機構.
抱負:ゲノム編集技術を使ってユニークな研究をしたい.
© 2018 鮫島 久美子 Licensed under CC 表示 2.1 日本