ロイコトリエンB4受容体の結晶構造から明らかにされたGタンパク質共役型受容体の内部におけるNa+-水分子クラスターの作用を模倣する低分子化合物
堀 哲哉・横山茂之
(理化学研究所 横山構造生物学研究室)
email:堀 哲哉,横山茂之
DOI: 10.7875/first.author.2018.013
Na+-mimicking ligands stabilize the inactive state of leukotriene B4 receptor BLT1.
Tetsuya Hori, Toshiaki Okuno, Kunio Hirata, Keitaro Yamashita, Yoshiaki Kawano, Masaki Yamamoto, Masakatsu Hato, Motonao Nakamura, Takao Shimizu, Takehiko Yokomizo, Masashi Miyano, Shigeyuki Yokoyama
Nature Chemical Biology, 14, 262-269 (2018)
不活性な状態のGタンパク質共役型受容体において膜貫通ヘリックス束の内部にはNa+-水分子クラスターが結合し,その立体構造を安定化する.この研究において,筆者らは,Gタンパク質共役型受容体のひとつであるロイコトリエンB4受容体とその逆作動薬であるBIIL260との複合体の結晶構造を解析した.その結果,BIIL260の官能基であるベンズアミジン基がロイコトリエンB4受容体のNa+-水分子クラスター結合部位と結合し,このクラスターと同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化することが推定され,これは生化学的な実験により実証された.ベンズアミジン基の結合部位の配列は多くのGタンパク質共役型受容体において保存されている一方,固有の配列からなる内在性のリガンドの結合部位が隣接して存在する.したがって,ベンズアミジン基がNa+-水分子クラスター結合部位と結合することにより不活性な状態を安定化し,かつ,ほかの部位が内在性のリガンドの結合部位と結合することにより特異的な結合を担うような低分子化合物は,おのおののGタンパク質共役型受容体に特異的な逆作動薬となる可能性がある.
Gタンパク質共役型受容体(G protein-coupled receptor:GPCR)は細胞の表面に発現して細胞外のシグナルを細胞内へと伝達するシグナル伝達タンパク質であり,ヒトのゲノムには約800種類がコードされている.おのおののGタンパク質共役型受容体の内在性のリガンドは細胞の外側のシグナル伝達物質として作用し,その種類は,光,低分子,ペプチド,脂質,タンパク質と多岐にわたる.すべてのGタンパク質共役型受容体は7回膜貫通ヘリックス構造をとり,内在性のリガンドが結合すると膜貫通ヘリックス束の構造が変化することにより活性化され,細胞内のエフェクタータンパク質であるGタンパク質やβアレスチンを活性化することにより細胞外のシグナルを細胞内へと伝達する.
Gタンパク質共役型受容体の研究が重要である理由は,その多くが創薬の標的となっているからである.事実,2005年から2014年までのあいだに米国食品医薬品局により承認された新規の薬剤219種類のうち,54種類はGタンパク質共役型受容体を標的とする1).Gタンパク質共役型受容体を標的とする薬剤は大きく分類すると,作動薬(アゴニスト),拮抗薬(アンタゴニスト),逆作動薬(インバースアゴニスト)の3つに分類される.作動薬は内在性のリガンドと同様にGタンパク質共役型受容体を活性化してエフェクタータンパク質を活性化する薬剤,拮抗薬は作動薬の作用を遮断するが単独ではエフェクタータンパク質の活性に影響をあたえない薬剤である.また,Gタンパク質共役型受容体のなかには作動薬が存在しない状態でもエフェクタータンパク質を活性化する内在性の活性をもつものがあり,作動薬によるエフェクタータンパク質の活性化能を遮断すると同時に内在性の活性をも抑制する薬剤が逆作動薬である.
Gタンパク質共役型受容体はアミノ酸配列の類似性から5つのクラスに分類され,719種類あるクラスA(あるいは,ロドプシンクラス)が最大のクラスである.クラスAのGタンパク質共役型受容体の多くは,生理学的な濃度のNa+のもとでは,低濃度のNa+のもとに比べ,拮抗薬や逆作動薬がより高親和性に結合し2).逆に,作動薬は低濃度のNa+のほうがより高親和性に結合する2).高分解能でのA2Aアデノシン受容体の結晶構造から,Na+は水分子とクラスター構造を形成し,クラスAのGタンパク質共役型受容体において高度に保存されている膜貫通ヘリックス束の内部のAspおよびSerと相互作用することが明らかにされた3).また,不活性な状態ではNa+が結合するのに十分な大きさをもつ膜貫通ヘリックス束の内部の空間は,作動薬が結合した活性な状態の構造ではNa+が存在できない程度に狭くなる4).これらの結果から,Na+は不活性な状態のGタンパク質共役型受容体の立体構造を安定化することが構造学的にも説明された.
Na+-水分子クラスターも逆作動薬も,不活性な状態のGタンパク質共役型受容体の立体構造を安定化するという機能は共通する.したがって,Na+-水分子クラスター結合部位と結合しこのクラスターの作用を模倣するような低分子化合物は,逆作動薬としての活性をもつと考えられる5).そのような低分子化合物は同定されていなかったが,仮に同定されれば,その情報をもとに,クラスAのGタンパク質共役型受容体の逆作動薬を効率よく設計できると考えられた.この研究においては,クラスAのGタンパク質共役型受容体のひとつであるロイコトリエンB4受容体のうちのBLT1とその拮抗薬とされていたBIIL260との複合体の結晶構造を解析した.
メタノール資化酵母を用いて,ヒト,マウス,ラットに由来するロイコトリエンB4受容体を発現させた場合,作動薬であるロイコトリエンB4への結合の親和性が低いあるいはなかったことから,モルモットに由来するロイコトリエンB4受容体を選択した.さらに,ロイコトリエンB4受容体のN末端側の領域を欠損させた場合,活性体として発現する割合が上昇した.理由は不明であるが,N末端側の領域とC末端側の領域を同時に欠損させた場合,活性体としては発現しなかった.さらに,質量分析により部分的にリン酸化をうけることが明らかにされたSerをAlaに置換した.この段階で,1リットルの培養液から100μgのロイコトリエンB4受容体が精製されたが,結晶は析出しなかった6).
一方で,2008年に報告された熱安定化β1アドレナリン受容体の結晶構造においては,ひとつひとつの残基をAlaに置換してそれぞれの変異体の熱安定性を測定し,熱安定性の向上した置換をすべて導入した多重Ala置換体について結晶化に成功していた7).ロイコトリエンB4受容体の熱安定化をはかる変異体を作製すれば発現量も増加し結晶化も実現するのではないかと思われたが,同様にロイコトリエンB4受容体の約300残基をひとつずつAlaに置換していく実験が現実的に可能とは思えなかったため,合理的な変異体の作製を計画した.まず,構造が既知のGタンパク質共役型受容体をもとにロイコトリエンB4受容体をモデリングした.その結果,膜貫通ヘリックスの双極子モーメントと反発する残基2箇所,ほかのGタンパク質共役型受容体には存在するがロイコトリエンB4受容体には存在しない水素結合2箇所,同じくロイコトリエンB4受容体であるBLT2に存在すると考えられるがこのBLT1には存在しないジスルフィド結合1箇所の,合計5箇所の立体構造を不安定化させると考えられる残基を置換の候補とした.結果的に,膜貫通ヘリックスの双極子モーメントと反発する2つの残基をいずれもGlyに置換した結果,変異体の熱安定性は5℃ほど向上し,活性体のロイコトリエンB4受容体の発現量は6倍に増加した8).さらに,ほかの生物種のロイコトリエンB4受容体のあいだでは高度に保存されているがモルモットに由来するロイコトリエンB4受容体では異なる残基について,保存されている残基に置換する安定化法(consensus method)により,さらに1残基の置換を導入した.これらの結果,1リットルの培養液から2 mg以上のロイコトリエンB4受容体が精製された.
さらに,立体構造を認識する抗ロイコトリエンB4受容体抗体を作製し,FabドメインとロイコトリエンB4受容体との複合体として結晶化を試みたが,結晶は析出しなかった.他方で,2007年に報告されたβ2アドレナリン受容体の結晶構造においては,細胞内第3ループをT4リゾチームに置換するという,当時の結晶学の常識ではとても考えられない方法により結晶化に成功していた9).そこで,熱安定化ロイコトリエンB4受容体にもT4リゾチームを挿入した結果,熱安定性は低下したものの結晶が析出するようになった.脂質キュービック相法により析出させた結晶は一辺が10μm程度の板状の微結晶であり,SPring-8 BL32XUのマイクロフォーカスビームラインにてデータを収集した.最終的に,494個の結晶からの回折データを重ね合わせた(PDB ID:5X33).分解能は3.7Åと低かったが,データの重複性が高かったため,逆作動薬BIIL260の電子密度は良好であった.
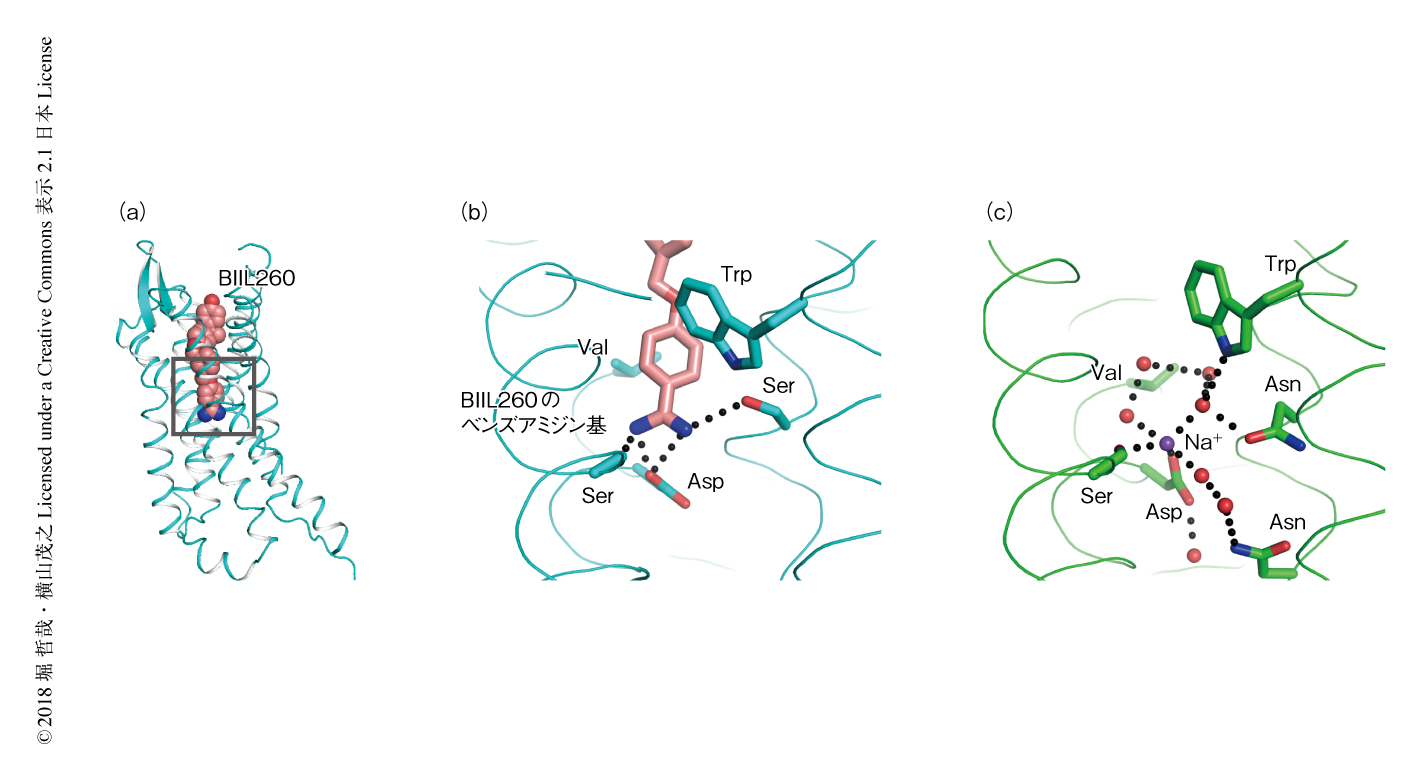
ロイコトリエンB4受容体は,ほかのGタンパク質共役型受容体と同様に,7回膜貫通ヘリックス構造をとっていた.そして,逆作動薬であるBIIL260のもつベンズアミジン基が,クラスAのGタンパク質共役型受容体のあいだで配列が高度に保存されているNa+-水分子クラスター結合部位と結合していた(図1).このベンズアミジン基は,Na+-水分子クラスターが存在するなら重なる位置に結合していたことから,ロイコトリエンB4受容体とBIIL260との複合体においてはNa+も水分子も立体障害により完全に追い出されていると想定された.A2Aアデノシン受容体と同様に,ベンズアミジン基のプロトン化アミジン基はロイコトリエンB4受容体のAspおよびSerとそれぞれ塩橋および水素結合を形成していた.また,A2Aアデノシン受容体においてNa+-水分子クラスターの水分子と相互作用する残基は,ロイコトリエンB4受容体においてはベンズアミジン基のベンゼン環と相互作用していた.全体として,ロイコトリエンB4受容体とベンズアミジン基との結合様式は,A2Aアデノシン受容体とNa+-水分子クラスターとの結合様式と類似していた(図1).これまで,クラスAのGタンパク質共役型受容体の結晶構造として約40種類が報告されているが,Na+-水分子クラスター結合部位に低分子化合物が結合する構造ははじめての報告であった.
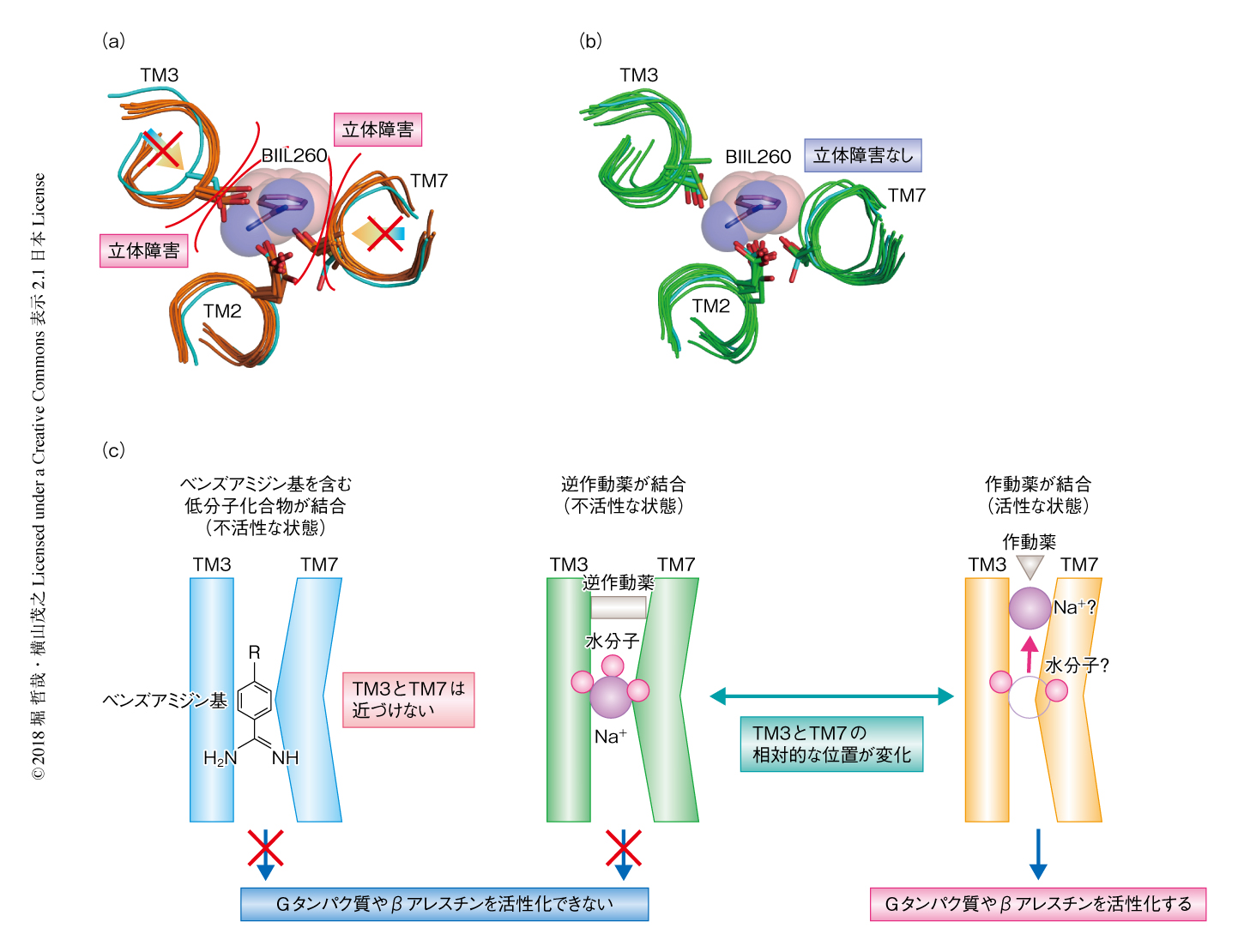
Na+-水分子クラスターは不活性な状態のクラスAのGタンパク質共役型受容体の立体構造を安定化するが3),結合様式の類似性から,BIIL260のベンズアミジン基も同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化すると考えられた.活性な状態のGタンパク質共役型受容体として作動薬との複合体のGタンパク質共役型受容体の構造を,不活性な状態のGタンパク質共役型受容体として逆作動薬あるいは拮抗薬との複合体のGタンパク質共役型受容体の構造を,それぞれ,ロイコトリエンB4受容体とBIIL260との複合体の構造と重ね合わせた(図2 a, b).その結果,いずれの不活性な状態のGタンパク質共役型受容体もロイコトリエンB4受容体のベンズアミジン基とは立体的に重ならないが,活性な状態のGタンパク質共役型受容体とは重なった.この部位は,活性な状態では不活性な状態に比べ空間的に狭くなりNa+が追い出されると考えられているが10),ベンズアミジン基はかさ高いため狭くなった空間に収まらないことは明らかであった(図2 a, c).したがって,ベンズアミジン基がNa+-水分子クラスター結合部位と結合した場合,Gタンパク質共役型受容体の活性な状態への構造変化が阻害され,不活性な状態の立体構造が安定化されると考えられた.とくに,内在性の活性を示すGタンパク質共役型受容体にベンズアミジン基をもつ低分子化合物が結合した場合,活性な状態への構造変化がベンズアミジン基によりさまたげられ不活性な状態が安定化されると考えられた.この場合,ベンズアミジン基を含む低分子化合物は逆作動薬になる.
ロイコトリエンB4受容体とBIIL260との複合体の結晶構造から,BIIL260は不活性な状態のロイコトリエンB4受容体の立体構造を安定化するので定義的には逆作動薬であると考えられ,ここまでも,そう記してきた.しかしながら,ロイコトリエンB4受容体には実験的に検出される内在性の活性がないので,BIIL260が逆作動薬であることを実験的に直接に実証することはできなかった.そこで,作動薬であるロイコトリエンB4の刺激によるロイコトリエンB4受容体の活性を単独のベンズアミジン“分子”が抑制するなら,ベンズアミジン分子が不活性な状態の立体構造を安定化することになるので,ベンズアミジン基を含むBIIL260も同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化する逆作動薬としての活性があることが実証されると考えた.実際に,ベンズアミジン分子はロイコトリエンB4のロイコトリエンB4受容体に対する結合の親和性を低下させ,ロイコトリエンB4受容体とロイコトリエンB4との結合に依存的なGタンパク質の活性をアロステリック様に抑制した.また,Na+およびベンズアミジン分子は,いずれもロイコトリエンB4受容体に対するBIIL260の結合を競合的に阻害した.これらの結果から,Na+-水分子クラスターはロイコトリエンB4受容体にも存在し,ベンズアミジン分子はBIIL260のベンズアミジン基と同じ部位に結合して不活性な状態のロイコトリエンB4受容体の立体構造を安定化することが示された.したがって,BIIL260は不活性な状態のロイコトリエンB4受容体の立体構造を安定化するのでロイコトリエンB4受容体に対する逆作動薬であるという構造解析から考察された仮説は,実験的にも実証された.
ロイコトリエンB4受容体のベンズアミジン基の結合部位に相当するアミノ酸配列は,クラスAのGタンパク質共役型受容体において高度に保存されている.つまり,ベンズアミジン基をもつ低分子化合物はクラスAのGタンパク質共役型受容体の多くに結合し,その不活性な状態の立体構造を安定化する可能性がある.また,ベンズアミジン基の結合部位に隣接して,内在性のリガンドとの結合部位が存在する.したがって,ベンズアミジン基がGタンパク質共役型受容体の不活性な状態を安定化する作用をもち,ほかの部位がおのおののGタンパク質共役型受容体の内在性のリガンドとの結合部位と結合することにより特異的な結合を担うような低分子化合物は,おのおののGタンパク質共役型受容体と特異的に結合する逆作動薬になりうると考えられる.ロイコトリエンB4受容体とBIIL260との複合体の結晶構造の解析によりNa+-水分子クラスターの機能を模倣する低分子化合物が同定されたが,この情報は,クラスAのGタンパク質共役型受容体の逆作動薬の合理的な設計のために有益であろう.
略歴:2001年 東京工業大学大学院生命理工学研究科 修了,理化学研究所 専任研究員.
研究テーマ:Gタンパク質共役型受容体の構造生物学.
関心事:10年後の世の中と研究環境.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
© 2018 堀 哲哉・横山茂之 Licensed under CC 表示 2.1 日本
(理化学研究所 横山構造生物学研究室)
email:堀 哲哉,横山茂之
DOI: 10.7875/first.author.2018.013
Na+-mimicking ligands stabilize the inactive state of leukotriene B4 receptor BLT1.
Tetsuya Hori, Toshiaki Okuno, Kunio Hirata, Keitaro Yamashita, Yoshiaki Kawano, Masaki Yamamoto, Masakatsu Hato, Motonao Nakamura, Takao Shimizu, Takehiko Yokomizo, Masashi Miyano, Shigeyuki Yokoyama
Nature Chemical Biology, 14, 262-269 (2018)
要 約
不活性な状態のGタンパク質共役型受容体において膜貫通ヘリックス束の内部にはNa+-水分子クラスターが結合し,その立体構造を安定化する.この研究において,筆者らは,Gタンパク質共役型受容体のひとつであるロイコトリエンB4受容体とその逆作動薬であるBIIL260との複合体の結晶構造を解析した.その結果,BIIL260の官能基であるベンズアミジン基がロイコトリエンB4受容体のNa+-水分子クラスター結合部位と結合し,このクラスターと同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化することが推定され,これは生化学的な実験により実証された.ベンズアミジン基の結合部位の配列は多くのGタンパク質共役型受容体において保存されている一方,固有の配列からなる内在性のリガンドの結合部位が隣接して存在する.したがって,ベンズアミジン基がNa+-水分子クラスター結合部位と結合することにより不活性な状態を安定化し,かつ,ほかの部位が内在性のリガンドの結合部位と結合することにより特異的な結合を担うような低分子化合物は,おのおののGタンパク質共役型受容体に特異的な逆作動薬となる可能性がある.
はじめに
Gタンパク質共役型受容体(G protein-coupled receptor:GPCR)は細胞の表面に発現して細胞外のシグナルを細胞内へと伝達するシグナル伝達タンパク質であり,ヒトのゲノムには約800種類がコードされている.おのおののGタンパク質共役型受容体の内在性のリガンドは細胞の外側のシグナル伝達物質として作用し,その種類は,光,低分子,ペプチド,脂質,タンパク質と多岐にわたる.すべてのGタンパク質共役型受容体は7回膜貫通ヘリックス構造をとり,内在性のリガンドが結合すると膜貫通ヘリックス束の構造が変化することにより活性化され,細胞内のエフェクタータンパク質であるGタンパク質やβアレスチンを活性化することにより細胞外のシグナルを細胞内へと伝達する.
Gタンパク質共役型受容体の研究が重要である理由は,その多くが創薬の標的となっているからである.事実,2005年から2014年までのあいだに米国食品医薬品局により承認された新規の薬剤219種類のうち,54種類はGタンパク質共役型受容体を標的とする1).Gタンパク質共役型受容体を標的とする薬剤は大きく分類すると,作動薬(アゴニスト),拮抗薬(アンタゴニスト),逆作動薬(インバースアゴニスト)の3つに分類される.作動薬は内在性のリガンドと同様にGタンパク質共役型受容体を活性化してエフェクタータンパク質を活性化する薬剤,拮抗薬は作動薬の作用を遮断するが単独ではエフェクタータンパク質の活性に影響をあたえない薬剤である.また,Gタンパク質共役型受容体のなかには作動薬が存在しない状態でもエフェクタータンパク質を活性化する内在性の活性をもつものがあり,作動薬によるエフェクタータンパク質の活性化能を遮断すると同時に内在性の活性をも抑制する薬剤が逆作動薬である.
Gタンパク質共役型受容体はアミノ酸配列の類似性から5つのクラスに分類され,719種類あるクラスA(あるいは,ロドプシンクラス)が最大のクラスである.クラスAのGタンパク質共役型受容体の多くは,生理学的な濃度のNa+のもとでは,低濃度のNa+のもとに比べ,拮抗薬や逆作動薬がより高親和性に結合し2).逆に,作動薬は低濃度のNa+のほうがより高親和性に結合する2).高分解能でのA2Aアデノシン受容体の結晶構造から,Na+は水分子とクラスター構造を形成し,クラスAのGタンパク質共役型受容体において高度に保存されている膜貫通ヘリックス束の内部のAspおよびSerと相互作用することが明らかにされた3).また,不活性な状態ではNa+が結合するのに十分な大きさをもつ膜貫通ヘリックス束の内部の空間は,作動薬が結合した活性な状態の構造ではNa+が存在できない程度に狭くなる4).これらの結果から,Na+は不活性な状態のGタンパク質共役型受容体の立体構造を安定化することが構造学的にも説明された.
Na+-水分子クラスターも逆作動薬も,不活性な状態のGタンパク質共役型受容体の立体構造を安定化するという機能は共通する.したがって,Na+-水分子クラスター結合部位と結合しこのクラスターの作用を模倣するような低分子化合物は,逆作動薬としての活性をもつと考えられる5).そのような低分子化合物は同定されていなかったが,仮に同定されれば,その情報をもとに,クラスAのGタンパク質共役型受容体の逆作動薬を効率よく設計できると考えられた.この研究においては,クラスAのGタンパク質共役型受容体のひとつであるロイコトリエンB4受容体のうちのBLT1とその拮抗薬とされていたBIIL260との複合体の結晶構造を解析した.
1.ロイコトリエンB4受容体の精製および結晶化
メタノール資化酵母を用いて,ヒト,マウス,ラットに由来するロイコトリエンB4受容体を発現させた場合,作動薬であるロイコトリエンB4への結合の親和性が低いあるいはなかったことから,モルモットに由来するロイコトリエンB4受容体を選択した.さらに,ロイコトリエンB4受容体のN末端側の領域を欠損させた場合,活性体として発現する割合が上昇した.理由は不明であるが,N末端側の領域とC末端側の領域を同時に欠損させた場合,活性体としては発現しなかった.さらに,質量分析により部分的にリン酸化をうけることが明らかにされたSerをAlaに置換した.この段階で,1リットルの培養液から100μgのロイコトリエンB4受容体が精製されたが,結晶は析出しなかった6).
一方で,2008年に報告された熱安定化β1アドレナリン受容体の結晶構造においては,ひとつひとつの残基をAlaに置換してそれぞれの変異体の熱安定性を測定し,熱安定性の向上した置換をすべて導入した多重Ala置換体について結晶化に成功していた7).ロイコトリエンB4受容体の熱安定化をはかる変異体を作製すれば発現量も増加し結晶化も実現するのではないかと思われたが,同様にロイコトリエンB4受容体の約300残基をひとつずつAlaに置換していく実験が現実的に可能とは思えなかったため,合理的な変異体の作製を計画した.まず,構造が既知のGタンパク質共役型受容体をもとにロイコトリエンB4受容体をモデリングした.その結果,膜貫通ヘリックスの双極子モーメントと反発する残基2箇所,ほかのGタンパク質共役型受容体には存在するがロイコトリエンB4受容体には存在しない水素結合2箇所,同じくロイコトリエンB4受容体であるBLT2に存在すると考えられるがこのBLT1には存在しないジスルフィド結合1箇所の,合計5箇所の立体構造を不安定化させると考えられる残基を置換の候補とした.結果的に,膜貫通ヘリックスの双極子モーメントと反発する2つの残基をいずれもGlyに置換した結果,変異体の熱安定性は5℃ほど向上し,活性体のロイコトリエンB4受容体の発現量は6倍に増加した8).さらに,ほかの生物種のロイコトリエンB4受容体のあいだでは高度に保存されているがモルモットに由来するロイコトリエンB4受容体では異なる残基について,保存されている残基に置換する安定化法(consensus method)により,さらに1残基の置換を導入した.これらの結果,1リットルの培養液から2 mg以上のロイコトリエンB4受容体が精製された.
さらに,立体構造を認識する抗ロイコトリエンB4受容体抗体を作製し,FabドメインとロイコトリエンB4受容体との複合体として結晶化を試みたが,結晶は析出しなかった.他方で,2007年に報告されたβ2アドレナリン受容体の結晶構造においては,細胞内第3ループをT4リゾチームに置換するという,当時の結晶学の常識ではとても考えられない方法により結晶化に成功していた9).そこで,熱安定化ロイコトリエンB4受容体にもT4リゾチームを挿入した結果,熱安定性は低下したものの結晶が析出するようになった.脂質キュービック相法により析出させた結晶は一辺が10μm程度の板状の微結晶であり,SPring-8 BL32XUのマイクロフォーカスビームラインにてデータを収集した.最終的に,494個の結晶からの回折データを重ね合わせた(PDB ID:5X33).分解能は3.7Åと低かったが,データの重複性が高かったため,逆作動薬BIIL260の電子密度は良好であった.
2.ロイコトリエンB4受容体の全体構造および逆作動薬BIIL260の結合部位の構造
ロイコトリエンB4受容体は,ほかのGタンパク質共役型受容体と同様に,7回膜貫通ヘリックス構造をとっていた.そして,逆作動薬であるBIIL260のもつベンズアミジン基が,クラスAのGタンパク質共役型受容体のあいだで配列が高度に保存されているNa+-水分子クラスター結合部位と結合していた(図1).このベンズアミジン基は,Na+-水分子クラスターが存在するなら重なる位置に結合していたことから,ロイコトリエンB4受容体とBIIL260との複合体においてはNa+も水分子も立体障害により完全に追い出されていると想定された.A2Aアデノシン受容体と同様に,ベンズアミジン基のプロトン化アミジン基はロイコトリエンB4受容体のAspおよびSerとそれぞれ塩橋および水素結合を形成していた.また,A2Aアデノシン受容体においてNa+-水分子クラスターの水分子と相互作用する残基は,ロイコトリエンB4受容体においてはベンズアミジン基のベンゼン環と相互作用していた.全体として,ロイコトリエンB4受容体とベンズアミジン基との結合様式は,A2Aアデノシン受容体とNa+-水分子クラスターとの結合様式と類似していた(図1).これまで,クラスAのGタンパク質共役型受容体の結晶構造として約40種類が報告されているが,Na+-水分子クラスター結合部位に低分子化合物が結合する構造ははじめての報告であった.
3.Na+-水分子クラスターの作用を模倣するベンズアミジン基による不活性な状態のロイコトリエンB4受容体の立体構造の安定化
Na+-水分子クラスターは不活性な状態のクラスAのGタンパク質共役型受容体の立体構造を安定化するが3),結合様式の類似性から,BIIL260のベンズアミジン基も同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化すると考えられた.活性な状態のGタンパク質共役型受容体として作動薬との複合体のGタンパク質共役型受容体の構造を,不活性な状態のGタンパク質共役型受容体として逆作動薬あるいは拮抗薬との複合体のGタンパク質共役型受容体の構造を,それぞれ,ロイコトリエンB4受容体とBIIL260との複合体の構造と重ね合わせた(図2 a, b).その結果,いずれの不活性な状態のGタンパク質共役型受容体もロイコトリエンB4受容体のベンズアミジン基とは立体的に重ならないが,活性な状態のGタンパク質共役型受容体とは重なった.この部位は,活性な状態では不活性な状態に比べ空間的に狭くなりNa+が追い出されると考えられているが10),ベンズアミジン基はかさ高いため狭くなった空間に収まらないことは明らかであった(図2 a, c).したがって,ベンズアミジン基がNa+-水分子クラスター結合部位と結合した場合,Gタンパク質共役型受容体の活性な状態への構造変化が阻害され,不活性な状態の立体構造が安定化されると考えられた.とくに,内在性の活性を示すGタンパク質共役型受容体にベンズアミジン基をもつ低分子化合物が結合した場合,活性な状態への構造変化がベンズアミジン基によりさまたげられ不活性な状態が安定化されると考えられた.この場合,ベンズアミジン基を含む低分子化合物は逆作動薬になる.
4.ベンズアミジン分子による不活性な状態のGタンパク質共役型受容体の立体構造の安定化
ロイコトリエンB4受容体とBIIL260との複合体の結晶構造から,BIIL260は不活性な状態のロイコトリエンB4受容体の立体構造を安定化するので定義的には逆作動薬であると考えられ,ここまでも,そう記してきた.しかしながら,ロイコトリエンB4受容体には実験的に検出される内在性の活性がないので,BIIL260が逆作動薬であることを実験的に直接に実証することはできなかった.そこで,作動薬であるロイコトリエンB4の刺激によるロイコトリエンB4受容体の活性を単独のベンズアミジン“分子”が抑制するなら,ベンズアミジン分子が不活性な状態の立体構造を安定化することになるので,ベンズアミジン基を含むBIIL260も同様に不活性な状態のロイコトリエンB4受容体の立体構造を安定化する逆作動薬としての活性があることが実証されると考えた.実際に,ベンズアミジン分子はロイコトリエンB4のロイコトリエンB4受容体に対する結合の親和性を低下させ,ロイコトリエンB4受容体とロイコトリエンB4との結合に依存的なGタンパク質の活性をアロステリック様に抑制した.また,Na+およびベンズアミジン分子は,いずれもロイコトリエンB4受容体に対するBIIL260の結合を競合的に阻害した.これらの結果から,Na+-水分子クラスターはロイコトリエンB4受容体にも存在し,ベンズアミジン分子はBIIL260のベンズアミジン基と同じ部位に結合して不活性な状態のロイコトリエンB4受容体の立体構造を安定化することが示された.したがって,BIIL260は不活性な状態のロイコトリエンB4受容体の立体構造を安定化するのでロイコトリエンB4受容体に対する逆作動薬であるという構造解析から考察された仮説は,実験的にも実証された.
おわりに
ロイコトリエンB4受容体のベンズアミジン基の結合部位に相当するアミノ酸配列は,クラスAのGタンパク質共役型受容体において高度に保存されている.つまり,ベンズアミジン基をもつ低分子化合物はクラスAのGタンパク質共役型受容体の多くに結合し,その不活性な状態の立体構造を安定化する可能性がある.また,ベンズアミジン基の結合部位に隣接して,内在性のリガンドとの結合部位が存在する.したがって,ベンズアミジン基がGタンパク質共役型受容体の不活性な状態を安定化する作用をもち,ほかの部位がおのおののGタンパク質共役型受容体の内在性のリガンドとの結合部位と結合することにより特異的な結合を担うような低分子化合物は,おのおののGタンパク質共役型受容体と特異的に結合する逆作動薬になりうると考えられる.ロイコトリエンB4受容体とBIIL260との複合体の結晶構造の解析によりNa+-水分子クラスターの機能を模倣する低分子化合物が同定されたが,この情報は,クラスAのGタンパク質共役型受容体の逆作動薬の合理的な設計のために有益であろう.
文 献
- Fang, Y., Kenakin, T. & Liu, C.: Editorial: orphan GPCRs as emerging drug targets. Front. Pharmacol., 6, 1-2 (2015)[PubMed]
- Pert, C. B., Pasternak, G. & Snyder, S. H.: Opiate agonists and antagonists discriminated by receptor binding in brain. Science, 182, 1359-1361 (1973)[PubMed]
- Liu, W., Chun, E., Thompson, A. A. et al.: Structural basis for allosteric regulation of GPCRs by sodium ions. Science, 337, 232-236 (2012)[PubMed]
- Rasmussen, S. G., DeVree, B. T., Zou, Y. et al.: Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature, 477, 549-555 (2011)[PubMed]
- Roth, B. L., Irwin, J. J. & Shoichet, B. K.: Discovery of new GPCR ligands to illuminate new biology. Nat. Chem. Biol., 13, 1143-1151 (2017)[PubMed]
- Hori, T., Sato, Y., Takahashi, N. et al.: Expression, purification and characterization of leukotriene B4 receptor, BLT1 in Pichia pastoris. Protein Expr. Purif., 72, 66-74 (2010)[PubMed]
- Warne, T., Serrano-Vega, M. J., Baker, J. G. et al.: Structure of a β1-adrenergic G-protein coupled receptor. Nature, 454, 486-491 (2008)[PubMed]
- Hori, T., Nakamura, M., Yokomizo, T. et al.: The leukotriene B4 receptor BLT1 is stabilized by transmembrane helix capping mutations. Biochem. Biophys. Rep., 4, 243-249 (2015)[PubMed]
- Rosenbaum, D. M. Cherezov, V., Hanson, M. A. et al.: GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function. Science, 318, 1266-1273 (2007)[PubMed]
- Katritch, V., Fenalti, G., Abola, E. E. et al.: Allosteric sodium in class A GPCR signaling. Trends Biochem. Sci., 39, 233-244 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2001年 東京工業大学大学院生命理工学研究科 修了,理化学研究所 専任研究員.
研究テーマ:Gタンパク質共役型受容体の構造生物学.
関心事:10年後の世の中と研究環境.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
© 2018 堀 哲哉・横山茂之 Licensed under CC 表示 2.1 日本