細胞外基質のリモデリングによりひき起こされるYAP/TAZに依存性の大腸上皮細胞のリプログラミングは大腸上皮組織の修復に不可欠である
油井史郎1・中村哲也2・渡辺 守3
(1デンマークCopenhagen大学Biotech Research and Innovation Centre,東京医科歯科大学大学院医歯学総合研究科 2消化管先端治療学,3消化器病態学)
email:油井史郎
DOI: 10.7875/first.author.2018.005
YAP/TAZ-dependent reprogramming of colonic epithelium links ECM remodeling to tissue regeneration.
Shiro Yui, Luca Azzolin, Martti Maimets, Marianne Terndrup Pedersen, Robert P. Fordham, Stine L. Hansen, Hjalte L. Larsen, Jordi Guiu, Mariana R.P. Alves, Carsten F. Rundsten, Jens V. Johansen, Yuan Li, Chris D. Madsen, Tetsuya Nakamura, Mamoru Watanabe, Ole H. Nielsen, Pawel J. Schweiger, Stefano Piccolo, Kim B. Jensen
Cell Stem Cell, 22, 35-49.e7 (2018)
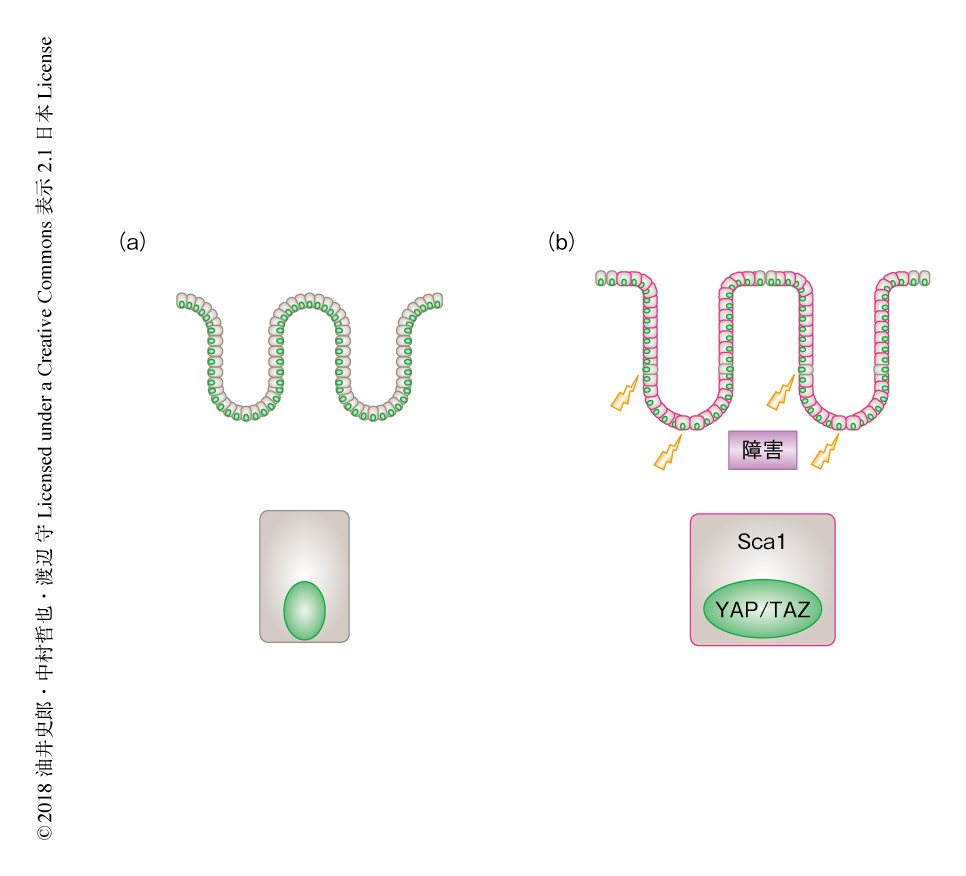
組織が傷害をうけたのち自己修復する再生の過程においては,細胞が定常な状態とは異なる状態に遷移しもとにもどるという可逆的な機構の存在が想定される.腸管上皮組織は生体において細胞のターンオーバーがもっとも速い組織であるが,傷害をうけた際に自己修復する過程については,上皮幹細胞のもつ旺盛な細胞の供給能により担保されると漠然と想定されるにすぎなかった.この研究において,筆者らは,マウスの大腸炎モデルやヒトの潰瘍性大腸炎の病理試料などを用いて,大腸上皮組織が自己修復する際には一時的に胎児型の表現型を呈し,その際にはコラーゲン線維とWntリガンドとの協調による転写因子YAP/TAZに依存性の大腸上皮細胞のリプログラミングが関与するという新しいコンセプトを提唱し,遺伝子改変マウス,初代培養系,腸管上皮細胞の移植などを駆使してこれを証明した.この研究の成果は,炎症性腸疾患の研究や腸管上皮組織の再生医療の発展にとり有意義な知見を提供するものである
腸管上皮組織が傷害をうけた際の再生において転写因子YAP/TAZが必須であることが明らかにされ1),組織の再生における役割が注目されているものの,傷害の際にYAP/TAZが発現する機構や,YAP/TAZの活性化の結果として腸管上皮組織に生じる形質の変化などの詳細は不明であり,これらの理解は炎症性腸疾患など難治性の腸疾患における粘膜の治癒の過程の理解およびその促進において重要である.また,傷害の際には組織にコラーゲン線維が増生し線維化を生じることはよく知られているが2),線維化と組織の再生との関連を腸管上皮組織において解析した例はなく,腸管上皮組織における線維化の生物学的な意義はもっぱら炎症の副反応として理解されるのみであった.
デキストラン硫酸塩により遠位大腸に上皮組織の傷害および炎症を惹起する潰瘍性大腸炎のマウスモデルにおいて,再生が顕著に観察される時期を同定した.この時期に生じる過形成した大腸上皮組織(修復された大腸上皮細胞)においては,正常な大腸上皮細胞には発現のないSca1が特異的に発現していた.修復上皮細胞に生じたSca1陽性細胞を回収し,遺伝子の発現をマイクロアレイ法により網羅的に解析したところ,遺伝子の発現プロファイルは正常な大腸上皮細胞とは大きく異なり,上皮幹細胞に豊富に発現する遺伝子セット3) の発現は大きく低下していた.幹細胞性の喪失は,修復上皮細胞における幹細胞マーカーLrig1 4) の発現の低下からも支持された.しかしながら,単一の細胞からの培養においてはSca1陽性細胞も正常な大腸上皮細胞と同様にオルガノイドを形成する能力をもっていた.この結果から,修復上皮細胞へと分化するSca1陽性細胞は正常な上皮幹細胞とは異なる遺伝子の発現プロファイルをもちながらも,機能的には幹細胞であるという特殊な細胞であることが示唆された.
成体および胎生期の腸管に由来する上皮細胞を同じ条件で培養し5,6),遺伝子の発現をマイクロアレイ法により解析し,胎児のオルガノイドにおいて高発現する遺伝子セット(胎児型遺伝子セット)を同定した.胎児型遺伝子セットにはSca1遺伝子などLy6遺伝子ファミリーが含まれており,エンリッチメント解析により,Sca1陽性細胞における遺伝子の発現プロファイルは胎児型遺伝子セットと高い相同性を示した.この相同性は,胎児に由来する細胞塊や胎生期の大腸上皮細胞には発現するが成体の大腸上皮細胞には発現が認められないAnxa1などが修復上皮細胞に発現することからも強く支持された.また,潰瘍性大腸炎の患者に由来する炎症部位および健常部位それぞれの遺伝子発現プロファイル7) と,胎児型遺伝子セットやSca1陽性細胞において高発現する遺伝子セット(修復上皮遺伝子セット)との相関をエンリッチメント解析により調べたところ,胎児型遺伝子セットおよび修復上皮遺伝子セットはともに炎症部位における遺伝子発現プロファイルと高い相同性を示し,タンパク質のレベルにおいても,ANXA1がヒトの潰瘍性大腸炎の炎症部位に特異的な発現を示した.これらの結果から,修復上皮細胞が胎児期の未熟な腸管上皮細胞と類似した遺伝子の発現プロファイルをもつことが示され,この“胎児化”がヒトの潰瘍性大腸炎および潰瘍性大腸炎のモデルマウスにおいて共通する現象であることが示唆された(図1).
修復上皮遺伝子セットにはLy6遺伝子ファミリーやAnnexin遺伝子ファミリー遺伝子にくわえ,細胞外基質に関連する遺伝子が多く含まれていた.傷害部位においてコラーゲン線維を可視化して観察したところ,修復上皮細胞は増生したコラーゲン線維につつまれており,コラーゲン線維の膜受容体であるβ1インテグリンおよびその下流のFAKやリン酸化Srcなども修復上皮細胞に強く発現することが確認され,上皮下間質における細胞外基質のリモデリングが大腸上皮組織の表現型に強く影響するようすが観察された.呼応するように,修復上皮細胞においてはYAP/TAZが強く発現し,修復上皮細胞における遺伝子の発現プロファイルは,腸管上皮細胞において活性型のYAPを強制発現した際に発現する遺伝子セット8)(YAP誘導遺伝子セット)とも高い相同性を示すことがエンリッチメント解析により明らかにされた.FAK阻害剤あるいはSrc阻害剤により大腸上皮組織の再生が抑制され,修復上皮細胞におけるYAP/TAZの活性も消失したことから,シグナルはコラーゲン→FAK-Src→YAP/TAZの経路で伝達されることが示唆された.
独自の初代培養系を用いてコラーゲン線維の腸管上皮細胞への影響を直接的に評価した.まず,EGF,Noggin,R-spondin1の存在下において腸管上皮細胞をコラーゲンに包埋して培養したが,ラミニンを主成分とするマトリゲルに包埋して培養するとオルガノイドが形成される5) ことと対照的に,培養はできなかった.しかしながら,EGF,Noggin,R-spondin1にくわえ,WntリガンドであるWnt3aを添加すると,マトリゲルあるいはコラーゲンに包埋して培養すると腸管上皮細胞は旺盛に増殖した.これらの細胞における遺伝子の発現をマイクロアレイ法により評価したところ,コラーゲンに包埋して培養した腸管上皮細胞においては修復上皮細胞および胎児のオルガノイドにおいて高い発現の認められるLy6遺伝子ファミリーやAnnexin遺伝子ファミリー,YAPの標的遺伝子であるAnkrd1遺伝子やCyr61遺伝子が高発現していた.逆に,成熟した幹細胞のマーカー遺伝子や分化のマーカー遺伝子の発現は著明に減弱した.タンパク質のレベルにおいても,コラーゲンに包埋して培養した腸管上皮細胞においては核に局在する強いYAPの発現が認められ,Sca1やAnxa1の強い発現も確認された.エンリッチメント解析により,コラーゲンに包埋して培養した腸管上皮細胞において発現の高い遺伝子セットは修復上皮細胞における遺伝子の発現プロファイルと高い相同性を示し,また,YAP誘導遺伝子セットおよび胎児型遺伝子セットもやはり高い相同性を示した.これらのことから,コラーゲン線維はWntリガンドと協調してYAPを活性化し,また,腸管上皮細胞を胎児型の修復上皮細胞へとリプログラミングする能力のあることが示唆された.
コラーゲン線維はYAP/TAZの活性化を介して大腸上皮細胞をリプログラミングするのか,すなわち,転写因子の活性と表現型との因果関係について種々の遺伝子改変マウスを用いて確認した.Wntシグナル伝達経路の抑制性タンパク質であるApcのノックアウトによるWntシグナルの恒常的な活性化や,活性型のYAPの強制発現系を用いると9),コラーゲンに包埋しての培養に必須のWnt3aを含まない培地においても腸管上皮細胞は培養が可能になった.また,FAK阻害剤あるいはSrc阻害剤の存在下ではWnt3aが存在してもコラーゲンに包埋しての培養は困難であったが,活性型のYAPを強制発現することにより培養は可能になった.これらのことから,コラーゲン線維により腸管上皮細胞がリプログラミングされる際にはFAKおよびSrcを介するYAPの活性化が必須であることが示された.in vivoにおいてYAP/TAZのノックアウトにより大腸上皮組織の再生が完全に損なわれ,傷害上皮細胞におけるSca1の発現も消失し,大腸上皮細胞の傷害に関連するリプログラミングはYAP/TAZの活性によりひき起こされることが明らかにされた.
再生期にみられる過形成性の変化は時間の経過とともに正常な大腸上皮細胞へと成熟する可逆性をもつ.コラーゲン線維とWntリガンドによるリプログラミングが大腸上皮組織の再生の機構であるなら,これは可逆性の変化でなければ論理的な整合性がとれない.マトリゲルに包埋して培養された成熟型の腸管上皮オルガノイドは,大腸上皮組織の傷害部位に移植10) されるとSca1陽性細胞へとリプログラミングされるとともに,傷害部位への生着にはYAP/TAZに依存性のリプログラミングが必須であったものの,未熟な腸管上皮細胞として生着したのちに成熟型の大腸上皮細胞へと分化した.さらに,コラーゲンに包埋し数回の培養により胎児型の修復上皮細胞にリプログラミングされた腸管上皮細胞は,マトリゲルに包埋しなおすと成熟型の腸管上皮オルガノイドに分化した.これらの結果から,コラーゲンとWntリガンドの協調による大腸上皮細胞のリプログラミングは,細胞の特性の可逆的な変化をひき起こす大腸上皮組織の再生のしくみとして論理的な整合性をもつことが示された.
この研究は,炎症性腸疾患の病態の解明および粘膜の治癒の促進をめざした新規の治療法の開発にあたり,大腸上皮組織の再生を促進する作用点としての線維化およびその下流にある転写因子YAP/TAZの活性化をいかに制御するかが重要であることを示唆する画期的な成果である.炎症の遷延にともなう発がんの背景に大腸上皮細胞のリプログラミングのあることも示唆され,再生のみならず,発がんにも影響しうる線維化という現象が今後の腸管上皮組織の研究における重要なテーマのひとつとなることが示唆される.大腸上皮細胞のリプログラミングに異常のある場合には傷害の治癒が損なわれ粘膜に傷害が残存する可能性が示唆され,炎症性腸疾患の病因論の観点からも重要である.この研究においては,大腸上皮細胞のリプログラミングを模倣することにより,不純物をまったく含まないかたちで腸管上皮細胞に由来する細胞塊を作製する方法を確立したが,この細胞塊は難治性の腸疾患における再生医療において理想的な細胞の資材であると同時に,in vitroにおける上皮組織の再生の過程のモデルとしても価値をもつと考えられる.
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 同 メディカルフェロー,2013年 デンマークCopenhagen大学 博士研究員を経て,2017年より東京医科歯科大学統合研究機構 助教.
研究テーマ:腸管の再生医療,上皮組織の再生の機構.
抱負:腸管上皮細胞には非常に自律的な増殖能があり,現在,その増殖能に関する知識がオルガノイド培養という腸管上皮細胞を体外で培養する技術に生かされています.体外で旺盛に増殖する腸管上皮細胞の特性を生かした新しい再生医療の開発をめざすと同時に,上皮組織の再生のしくみの詳細を研究することにより科学的な知識に立脚した新しい炎症性腸疾患の診療を展開したいと思っています.
中村 哲也(Tetsuya Nakamura)
東京医科歯科大学大学院医歯学総合研究科 教授.
渡辺 守(Mamoru Watanabe)
東京医科歯科大学大学院医歯学総合研究科 教授.
© 2018 油井史郎・中村哲也・渡辺 守 Licensed under CC 表示 2.1 日本
(1デンマークCopenhagen大学Biotech Research and Innovation Centre,東京医科歯科大学大学院医歯学総合研究科 2消化管先端治療学,3消化器病態学)
email:油井史郎
DOI: 10.7875/first.author.2018.005
YAP/TAZ-dependent reprogramming of colonic epithelium links ECM remodeling to tissue regeneration.
Shiro Yui, Luca Azzolin, Martti Maimets, Marianne Terndrup Pedersen, Robert P. Fordham, Stine L. Hansen, Hjalte L. Larsen, Jordi Guiu, Mariana R.P. Alves, Carsten F. Rundsten, Jens V. Johansen, Yuan Li, Chris D. Madsen, Tetsuya Nakamura, Mamoru Watanabe, Ole H. Nielsen, Pawel J. Schweiger, Stefano Piccolo, Kim B. Jensen
Cell Stem Cell, 22, 35-49.e7 (2018)
要 約
組織が傷害をうけたのち自己修復する再生の過程においては,細胞が定常な状態とは異なる状態に遷移しもとにもどるという可逆的な機構の存在が想定される.腸管上皮組織は生体において細胞のターンオーバーがもっとも速い組織であるが,傷害をうけた際に自己修復する過程については,上皮幹細胞のもつ旺盛な細胞の供給能により担保されると漠然と想定されるにすぎなかった.この研究において,筆者らは,マウスの大腸炎モデルやヒトの潰瘍性大腸炎の病理試料などを用いて,大腸上皮組織が自己修復する際には一時的に胎児型の表現型を呈し,その際にはコラーゲン線維とWntリガンドとの協調による転写因子YAP/TAZに依存性の大腸上皮細胞のリプログラミングが関与するという新しいコンセプトを提唱し,遺伝子改変マウス,初代培養系,腸管上皮細胞の移植などを駆使してこれを証明した.この研究の成果は,炎症性腸疾患の研究や腸管上皮組織の再生医療の発展にとり有意義な知見を提供するものである
はじめに
腸管上皮組織が傷害をうけた際の再生において転写因子YAP/TAZが必須であることが明らかにされ1),組織の再生における役割が注目されているものの,傷害の際にYAP/TAZが発現する機構や,YAP/TAZの活性化の結果として腸管上皮組織に生じる形質の変化などの詳細は不明であり,これらの理解は炎症性腸疾患など難治性の腸疾患における粘膜の治癒の過程の理解およびその促進において重要である.また,傷害の際には組織にコラーゲン線維が増生し線維化を生じることはよく知られているが2),線維化と組織の再生との関連を腸管上皮組織において解析した例はなく,腸管上皮組織における線維化の生物学的な意義はもっぱら炎症の副反応として理解されるのみであった.
1.修復された大腸上皮細胞は正常な上皮幹細胞とは異なる遺伝子の発現プロファイルをもつ
デキストラン硫酸塩により遠位大腸に上皮組織の傷害および炎症を惹起する潰瘍性大腸炎のマウスモデルにおいて,再生が顕著に観察される時期を同定した.この時期に生じる過形成した大腸上皮組織(修復された大腸上皮細胞)においては,正常な大腸上皮細胞には発現のないSca1が特異的に発現していた.修復上皮細胞に生じたSca1陽性細胞を回収し,遺伝子の発現をマイクロアレイ法により網羅的に解析したところ,遺伝子の発現プロファイルは正常な大腸上皮細胞とは大きく異なり,上皮幹細胞に豊富に発現する遺伝子セット3) の発現は大きく低下していた.幹細胞性の喪失は,修復上皮細胞における幹細胞マーカーLrig1 4) の発現の低下からも支持された.しかしながら,単一の細胞からの培養においてはSca1陽性細胞も正常な大腸上皮細胞と同様にオルガノイドを形成する能力をもっていた.この結果から,修復上皮細胞へと分化するSca1陽性細胞は正常な上皮幹細胞とは異なる遺伝子の発現プロファイルをもちながらも,機能的には幹細胞であるという特殊な細胞であることが示唆された.
2.修復上皮細胞は胎生期の未熟な腸管上皮細胞と相同性をもつ
成体および胎生期の腸管に由来する上皮細胞を同じ条件で培養し5,6),遺伝子の発現をマイクロアレイ法により解析し,胎児のオルガノイドにおいて高発現する遺伝子セット(胎児型遺伝子セット)を同定した.胎児型遺伝子セットにはSca1遺伝子などLy6遺伝子ファミリーが含まれており,エンリッチメント解析により,Sca1陽性細胞における遺伝子の発現プロファイルは胎児型遺伝子セットと高い相同性を示した.この相同性は,胎児に由来する細胞塊や胎生期の大腸上皮細胞には発現するが成体の大腸上皮細胞には発現が認められないAnxa1などが修復上皮細胞に発現することからも強く支持された.また,潰瘍性大腸炎の患者に由来する炎症部位および健常部位それぞれの遺伝子発現プロファイル7) と,胎児型遺伝子セットやSca1陽性細胞において高発現する遺伝子セット(修復上皮遺伝子セット)との相関をエンリッチメント解析により調べたところ,胎児型遺伝子セットおよび修復上皮遺伝子セットはともに炎症部位における遺伝子発現プロファイルと高い相同性を示し,タンパク質のレベルにおいても,ANXA1がヒトの潰瘍性大腸炎の炎症部位に特異的な発現を示した.これらの結果から,修復上皮細胞が胎児期の未熟な腸管上皮細胞と類似した遺伝子の発現プロファイルをもつことが示され,この“胎児化”がヒトの潰瘍性大腸炎および潰瘍性大腸炎のモデルマウスにおいて共通する現象であることが示唆された(図1).
3.修復上皮細胞は高いFAKシグナル活性およびYAP活性を示す
修復上皮遺伝子セットにはLy6遺伝子ファミリーやAnnexin遺伝子ファミリー遺伝子にくわえ,細胞外基質に関連する遺伝子が多く含まれていた.傷害部位においてコラーゲン線維を可視化して観察したところ,修復上皮細胞は増生したコラーゲン線維につつまれており,コラーゲン線維の膜受容体であるβ1インテグリンおよびその下流のFAKやリン酸化Srcなども修復上皮細胞に強く発現することが確認され,上皮下間質における細胞外基質のリモデリングが大腸上皮組織の表現型に強く影響するようすが観察された.呼応するように,修復上皮細胞においてはYAP/TAZが強く発現し,修復上皮細胞における遺伝子の発現プロファイルは,腸管上皮細胞において活性型のYAPを強制発現した際に発現する遺伝子セット8)(YAP誘導遺伝子セット)とも高い相同性を示すことがエンリッチメント解析により明らかにされた.FAK阻害剤あるいはSrc阻害剤により大腸上皮組織の再生が抑制され,修復上皮細胞におけるYAP/TAZの活性も消失したことから,シグナルはコラーゲン→FAK-Src→YAP/TAZの経路で伝達されることが示唆された.
4.成体のしくみを利用して修復上皮細胞を人工的に分化させる
独自の初代培養系を用いてコラーゲン線維の腸管上皮細胞への影響を直接的に評価した.まず,EGF,Noggin,R-spondin1の存在下において腸管上皮細胞をコラーゲンに包埋して培養したが,ラミニンを主成分とするマトリゲルに包埋して培養するとオルガノイドが形成される5) ことと対照的に,培養はできなかった.しかしながら,EGF,Noggin,R-spondin1にくわえ,WntリガンドであるWnt3aを添加すると,マトリゲルあるいはコラーゲンに包埋して培養すると腸管上皮細胞は旺盛に増殖した.これらの細胞における遺伝子の発現をマイクロアレイ法により評価したところ,コラーゲンに包埋して培養した腸管上皮細胞においては修復上皮細胞および胎児のオルガノイドにおいて高い発現の認められるLy6遺伝子ファミリーやAnnexin遺伝子ファミリー,YAPの標的遺伝子であるAnkrd1遺伝子やCyr61遺伝子が高発現していた.逆に,成熟した幹細胞のマーカー遺伝子や分化のマーカー遺伝子の発現は著明に減弱した.タンパク質のレベルにおいても,コラーゲンに包埋して培養した腸管上皮細胞においては核に局在する強いYAPの発現が認められ,Sca1やAnxa1の強い発現も確認された.エンリッチメント解析により,コラーゲンに包埋して培養した腸管上皮細胞において発現の高い遺伝子セットは修復上皮細胞における遺伝子の発現プロファイルと高い相同性を示し,また,YAP誘導遺伝子セットおよび胎児型遺伝子セットもやはり高い相同性を示した.これらのことから,コラーゲン線維はWntリガンドと協調してYAPを活性化し,また,腸管上皮細胞を胎児型の修復上皮細胞へとリプログラミングする能力のあることが示唆された.
5.YAP/TAZは大腸上皮細胞のリプログラミングをつうじ大腸上皮組織の再生に必須である
コラーゲン線維はYAP/TAZの活性化を介して大腸上皮細胞をリプログラミングするのか,すなわち,転写因子の活性と表現型との因果関係について種々の遺伝子改変マウスを用いて確認した.Wntシグナル伝達経路の抑制性タンパク質であるApcのノックアウトによるWntシグナルの恒常的な活性化や,活性型のYAPの強制発現系を用いると9),コラーゲンに包埋しての培養に必須のWnt3aを含まない培地においても腸管上皮細胞は培養が可能になった.また,FAK阻害剤あるいはSrc阻害剤の存在下ではWnt3aが存在してもコラーゲンに包埋しての培養は困難であったが,活性型のYAPを強制発現することにより培養は可能になった.これらのことから,コラーゲン線維により腸管上皮細胞がリプログラミングされる際にはFAKおよびSrcを介するYAPの活性化が必須であることが示された.in vivoにおいてYAP/TAZのノックアウトにより大腸上皮組織の再生が完全に損なわれ,傷害上皮細胞におけるSca1の発現も消失し,大腸上皮細胞の傷害に関連するリプログラミングはYAP/TAZの活性によりひき起こされることが明らかにされた.
6.大腸上皮細胞のリプログラミングは可逆性である
再生期にみられる過形成性の変化は時間の経過とともに正常な大腸上皮細胞へと成熟する可逆性をもつ.コラーゲン線維とWntリガンドによるリプログラミングが大腸上皮組織の再生の機構であるなら,これは可逆性の変化でなければ論理的な整合性がとれない.マトリゲルに包埋して培養された成熟型の腸管上皮オルガノイドは,大腸上皮組織の傷害部位に移植10) されるとSca1陽性細胞へとリプログラミングされるとともに,傷害部位への生着にはYAP/TAZに依存性のリプログラミングが必須であったものの,未熟な腸管上皮細胞として生着したのちに成熟型の大腸上皮細胞へと分化した.さらに,コラーゲンに包埋し数回の培養により胎児型の修復上皮細胞にリプログラミングされた腸管上皮細胞は,マトリゲルに包埋しなおすと成熟型の腸管上皮オルガノイドに分化した.これらの結果から,コラーゲンとWntリガンドの協調による大腸上皮細胞のリプログラミングは,細胞の特性の可逆的な変化をひき起こす大腸上皮組織の再生のしくみとして論理的な整合性をもつことが示された.
おわりに
この研究は,炎症性腸疾患の病態の解明および粘膜の治癒の促進をめざした新規の治療法の開発にあたり,大腸上皮組織の再生を促進する作用点としての線維化およびその下流にある転写因子YAP/TAZの活性化をいかに制御するかが重要であることを示唆する画期的な成果である.炎症の遷延にともなう発がんの背景に大腸上皮細胞のリプログラミングのあることも示唆され,再生のみならず,発がんにも影響しうる線維化という現象が今後の腸管上皮組織の研究における重要なテーマのひとつとなることが示唆される.大腸上皮細胞のリプログラミングに異常のある場合には傷害の治癒が損なわれ粘膜に傷害が残存する可能性が示唆され,炎症性腸疾患の病因論の観点からも重要である.この研究においては,大腸上皮細胞のリプログラミングを模倣することにより,不純物をまったく含まないかたちで腸管上皮細胞に由来する細胞塊を作製する方法を確立したが,この細胞塊は難治性の腸疾患における再生医療において理想的な細胞の資材であると同時に,in vitroにおける上皮組織の再生の過程のモデルとしても価値をもつと考えられる.
文 献
- Cai, J., Zhang, N., Zheng, Y. et al.: The Hippo signaling pathway restricts the oncogenic potential of an intestinal regeneration program. Genes Dev., 24, 2383-2388 (2010)[PubMed]
- Ding, S., Walton, K., Blue, R. et al.: Mucosal healing and fibrosis after acute or chronic inflammation in wild type FVB-N mice and C57BL6 procollagen α1(I)-promoter-GFP reporter mice. PLoS One, 7 e42568 (2012)[PubMed]
- Munoz, J., Stange, D. E., Schepers, A. G. et al.: The Lgr5 intestinal stem cell signature: robust expression of proposed quiescent '+4' cell markers. EMBO J., 31, 3079-3091 (2012)[PubMed]
- Wong, V. W., Stange, D. E., Page, M. E. et al.: Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat. Cell Biol., 14, 401-408 (2012)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Fordham, R. P., Yui, S., Hannan, N. R. et al.: Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell, 13, 734-744 (2013)[PubMed] [新着論文レビュー]
- Van der Goten, J., Vanhove, W., Lemaire, K. et al.: Integrated miRNA and mRNA expression profiling in inflamed colon of patients with ulcerative colitis. PLoS One, 9, e116117 (2014)[PubMed]
- Gregorieff, A., Liu, Y., Inanlou, M. R. et al.: Yap-dependent reprogramming of Lgr5+ stem cells drives intestinal regeneration and cancer. Nature, 526, 715-718 (2015)[PubMed]
- Azzolin, L., Panciera, T., Soligo, S. et al.: YAP/TAZ incorporation in the β-catenin destruction complex orchestrates the Wnt response. Cell, 158, 157-170 (2014)[PubMed]
- Yui, S., Nakamura, T., Sato, T. et al.: Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat. Med., 18, 618-623 (2012)[PubMed]
著者プロフィール
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科 修了,同年 同 メディカルフェロー,2013年 デンマークCopenhagen大学 博士研究員を経て,2017年より東京医科歯科大学統合研究機構 助教.
研究テーマ:腸管の再生医療,上皮組織の再生の機構.
抱負:腸管上皮細胞には非常に自律的な増殖能があり,現在,その増殖能に関する知識がオルガノイド培養という腸管上皮細胞を体外で培養する技術に生かされています.体外で旺盛に増殖する腸管上皮細胞の特性を生かした新しい再生医療の開発をめざすと同時に,上皮組織の再生のしくみの詳細を研究することにより科学的な知識に立脚した新しい炎症性腸疾患の診療を展開したいと思っています.
中村 哲也(Tetsuya Nakamura)
東京医科歯科大学大学院医歯学総合研究科 教授.
渡辺 守(Mamoru Watanabe)
東京医科歯科大学大学院医歯学総合研究科 教授.
© 2018 油井史郎・中村哲也・渡辺 守 Licensed under CC 表示 2.1 日本