Rad51に依存的なDNA鎖交換反応は2種類の3本鎖DNA中間体をへて進行する
伊藤健太郎1・村山泰斗1・TAKAHASHI MASAYUKI 2・岩崎博史1
(1東京工業大学科学技術創成研究院 細胞制御工学研究センター,2東京工業大学生命理工学院)
email:岩崎博史
DOI: 10.7875/first.author.2018.001
Two three-strand intermediates are processed during Rad51-driven DNA strand exchange.
Kentaro Ito, Yasuto Murayama, Masayuki Takahashi, Hiroshi Iwasaki
Nature Structural & Molecular Biology, 25, 29-36 (2018)
相同組換えにおいて,Rad51は1本鎖DNAと結合してフィラメント構造を形成し,相同な2本鎖DNAとのDNA鎖交換反応を行う.この研究において,筆者らは,リアルタイムアッセイ系を用いて,分裂酵母のRad51によるDNA鎖交換反応は2種類の異なる3本鎖DNA中間体をへて進行することを見い出した.2種類の3本鎖DNA中間体ともRad51を含むが,C1中間体では取り込まれた2本鎖DNAの対合は維持されているのに対し,C2中間体では1本鎖DNAが取り込まれた2本鎖DNAの相補鎖と対合して新たな2本鎖DNAを形成していた.進化的に保存されているSwi5-Sfr1ヘテロ二量体は,C1中間体からC2中間体への遷移およびC2中間体からの1本鎖DNAの放出を促進し,これは,Rad51によるATPの加水分解を必要とした.一方,Ca2+はRad51のATPase活性を抑制することによりRad51と1本鎖DNAからなるフィラメント構造を活性型に維持し,DNA鎖交換反応を促進すると考えられていた.今回,リアルタイムアッセイ系を用いることにより,Ca2+はRad51によるATPの加水分解には関係なくC1中間体からC2中間体への遷移を促進するが,C2中間体からの1本鎖DNAの放出は促進しないことがわかった.すなわち,Swi5-Sfr1ヘテロ二量体とCa2+は,Rad51と1本鎖DNAからなるフィラメント構造を安定化するという共通の機能をもつが,3本鎖DNA中間体の形成ののちには異なる機構により反応を促進することが明らかにされた.
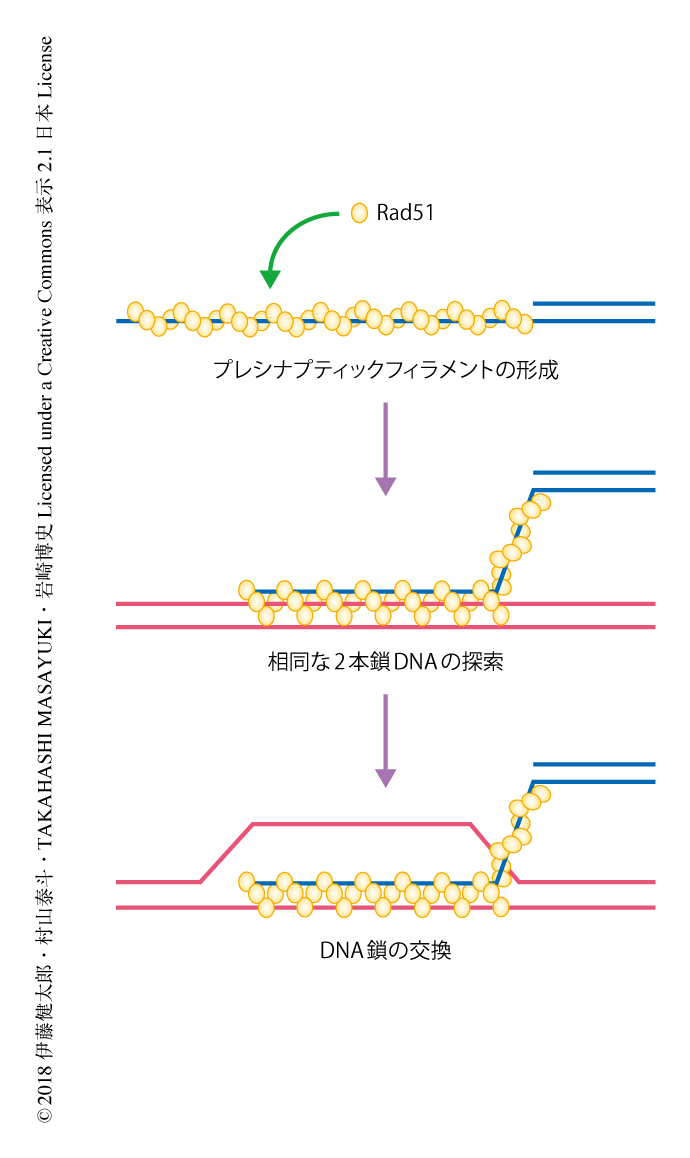
相同組換えは遺伝的な多様性の獲得やゲノムの安定性に関与する.相同組換えの中心的な過程は,進化的に高度に保存されたRecAファミリーリコンビナーゼが触媒するDNA鎖交換反応である.このファミリーには,細菌のRecAのほか,真核生物においてはRad51およびDmc1が,古細菌においてはRadAが属する1).一般に,リコンビナーゼは1本鎖DNAと結合してプレシナプティックフィラメントとよばれる右巻きのらせん構造を構築し,相同な2本鎖DNAを探索しこれが存在すると1本鎖DNAをひきはがして相補鎖と対合する,DNA鎖交換反応を触媒する(図1).プレシナプティックフィラメントにおいて,リコンビナーゼはATPと結合した状態が活性型であり,ADPと結合したときは不活性型であると考えられている2).
真核生物のRad51によるDNA鎖交換反応においては,Rad51と相互作用するいくつかのタンパク質が知られている.筆者らは,Rad51と相互作用してDNA鎖交換反応を促進するタンパク質として分裂酵母からSwi5-Sfr1ヘテロ二量体を発見し3),その機能の解析をつづけてきた.これまでに,以下のことが明らかにされている4).1)Swi5-Sfr1ヘテロ二量体はRad51によるDNA鎖交換反応を促進する5).2)Swi5-Sfr1ヘテロ二量体はRad51のもつ1本鎖DNAに依存的なATPase活性を促進する5).3)Swi5-Sfr1ヘテロ二量体はRad51と1本鎖DNAからなるプレシナプティックフィラメントを安定化する6).4)構造解析によりSwi5-Sfr1ヘテロ二量体は“く”の字型をしている.そして,ドッキング実験から,Swi5-Sfr1ヘテロ二量体がプレシナプティックフィラメントのらせん構造の溝にはまり込むことによりこれを安定化するというモデルを提唱した7,8).しかし,プレシナプティックフィラメントを安定化するというだけではSwi5-Sfr1ヘテロ二量体によるDNA鎖交換反応の促進の効果は十分には説明されない.
一方,Ca2+がRad51のDNA鎖交換反応を促進することが知られている9).その機構として,Ca2+はRad51の1本鎖DNAに依存的なATPase活性を阻害することにより,Rad51を活性型であるATP結合型に固定することでDNA鎖交換反応を促進するというモデルが提唱された.しかし,Swi5-Sfr1ヘテロ二量体はRad51のATPase活性を促進することから,たんにATPaseを阻害することでDNA鎖交換反応が促進されるという機構では,Swi5-Sfr1ヘテロ二量体およびCa2+による促進の機構は合理的には説明されない.また,そもそも,構造的な観点からも,Rad51によるDNA鎖交換反応には不明な点が多く存在する.この研究において,筆者らは,分裂酵母のRad51によるDNA鎖交換反応をリアルタイムで観察する系を確立し,これらの問題の解決を試みた.
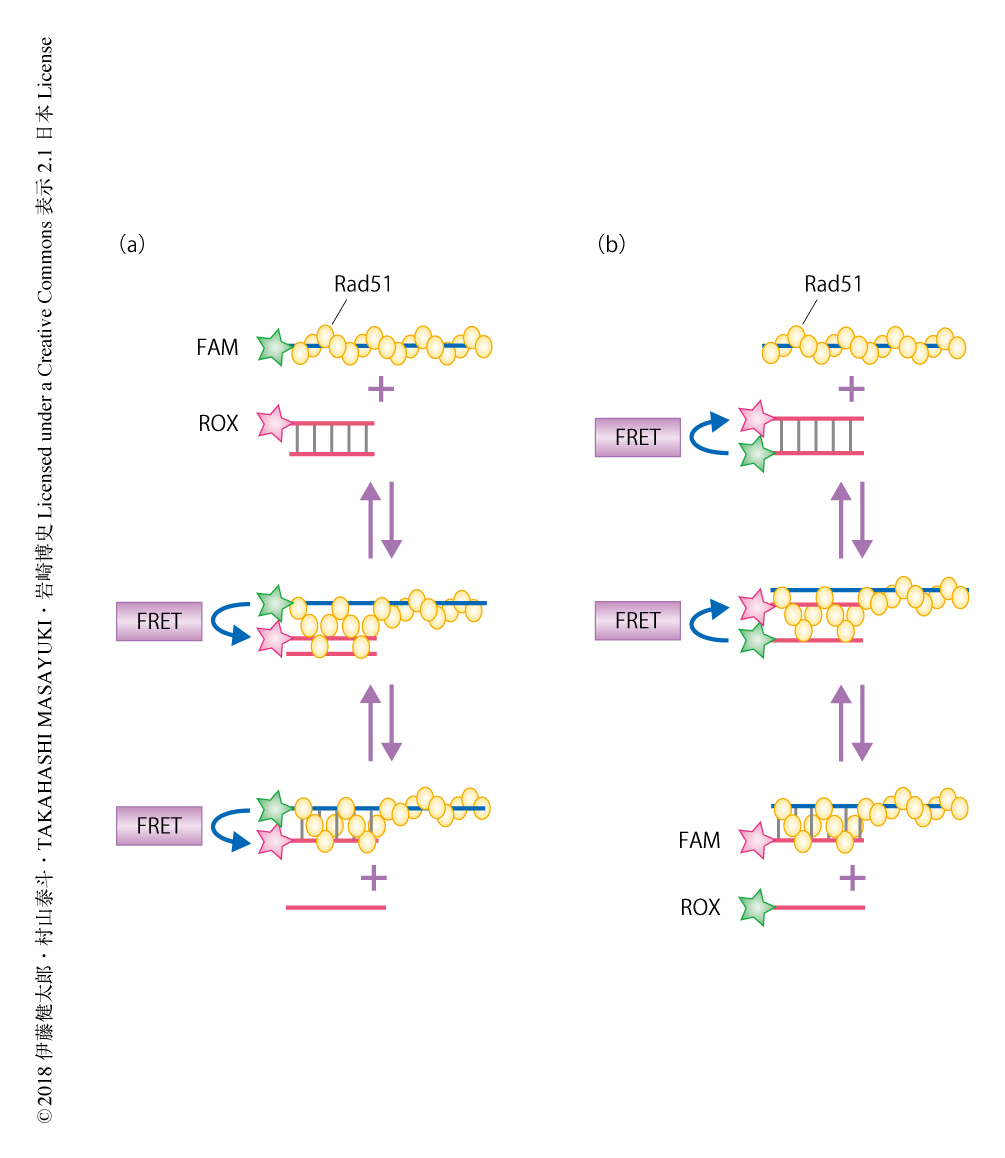
すでに報告されているアッセイ系10) を改良して,プレシナプティックフィラメントと2本鎖DNAとが対合する過程を観察するDNA鎖ペアリングアッセイ,および,形成された3本鎖DNA中間体から1本鎖DNAが放出される過程を観察するDNA鎖解離アッセイを構築した.これは,オリゴDNAの末端を2種類の蛍光基により標識して,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)の原理を利用したものである(図2).
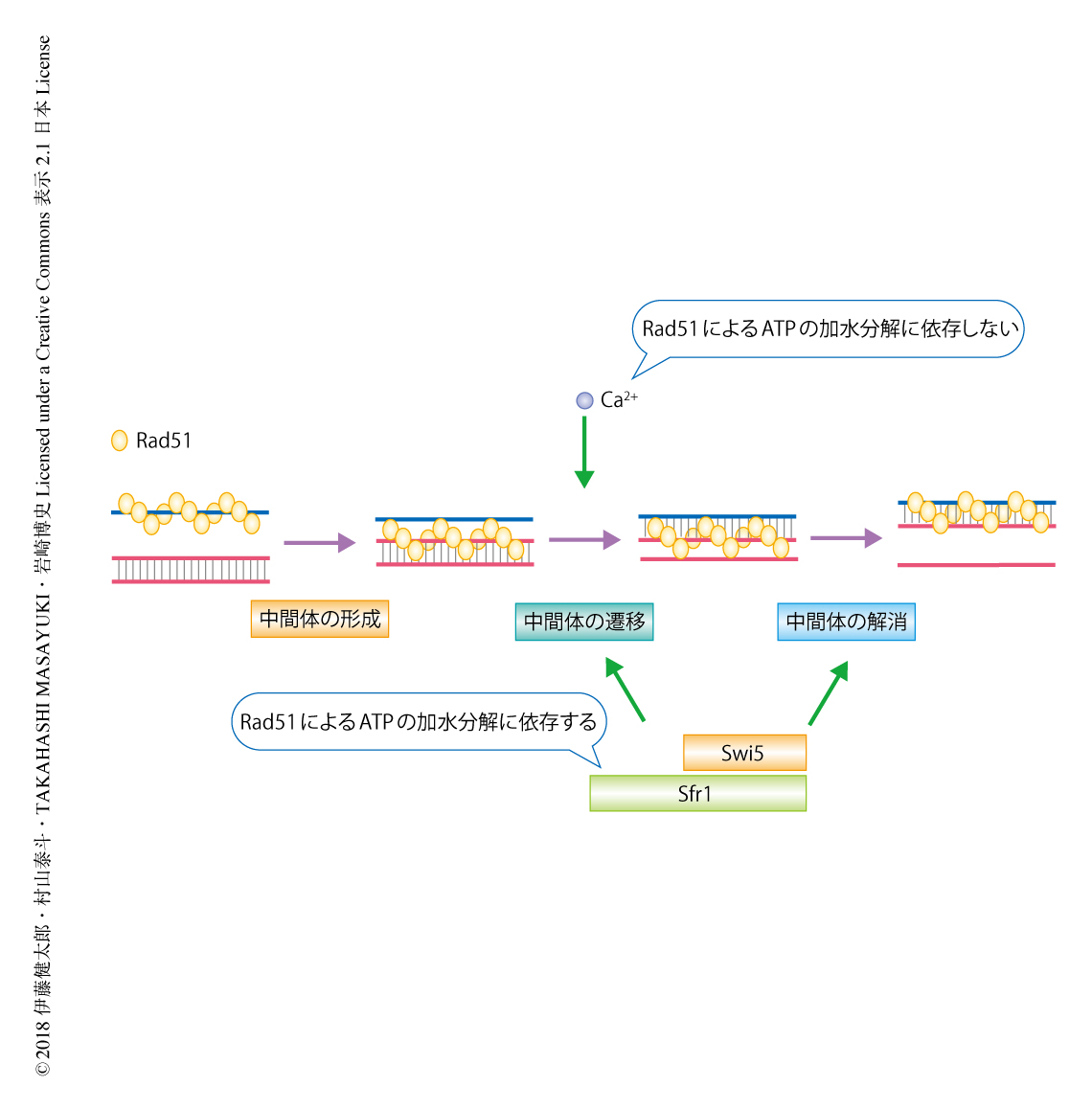
得られた結果をシミュレーションして,DNA鎖交換反応を動力学的に解析した.その結果,Rad51によるDNA鎖交換反応は,1)1本鎖DNAと相同な2本鎖DNAとの3本鎖DNA中間体(C1中間体)の形成,2)C1中間体から質的に異なる第2の3本鎖DNA中間体(C2中間体)への遷移,3)C2中間体からの1本鎖DNAの放出,の3つの段階で進行することが明らかにされた(図3).さらに,非加水分解性のATPアナログであるAMP-PNPを用いた実験から,C1中間体の形成にはRad51へのATPの結合が必須で,そののちの過程,とくに最終産物の生成にはRad51によるATPの加水分解が重要であることが明らかにされた.
Swi5-Sfr1ヘテロ二量体による促進の効果について調べてみると,その効果は濃度に依存的であり,至適条件はRad51に対し1/5~1/10等量のSwi5-Sfr1ヘテロ二量体であった.一方,これより過剰量のSwi5-Sfr1ヘテロ二量体はDNA鎖交換反応を阻害した.この特徴は,以前の生化学的な実験による報告と一致した5,8).至適濃度においてSwi5-Sfr1ヘテロ二量体の反応平衡定数をもとめると,K1値(C1中間体の形成)についてはSwi5-Sfr1ヘテロ二量体の有無により変化はなかったが,K2値(C1中間体からC2中間体への遷移)およびK3値(C2中間体から1本鎖DNAの放出)についてはともに5倍ほど上昇していた.この効果はATPの存在下においてのみ観察され,AMP-PNPの存在下においては起こらなかった.このことから,Swi5-Sfr1ヘテロ二量体は,C1中間体の形成は促進しないが,Rad51によるATPの加水分解に依存してC1中間体からC2中間体への遷移および最終産物の生成を強く促進することが判明した.すなわち,Swi5-Sfr1ヘテロ二量体はRad51の反応活性を直接的に変化させてDNA鎖交換反応を促進するアクチベーターであった(図3).
DNA鎖交換反応においてドナーとなる2本鎖DNAの長さの影響について検討した.その結果,Swi5-Sfr1ヘテロ二量体が存在しないとき,K1値およびK3値はDNA鎖の長さに大きな影響をうけなかったが,K2値はDNA鎖が長くなればなるほど低下した.至適濃度のSwi5-Sfr1ヘテロ二量体が存在するとき,K1値に対しDNA鎖の長さは影響しなかったが,K2値はDNA鎖が長くなると低下した.しかし,Swi5-Sfr1ヘテロ二量体の促進の効果,すなわち,Swi5-Sfr1ヘテロ二量体が存在するときと存在しないときの反応定数の比は,DNA鎖が長いときに顕著に大きかった.一方,20 bpの短い2本鎖DNAを用いた場合には促進の効果はまったくなかった.また,K3値については,Swi5-Sfr1ヘテロ二量体が存在するとき,2本鎖DNAが長ければ長いほど促進の効果が顕著であった.このことから,短いDNAとのあいだではC1中間体からC2中間体への遷移の過程およびC2中間体から1本鎖DNAの放出の過程はRad51の単独の活性により進行しうるが,ドナーとなる2本鎖DNAが長くなるとSwi5-Sfr1ヘテロ二量体の助けを必要とすることが示唆された.この結果からも,DNA鎖交換反応の後半の2つの過程がSwi5-Sfr1ヘテロ二量体の作用点であることが支持された.
Ca2+はRad51によるDNA鎖交換反応を促進することが知られている9).Swi5-Sfr1ヘテロ二量体との差異を明らかにするため,Ca2+によるDNA鎖交換反応の促進の機構についてリアルタイムアッセイ系を用いて解析した.その結果,Ca2+はC1中間体の形成には影響せず,C1中間体からC2中間体への遷移を強く促進することがわかった.中間体の遷移の反応平衡定数はMg2+と比べ10倍以上も上昇した.AMP-PNPでも同様な効果があったことから,Ca2+による中間体の遷移の促進はATPの加水分解を必要としないことがわかった.しかし一方で,Ca2+は最終産物の生成はまったく促進しなかった(図3).このことから,最後の過程であるC2中間体からの1本鎖DNAの放出にはRad51によるATPの加水分解が重要であることが明らかにされた.ちなみに,Ca2+の存在下においてはSwi5-Sfr1ヘテロ二量体の効果はまったくなかった.
C1中間体およびC2中間体の実体は何か? この問題にせまるため,DNA鎖交換反応の途中でEDTAを添加して反応を強制的に停止した.Rad51とDNAとの結合には2価の陽イオンに依存的なヌクレオチドの要求性がある.そのため,EDTAを添加してDNA鎖交換反応を強制的に停止させると,3本鎖DNA中間体に含まれるRad51は遊離し,3本のDNA鎖のうち,どれとどれが対合していたのかを調べることが可能になる.すなわち,DNA鎖ペアリングアッセイを強制停止させて蛍光強度が上昇すればC1中間体に取り込まれた2本鎖DNAの存在することが,一方,DNA鎖解離アッセイを強制停止させて蛍光強度が上昇すればC2中間体に新たな2本鎖DNAの存在することが予想される.これを利用して,Mg2+ + ATP,Mg2+ + AMP-PNP,Mg2+ + ATP + Swi5-Sfr1,Ca2+ + ATP,Ca2+ + AMP-PNPの5つの反応条件について調べた.その結果,DNA鎖ペアリングアッセイの強制停止においては,5つの反応条件ともC1中間体に取り込まれた2本鎖DNAの存在が確認された.このことから,これらの反応条件においてC1中間体は取り込まれた2本鎖DNAを含むことが示唆された.一方,DNA鎖解離アッセイにおいては,Ca2+の存在する2種類の条件においてC2中間体の蓄積が観察され,Mg2+の存在する条件においてはC2中間体の蓄積は認められなかった.さきの実験から,Ca2+の存在下においてC2中間体の蓄積することはわかっていたが,C2中間体を崩壊させると最終産物が生成されたことから,C2中間体においては,すでに1本鎖DNAが取り込まれた2本鎖DNAの相補鎖と対合して新たな2本鎖DNAを形成していることが示された.以上の結果から,C1中間体には取り込まれた2本鎖DNAが,C2中間体には新たな2本鎖DNAが含まれることが示され,C1中間体からC2中間体への遷移は実際にDNA鎖が交換される過程であることが明らかにされた.
この研究においては,Rad51に依存的なDNA鎖交換反応の素反応が3つの過程から構成されることが明らかにされたとともに,Swi5-Sfr1ヘテロ二量体およびCa2+によるRad51に依存的なDNA鎖交換反応の活性化の機構について解明された.これまで,RecAあるいはRad51と1本鎖DNAからなるプレシナプティックフィラメントの安定化が作用点となる活性化因子は多く報告されていたが,今回,DNA鎖交換反応そのものの活性化因子の存在がはじめて明らかにされた.Swi5-Sfr1ヘテロ二量体は酵母からヒトまで広く保存されており,Swi5-Sfr1ヘテロ二量体によるRad51の活性の制御機構は真核生物において普遍的に機能すると考えられる.
略歴:2017年 東京工業大学大学院生命理工学研究科 単位取得後満期退学,同年より東京工業大学生命理工学院 研究員.
村山 泰斗(Yasuto Murayama)
国立遺伝学研究所 准教授.
TAKAHASHI MASAYUKI(Masayuki Takahashi)
東京工業大学生命理工学院 教授.
岩崎 博史(Hiroshi Iwasaki)
東京工業大学科学技術創成研究院 教授.
研究室URL:http://www.iwasakilab.bio.titech.ac.jp
© 2018 伊藤健太郎・村山泰斗・TAKAHASHI MASAYUKI・岩崎博史 Licensed under CC 表示 2.1 日本
(1東京工業大学科学技術創成研究院 細胞制御工学研究センター,2東京工業大学生命理工学院)
email:岩崎博史
DOI: 10.7875/first.author.2018.001
Two three-strand intermediates are processed during Rad51-driven DNA strand exchange.
Kentaro Ito, Yasuto Murayama, Masayuki Takahashi, Hiroshi Iwasaki
Nature Structural & Molecular Biology, 25, 29-36 (2018)
要 約
相同組換えにおいて,Rad51は1本鎖DNAと結合してフィラメント構造を形成し,相同な2本鎖DNAとのDNA鎖交換反応を行う.この研究において,筆者らは,リアルタイムアッセイ系を用いて,分裂酵母のRad51によるDNA鎖交換反応は2種類の異なる3本鎖DNA中間体をへて進行することを見い出した.2種類の3本鎖DNA中間体ともRad51を含むが,C1中間体では取り込まれた2本鎖DNAの対合は維持されているのに対し,C2中間体では1本鎖DNAが取り込まれた2本鎖DNAの相補鎖と対合して新たな2本鎖DNAを形成していた.進化的に保存されているSwi5-Sfr1ヘテロ二量体は,C1中間体からC2中間体への遷移およびC2中間体からの1本鎖DNAの放出を促進し,これは,Rad51によるATPの加水分解を必要とした.一方,Ca2+はRad51のATPase活性を抑制することによりRad51と1本鎖DNAからなるフィラメント構造を活性型に維持し,DNA鎖交換反応を促進すると考えられていた.今回,リアルタイムアッセイ系を用いることにより,Ca2+はRad51によるATPの加水分解には関係なくC1中間体からC2中間体への遷移を促進するが,C2中間体からの1本鎖DNAの放出は促進しないことがわかった.すなわち,Swi5-Sfr1ヘテロ二量体とCa2+は,Rad51と1本鎖DNAからなるフィラメント構造を安定化するという共通の機能をもつが,3本鎖DNA中間体の形成ののちには異なる機構により反応を促進することが明らかにされた.
はじめに
相同組換えは遺伝的な多様性の獲得やゲノムの安定性に関与する.相同組換えの中心的な過程は,進化的に高度に保存されたRecAファミリーリコンビナーゼが触媒するDNA鎖交換反応である.このファミリーには,細菌のRecAのほか,真核生物においてはRad51およびDmc1が,古細菌においてはRadAが属する1).一般に,リコンビナーゼは1本鎖DNAと結合してプレシナプティックフィラメントとよばれる右巻きのらせん構造を構築し,相同な2本鎖DNAを探索しこれが存在すると1本鎖DNAをひきはがして相補鎖と対合する,DNA鎖交換反応を触媒する(図1).プレシナプティックフィラメントにおいて,リコンビナーゼはATPと結合した状態が活性型であり,ADPと結合したときは不活性型であると考えられている2).
真核生物のRad51によるDNA鎖交換反応においては,Rad51と相互作用するいくつかのタンパク質が知られている.筆者らは,Rad51と相互作用してDNA鎖交換反応を促進するタンパク質として分裂酵母からSwi5-Sfr1ヘテロ二量体を発見し3),その機能の解析をつづけてきた.これまでに,以下のことが明らかにされている4).1)Swi5-Sfr1ヘテロ二量体はRad51によるDNA鎖交換反応を促進する5).2)Swi5-Sfr1ヘテロ二量体はRad51のもつ1本鎖DNAに依存的なATPase活性を促進する5).3)Swi5-Sfr1ヘテロ二量体はRad51と1本鎖DNAからなるプレシナプティックフィラメントを安定化する6).4)構造解析によりSwi5-Sfr1ヘテロ二量体は“く”の字型をしている.そして,ドッキング実験から,Swi5-Sfr1ヘテロ二量体がプレシナプティックフィラメントのらせん構造の溝にはまり込むことによりこれを安定化するというモデルを提唱した7,8).しかし,プレシナプティックフィラメントを安定化するというだけではSwi5-Sfr1ヘテロ二量体によるDNA鎖交換反応の促進の効果は十分には説明されない.
一方,Ca2+がRad51のDNA鎖交換反応を促進することが知られている9).その機構として,Ca2+はRad51の1本鎖DNAに依存的なATPase活性を阻害することにより,Rad51を活性型であるATP結合型に固定することでDNA鎖交換反応を促進するというモデルが提唱された.しかし,Swi5-Sfr1ヘテロ二量体はRad51のATPase活性を促進することから,たんにATPaseを阻害することでDNA鎖交換反応が促進されるという機構では,Swi5-Sfr1ヘテロ二量体およびCa2+による促進の機構は合理的には説明されない.また,そもそも,構造的な観点からも,Rad51によるDNA鎖交換反応には不明な点が多く存在する.この研究において,筆者らは,分裂酵母のRad51によるDNA鎖交換反応をリアルタイムで観察する系を確立し,これらの問題の解決を試みた.
1.Rad51によるDNA鎖交換反応は3つの過程から構成される
すでに報告されているアッセイ系10) を改良して,プレシナプティックフィラメントと2本鎖DNAとが対合する過程を観察するDNA鎖ペアリングアッセイ,および,形成された3本鎖DNA中間体から1本鎖DNAが放出される過程を観察するDNA鎖解離アッセイを構築した.これは,オリゴDNAの末端を2種類の蛍光基により標識して,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)の原理を利用したものである(図2).
得られた結果をシミュレーションして,DNA鎖交換反応を動力学的に解析した.その結果,Rad51によるDNA鎖交換反応は,1)1本鎖DNAと相同な2本鎖DNAとの3本鎖DNA中間体(C1中間体)の形成,2)C1中間体から質的に異なる第2の3本鎖DNA中間体(C2中間体)への遷移,3)C2中間体からの1本鎖DNAの放出,の3つの段階で進行することが明らかにされた(図3).さらに,非加水分解性のATPアナログであるAMP-PNPを用いた実験から,C1中間体の形成にはRad51へのATPの結合が必須で,そののちの過程,とくに最終産物の生成にはRad51によるATPの加水分解が重要であることが明らかにされた.
2.Swi5-Sfr1ヘテロ二量体はATPの加水分解に依存的に中間体の遷移および1本鎖DNAの放出を促進する
Swi5-Sfr1ヘテロ二量体による促進の効果について調べてみると,その効果は濃度に依存的であり,至適条件はRad51に対し1/5~1/10等量のSwi5-Sfr1ヘテロ二量体であった.一方,これより過剰量のSwi5-Sfr1ヘテロ二量体はDNA鎖交換反応を阻害した.この特徴は,以前の生化学的な実験による報告と一致した5,8).至適濃度においてSwi5-Sfr1ヘテロ二量体の反応平衡定数をもとめると,K1値(C1中間体の形成)についてはSwi5-Sfr1ヘテロ二量体の有無により変化はなかったが,K2値(C1中間体からC2中間体への遷移)およびK3値(C2中間体から1本鎖DNAの放出)についてはともに5倍ほど上昇していた.この効果はATPの存在下においてのみ観察され,AMP-PNPの存在下においては起こらなかった.このことから,Swi5-Sfr1ヘテロ二量体は,C1中間体の形成は促進しないが,Rad51によるATPの加水分解に依存してC1中間体からC2中間体への遷移および最終産物の生成を強く促進することが判明した.すなわち,Swi5-Sfr1ヘテロ二量体はRad51の反応活性を直接的に変化させてDNA鎖交換反応を促進するアクチベーターであった(図3).
DNA鎖交換反応においてドナーとなる2本鎖DNAの長さの影響について検討した.その結果,Swi5-Sfr1ヘテロ二量体が存在しないとき,K1値およびK3値はDNA鎖の長さに大きな影響をうけなかったが,K2値はDNA鎖が長くなればなるほど低下した.至適濃度のSwi5-Sfr1ヘテロ二量体が存在するとき,K1値に対しDNA鎖の長さは影響しなかったが,K2値はDNA鎖が長くなると低下した.しかし,Swi5-Sfr1ヘテロ二量体の促進の効果,すなわち,Swi5-Sfr1ヘテロ二量体が存在するときと存在しないときの反応定数の比は,DNA鎖が長いときに顕著に大きかった.一方,20 bpの短い2本鎖DNAを用いた場合には促進の効果はまったくなかった.また,K3値については,Swi5-Sfr1ヘテロ二量体が存在するとき,2本鎖DNAが長ければ長いほど促進の効果が顕著であった.このことから,短いDNAとのあいだではC1中間体からC2中間体への遷移の過程およびC2中間体から1本鎖DNAの放出の過程はRad51の単独の活性により進行しうるが,ドナーとなる2本鎖DNAが長くなるとSwi5-Sfr1ヘテロ二量体の助けを必要とすることが示唆された.この結果からも,DNA鎖交換反応の後半の2つの過程がSwi5-Sfr1ヘテロ二量体の作用点であることが支持された.
3.Ca2+はATPの加水分解に非依存的に中間体の遷移を促進する
Ca2+はRad51によるDNA鎖交換反応を促進することが知られている9).Swi5-Sfr1ヘテロ二量体との差異を明らかにするため,Ca2+によるDNA鎖交換反応の促進の機構についてリアルタイムアッセイ系を用いて解析した.その結果,Ca2+はC1中間体の形成には影響せず,C1中間体からC2中間体への遷移を強く促進することがわかった.中間体の遷移の反応平衡定数はMg2+と比べ10倍以上も上昇した.AMP-PNPでも同様な効果があったことから,Ca2+による中間体の遷移の促進はATPの加水分解を必要としないことがわかった.しかし一方で,Ca2+は最終産物の生成はまったく促進しなかった(図3).このことから,最後の過程であるC2中間体からの1本鎖DNAの放出にはRad51によるATPの加水分解が重要であることが明らかにされた.ちなみに,Ca2+の存在下においてはSwi5-Sfr1ヘテロ二量体の効果はまったくなかった.
4.C1中間体とC2中間体は対合するDNA鎖が異なる
C1中間体およびC2中間体の実体は何か? この問題にせまるため,DNA鎖交換反応の途中でEDTAを添加して反応を強制的に停止した.Rad51とDNAとの結合には2価の陽イオンに依存的なヌクレオチドの要求性がある.そのため,EDTAを添加してDNA鎖交換反応を強制的に停止させると,3本鎖DNA中間体に含まれるRad51は遊離し,3本のDNA鎖のうち,どれとどれが対合していたのかを調べることが可能になる.すなわち,DNA鎖ペアリングアッセイを強制停止させて蛍光強度が上昇すればC1中間体に取り込まれた2本鎖DNAの存在することが,一方,DNA鎖解離アッセイを強制停止させて蛍光強度が上昇すればC2中間体に新たな2本鎖DNAの存在することが予想される.これを利用して,Mg2+ + ATP,Mg2+ + AMP-PNP,Mg2+ + ATP + Swi5-Sfr1,Ca2+ + ATP,Ca2+ + AMP-PNPの5つの反応条件について調べた.その結果,DNA鎖ペアリングアッセイの強制停止においては,5つの反応条件ともC1中間体に取り込まれた2本鎖DNAの存在が確認された.このことから,これらの反応条件においてC1中間体は取り込まれた2本鎖DNAを含むことが示唆された.一方,DNA鎖解離アッセイにおいては,Ca2+の存在する2種類の条件においてC2中間体の蓄積が観察され,Mg2+の存在する条件においてはC2中間体の蓄積は認められなかった.さきの実験から,Ca2+の存在下においてC2中間体の蓄積することはわかっていたが,C2中間体を崩壊させると最終産物が生成されたことから,C2中間体においては,すでに1本鎖DNAが取り込まれた2本鎖DNAの相補鎖と対合して新たな2本鎖DNAを形成していることが示された.以上の結果から,C1中間体には取り込まれた2本鎖DNAが,C2中間体には新たな2本鎖DNAが含まれることが示され,C1中間体からC2中間体への遷移は実際にDNA鎖が交換される過程であることが明らかにされた.
おわりに
この研究においては,Rad51に依存的なDNA鎖交換反応の素反応が3つの過程から構成されることが明らかにされたとともに,Swi5-Sfr1ヘテロ二量体およびCa2+によるRad51に依存的なDNA鎖交換反応の活性化の機構について解明された.これまで,RecAあるいはRad51と1本鎖DNAからなるプレシナプティックフィラメントの安定化が作用点となる活性化因子は多く報告されていたが,今回,DNA鎖交換反応そのものの活性化因子の存在がはじめて明らかにされた.Swi5-Sfr1ヘテロ二量体は酵母からヒトまで広く保存されており,Swi5-Sfr1ヘテロ二量体によるRad51の活性の制御機構は真核生物において普遍的に機能すると考えられる.
文 献
- Haber, J. E.: Genome Stability: DNA Repair and Recombination. Gerland Science, New York (2013)
- Yu, X., Jacobs, S. A., West, S. C. et al.: Domain structure and dynamics in the helical filaments formed by RecA and Rad51 on DNA. Proc. Natl. Acad. Sci. USA, 98, 8419-8424 (2001)[PubMed]
- Akamatsu, Y., Dziadkowiec, D., Ikeguchi, M. et al.: Two different Swi5-containing protein complexes are involved in mating-type switching and recombination repair in fission yeast. Proc. Natl. Acad. Sci. USA, 100, 15770-15775 (2003)[PubMed]
- Argunhan, B., Murayama, Y. & Iwasaki, H.: The differentiated and conserved roles of Swi5-Sfr1 in homologous recombination. FEBS Lett., 591, 2035-2047 (2017)[PubMed]
- Haruta, N., Kurokawa, Y., Murayama, Y. et al.: The Swi5-Sfr1 complex stimulates Rhp51/Rad51 - and Dmc1-mediated DNA strand exchange in vitro. Nat. Struct. Mol. Biol., 13, 823-830 (2006)[PubMed]
- Kurokawa, Y., Murayama, Y., Haruta-Takahashi, N. et al.: Reconstitution of DNA strand exchange mediated by Rhp51 recombinase and two mediators. PLoS Biol., 6, e88 (2008)[PubMed]
- Kokabu, Y., Murayama, Y., Kuwabara, N. et al.: Fission yeast Swi5-Sfr1 protein complex, an activator of Rad51 recombinase, forms an extremely elongated dogleg-shaped structure. J. Biol. Chem., 286, 43569-43576 (2011)[PubMed]
- Kuwabara, N., Murayama, Y., Hashimoto, H. et al.: Mechanistic insights into the activation of Rad51-mediated strand exchange from the structure of a recombination activator, the Swi5-Sfr1 complex. Structure, 20, 440-449 (2012)[PubMed]
- Bugreev, D. V. & Mazin, A. V.: Ca2+ activates human homologous recombination protein Rad51 by modulating its ATPase activity. Proc. Natl. Acad. Sci. USA, 101, 9988-9993 (2004)[PubMed]
- Bazemore, L. R., Takahashi, M. & Radding, C. M.: Kinetic analysis of pairing and strand exchange catalyzed by RecA. Detection by fluorescence energy transfer. J. Biol. Chem., 272, 14672-14682 (1997)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 東京工業大学大学院生命理工学研究科 単位取得後満期退学,同年より東京工業大学生命理工学院 研究員.
村山 泰斗(Yasuto Murayama)
国立遺伝学研究所 准教授.
TAKAHASHI MASAYUKI(Masayuki Takahashi)
東京工業大学生命理工学院 教授.
岩崎 博史(Hiroshi Iwasaki)
東京工業大学科学技術創成研究院 教授.
研究室URL:http://www.iwasakilab.bio.titech.ac.jp
© 2018 伊藤健太郎・村山泰斗・TAKAHASHI MASAYUKI・岩崎博史 Licensed under CC 表示 2.1 日本