多能性幹細胞から腎臓の高次構造を構築する
太口敦博・西中村隆一
(熊本大学発生医学研究所 腎臓発生分野)
email:太口敦博,西中村隆一
DOI: 10.7875/first.author.2017.136
Higher-order kidney organogenesis from pluripotent stem cells.
Atsuhiro Taguchi, Ryuichi Nishinakamura
Cell Stem Cell, 21, 730-746.e6 (2017)
これまで,多能性幹細胞からさまざまな臓器の細胞や組織を形成させる方法が報告されているが,多くの場合,臓器の機能単位をなす小構造の再現にとどまっており,小構造どうしが有機的に連結された高次構造の再現にはいたっていない.腎臓はおもにネフロン前駆細胞,尿管芽,間質前駆細胞の相互作用によりかたちづくられるが,そのなかでも,尿管芽は発生の過程において樹状の分岐をくり返しながら高次構造を組織化する役割をもつ.腎臓については多能性幹細胞からネフロン前駆細胞をへて機能単位であるネフロンを形成させる方法が報告されてきたが,尿管芽を分化させる方法は確立されておらず,高次構造の再現にはいたっていなかった.この研究において,筆者らは,尿管芽の生体における初期の発生の過程を解析することにより,尿管芽の分化および成熟に必要なシグナルを同定し,多能性幹細胞から尿管芽を選択的に分化させる方法を確立した.さらに,多能性幹細胞から分化させたネフロン前駆細胞とマウスの胎仔から採取した間質前駆細胞と組み合わせることにより,多能性幹細胞からネフロンどうしが集合管により接続された腎臓の高次構造を構築することに成功した.
近年,多能性幹細胞からさまざまな臓器の立体的な構造を模した組織“オルガノイド”を構築する方法が報告され,臓器の発生のモデルおよび疾患の研究へと広く応用されている.これらの多くは,いわゆる細胞の自己組織化を利用し,ひとつのプロトコールにより分化させた細胞の細胞間コミュニケーションにより組織を細胞まかせに形成させるという戦略をとっている.この戦略は臓器の機能単位である小構造の再現を可能にしたが,小構造どうしがさらに有機的にオーガナイズされた高次構造を再現するにはいたっていない.いかにして高次構造を再現するかということは臓器の再生の研究における共通の課題といえる.
腎臓は血液をろ過することにより尿を産生するが,この機能はネフロンとよばれる多数の機能単位により担われる.ネフロンにおいて産生された尿が体外へと排泄されるためには,個々のネフロンが集合管に接続し,尿管,膀胱へとつながる高次構造が必須である.これまでの発生学的な研究により,腎臓の高次構造は胎仔の腎臓に含まれる3つの前駆細胞の相互作用により形成されることが明らかにされている.ネフロンのもとになるネフロン前駆細胞,集合管のもとになる尿管芽,これらの構造のあいだをうめる支持組織を形成する間質前駆細胞である.なかでも,尿管芽はひとつの突起の先端から分岐をくり返し特有の樹状の分岐を形成することによりネフロンどうしを連結し,腎臓の高次構造の組織化において中心的な役割をはたす.また,胎仔の腎臓において,尿管芽の先端部は未分化なネフロン前駆細胞を維持するニッチを形成することによりネフロン前駆細胞を増幅し,ヒトでは100万個にもおよぶネフロンの数を担保する役割も担う1).
以前に,筆者らは,マウスのES細胞およびヒトのiPS細胞からネフロン前駆細胞を分化させる方法を確立し,立体的なネフロンの構造を含む腎臓の組織の一部を作製する方法を報告した2)(新着論文レビュー でも掲載).これまでに,尿管芽を選択的に分化させたとする報告3),ネフロン前駆細胞の分化の効率を高めたとする報告4),ネフロン前駆細胞,間質前駆細胞,尿管芽,血管細胞などをひとつのプロトコールにより同時に分化させたとする報告5)(新着論文レビュー でも掲載)がなされているが,これらの報告は,いずれもネフロンどうしを接続する集合管の構造を再現できておらず,このことから,機能的な尿管芽を分化させる方法は確立されていないことが示唆された.その最大の理由は,生体における初期の発生の過程において,どのようなシグナルの違いによりネフロン前駆細胞および尿管芽は異なる形質を獲得するのか,その詳細が明らかにされていないことによる.
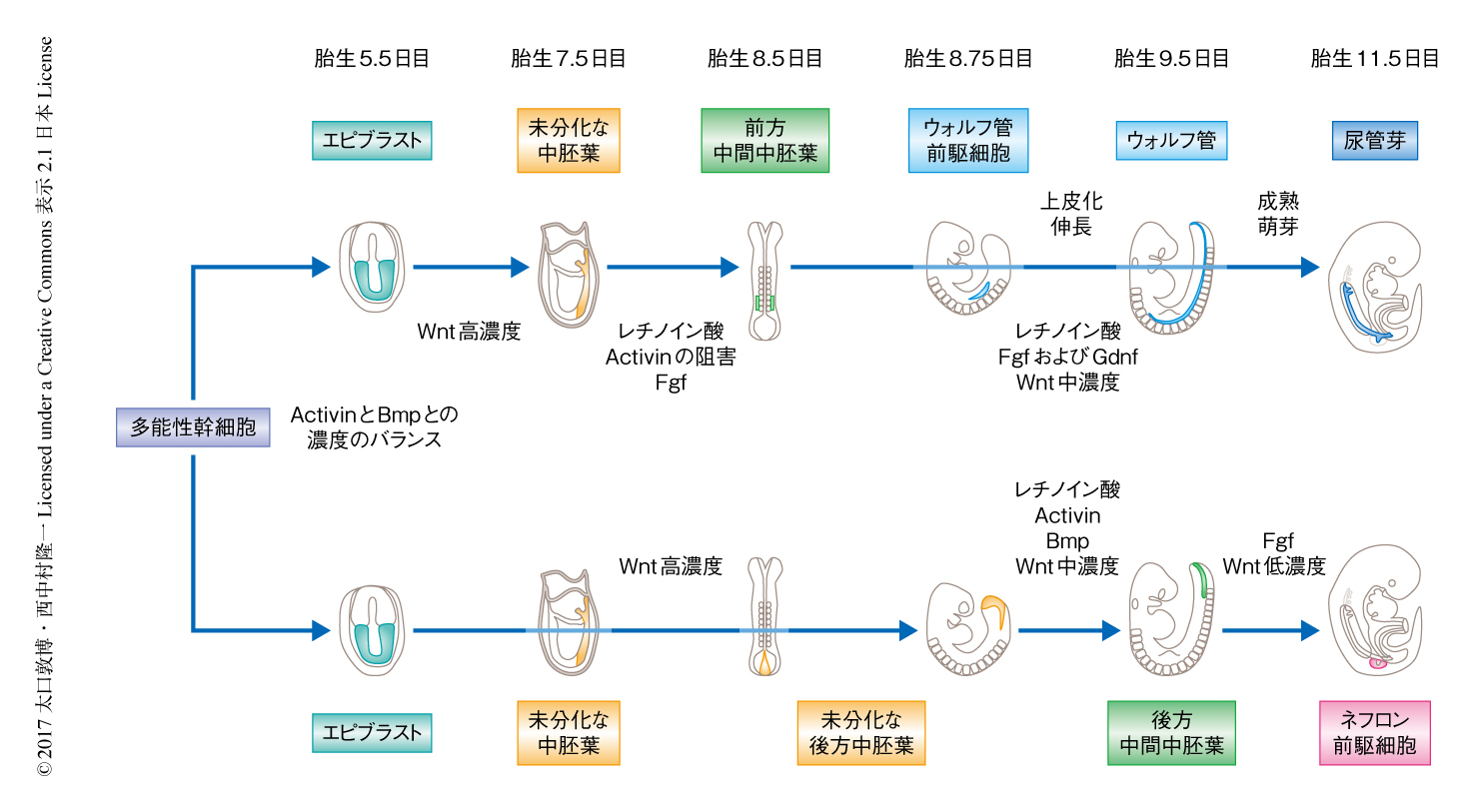
発生学的に腎臓は中胚葉系組織であり,未分化な中胚葉から中間中胚葉をへてネフロン前駆細胞および尿管芽が分化する.以前に,筆者らは,遺伝子改変マウスを用いた細胞系譜の追跡により,ネフロン前駆細胞および尿管芽は未分化な中胚葉から中間中胚葉へと分化する場所および時期が異なることを明らかにした2).すなわち,尿管芽については胎生7.5日目ころの未分化な中胚葉が胎生8.5日目に前方中間中胚葉へと分化したのちウォルフ管を形成し,胎生9.5日目にかけて後方へ伸張して成熟したのち胎生10.5日目ころに胎仔の尾部において萌芽する.一方,ネフロン前駆細胞については胎生8.5日目ころまで尾部の未分化な中胚葉にとどまり,胎生9.5日目ころに後方中間中胚葉へと分化し,胎生10.5日目に分化する.そこで,筆者らは,ネフロン前駆細胞と尿管芽はその起源と成り立ちの違いに応じて別々のプロトコールにより分化させる必要があると考え,マウスおよびマウスのES細胞を用いて尿管芽を分化させるプロトコールの確立を試みた.
尿管芽の細胞系譜に運命を決定したウォルフ管の成熟の過程について調べるため,ウォルフ管および尿管芽に特異的にGFPを発現するマウスを用いて胎生9.5日目から胎生11.5日目のウォルフ管および尿管芽を単離し,胎生11.5日目のネフロン前駆細胞および間質前駆細胞と再凝集させて培養した.その結果,発生の進行とともにウォルフ管が樹状に分岐する能力を獲得することが確認された.そこで,この成熟の過程をモニターしうるマーカー遺伝子および成熟を促進するシグナルを同定するため,おのおのの段階のウォルフ管および尿管芽においてマイクロアレイ法により遺伝子の発現を解析した.その結果,ウォルフ管の形成に必須であることが知られている細胞系譜を規定する遺伝子は発生の段階や位置にかかわらず比較的安定して発現するのに対し,E-cadherin遺伝子,Calb1遺伝子,Hnf1b遺伝子といった遺伝子は発生の進行とともに発現が上昇することが明らかにされ,成熟のマーカーとして有用であることが示唆された.
マイクロアレイ法による解析の結果をもとに,胎生9.5日目のウォルフ管が胎生11.5日目の尿管芽に相当する細胞に成熟するのに必要な成長因子を推定し,マウスの胎仔から分取したウォルフ管をレチノイン酸,Wntアゴニスト,Fgf9の存在下において培養した.さらに,尿管芽の主要なマーカーのひとつであるWnt11遺伝子の発現および尿管芽の萌芽に重要であることが知られているGdnfをFgf9とともにくわえることにより,尿管芽を分化させうる条件を確立した.つづいて,はじめにウォルフ管前駆細胞が検出される胎生8.75日目の胎仔からウォルフ管前駆細胞を回収し,胎生9.5日目のウォルフ管へと分化させた.条件を検討した結果,この時期においてはレチノイン酸にくわえ,WntアゴニストおよびFgf9の濃度を低くすることにより成熟のマーカーであるE-cadherin遺伝子,Calb1遺伝子,Hnf1b遺伝子の発現が促進されることが判明した.最終的に,胎生9.5日目から胎生11.5日目の分化を誘導する因子および胎生8.75日目から胎生9.5日目の分化を誘導する因子を組み合わせた3日間のプロトコールにより,胎生8.75日目のウォルフ管前駆細胞を胎生11.5日目の尿管芽様の組織へと分化させる培養条件が確立された.
マウスのES細胞から胎生8.75日目のウォルフ管前駆細胞に相当する細胞を分化させる方法の確立を試みた.胎生8.75日目のウォルフ管前駆細胞のマイクロアレイ法による解析から,細胞表面マーカーであるCxcr4遺伝子とKit遺伝子に共陽性の集団にウォルフ管前駆細胞が濃縮されていることを見い出し,分化の効率をモニターした.ウォルフ管前駆細胞はネフロン前駆細胞と比較してより早期に未分化な中胚葉から前方中間中胚葉へと分化することが示唆されていたことから,中胚葉の維持因子である高濃度のWntアゴニストを投与する期間を短縮して前方中間中胚葉の誘導因子を探索した.その結果,レチノイン酸,高濃度のFgf9,Activin-Tgfβシグナルの阻害剤をくわえることにより前方中間中胚葉が効率的に得られることが判明した.この結果から,尿管芽の細胞系譜の誘導(前方中間中胚葉の誘導)においても,ネフロン前駆細胞の細胞系譜の誘導(後方中間中胚葉の誘導)と同様に,レチノイン酸が分化に有効である一方,Activin-Tgfβシグナルの有無(あるいは,強弱)がおのおのの細胞系譜の選択に重要な役割をはたすことが示された.
前方中間中胚葉から胎生8.75日目のウォルフ管前駆細胞を分化させるのに必要なシグナルを検証し,この過程においては,レチノイン酸,Wntアゴニスト,Fgf9が協調的にはたらくこと,なかでも,Wntシグナルがウォルフ管前駆細胞の分化に必須であることが判明した.さらに,その前段階である多能性幹細胞からエピブラストおよび中胚葉の分化の過程におけるパターニング因子,Activin,Bmpの濃度の細胞系譜の選択への影響について検証した.その結果,ネフロン前駆細胞の細胞系譜と尿管芽の細胞系譜においては分化のごく早い段階からこれらの至適濃度が異なることが明らかにされた.また,中胚葉の分化および維持の過程に必須となる高濃度のWntシグナルは,おのおのの細胞系譜の選択的な分化においてはきわめて時間依存的に作用し,早い段階で中間中胚葉へと分化するウォルフ管には短時間,あとに分化するネフロン前駆細胞には長時間にわたる曝露が必要であり,生体における分化の時期が異なることを示したさきの研究2) を裏づける結果となった.
以上の結果から,ネフロン前駆細胞の細胞系譜と尿管芽の細胞系譜では,発生のごく初期の段階からすべての過程において必要とする成長因子が異なることが示された(図1).
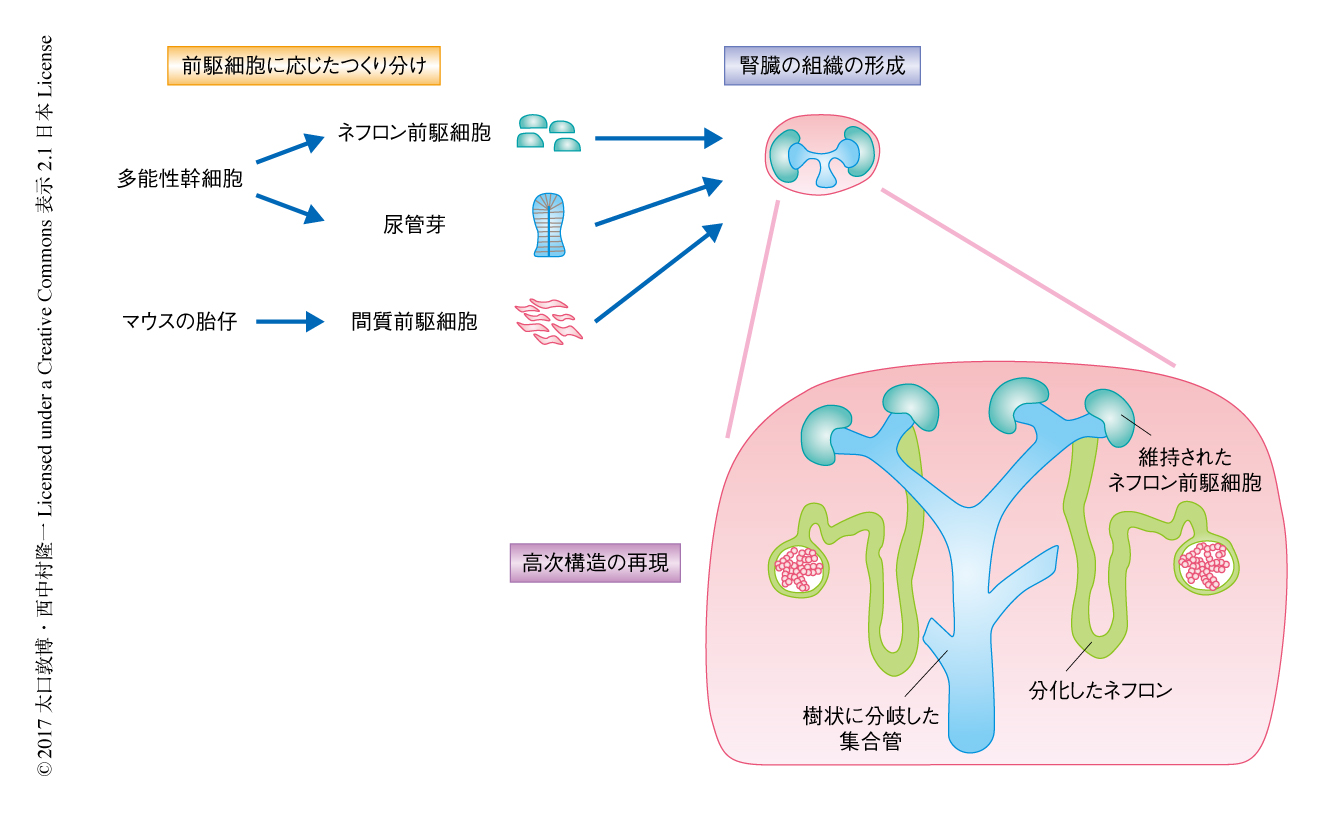
マウスのES細胞から分化させたウォルフ管前駆細胞をマウスの胚を用いて確立された培養条件において培養し,尿管芽様の構造を形成させた.ES細胞から形成させた尿管芽の機能を確認するため,尿管芽の1つの“芽”を単離し,マウスの胎仔から採取したネフロン前駆細胞および間質前駆細胞とともに凝集させ培養した.その結果,尿管芽は1日1世代のペースで樹状の分岐をくり返し,1週間の培養で1つの尿管芽から平均141個の分岐が形成された.これは生体の尿管芽に匹敵し,ES細胞から形成させた尿管芽の分岐能力が確認された.さらに,ES細胞から形成させた尿管芽において,先端が位置する組織の辺縁部においてはネフロン前駆細胞が維持されるとともに,内側ではネフロンが分化し,分化したネフロンの遠位端では尿管芽との接続が確認された(図2).これらの結果から,ES細胞から形成させた尿管芽はその主要な3つの機能要件,すなわち,樹状に分岐する能力,ネフロン前駆細胞を維持する能力,ネフロン前駆細胞を分化させる能力をもつことが示されるとともに,腎臓の高次構造を組織化する能力のあることも示された.
腎臓の組織の再構築に尿管芽を組み込むことの機能的な優位性を,古典的なネフロンの分化法である後腎間葉と胎仔の脊髄とを共培養する系と比較した.その結果,ES細胞から形成させた尿管芽を組み込んだ腎臓の組織においては古典的な方法により分化させた腎臓の組織と比較して10倍以上の数のネフロンが形成されることが判明し,いちどにネフロン前駆細胞を非生理的に分化させてしまう古典的な方法とは異なり,ネフロン前駆細胞のニッチが維持されることによりネフロン前駆細胞が増幅され,最終的に形成されるネフロンの数の増加にも寄与することが示された.
ES細胞から形成させた尿管芽に,以前に筆者らが確立した方法により別々に分化させたネフロン前駆細胞と胎仔に由来する間質前駆細胞を組み合わせることによっても同様に腎臓の高次構造が再現された.この再構成された腎臓の組織をマイクロアレイ法による解析によりおのおのの発生段階の胎仔の腎臓の組織と比較したところ,胎生15.5日目の腎臓の組織にもっとも近い遺伝子発現プロファイルをもつことが確認された.
マウスのES細胞から尿管芽を形成させる方法を応用し,ヒトのiPS細胞から尿管芽を形成させる方法について検討した.ヒトにおいても,マウスと同様にレチノイン酸,Fgf,Activin-Tgfβシグナル阻害剤の組合せにより前方中間中胚葉のマーカーの発現が認められたが,これにさらにBmpシグナルの阻害剤をくわえることによって前方中間中胚葉のマーカーがより強力に発現し,ウォルフ管前駆細胞の分化の効率も上昇した.また,強いWntシグナルにより未分化な中胚葉が維持され期間は,マウスの場合と同様に,尿管芽の細胞系譜とネフロン前駆細胞の細胞系譜では大きく異なること,エピブラストおよび中胚葉の分化の時期におけるActivinおよびBmpの至適濃度が異なることも確認された.分化させたウォルフ管前駆細胞を成熟させる培養条件においては,マウスで用いた成長因子にBmpシグナルの阻害剤およびFgf1をくわえることにより尿管芽の形成が促進された.形成された尿管芽をさらにマトリゲルと尿管芽の分岐を促進する成長因子の存在下において培養することにより樹状の分岐の形成が観察された.さらに,マウスにおいて尿管芽の形成に必須であることが知られているPAX2遺伝子の変異を導入したヒトのiPS細胞株においてはウォルフ管前駆細胞の分化の効率がわずかに低下すること,そこから尿管芽への成熟の過程においてE-cadherin遺伝子の発現が上昇せず尿管芽が正しく形成されず樹状の分岐の能力が失われることが確認され,ヒトにおいては尿管芽の形成にPAX2が必須であることが示された.このことは,最近,筆者らが報告したネフロン前駆細胞の細胞系譜におけるネフロンの分化にPAX2の欠損がほとんど影響しないこと6) とは異なっており,ヒトの腎臓におけるPAX2の細胞系譜に特異的な役割が示唆された.
今回,筆者らは,腎臓を構成する細胞の前駆細胞である尿管芽およびネフロン前駆細胞はその起源と発生の過程の違いに応じて最適化した条件により多能性幹細胞からつくり分けることが可能で(図1),さらに,生理的なタイミングで組み合わせることにより腎臓の高次構造が再現されることを示した(図2).このことから,腎臓の再生の研究のみならず,ほかの多くの臓器においても発生の過程において起源が大きく異なるものは個別に分化させて組み合わせるという戦略が有効である可能性が強く示唆され,臓器を横断して適応しうる基盤となる戦略を示したといえる.依然,血液から尿を産生しうる腎臓の構築には血管系の導入や間質前駆細胞の分化など課題が残るが,これらの成果は,今後,臓器のかたちができるしくみの解明,また,先天性疾患の病態の解明にも寄与しうると期待される.
略歴:2014年 熊本大学大学院医学研究科博士課程 修了,同年 同 助教を経て,2017年 ドイツMax Planck Institute for Molecular Geneticsポストドクトラルフェロー.
研究テーマ:腎臓の初期の発生の過程および多能性幹細胞を用いた再現.
抱負:いつか“昔,透析というたいへんな治療もあったね”と言ってみたい.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
© 2017 太口敦博・西中村隆一 Licensed under CC 表示 2.1 日本
(熊本大学発生医学研究所 腎臓発生分野)
email:太口敦博,西中村隆一
DOI: 10.7875/first.author.2017.136
Higher-order kidney organogenesis from pluripotent stem cells.
Atsuhiro Taguchi, Ryuichi Nishinakamura
Cell Stem Cell, 21, 730-746.e6 (2017)
要 約
これまで,多能性幹細胞からさまざまな臓器の細胞や組織を形成させる方法が報告されているが,多くの場合,臓器の機能単位をなす小構造の再現にとどまっており,小構造どうしが有機的に連結された高次構造の再現にはいたっていない.腎臓はおもにネフロン前駆細胞,尿管芽,間質前駆細胞の相互作用によりかたちづくられるが,そのなかでも,尿管芽は発生の過程において樹状の分岐をくり返しながら高次構造を組織化する役割をもつ.腎臓については多能性幹細胞からネフロン前駆細胞をへて機能単位であるネフロンを形成させる方法が報告されてきたが,尿管芽を分化させる方法は確立されておらず,高次構造の再現にはいたっていなかった.この研究において,筆者らは,尿管芽の生体における初期の発生の過程を解析することにより,尿管芽の分化および成熟に必要なシグナルを同定し,多能性幹細胞から尿管芽を選択的に分化させる方法を確立した.さらに,多能性幹細胞から分化させたネフロン前駆細胞とマウスの胎仔から採取した間質前駆細胞と組み合わせることにより,多能性幹細胞からネフロンどうしが集合管により接続された腎臓の高次構造を構築することに成功した.
はじめに
近年,多能性幹細胞からさまざまな臓器の立体的な構造を模した組織“オルガノイド”を構築する方法が報告され,臓器の発生のモデルおよび疾患の研究へと広く応用されている.これらの多くは,いわゆる細胞の自己組織化を利用し,ひとつのプロトコールにより分化させた細胞の細胞間コミュニケーションにより組織を細胞まかせに形成させるという戦略をとっている.この戦略は臓器の機能単位である小構造の再現を可能にしたが,小構造どうしがさらに有機的にオーガナイズされた高次構造を再現するにはいたっていない.いかにして高次構造を再現するかということは臓器の再生の研究における共通の課題といえる.
腎臓は血液をろ過することにより尿を産生するが,この機能はネフロンとよばれる多数の機能単位により担われる.ネフロンにおいて産生された尿が体外へと排泄されるためには,個々のネフロンが集合管に接続し,尿管,膀胱へとつながる高次構造が必須である.これまでの発生学的な研究により,腎臓の高次構造は胎仔の腎臓に含まれる3つの前駆細胞の相互作用により形成されることが明らかにされている.ネフロンのもとになるネフロン前駆細胞,集合管のもとになる尿管芽,これらの構造のあいだをうめる支持組織を形成する間質前駆細胞である.なかでも,尿管芽はひとつの突起の先端から分岐をくり返し特有の樹状の分岐を形成することによりネフロンどうしを連結し,腎臓の高次構造の組織化において中心的な役割をはたす.また,胎仔の腎臓において,尿管芽の先端部は未分化なネフロン前駆細胞を維持するニッチを形成することによりネフロン前駆細胞を増幅し,ヒトでは100万個にもおよぶネフロンの数を担保する役割も担う1).
以前に,筆者らは,マウスのES細胞およびヒトのiPS細胞からネフロン前駆細胞を分化させる方法を確立し,立体的なネフロンの構造を含む腎臓の組織の一部を作製する方法を報告した2)(新着論文レビュー でも掲載).これまでに,尿管芽を選択的に分化させたとする報告3),ネフロン前駆細胞の分化の効率を高めたとする報告4),ネフロン前駆細胞,間質前駆細胞,尿管芽,血管細胞などをひとつのプロトコールにより同時に分化させたとする報告5)(新着論文レビュー でも掲載)がなされているが,これらの報告は,いずれもネフロンどうしを接続する集合管の構造を再現できておらず,このことから,機能的な尿管芽を分化させる方法は確立されていないことが示唆された.その最大の理由は,生体における初期の発生の過程において,どのようなシグナルの違いによりネフロン前駆細胞および尿管芽は異なる形質を獲得するのか,その詳細が明らかにされていないことによる.
発生学的に腎臓は中胚葉系組織であり,未分化な中胚葉から中間中胚葉をへてネフロン前駆細胞および尿管芽が分化する.以前に,筆者らは,遺伝子改変マウスを用いた細胞系譜の追跡により,ネフロン前駆細胞および尿管芽は未分化な中胚葉から中間中胚葉へと分化する場所および時期が異なることを明らかにした2).すなわち,尿管芽については胎生7.5日目ころの未分化な中胚葉が胎生8.5日目に前方中間中胚葉へと分化したのちウォルフ管を形成し,胎生9.5日目にかけて後方へ伸張して成熟したのち胎生10.5日目ころに胎仔の尾部において萌芽する.一方,ネフロン前駆細胞については胎生8.5日目ころまで尾部の未分化な中胚葉にとどまり,胎生9.5日目ころに後方中間中胚葉へと分化し,胎生10.5日目に分化する.そこで,筆者らは,ネフロン前駆細胞と尿管芽はその起源と成り立ちの違いに応じて別々のプロトコールにより分化させる必要があると考え,マウスおよびマウスのES細胞を用いて尿管芽を分化させるプロトコールの確立を試みた.
1.ウォルフ管は発生の進行にともない樹状に分岐する能力を獲得する
尿管芽の細胞系譜に運命を決定したウォルフ管の成熟の過程について調べるため,ウォルフ管および尿管芽に特異的にGFPを発現するマウスを用いて胎生9.5日目から胎生11.5日目のウォルフ管および尿管芽を単離し,胎生11.5日目のネフロン前駆細胞および間質前駆細胞と再凝集させて培養した.その結果,発生の進行とともにウォルフ管が樹状に分岐する能力を獲得することが確認された.そこで,この成熟の過程をモニターしうるマーカー遺伝子および成熟を促進するシグナルを同定するため,おのおのの段階のウォルフ管および尿管芽においてマイクロアレイ法により遺伝子の発現を解析した.その結果,ウォルフ管の形成に必須であることが知られている細胞系譜を規定する遺伝子は発生の段階や位置にかかわらず比較的安定して発現するのに対し,E-cadherin遺伝子,Calb1遺伝子,Hnf1b遺伝子といった遺伝子は発生の進行とともに発現が上昇することが明らかにされ,成熟のマーカーとして有用であることが示唆された.
2.ウォルフ管前駆細胞はレチノイン酸,Wnt,Fgf,Gdnfのシグナルにより成熟する
マイクロアレイ法による解析の結果をもとに,胎生9.5日目のウォルフ管が胎生11.5日目の尿管芽に相当する細胞に成熟するのに必要な成長因子を推定し,マウスの胎仔から分取したウォルフ管をレチノイン酸,Wntアゴニスト,Fgf9の存在下において培養した.さらに,尿管芽の主要なマーカーのひとつであるWnt11遺伝子の発現および尿管芽の萌芽に重要であることが知られているGdnfをFgf9とともにくわえることにより,尿管芽を分化させうる条件を確立した.つづいて,はじめにウォルフ管前駆細胞が検出される胎生8.75日目の胎仔からウォルフ管前駆細胞を回収し,胎生9.5日目のウォルフ管へと分化させた.条件を検討した結果,この時期においてはレチノイン酸にくわえ,WntアゴニストおよびFgf9の濃度を低くすることにより成熟のマーカーであるE-cadherin遺伝子,Calb1遺伝子,Hnf1b遺伝子の発現が促進されることが判明した.最終的に,胎生9.5日目から胎生11.5日目の分化を誘導する因子および胎生8.75日目から胎生9.5日目の分化を誘導する因子を組み合わせた3日間のプロトコールにより,胎生8.75日目のウォルフ管前駆細胞を胎生11.5日目の尿管芽様の組織へと分化させる培養条件が確立された.
3.マウスのES細胞からウォルフ管前駆細胞を分化させる方法の確立
マウスのES細胞から胎生8.75日目のウォルフ管前駆細胞に相当する細胞を分化させる方法の確立を試みた.胎生8.75日目のウォルフ管前駆細胞のマイクロアレイ法による解析から,細胞表面マーカーであるCxcr4遺伝子とKit遺伝子に共陽性の集団にウォルフ管前駆細胞が濃縮されていることを見い出し,分化の効率をモニターした.ウォルフ管前駆細胞はネフロン前駆細胞と比較してより早期に未分化な中胚葉から前方中間中胚葉へと分化することが示唆されていたことから,中胚葉の維持因子である高濃度のWntアゴニストを投与する期間を短縮して前方中間中胚葉の誘導因子を探索した.その結果,レチノイン酸,高濃度のFgf9,Activin-Tgfβシグナルの阻害剤をくわえることにより前方中間中胚葉が効率的に得られることが判明した.この結果から,尿管芽の細胞系譜の誘導(前方中間中胚葉の誘導)においても,ネフロン前駆細胞の細胞系譜の誘導(後方中間中胚葉の誘導)と同様に,レチノイン酸が分化に有効である一方,Activin-Tgfβシグナルの有無(あるいは,強弱)がおのおのの細胞系譜の選択に重要な役割をはたすことが示された.
前方中間中胚葉から胎生8.75日目のウォルフ管前駆細胞を分化させるのに必要なシグナルを検証し,この過程においては,レチノイン酸,Wntアゴニスト,Fgf9が協調的にはたらくこと,なかでも,Wntシグナルがウォルフ管前駆細胞の分化に必須であることが判明した.さらに,その前段階である多能性幹細胞からエピブラストおよび中胚葉の分化の過程におけるパターニング因子,Activin,Bmpの濃度の細胞系譜の選択への影響について検証した.その結果,ネフロン前駆細胞の細胞系譜と尿管芽の細胞系譜においては分化のごく早い段階からこれらの至適濃度が異なることが明らかにされた.また,中胚葉の分化および維持の過程に必須となる高濃度のWntシグナルは,おのおのの細胞系譜の選択的な分化においてはきわめて時間依存的に作用し,早い段階で中間中胚葉へと分化するウォルフ管には短時間,あとに分化するネフロン前駆細胞には長時間にわたる曝露が必要であり,生体における分化の時期が異なることを示したさきの研究2) を裏づける結果となった.
以上の結果から,ネフロン前駆細胞の細胞系譜と尿管芽の細胞系譜では,発生のごく初期の段階からすべての過程において必要とする成長因子が異なることが示された(図1).
4.マウスのES細胞から形成させた尿管芽は高次構造を形成する
マウスのES細胞から分化させたウォルフ管前駆細胞をマウスの胚を用いて確立された培養条件において培養し,尿管芽様の構造を形成させた.ES細胞から形成させた尿管芽の機能を確認するため,尿管芽の1つの“芽”を単離し,マウスの胎仔から採取したネフロン前駆細胞および間質前駆細胞とともに凝集させ培養した.その結果,尿管芽は1日1世代のペースで樹状の分岐をくり返し,1週間の培養で1つの尿管芽から平均141個の分岐が形成された.これは生体の尿管芽に匹敵し,ES細胞から形成させた尿管芽の分岐能力が確認された.さらに,ES細胞から形成させた尿管芽において,先端が位置する組織の辺縁部においてはネフロン前駆細胞が維持されるとともに,内側ではネフロンが分化し,分化したネフロンの遠位端では尿管芽との接続が確認された(図2).これらの結果から,ES細胞から形成させた尿管芽はその主要な3つの機能要件,すなわち,樹状に分岐する能力,ネフロン前駆細胞を維持する能力,ネフロン前駆細胞を分化させる能力をもつことが示されるとともに,腎臓の高次構造を組織化する能力のあることも示された.
腎臓の組織の再構築に尿管芽を組み込むことの機能的な優位性を,古典的なネフロンの分化法である後腎間葉と胎仔の脊髄とを共培養する系と比較した.その結果,ES細胞から形成させた尿管芽を組み込んだ腎臓の組織においては古典的な方法により分化させた腎臓の組織と比較して10倍以上の数のネフロンが形成されることが判明し,いちどにネフロン前駆細胞を非生理的に分化させてしまう古典的な方法とは異なり,ネフロン前駆細胞のニッチが維持されることによりネフロン前駆細胞が増幅され,最終的に形成されるネフロンの数の増加にも寄与することが示された.
ES細胞から形成させた尿管芽に,以前に筆者らが確立した方法により別々に分化させたネフロン前駆細胞と胎仔に由来する間質前駆細胞を組み合わせることによっても同様に腎臓の高次構造が再現された.この再構成された腎臓の組織をマイクロアレイ法による解析によりおのおのの発生段階の胎仔の腎臓の組織と比較したところ,胎生15.5日目の腎臓の組織にもっとも近い遺伝子発現プロファイルをもつことが確認された.
5.ヒトのiPS細胞から尿管芽を形成させる方法の確立
マウスのES細胞から尿管芽を形成させる方法を応用し,ヒトのiPS細胞から尿管芽を形成させる方法について検討した.ヒトにおいても,マウスと同様にレチノイン酸,Fgf,Activin-Tgfβシグナル阻害剤の組合せにより前方中間中胚葉のマーカーの発現が認められたが,これにさらにBmpシグナルの阻害剤をくわえることによって前方中間中胚葉のマーカーがより強力に発現し,ウォルフ管前駆細胞の分化の効率も上昇した.また,強いWntシグナルにより未分化な中胚葉が維持され期間は,マウスの場合と同様に,尿管芽の細胞系譜とネフロン前駆細胞の細胞系譜では大きく異なること,エピブラストおよび中胚葉の分化の時期におけるActivinおよびBmpの至適濃度が異なることも確認された.分化させたウォルフ管前駆細胞を成熟させる培養条件においては,マウスで用いた成長因子にBmpシグナルの阻害剤およびFgf1をくわえることにより尿管芽の形成が促進された.形成された尿管芽をさらにマトリゲルと尿管芽の分岐を促進する成長因子の存在下において培養することにより樹状の分岐の形成が観察された.さらに,マウスにおいて尿管芽の形成に必須であることが知られているPAX2遺伝子の変異を導入したヒトのiPS細胞株においてはウォルフ管前駆細胞の分化の効率がわずかに低下すること,そこから尿管芽への成熟の過程においてE-cadherin遺伝子の発現が上昇せず尿管芽が正しく形成されず樹状の分岐の能力が失われることが確認され,ヒトにおいては尿管芽の形成にPAX2が必須であることが示された.このことは,最近,筆者らが報告したネフロン前駆細胞の細胞系譜におけるネフロンの分化にPAX2の欠損がほとんど影響しないこと6) とは異なっており,ヒトの腎臓におけるPAX2の細胞系譜に特異的な役割が示唆された.
おわりに
今回,筆者らは,腎臓を構成する細胞の前駆細胞である尿管芽およびネフロン前駆細胞はその起源と発生の過程の違いに応じて最適化した条件により多能性幹細胞からつくり分けることが可能で(図1),さらに,生理的なタイミングで組み合わせることにより腎臓の高次構造が再現されることを示した(図2).このことから,腎臓の再生の研究のみならず,ほかの多くの臓器においても発生の過程において起源が大きく異なるものは個別に分化させて組み合わせるという戦略が有効である可能性が強く示唆され,臓器を横断して適応しうる基盤となる戦略を示したといえる.依然,血液から尿を産生しうる腎臓の構築には血管系の導入や間質前駆細胞の分化など課題が残るが,これらの成果は,今後,臓器のかたちができるしくみの解明,また,先天性疾患の病態の解明にも寄与しうると期待される.
文 献
- Costantini, F. & Kopan, R.: Patterning a complex organ: branching morphogenesis and nephron segmentation in kidney development. Dev. Cell, 18, 698-712 (2010)[PubMed]
- Taguchi, A., Kaku, Y., Ohmori, T. et al.: Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell, 14, 53-67 (2014)[PubMed] [新着論文レビュー]
- Xia, Y., Nivet, E., Sancho-Martinez, I. et al.: Directed differentiation of human pluripotent cells to ureteric bud kidney progenitor-like cells. Nat. Cell Biol., 15, 1507-1515 (2013)[PubMed]
- Morizane, R., Lam, A. Q., Freedman, B. S. et al.: Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nat. Biotechnol., 33, 1193-1200 (2015)[PubMed]
- Takasato, M., Er, P. X., Chiu, H. S. et al.: Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature, 526, 564-568 (2015)[PubMed] [新着論文レビュー]
- Kaku, Y., Taguchi, A., Tanigawa, S. et al.: PAX2 is dispensable for in vitro nephron formation from human induced pluripotent stem cells. Sci. Rep., 7, 4554 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 熊本大学大学院医学研究科博士課程 修了,同年 同 助教を経て,2017年 ドイツMax Planck Institute for Molecular Geneticsポストドクトラルフェロー.
研究テーマ:腎臓の初期の発生の過程および多能性幹細胞を用いた再現.
抱負:いつか“昔,透析というたいへんな治療もあったね”と言ってみたい.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
© 2017 太口敦博・西中村隆一 Licensed under CC 表示 2.1 日本