サイトゾルタンパク質Vms1による新生ミトコンドリアタンパク質の品質管理機構
井澤俊明1,2・Ulrich Hartl 2・Walter Neupert 1
(1ドイツMunich大学,Faculty of Medicine,Biomedical Center,Division of Cell Biology,2ドイツMax Planck Institute of Biochemistry,Department of Cellular Biochemistry)
email:井澤俊明
DOI: 10.7875/first.author.2017.127
Cytosolic protein Vms1 links ribosome quality control to mitochondrial and cellular homeostasis.
Toshiaki Izawa, Sae-Hun Park, Liang Zhao, F. Ulrich Hartl, Walter Neupert
Cell, 171, 890-903.e18 (2017)
真核生物にはリボソームの異常な停止により生じる不完全な新生ポリペプチド鎖を監視しこれを除去するリボソーム品質管理機構が備わっている.サイトゾルタンパク質の場合,異常な新生ポリペプチド鎖はRqc2によるC末端への複数のAlaおよびThrの付加,および,ユビキチンリガーゼLtn1によるユビキチン化により,プロテアソームにより分解される.一方,ミトコンドリアタンパク質の場合,サイトゾルでの翻訳とミトコンドリアへの輸送が共役しているため,異常な新生ポリペプチド鎖の一部はサイトゾルにおける分解を回避しミトコンドリアへと輸送されてしまう.筆者らは,サイトゾルにおける分解の困難な異常な新生ミトコンドリアタンパク質を処理する新規の品質管理機構を同定した.Ltn1およびリボソーム品質管理機構にかかわる新規のタンパク質Vms1を欠損した細胞においては,Rqc2によりC末端にAlaおよびThrの付加されたミトコンドリアタンパク質がほかのミトコンドリアタンパク質をまき込んで凝集し,ミトコンドリアの機能の破綻がひき起こされた.Vms1は60Sリボソームと結合し,サイトゾルにおいて分解されない新生ポリペプチド鎖のC末端へのAlaおよびThrの付加を抑制した.AlaおよびThrの付加の抑制された新生ポリペプチド鎖はミトコンドリアへと輸送され,ミトコンドリアにおける品質管理機構により処理された.
ミトコンドリアはヒトを含む真核生物に必須のオルガネラであり,エネルギーの産生,アミノ酸や脂肪酸の代謝,鉄硫黄クラスター,ヘム,脂質などの合成のほか,アポトーシスや老化とも密接にかかわる.ミトコンドリアタンパク質のほとんどは核のゲノムにコードされており,サイトゾルにおいて翻訳され,ミトコンドリア膜透過装置を介してミトコンドリアへと輸送される.輸送されたミトコンドリアタンパク質は正しくフォールディングされ,場合によっては複数のサブユニットから構成されるタンパク質複合体に正確に組み込まれる.これら一連の過程においてはエラーが生じやすく,一定の確率でミスフォールドしたタンパク質や異常なタンパク質が生じる.細胞にはこのような有害なタンパク質を除去する厳密な品質管理機構が備わっている.遺伝子の損傷や老化にともなう品質管理機構の異常はミトコンドリアの機能の破綻をひき起こし,パーキンソン病やアルツハイマー病などの神経変性疾患とも密接にかかわる.
異常なタンパク質の生じる原因のひとつに翻訳中のリボソームの異常な停止があげられる.たとえば,終止コドンを欠損した異常なmRNAが翻訳されると,正常な翻訳終結が起こらずリボソームはmRNAの3’末端において停止する.停止したリボソームは60Sリボソームと40Sリボソームに解体される1).リボソームの異常な停止により生じた不完全な新生ポリペプチド鎖は60Sリボソームと結合したままの状態でリボソーム品質管理機構により処理される.リボソーム品質管理機構は出芽酵母をモデルとして精力的に研究されている.サイトゾルタンパク質の場合,異常な新生ポリペプチド鎖はRqc2(ヒトにおいては,NEMF)によるC末端への複数のAlaおよびThrの付加,および,ユビキチンリガーゼLtn1(ヒトにおいては,Listerin)によるユビキチン化により,プロテアソームによりすみやかに分解される2,3).近年,異常な新生ポリペプチド鎖のC末端へのAlaおよびThrの付加はLtn1による効率的なユビキチン化およびサイトゾルにおける分解を促進することが報告された4,5).
新生ミトコンドリアタンパク質の品質管理は,サイトゾルタンパク質の品質管理よりも複雑である.ミトコンドリアタンパク質のミトコンドリアへの輸送は,サイトゾルにおける翻訳が完了するまえに開始される例が多く知られている.この場合,リボソームの異常な停止は新生ポリペプチド鎖がミトコンドリア膜を透過しているときに起こり,新生ポリペプチド鎖はすでにミトコンドリアの内部に露出しているため,サイトゾルにおけるユビキチン化および分解を回避してしまう6).それでは,このような異常な新生ポリペプチド鎖はどのように処理されるのだろうか? 筆者らは,サイトゾルにおける分解の困難な異常な新生ミトコンドリアタンパク質の品質管理機構に着目した.
サイトゾルタンパク質であるVms1は酸化ストレス条件においてミトコンドリアの表面に局在し異常なミトコンドリアタンパク質の品質管理にかかわることが報告されていた7).しかし,どのようなタンパク質がVms1の基質になるのか,その分子機構は不明であった.Vms1の機能を明らかにするため,出芽酵母をモデルとして,Vms1の相互作用タンパク質のプロテオームを解析した結果,Vms1は60Sリボソームの結合タンパク質であることが明らかにされた.さらに,Vms1と相互作用するタンパク質としてリボソーム品質管理機構にかかわるRqc2およびLtn1が同定された.この結果より,Vms1はミトコンドリアにおいてリボソーム品質管理機構にかかわることが示唆された.
リボソーム品質管理機構にかかわるタンパク質を欠損した出芽酵母株を作製しその表現型を解析した結果,Vms1およびLtn1を欠損した細胞においては,ストレスをあたえていない通常の生育条件においてでさえ,ミトコンドリアタンパク質が特異的に凝集することが明らかにされた.分子シャペロン,プロテアーゼ,翻訳因子,呼吸鎖複合体の構成タンパク質など,ミトコンドリアの機能に必須の多くのタンパク質が凝集し,呼吸鎖複合体やATP合成酵素など,エネルギーの産生に必要なタンパク質複合体の形成が顕著に阻害された.
サイトゾルに存在するVms1およびLtn1を欠損した細胞において,なぜ,ミトコンドリアタンパク質が凝集するのだろうか? 近年,Rqc2によりC末端にAlaおよびThrの付加されたタンパク質が分解されずにサイトゾルに蓄積すると,凝集体を形成することが報告された8,9).そこで,Vms1およびLtn1を欠損した細胞においてはRqc2によりC末端にAlaおよびThrの付加された異常な新生ポリペプチド鎖がミトコンドリアに蓄積してタンパク質の凝集をひき起こすのではないかと考えた.Rqc2を欠損させた細胞においてはVms1およびLtn1の欠損によるミトコンドリアタンパク質の凝集が抑制され,ミトコンドリアの機能が回復した.この結果から,Vms1およびLtn1を欠損した細胞におけるミトコンドリアタンパク質の特異的な凝集はRqc2によりひき起こされることが示された.
Rqc2によりC末端にAlaおよびThrの付加された異常なタンパク質が実際にミトコンドリアタンパク質の凝集をひき起こすのかどうか調べるため,リボソームの異常な停止により生じる不完全な新生ポリペプチド鎖のモデルとして,終止コドンを欠損させたGFP遺伝子の翻訳産物を解析した.この異常なGFPにミトコンドリア移行シグナルを付加してミトコンドリアに局在させたところ,Ltn1あるいはVms1を欠損した細胞において高分子量の凝集体が観察された.この凝集体の形成はRqc2に依存的であったことから,C末端へのAlaおよびThrの付加がリボソームの異常な停止により生じた不完全な新生ポリペプチド鎖の凝集をひき起こすことが示唆された.一方,異常なGFPをサイトゾルに局在させたところ,Ltn1を欠損した細胞においては高分子量の凝集体が観察されたが,Vms1を欠損した細胞において凝集体はみられなかった.このことから,Vms1はミトコンドリアタンパク質の凝集の抑制に特異的に機能することが示唆された.また,C末端にAlaおよびThrの付加された異常なGFPは,ミトコンドリアの内部においてミトコンドリアの機能に必須のタンパク質をまき込んで封入体を形成した.さらに,C末端へのAlaおよびThrの付加がタンパク質の凝集の直接の原因であるかどうかを検証するため,ミトコンドリア移行シグナルを付加した正常なGFPのC末端にAla-Thrの10回くり返し配列を人工的に付加したところ凝集がひき起こされた.以上より,ミトコンドリアタンパク質のC末端へのAlaおよびThrの付加がミトコンドリアの内部における封入体の形成のひき金になることが明らかにされた.
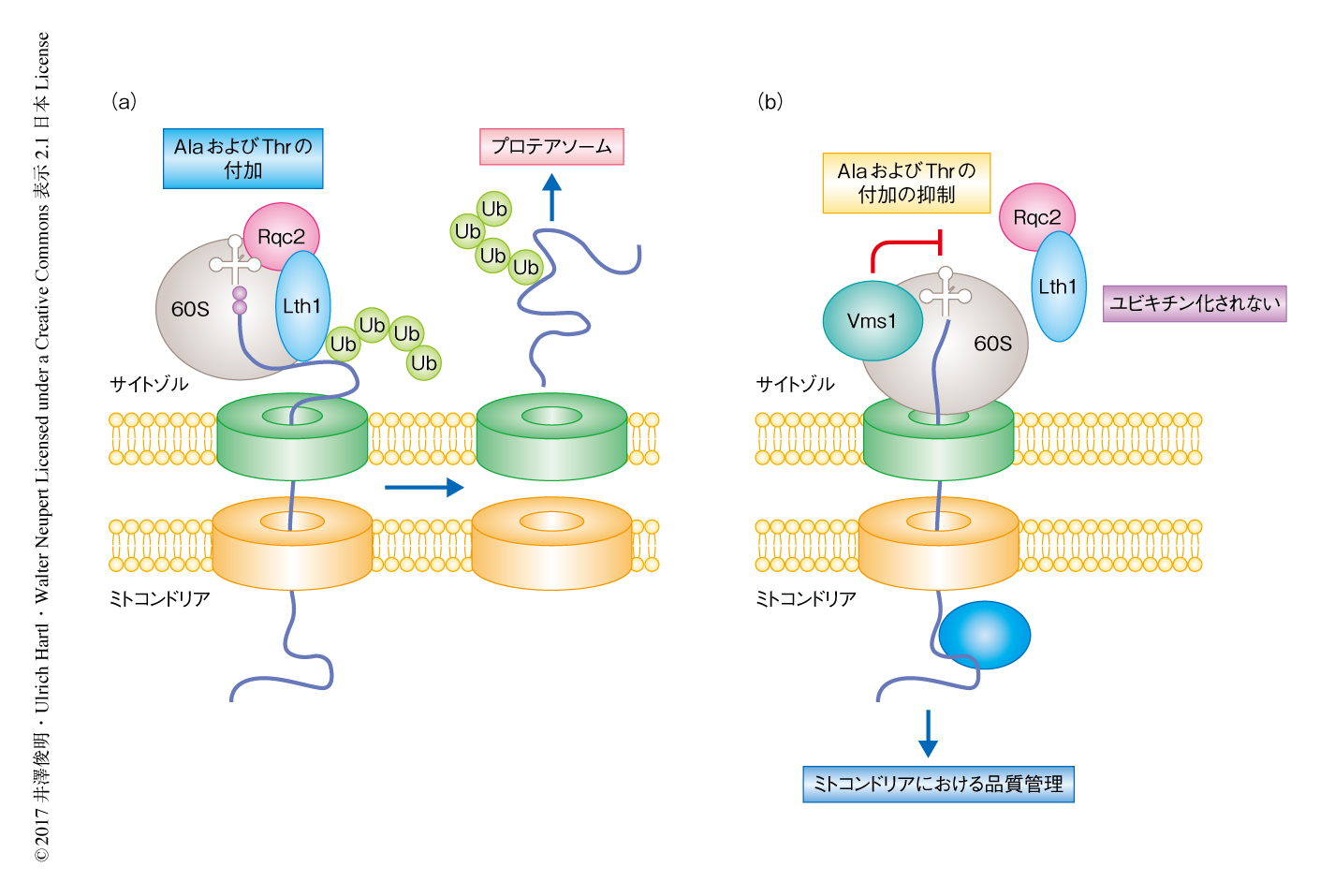
Ltn1は異常な新生ポリペプチド鎖をユビキチン化し,プロテアソームにより分解することにより異常な新生ポリペプチド鎖の蓄積および凝集を抑制する.それでは,Vms1はどのようにして異常な新生ポリペプチド鎖の凝集を抑制するのだろうか? 細胞溶出液からミトコンドリア移行シグナルを付加した異常なGFPを単離しプロテオーム解析した結果,Vms1の欠損によりRqc2と異常なGFPとの相互作用が促進され,AlaおよびThrの付加および凝集体の形成が亢進されることが示された.一方,Vms1を過剰に発現させるとRqc2の60Sリボソームからの解離が促進され,AlaおよびThrの付加が抑制された.AlaおよびThrの付加が抑制された異常なGFPはサイトゾルにおいて分解されるのではなく,ミトコンドリアへと輸送され,ミトコンドリアにおける品質管理機構により処理された.また,Vms1は異常な新生ポリペプチド鎖の分解に必要なCdc48(ヒトにおいては,p97)と結合するドメインをもつが,このドメインはAlaおよびThrの付加の抑制には必要ではなかった.以上から,Vms1は新生ポリペプチド鎖のC末端へのAlaおよびThrの付加を抑制するという,サイトゾルにおける分解とは異なる手段を用いることにより,ミトコンドリアの内部における凝集体の形成を抑制することが明らかにされた(図1).ミトコンドリアタンパク質はサイトゾルタンパク質とは異なり,サイトゾルでの翻訳とミトコンドリアへの輸送とが共役しているため,異常な新生ポリペプチド鎖の一部はサイトゾルにおける分解を回避してしまう.Vms1が機能しないとRqc2によるC末端へのAlaおよびThrの付加が亢進し,異常な新生ポリペプチド鎖はミトコンドリアの内部においてミトコンドリアの機能に必須のタンパク質をまき込んで凝集してしまう.Vms1は,このようなサイトゾルにおける分解の困難な異常なタンパク質を適切に処理するために進化したと考えられる.
Vms1およびLtn1を欠損した細胞では,とくにストレスをあたえていない通常の生育条件においてもミトコンドリアの機能が破綻することが示された.このことから,細胞においてはつねに異常な新生ポリペプチド鎖が生じており,新生ミトコンドリアタンパク質の品質管理機構によりたえずミトコンドリアの恒常性が維持されることが示唆された.Vms1を含むリボソーム品質管理機構にかかわるタンパク質はヒトにも保存されていることから,この研究において明らかにされたリボソーム品質管理機構の異常は,ミトコンドリアの異常に起因する神経変性疾患などとも密接に関連することが予想される.実際に,Listerin変異体を発現するマウスは神経変性疾患を発症することが報告されている10).また,Rqc2によるC末端へのAlaおよびThrの付加の亢進およびVms1によるその抑制がどのような分子機構によるのかも興味深い.今後は,クライオ電子顕微鏡解析,X線結晶構造解析,生化学的な解析などを組み合わせることにより,Vms1によるC末端へのAlaおよびThrの付加の制御の詳細な分子機構が明らかにされるであろう.
Rqc2は真核生物のみならず,ミトコンドリアが共生する以前の真核生物の祖先と考えられる古細菌にまで広く保存されている.一方,Vms1は古細菌には保存されていないが,酵母,植物,ヒトを含む真核生物に広く保存されている.真核生物の誕生の際,ミトコンドリア遺伝子のほとんどは核へと移動し,サイトゾルにおける翻訳系によりタンパク質を合成しミトコンドリアに取り込むというシステムがつくりあげられたときに,Rqc2による異常な新生ポリペプチド鎖のC末端へのAlaおよびThrの付加は大きな問題になったであろう.Vms1は,このミトコンドリアの共生の過程において生じたジレンマを克服するために現われたのかもしれない.
略歴:2012年 名古屋大学大学院理学研究科にて博士号取得,同年 ドイツMax Planck Institute of Biochemistry博士研究員,2015年 九州大学大学院医学研究院 助教を経て,2016年よりドイツMunich大学にて博士研究員.
研究テーマ:ミトコンドリアにおける品質管理機構.
関心事:脊椎動物の発生の初期におけるミトコンドリアの分裂および融合のダイナミクス.
F. Ulrich Hartl
ドイツMax Planck Institute of BiochemistryにてProfessor.
研究室URL:http://www.biochem.mpg.de/en/rd/hartl
Walter Neupert
ドイツMunich大学にてProfessor.
研究室URL:
http://www.zellbio.anatomie.med.uni-muenchen.de/about_us/walter-neupert/index.html
© 2017 井澤俊明・Ulrich Hartl・Walter Neupert Licensed under CC 表示 2.1 日本
(1ドイツMunich大学,Faculty of Medicine,Biomedical Center,Division of Cell Biology,2ドイツMax Planck Institute of Biochemistry,Department of Cellular Biochemistry)
email:井澤俊明
DOI: 10.7875/first.author.2017.127
Cytosolic protein Vms1 links ribosome quality control to mitochondrial and cellular homeostasis.
Toshiaki Izawa, Sae-Hun Park, Liang Zhao, F. Ulrich Hartl, Walter Neupert
Cell, 171, 890-903.e18 (2017)
要 約
真核生物にはリボソームの異常な停止により生じる不完全な新生ポリペプチド鎖を監視しこれを除去するリボソーム品質管理機構が備わっている.サイトゾルタンパク質の場合,異常な新生ポリペプチド鎖はRqc2によるC末端への複数のAlaおよびThrの付加,および,ユビキチンリガーゼLtn1によるユビキチン化により,プロテアソームにより分解される.一方,ミトコンドリアタンパク質の場合,サイトゾルでの翻訳とミトコンドリアへの輸送が共役しているため,異常な新生ポリペプチド鎖の一部はサイトゾルにおける分解を回避しミトコンドリアへと輸送されてしまう.筆者らは,サイトゾルにおける分解の困難な異常な新生ミトコンドリアタンパク質を処理する新規の品質管理機構を同定した.Ltn1およびリボソーム品質管理機構にかかわる新規のタンパク質Vms1を欠損した細胞においては,Rqc2によりC末端にAlaおよびThrの付加されたミトコンドリアタンパク質がほかのミトコンドリアタンパク質をまき込んで凝集し,ミトコンドリアの機能の破綻がひき起こされた.Vms1は60Sリボソームと結合し,サイトゾルにおいて分解されない新生ポリペプチド鎖のC末端へのAlaおよびThrの付加を抑制した.AlaおよびThrの付加の抑制された新生ポリペプチド鎖はミトコンドリアへと輸送され,ミトコンドリアにおける品質管理機構により処理された.
はじめに
ミトコンドリアはヒトを含む真核生物に必須のオルガネラであり,エネルギーの産生,アミノ酸や脂肪酸の代謝,鉄硫黄クラスター,ヘム,脂質などの合成のほか,アポトーシスや老化とも密接にかかわる.ミトコンドリアタンパク質のほとんどは核のゲノムにコードされており,サイトゾルにおいて翻訳され,ミトコンドリア膜透過装置を介してミトコンドリアへと輸送される.輸送されたミトコンドリアタンパク質は正しくフォールディングされ,場合によっては複数のサブユニットから構成されるタンパク質複合体に正確に組み込まれる.これら一連の過程においてはエラーが生じやすく,一定の確率でミスフォールドしたタンパク質や異常なタンパク質が生じる.細胞にはこのような有害なタンパク質を除去する厳密な品質管理機構が備わっている.遺伝子の損傷や老化にともなう品質管理機構の異常はミトコンドリアの機能の破綻をひき起こし,パーキンソン病やアルツハイマー病などの神経変性疾患とも密接にかかわる.
異常なタンパク質の生じる原因のひとつに翻訳中のリボソームの異常な停止があげられる.たとえば,終止コドンを欠損した異常なmRNAが翻訳されると,正常な翻訳終結が起こらずリボソームはmRNAの3’末端において停止する.停止したリボソームは60Sリボソームと40Sリボソームに解体される1).リボソームの異常な停止により生じた不完全な新生ポリペプチド鎖は60Sリボソームと結合したままの状態でリボソーム品質管理機構により処理される.リボソーム品質管理機構は出芽酵母をモデルとして精力的に研究されている.サイトゾルタンパク質の場合,異常な新生ポリペプチド鎖はRqc2(ヒトにおいては,NEMF)によるC末端への複数のAlaおよびThrの付加,および,ユビキチンリガーゼLtn1(ヒトにおいては,Listerin)によるユビキチン化により,プロテアソームによりすみやかに分解される2,3).近年,異常な新生ポリペプチド鎖のC末端へのAlaおよびThrの付加はLtn1による効率的なユビキチン化およびサイトゾルにおける分解を促進することが報告された4,5).
新生ミトコンドリアタンパク質の品質管理は,サイトゾルタンパク質の品質管理よりも複雑である.ミトコンドリアタンパク質のミトコンドリアへの輸送は,サイトゾルにおける翻訳が完了するまえに開始される例が多く知られている.この場合,リボソームの異常な停止は新生ポリペプチド鎖がミトコンドリア膜を透過しているときに起こり,新生ポリペプチド鎖はすでにミトコンドリアの内部に露出しているため,サイトゾルにおけるユビキチン化および分解を回避してしまう6).それでは,このような異常な新生ポリペプチド鎖はどのように処理されるのだろうか? 筆者らは,サイトゾルにおける分解の困難な異常な新生ミトコンドリアタンパク質の品質管理機構に着目した.
1.リボソーム品質管理機構にかかわる新規のタンパク質Vms1
サイトゾルタンパク質であるVms1は酸化ストレス条件においてミトコンドリアの表面に局在し異常なミトコンドリアタンパク質の品質管理にかかわることが報告されていた7).しかし,どのようなタンパク質がVms1の基質になるのか,その分子機構は不明であった.Vms1の機能を明らかにするため,出芽酵母をモデルとして,Vms1の相互作用タンパク質のプロテオームを解析した結果,Vms1は60Sリボソームの結合タンパク質であることが明らかにされた.さらに,Vms1と相互作用するタンパク質としてリボソーム品質管理機構にかかわるRqc2およびLtn1が同定された.この結果より,Vms1はミトコンドリアにおいてリボソーム品質管理機構にかかわることが示唆された.
2.Vms1およびLtn1の欠損はRqc2に依存的なミトコンドリアタンパク質の凝集をひき起こす
リボソーム品質管理機構にかかわるタンパク質を欠損した出芽酵母株を作製しその表現型を解析した結果,Vms1およびLtn1を欠損した細胞においては,ストレスをあたえていない通常の生育条件においてでさえ,ミトコンドリアタンパク質が特異的に凝集することが明らかにされた.分子シャペロン,プロテアーゼ,翻訳因子,呼吸鎖複合体の構成タンパク質など,ミトコンドリアの機能に必須の多くのタンパク質が凝集し,呼吸鎖複合体やATP合成酵素など,エネルギーの産生に必要なタンパク質複合体の形成が顕著に阻害された.
サイトゾルに存在するVms1およびLtn1を欠損した細胞において,なぜ,ミトコンドリアタンパク質が凝集するのだろうか? 近年,Rqc2によりC末端にAlaおよびThrの付加されたタンパク質が分解されずにサイトゾルに蓄積すると,凝集体を形成することが報告された8,9).そこで,Vms1およびLtn1を欠損した細胞においてはRqc2によりC末端にAlaおよびThrの付加された異常な新生ポリペプチド鎖がミトコンドリアに蓄積してタンパク質の凝集をひき起こすのではないかと考えた.Rqc2を欠損させた細胞においてはVms1およびLtn1の欠損によるミトコンドリアタンパク質の凝集が抑制され,ミトコンドリアの機能が回復した.この結果から,Vms1およびLtn1を欠損した細胞におけるミトコンドリアタンパク質の特異的な凝集はRqc2によりひき起こされることが示された.
3.Rqc2による新生ポリペプチド鎖のC末端へのAlaおよびThrの付加がミトコンドリアタンパク質の凝集をひき起こす
Rqc2によりC末端にAlaおよびThrの付加された異常なタンパク質が実際にミトコンドリアタンパク質の凝集をひき起こすのかどうか調べるため,リボソームの異常な停止により生じる不完全な新生ポリペプチド鎖のモデルとして,終止コドンを欠損させたGFP遺伝子の翻訳産物を解析した.この異常なGFPにミトコンドリア移行シグナルを付加してミトコンドリアに局在させたところ,Ltn1あるいはVms1を欠損した細胞において高分子量の凝集体が観察された.この凝集体の形成はRqc2に依存的であったことから,C末端へのAlaおよびThrの付加がリボソームの異常な停止により生じた不完全な新生ポリペプチド鎖の凝集をひき起こすことが示唆された.一方,異常なGFPをサイトゾルに局在させたところ,Ltn1を欠損した細胞においては高分子量の凝集体が観察されたが,Vms1を欠損した細胞において凝集体はみられなかった.このことから,Vms1はミトコンドリアタンパク質の凝集の抑制に特異的に機能することが示唆された.また,C末端にAlaおよびThrの付加された異常なGFPは,ミトコンドリアの内部においてミトコンドリアの機能に必須のタンパク質をまき込んで封入体を形成した.さらに,C末端へのAlaおよびThrの付加がタンパク質の凝集の直接の原因であるかどうかを検証するため,ミトコンドリア移行シグナルを付加した正常なGFPのC末端にAla-Thrの10回くり返し配列を人工的に付加したところ凝集がひき起こされた.以上より,ミトコンドリアタンパク質のC末端へのAlaおよびThrの付加がミトコンドリアの内部における封入体の形成のひき金になることが明らかにされた.
4.Vms1はRqc2による異常な新生ポリペプチド鎖のC末端へのAlaおよびThrの付加を抑制する
Ltn1は異常な新生ポリペプチド鎖をユビキチン化し,プロテアソームにより分解することにより異常な新生ポリペプチド鎖の蓄積および凝集を抑制する.それでは,Vms1はどのようにして異常な新生ポリペプチド鎖の凝集を抑制するのだろうか? 細胞溶出液からミトコンドリア移行シグナルを付加した異常なGFPを単離しプロテオーム解析した結果,Vms1の欠損によりRqc2と異常なGFPとの相互作用が促進され,AlaおよびThrの付加および凝集体の形成が亢進されることが示された.一方,Vms1を過剰に発現させるとRqc2の60Sリボソームからの解離が促進され,AlaおよびThrの付加が抑制された.AlaおよびThrの付加が抑制された異常なGFPはサイトゾルにおいて分解されるのではなく,ミトコンドリアへと輸送され,ミトコンドリアにおける品質管理機構により処理された.また,Vms1は異常な新生ポリペプチド鎖の分解に必要なCdc48(ヒトにおいては,p97)と結合するドメインをもつが,このドメインはAlaおよびThrの付加の抑制には必要ではなかった.以上から,Vms1は新生ポリペプチド鎖のC末端へのAlaおよびThrの付加を抑制するという,サイトゾルにおける分解とは異なる手段を用いることにより,ミトコンドリアの内部における凝集体の形成を抑制することが明らかにされた(図1).ミトコンドリアタンパク質はサイトゾルタンパク質とは異なり,サイトゾルでの翻訳とミトコンドリアへの輸送とが共役しているため,異常な新生ポリペプチド鎖の一部はサイトゾルにおける分解を回避してしまう.Vms1が機能しないとRqc2によるC末端へのAlaおよびThrの付加が亢進し,異常な新生ポリペプチド鎖はミトコンドリアの内部においてミトコンドリアの機能に必須のタンパク質をまき込んで凝集してしまう.Vms1は,このようなサイトゾルにおける分解の困難な異常なタンパク質を適切に処理するために進化したと考えられる.
おわりに
Vms1およびLtn1を欠損した細胞では,とくにストレスをあたえていない通常の生育条件においてもミトコンドリアの機能が破綻することが示された.このことから,細胞においてはつねに異常な新生ポリペプチド鎖が生じており,新生ミトコンドリアタンパク質の品質管理機構によりたえずミトコンドリアの恒常性が維持されることが示唆された.Vms1を含むリボソーム品質管理機構にかかわるタンパク質はヒトにも保存されていることから,この研究において明らかにされたリボソーム品質管理機構の異常は,ミトコンドリアの異常に起因する神経変性疾患などとも密接に関連することが予想される.実際に,Listerin変異体を発現するマウスは神経変性疾患を発症することが報告されている10).また,Rqc2によるC末端へのAlaおよびThrの付加の亢進およびVms1によるその抑制がどのような分子機構によるのかも興味深い.今後は,クライオ電子顕微鏡解析,X線結晶構造解析,生化学的な解析などを組み合わせることにより,Vms1によるC末端へのAlaおよびThrの付加の制御の詳細な分子機構が明らかにされるであろう.
Rqc2は真核生物のみならず,ミトコンドリアが共生する以前の真核生物の祖先と考えられる古細菌にまで広く保存されている.一方,Vms1は古細菌には保存されていないが,酵母,植物,ヒトを含む真核生物に広く保存されている.真核生物の誕生の際,ミトコンドリア遺伝子のほとんどは核へと移動し,サイトゾルにおける翻訳系によりタンパク質を合成しミトコンドリアに取り込むというシステムがつくりあげられたときに,Rqc2による異常な新生ポリペプチド鎖のC末端へのAlaおよびThrの付加は大きな問題になったであろう.Vms1は,このミトコンドリアの共生の過程において生じたジレンマを克服するために現われたのかもしれない.
文 献
- Tsuboi, T., Kuroha, K., Kudo, K. et al.: Dom34:hbs1 plays a general role in quality-control systems by dissociation of a stalled ribosome at the 3' end of aberrant mRNA. Mol. Cell, 46, 518-529 (2012)[PubMed] [新着論文レビュー]
- Brandman, O., Stewart-Ornstein, J., Wong, D. et al.: A ribosome-bound quality control complex triggers degradation of nascent peptides and signals translation stress. Cell, 151, 1042-1054 (2012)[PubMed]
- Shen, P. S., Park, J., Qin, Y. et al.: Rqc2p and 60S ribosomal subunits mediate mRNA-independent elongation of nascent chains. Science, 347, 75-78 (2015)[PubMed]
- Kostova, K. K., Hickey, K. L., Osuna, B. A. et al.: CAT-tailing as a fail-safe mechanism for efficient degradation of stalled nascent polypeptides. Science, 357, 414-417 (2017)[PubMed]
- Osuna, B. A., Howard, C. J., Kc, S. et al.: In vitro analysis of RQC activities provides insights into the mechanism and function of CAT tailing. Elife, e27949 (2017)[PubMed]
- Izawa, T., Tsuboi, T., Kuroha, K. et al.: Roles of dom34:hbs1 in nonstop protein clearance from translocators for normal organelle protein influx. Cell Rep., 2, 447-453 (2012)[PubMed]
- Heo, J. M., Livnat-Levanon, N., Taylor, E. B. et al.: A stress-responsive system for mitochondrial protein degradation. Mol. Cell, 40, 465-480 (2010)[PubMed]
- Choe, Y. J., Park, S. H., Hassemer, T. et al.: Failure of RQC machinery causes protein aggregation and proteotoxic stress. Nature, 531, 191-195 (2016)[PubMed]
- Yonashiro, R., Tahara, E. B., Bengtson, M. H. et al.: The Rqc2/Tae2 subunit of the ribosome-associated quality control (RQC) complex marks ribosome-stalled nascent polypeptide chains for aggregation. Elife, e11794 (2016)[PubMed]
- Chu, J., Hong, N. A., Masuda, C. A. et al.: A mouse forward genetics screen identifies LISTERIN as an E3 ubiquitin ligase involved in neurodegeneration. Proc. Natl. Acad. Sci. USA, 106, 2097-2103 (2009)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 名古屋大学大学院理学研究科にて博士号取得,同年 ドイツMax Planck Institute of Biochemistry博士研究員,2015年 九州大学大学院医学研究院 助教を経て,2016年よりドイツMunich大学にて博士研究員.
研究テーマ:ミトコンドリアにおける品質管理機構.
関心事:脊椎動物の発生の初期におけるミトコンドリアの分裂および融合のダイナミクス.
F. Ulrich Hartl
ドイツMax Planck Institute of BiochemistryにてProfessor.
研究室URL:http://www.biochem.mpg.de/en/rd/hartl
Walter Neupert
ドイツMunich大学にてProfessor.
研究室URL:
http://www.zellbio.anatomie.med.uni-muenchen.de/about_us/walter-neupert/index.html
© 2017 井澤俊明・Ulrich Hartl・Walter Neupert Licensed under CC 表示 2.1 日本