PD-1欠損マウスにおける全身性のT細胞の活性化に起因するメタボロームのシフトを介した情動行動の変化
宮島倫生・Sidonia Fagarasan
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:宮島倫生
DOI: 10.7875/first.author.2017.126
Metabolic shift induced by systemic activation of T cells in PD-1-deficient mice perturbs brain monoamines and emotional behavior.
Michio Miyajima, Baihao Zhang, Yuki Sugiura, Kazuhiro Sonomura, Matteo M Guerrini, Yumi Tsutsui, Mikako Maruya, Alexis Vogelzang, Kenji Chamoto, Kurara Honda, Takatoshi Hikida, Satomi Ito, Hongyan Qin, Rikako Sanuki, Keiichiro Suzuki, Takahisa Furukawa, Yasushi Ishihama, Fumihiko Matsuda, Makoto Suematsu, Tasuku Honjo, Sidonia Fagarasan
Nature Immunology, 18, 1342-1352 (2017)
T細胞は活性化すると細胞における代謝経路が再編成されることが知られている.しかしながら,T細胞の活性化が全身性の代謝のプロファイルにおよぼす影響については明らかにされていない.筆者らは,T細胞の抑制性の免疫補助受容体であるPD-1を欠損するマウスにおいては,持続的なT細胞の活性化により,アミノ酸の減少により特徴づけられる血中のメタボロームの変化が生じることを見い出した.この血中のアミノ酸の減少はリンパ節において増殖し活性化したT細胞へのアミノ酸の蓄積に起因していた.PD-1欠損マウスにおいては,血中のトリプトファンおよびチロシンの減少により,脳においてもトリプトファンおよびチロシン,さらには,これらを前駆体とする神経伝達物質であるセロトニンおよびドーパミンが減少し,結果として,不安様の行動や恐怖反応が増強した.以上の結果から,持続的なT細胞の活性化が全身性のメタボロームのシフトを介して神経系に影響をおよぼすことにより情動行動を制御することが示された.
T細胞は活性化すると持続的な増殖やエフェクター機能の発揮のため細胞における代謝を変化させる1).たとえば,ATPの産生経路として定常状態のT細胞は酸化的リン酸化を使用するが,活性化した際には代謝経路が再編成されて好気性の解糖がその中心になる2).このように,免疫細胞の活性化はそれ自体のメタボロームを変化させるものの,全身性のメタボロームにどのように影響をおよぼすのかについてはほとんど明らかにされていない.また一方,われわれのからだは循環系,免疫系,神経系といったさまざまなシステムから構築されるが,それらのシステムのあいだの相互作用や制御機構についてはまだ多くの謎が残されている.このような背景のもと,筆者らは,持続的な免疫の活性化は全身性のメタボロームに影響をおよぼすのか,また,影響をおよぼすのであれば,その分子機構はどのようなものであるのか,さらに,免疫系はメタボロームの変化を介しほかのシステムにどのような影響をおよぼすのか,という問いをたてた.
PD-1はおもにT細胞に発現しT細胞受容体のシグナルを抑制する抑制性の免疫補助受容体である3).PD-1の欠損や抗体による中和は,T細胞の持続的な活性化により免疫の増強につながる一方,過剰な胚中心の形成や自己反応性の抗体の産生といった負の側面もひき起こす4,5).実際に,PD-1欠損マウスや抗PD-1抗体免疫療法を施した患者においては,拡張型心筋症,リウマチ性関節炎,全身性エリスマトーデスといった自己免疫疾患に対する感受性が上昇することが示されている3).筆者らは,PD-1を欠損したマウスを慢性的なT細胞の活性化のモデルとして用い,さきの問いに答えることを試みた.
PD-1欠損マウスの血中のメタボロームについて,とくに,低分子かつ水溶性の化合物を液体クロマトグラフィー-質量分析法およびガスクロマトグラフィー-質量分析法により解析した.部分最小2乗判別分析により,PD-1欠損マウスの全身性のメタボロームプロファイルは野生型のマウスとは異なることが示された.顕著な違いは,TCA回路やアミノ酸の代謝のようなエネルギーの産生にかかわる化合物の変化であり,ほとんどのアミノ酸が減少し,なかでも,芳香族アミノ酸であるトリプトファン,チロシン,フェニルアラニンの減少が顕著であった.
PD-1はおもに活性化したT細胞に発現する.PD-1欠損マウスの全身性のメタボロームプロファイルにおけるT細胞の寄与について調べるため,T細胞を欠損したマウス,および,T細胞およびPD-1を欠損したマウスにおいて血中のアミノ酸を測定した.その結果,芳香族アミノ酸を含む多くのアミノ酸の量は同じ程度であったことから,PD-1欠損マウスにおいて観察される血中のアミノ酸の減少はT細胞に依存することが明らかにされた.
PD-1欠損マウスにおける血中のアミノ酸の減少は,末梢における免疫の活性化,腸からの吸収の阻害,肝臓における生合成の低下,のいずれかに起因するとの仮説をたて,リンパ節,脾臓,小腸,大腸,肝臓においてメタボロームを解析した.その結果,野生型のマウスと比較して,PD-1欠損マウスのリンパ節においてはメタボロームプロファイルが変化したが,腸および肝臓においては顕著な変化は認められなかった.野生型のマウスと比較して,PD-1欠損マウスのリンパ節においてはトリプトファンを含む芳香族アミノ酸が2倍ほど増加しており,PD-1欠損マウスにおける血中のアミノ酸の減少はリンパ節へのアミノ酸の蓄積と対応していた.一方で,PD-1欠損マウスの末梢リンパ節においてはT細胞の数や活性化したT細胞の数が週齢に依存して増加しており,血中の芳香族アミノ酸の週齢に依存的な減少と対応していた.これらの結果から,リンパ節において増殖し活性化したT細胞がアミノ酸を蓄積する可能性が考えられた.
活性化したT細胞がアミノ酸を蓄積する可能性について検証するため,活性化したT細胞と活性化していないナイーブT細胞とでアミノ酸の量を比較した.野生型のマウスのリンパ節から単離された活性化したT細胞は,活性化していないT細胞と比較して,トリプトファンおよびチロシンが1.5倍ほど増加していた.さらに,フローサイトメトリー解析により,活性化したT細胞においてはトリプトファン輸送体であるCD98の発現の上昇が認められた.一方で,野生型のマウスおよびPD-1欠損マウスのリンパ節から単離されたT細胞をin vitroにおいて抗CD3抗体および抗CD28抗体により刺激したところ,活性化していないT細胞と比較して活性化したT細胞においてトリプトファンおよびチロシンは増加し,トリプトファン輸送体をコードするSlc3a2遺伝子およびSlc7a5遺伝子の発現が上昇した.さらに,放射性同位体により標識したトリプトファンを培地に添加してその取り込みを調べた結果,抗CD3抗体および抗CD28抗体により刺激した細胞において,刺激していない細胞と比較して取り込みが増加した.これらの結果から,リンパ節の活性化したT細胞がアミノ酸輸送体の発現を上昇させアミノ酸の取り込みを増加させることにより,アミノ酸を蓄積することが示された.
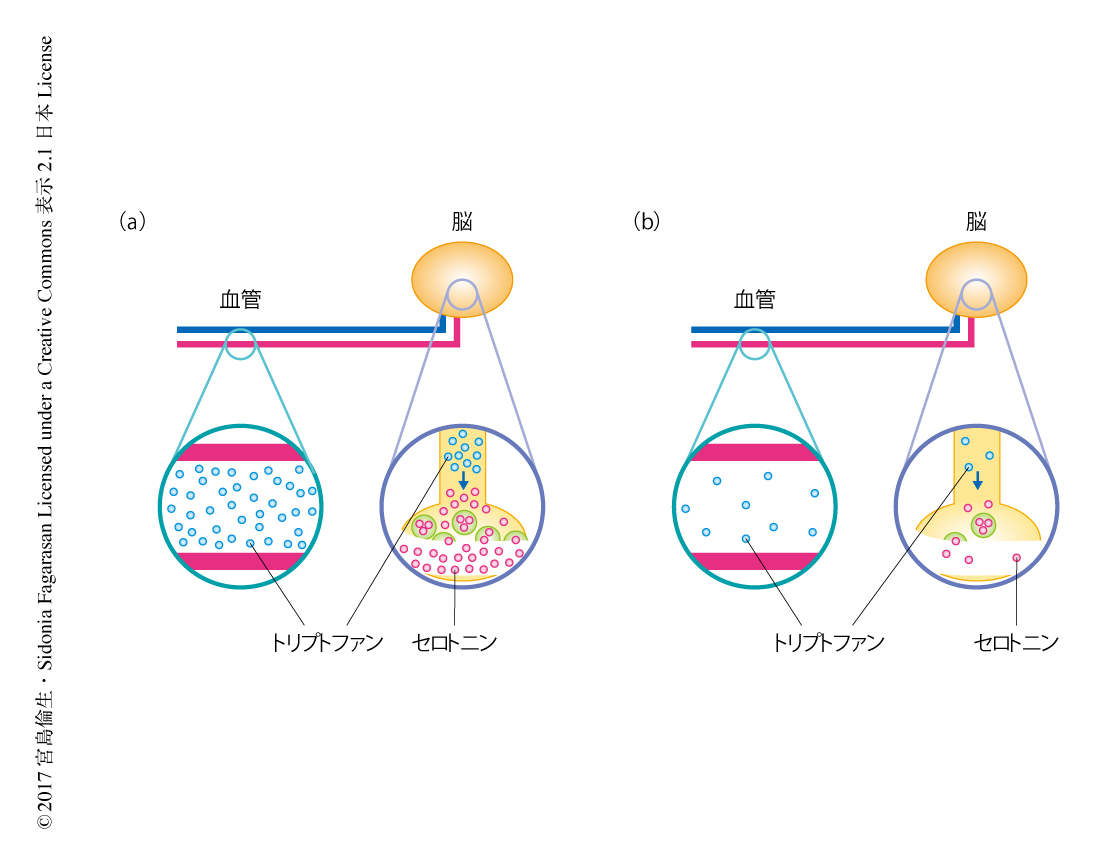
チロシンおよびトリプトファンは神経伝達物質であるドーパミンおよびセロトニンの前駆体でありその合成に必須である.ドーパミンは学習,意欲,運動などの行動を制御し6),セロトニンは不安や恐怖などの行動面を制御すると考えられている7,8).脳のメタボローム解析により,PD-1欠損マウスの脳においては野生型のマウスと比較してチロシンおよびトリプトファンが有意に減少していることが明らかにされた.また,ドーパミンおよびセロトニンも有意に減少していた.さらに,in situにおける免疫染色により,PD-1欠損マウスの中脳縫線核でのトリプトファンヒドロキシラーゼ陽性のセロトニン作動性ニューロンにおけるセロトニンの減少が示された.また,質量顕微鏡により,PD-1欠損マウスにおいては野生型のマウスと比較して,線条体においてドーパミンが,中脳においてセロトニンが,それぞれ減少していた.これらの結果から,PD-1欠損マウスにおいては血中のトリプトファンおよびチロシンの減少により,脳において神経伝達物質であるドーパミンおよびセロトニンが減少することが示唆された.
PD-1欠損マウスの脳におけるドーパミンおよびセロトニンの減少が行動に影響をおよぼすのかどうか調べた.不安様の行動の試験である高架式十字迷路において,PD-1欠損マウスは野生型のマウスと比較して高い不安性を示した.活動性および不安性の試験であるオープンフィールド試験において,PD-1欠損マウスは野生型のマウスと比較して高い不安性を示すとともに活動性の低下を示した.また,学習と環境刺激への嫌悪反応を探索する恐怖条件づけ試験において,PD-1欠損マウスは恐怖条件づけの過程においては大きな変化は観察されなかったが,条件づけののちの文脈や音に対する恐怖反応が有意に高く,恐怖記憶の消失の障害を示した.以上の結果より,PD-1欠損マウスにおいては活動性が低下しており,不安様の行動や恐怖応答が増強していることが明らかにされた.
神経伝達物質の薬理的な補充によりPD-1欠損マウスの条件つき恐怖反応が回復するかどうか調べた.フェネルジンおよびフルオキセチンは脳において神経伝達物質の量を変化させることにより恐怖反応を制御することが知られている9,10).フルオキセチンのような選択的なセロトニン再取り込み阻害剤はセロトニンの再取り込みを遅らせることによりシナプス間隙におけるセロトニンの機能の持続性を高め,フェネルジンのようなモノアミンオキシダーゼ阻害剤はセロトニンおよびドーパミンの分解を阻害する.恐怖条件づけのまえのフルオキセチンの投与は,PD-1欠損マウスの恐怖反応を未投与の野生型マウスにおいて観察されたレベルにまで低下させた.フェネルジンの投与は,野生型のマウスおよびPD-1欠損マウスにおいて恐怖反応をより大きく低下させた.
トリプトファン補給餌による血中のトリプトファンの濃度の回復がPD-1欠損マウスの不安様の行動を回復させるかどうか検証した.2%のトリプトファン補給餌によりPD-1欠損マウスの血中のトリプトファンは野生型のマウスと同じ程度にまで増加し,脳の中脳縫線核におけるセロトニンは野生型のマウスと同じ程度にまで増加した.さらに,高架式十字迷路試験において,トリプトファン添加餌はPD-1欠損マウスの不安様の行動を回復させた.また,オープンフィールド試験において,トリプトファン添加餌はPD-1欠損マウスの不安様の行動を回復させた一方,活動性は回復させなかった.以上の結果から,前駆体であるアミノ酸の利用性の限局による神経伝達物質の欠乏がPD-1欠損マウスの特定の行動の異常の原因であることが示唆された.
この研究により,免疫の活性化を起因とする不安様の行動や恐怖反応の増強の分子機構の一端が明らかにされた.PD-1欠損マウスにおいて,T細胞の活性化により血中のメタボロームの変化,とくに,アミノ酸の減少がひき起こされることが示された.さらに,PD-1欠損マウスにおける血中のアミノ酸の減少は,リンパ節において増殖した活性化したT細胞へのアミノ酸の蓄積に起因することが見い出された.この免疫の活性化により生じる全身性のアミノ酸の減少は,アミノ酸を前駆体とする代謝経路に影響をおよぼした.具体的には,PD-1欠損マウスの脳におけるトリプトファンおよびチロシンの減少はセロトニンおよびドーパミンの合成に影響をおよぼし,不安様の行動および恐怖反応の増強へとつながった.以上のように,持続的なT細胞の活性化は全身性の代謝の変化をつうじて行動に影響をおよぼしうることが示された(図1).
この研究をふまえると,精神疾患には免疫の活性化にともなうメタボロームの変化に起因して発症するものが含まれる可能性が考えられる.今後,精神疾患の患者において免疫系の活性化,免疫系の遺伝子の変異,メタボロームの変化を調べることにより,これまで不明だった発症の原因の解明,発症の予測,予防法および治療法の開発につながることが期待される.また,抗PD-1抗体は有効性の期待されるがん治療法として利用されているが,治療が有効でないケースもある.今回の結果から,抗PD-1抗体療法をうけている患者の血清のメタボロームプロファイルが治療の有効性を判定するマーカーとして応用できる可能性も考えられ,さらなる研究が待たれる.
略歴:2010年 東京大学大学院医学系研究科博士課程 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター)研究員.
関心事:生物学全般.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://www.ims.riken.jp/labo/12/index_j.html
© 2017 宮島倫生・Sidonia Fagarasan Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:宮島倫生
DOI: 10.7875/first.author.2017.126
Metabolic shift induced by systemic activation of T cells in PD-1-deficient mice perturbs brain monoamines and emotional behavior.
Michio Miyajima, Baihao Zhang, Yuki Sugiura, Kazuhiro Sonomura, Matteo M Guerrini, Yumi Tsutsui, Mikako Maruya, Alexis Vogelzang, Kenji Chamoto, Kurara Honda, Takatoshi Hikida, Satomi Ito, Hongyan Qin, Rikako Sanuki, Keiichiro Suzuki, Takahisa Furukawa, Yasushi Ishihama, Fumihiko Matsuda, Makoto Suematsu, Tasuku Honjo, Sidonia Fagarasan
Nature Immunology, 18, 1342-1352 (2017)
要 約
T細胞は活性化すると細胞における代謝経路が再編成されることが知られている.しかしながら,T細胞の活性化が全身性の代謝のプロファイルにおよぼす影響については明らかにされていない.筆者らは,T細胞の抑制性の免疫補助受容体であるPD-1を欠損するマウスにおいては,持続的なT細胞の活性化により,アミノ酸の減少により特徴づけられる血中のメタボロームの変化が生じることを見い出した.この血中のアミノ酸の減少はリンパ節において増殖し活性化したT細胞へのアミノ酸の蓄積に起因していた.PD-1欠損マウスにおいては,血中のトリプトファンおよびチロシンの減少により,脳においてもトリプトファンおよびチロシン,さらには,これらを前駆体とする神経伝達物質であるセロトニンおよびドーパミンが減少し,結果として,不安様の行動や恐怖反応が増強した.以上の結果から,持続的なT細胞の活性化が全身性のメタボロームのシフトを介して神経系に影響をおよぼすことにより情動行動を制御することが示された.
はじめに
T細胞は活性化すると持続的な増殖やエフェクター機能の発揮のため細胞における代謝を変化させる1).たとえば,ATPの産生経路として定常状態のT細胞は酸化的リン酸化を使用するが,活性化した際には代謝経路が再編成されて好気性の解糖がその中心になる2).このように,免疫細胞の活性化はそれ自体のメタボロームを変化させるものの,全身性のメタボロームにどのように影響をおよぼすのかについてはほとんど明らかにされていない.また一方,われわれのからだは循環系,免疫系,神経系といったさまざまなシステムから構築されるが,それらのシステムのあいだの相互作用や制御機構についてはまだ多くの謎が残されている.このような背景のもと,筆者らは,持続的な免疫の活性化は全身性のメタボロームに影響をおよぼすのか,また,影響をおよぼすのであれば,その分子機構はどのようなものであるのか,さらに,免疫系はメタボロームの変化を介しほかのシステムにどのような影響をおよぼすのか,という問いをたてた.
PD-1はおもにT細胞に発現しT細胞受容体のシグナルを抑制する抑制性の免疫補助受容体である3).PD-1の欠損や抗体による中和は,T細胞の持続的な活性化により免疫の増強につながる一方,過剰な胚中心の形成や自己反応性の抗体の産生といった負の側面もひき起こす4,5).実際に,PD-1欠損マウスや抗PD-1抗体免疫療法を施した患者においては,拡張型心筋症,リウマチ性関節炎,全身性エリスマトーデスといった自己免疫疾患に対する感受性が上昇することが示されている3).筆者らは,PD-1を欠損したマウスを慢性的なT細胞の活性化のモデルとして用い,さきの問いに答えることを試みた.
1.PD-1欠損マウスにおけるT細胞に依存的な血中のアミノ酸の減少
PD-1欠損マウスの血中のメタボロームについて,とくに,低分子かつ水溶性の化合物を液体クロマトグラフィー-質量分析法およびガスクロマトグラフィー-質量分析法により解析した.部分最小2乗判別分析により,PD-1欠損マウスの全身性のメタボロームプロファイルは野生型のマウスとは異なることが示された.顕著な違いは,TCA回路やアミノ酸の代謝のようなエネルギーの産生にかかわる化合物の変化であり,ほとんどのアミノ酸が減少し,なかでも,芳香族アミノ酸であるトリプトファン,チロシン,フェニルアラニンの減少が顕著であった.
PD-1はおもに活性化したT細胞に発現する.PD-1欠損マウスの全身性のメタボロームプロファイルにおけるT細胞の寄与について調べるため,T細胞を欠損したマウス,および,T細胞およびPD-1を欠損したマウスにおいて血中のアミノ酸を測定した.その結果,芳香族アミノ酸を含む多くのアミノ酸の量は同じ程度であったことから,PD-1欠損マウスにおいて観察される血中のアミノ酸の減少はT細胞に依存することが明らかにされた.
2.PD-1欠損マウスのリンパ節におけるアミノ酸の蓄積およびT細胞の活性化
PD-1欠損マウスにおける血中のアミノ酸の減少は,末梢における免疫の活性化,腸からの吸収の阻害,肝臓における生合成の低下,のいずれかに起因するとの仮説をたて,リンパ節,脾臓,小腸,大腸,肝臓においてメタボロームを解析した.その結果,野生型のマウスと比較して,PD-1欠損マウスのリンパ節においてはメタボロームプロファイルが変化したが,腸および肝臓においては顕著な変化は認められなかった.野生型のマウスと比較して,PD-1欠損マウスのリンパ節においてはトリプトファンを含む芳香族アミノ酸が2倍ほど増加しており,PD-1欠損マウスにおける血中のアミノ酸の減少はリンパ節へのアミノ酸の蓄積と対応していた.一方で,PD-1欠損マウスの末梢リンパ節においてはT細胞の数や活性化したT細胞の数が週齢に依存して増加しており,血中の芳香族アミノ酸の週齢に依存的な減少と対応していた.これらの結果から,リンパ節において増殖し活性化したT細胞がアミノ酸を蓄積する可能性が考えられた.
3.活性化したT細胞によるアミノ酸の蓄積とその分子機構
活性化したT細胞がアミノ酸を蓄積する可能性について検証するため,活性化したT細胞と活性化していないナイーブT細胞とでアミノ酸の量を比較した.野生型のマウスのリンパ節から単離された活性化したT細胞は,活性化していないT細胞と比較して,トリプトファンおよびチロシンが1.5倍ほど増加していた.さらに,フローサイトメトリー解析により,活性化したT細胞においてはトリプトファン輸送体であるCD98の発現の上昇が認められた.一方で,野生型のマウスおよびPD-1欠損マウスのリンパ節から単離されたT細胞をin vitroにおいて抗CD3抗体および抗CD28抗体により刺激したところ,活性化していないT細胞と比較して活性化したT細胞においてトリプトファンおよびチロシンは増加し,トリプトファン輸送体をコードするSlc3a2遺伝子およびSlc7a5遺伝子の発現が上昇した.さらに,放射性同位体により標識したトリプトファンを培地に添加してその取り込みを調べた結果,抗CD3抗体および抗CD28抗体により刺激した細胞において,刺激していない細胞と比較して取り込みが増加した.これらの結果から,リンパ節の活性化したT細胞がアミノ酸輸送体の発現を上昇させアミノ酸の取り込みを増加させることにより,アミノ酸を蓄積することが示された.
4.PD-1欠損マウスにおける脳での神経伝達物質の減少
チロシンおよびトリプトファンは神経伝達物質であるドーパミンおよびセロトニンの前駆体でありその合成に必須である.ドーパミンは学習,意欲,運動などの行動を制御し6),セロトニンは不安や恐怖などの行動面を制御すると考えられている7,8).脳のメタボローム解析により,PD-1欠損マウスの脳においては野生型のマウスと比較してチロシンおよびトリプトファンが有意に減少していることが明らかにされた.また,ドーパミンおよびセロトニンも有意に減少していた.さらに,in situにおける免疫染色により,PD-1欠損マウスの中脳縫線核でのトリプトファンヒドロキシラーゼ陽性のセロトニン作動性ニューロンにおけるセロトニンの減少が示された.また,質量顕微鏡により,PD-1欠損マウスにおいては野生型のマウスと比較して,線条体においてドーパミンが,中脳においてセロトニンが,それぞれ減少していた.これらの結果から,PD-1欠損マウスにおいては血中のトリプトファンおよびチロシンの減少により,脳において神経伝達物質であるドーパミンおよびセロトニンが減少することが示唆された.
5.PD-1欠損マウスに認められる活動性の低下と不安様の行動および恐怖反応の増強
PD-1欠損マウスの脳におけるドーパミンおよびセロトニンの減少が行動に影響をおよぼすのかどうか調べた.不安様の行動の試験である高架式十字迷路において,PD-1欠損マウスは野生型のマウスと比較して高い不安性を示した.活動性および不安性の試験であるオープンフィールド試験において,PD-1欠損マウスは野生型のマウスと比較して高い不安性を示すとともに活動性の低下を示した.また,学習と環境刺激への嫌悪反応を探索する恐怖条件づけ試験において,PD-1欠損マウスは恐怖条件づけの過程においては大きな変化は観察されなかったが,条件づけののちの文脈や音に対する恐怖反応が有意に高く,恐怖記憶の消失の障害を示した.以上の結果より,PD-1欠損マウスにおいては活動性が低下しており,不安様の行動や恐怖応答が増強していることが明らかにされた.
6.薬理的な補充や食餌の介入による行動の異常の回復
神経伝達物質の薬理的な補充によりPD-1欠損マウスの条件つき恐怖反応が回復するかどうか調べた.フェネルジンおよびフルオキセチンは脳において神経伝達物質の量を変化させることにより恐怖反応を制御することが知られている9,10).フルオキセチンのような選択的なセロトニン再取り込み阻害剤はセロトニンの再取り込みを遅らせることによりシナプス間隙におけるセロトニンの機能の持続性を高め,フェネルジンのようなモノアミンオキシダーゼ阻害剤はセロトニンおよびドーパミンの分解を阻害する.恐怖条件づけのまえのフルオキセチンの投与は,PD-1欠損マウスの恐怖反応を未投与の野生型マウスにおいて観察されたレベルにまで低下させた.フェネルジンの投与は,野生型のマウスおよびPD-1欠損マウスにおいて恐怖反応をより大きく低下させた.
トリプトファン補給餌による血中のトリプトファンの濃度の回復がPD-1欠損マウスの不安様の行動を回復させるかどうか検証した.2%のトリプトファン補給餌によりPD-1欠損マウスの血中のトリプトファンは野生型のマウスと同じ程度にまで増加し,脳の中脳縫線核におけるセロトニンは野生型のマウスと同じ程度にまで増加した.さらに,高架式十字迷路試験において,トリプトファン添加餌はPD-1欠損マウスの不安様の行動を回復させた.また,オープンフィールド試験において,トリプトファン添加餌はPD-1欠損マウスの不安様の行動を回復させた一方,活動性は回復させなかった.以上の結果から,前駆体であるアミノ酸の利用性の限局による神経伝達物質の欠乏がPD-1欠損マウスの特定の行動の異常の原因であることが示唆された.
おわりに
この研究により,免疫の活性化を起因とする不安様の行動や恐怖反応の増強の分子機構の一端が明らかにされた.PD-1欠損マウスにおいて,T細胞の活性化により血中のメタボロームの変化,とくに,アミノ酸の減少がひき起こされることが示された.さらに,PD-1欠損マウスにおける血中のアミノ酸の減少は,リンパ節において増殖した活性化したT細胞へのアミノ酸の蓄積に起因することが見い出された.この免疫の活性化により生じる全身性のアミノ酸の減少は,アミノ酸を前駆体とする代謝経路に影響をおよぼした.具体的には,PD-1欠損マウスの脳におけるトリプトファンおよびチロシンの減少はセロトニンおよびドーパミンの合成に影響をおよぼし,不安様の行動および恐怖反応の増強へとつながった.以上のように,持続的なT細胞の活性化は全身性の代謝の変化をつうじて行動に影響をおよぼしうることが示された(図1).
この研究をふまえると,精神疾患には免疫の活性化にともなうメタボロームの変化に起因して発症するものが含まれる可能性が考えられる.今後,精神疾患の患者において免疫系の活性化,免疫系の遺伝子の変異,メタボロームの変化を調べることにより,これまで不明だった発症の原因の解明,発症の予測,予防法および治療法の開発につながることが期待される.また,抗PD-1抗体は有効性の期待されるがん治療法として利用されているが,治療が有効でないケースもある.今回の結果から,抗PD-1抗体療法をうけている患者の血清のメタボロームプロファイルが治療の有効性を判定するマーカーとして応用できる可能性も考えられ,さらなる研究が待たれる.
文 献
- O'Neill, L. A., Kishton, R. J. & Rathmell, J.: A guide to immunometabolism for immunologists. Nat. Rev. Immunol., 16, 553-565 (2016)[PubMed]
- Loftus, R. M. & Finlay, D. K.: Immunometabolism: cellular metabolism turns immune regulator. J. Biol. Chem., 291, 1-10 (2016)[PubMed]
- Okazaki, T., Chikuma, S., Iwai, Y. et al.: A rheostat for immune responses: the unique properties of PD-1 and their advantages for clinical application. Nat. Immunol., 14, 1212-1218 (2013)[PubMed]
- Good-Jacobson, K. L., Szumilas, C. G., Chen, L. et al.: PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells. Nat. Immunol., 11, U535-U107 (2010)[PubMed]
- Kawamoto, S., Tran, T. H., Maruya, M. et al.: The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut. Science, 336, 485-489 (2012)[PubMed]
- Wise, R. A.: Dopamine, learning and motivation. Nat. Rev. Neurosci., 6, 483-494 (2004)[PubMed]
- Mosienko, V., Bert, B., Beis, D. et al.: Exaggerated aggression and decreased anxiety in mice deficient in brain serotonin. Transl, Psychiat., 2, e122 (2012)[PubMed]
- Bauer, E. P.: Serotonin in fear conditioning processes. Behav. Brain Res., 277, 68-77 (2015)[PubMed]
- Santos, J. M., Martinez, R. C. & Brandao, M. L.: Effects of acute and subchronic treatments with fluoxetine and desipramine on the memory of fear in moderate and high-intensity contextual conditioning. Eur. J. Pharmacol., 542, 121-128 (2006)[PubMed]
- Maki, Y., Inoue, T., Izumi, T. et al.: Monoamine oxidase inhibitors reduce conditioned fear stress-induced freezing behavior in rats. Eur. J. Pharmacol., 406, 411-418 (2000)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京大学大学院医学系研究科博士課程 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター)研究員.
関心事:生物学全般.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://www.ims.riken.jp/labo/12/index_j.html
© 2017 宮島倫生・Sidonia Fagarasan Licensed under CC 表示 2.1 日本