マウスにおける割球に類似した性質をもつ幹細胞株の樹立
正木英樹・中内啓光
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:中内啓光
DOI: 10.7875/first.author.2017.124
Establishment of mouse expanded potential stem cells.
Jian Yang, David J. Ryan, Wei Wang, Jason Cheuk-Ho Tsang, Guocheng Lan, Hideki Masaki, Xuefei Gao, Liliana Antunes, Yong Yu, Zhexin Zhu, Juexuan Wang, Aleksandra A. Kolodziejczyk, Lia S. Campos, Cui Wang, Fengtang Yang, Zhen Zhong, Beiyuan Fu, Melanie A. Eckersley-Maslin, Michael Woods, Yosuke Tanaka, Xi Chen, Adam C. Wilkinson, James Bussell, Jacqui White, Ramiro Ramirez-Solis, Wolf Reik, Berthold Göttgens, Sarah A. Teichmann, Patrick P. L. Tam, Hiromitsu Nakauchi, Xiangang Zou, Liming Lu, Pentao Liu
Nature, 550, 393-397 (2017)
マウスにおいて,着床前胚のエピブラストに由来するES細胞は,着床前胚に移植された際には体細胞系譜および生殖系列に寄与するが,栄養外胚葉や原始内胚葉に由来する胚体外組織には寄与しない.この研究において,筆者らは,8細胞期のおのおのの割球,および,ES細胞あるいはiPS細胞から,胚体および胚体外組織への分化能をもつ幹細胞株としてEPSC(expanded potential stem cell)を樹立した.キメラ形成実験において,ひとつのEPSCが胚体および栄養外胚葉の系列の双方に寄与することが示された.また,培養下においてEPSCから栄養外胚葉幹細胞および胚体外内胚葉幹細胞が作出された.さらに,エピゲノム解析および単一の細胞におけるトランスクリプトーム解析から,EPSCが割球に特異的なDNAメチロームおよび遺伝子の発現プロファイルをもつことが確認された.マウスにおいてこのような幹細胞株が樹立されたことから,ほかの哺乳動物においても同様の幹細胞株が樹立される可能性がある.
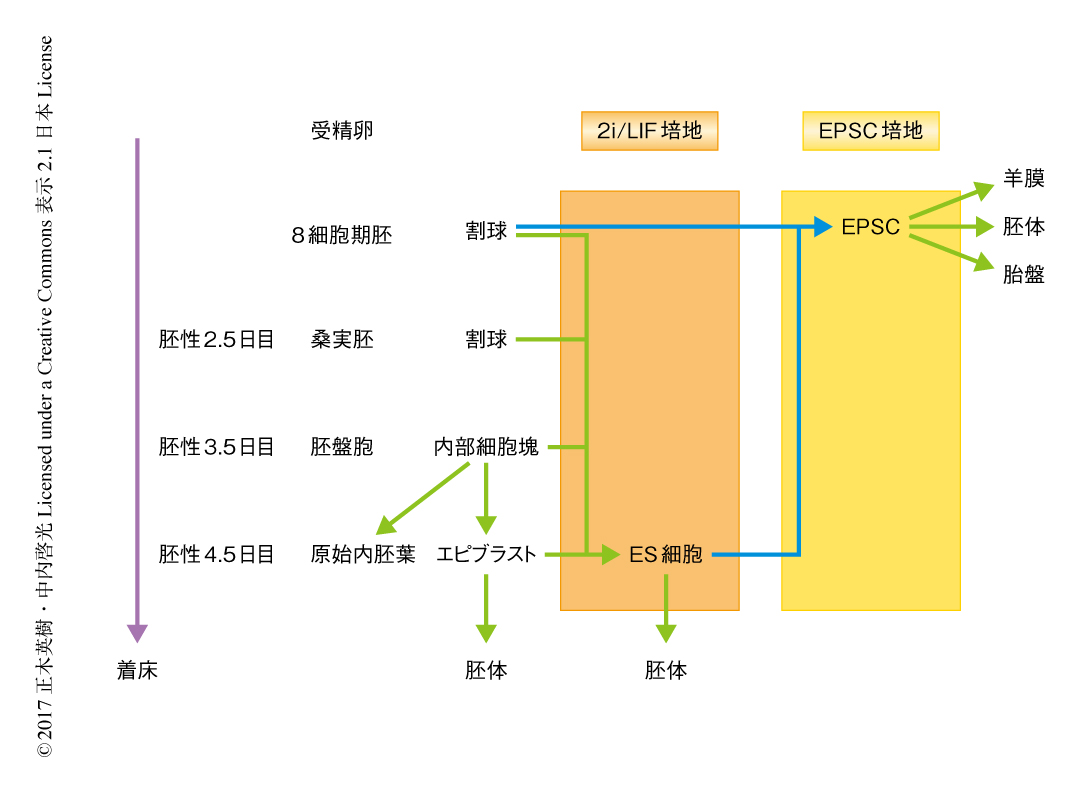
マウスのES細胞およびiPS細胞における未分化性の維持には,MEK阻害剤であるPD0325901およびGSK3β阻害剤であるCHIR99021を添加した2i/LIF培地を用いることにより分化を抑制する手法が広く用いられている1).2i/LIF培地を用いることにより桑実胚の割球,胚盤胞の内部細胞塊,初期のエピブラストからES細胞が樹立されるが,どの発生段階から樹立したES細胞も胎生4.5日目のエピブラストと近似した遺伝子の発現パターンを示すことが知られている2)(図1).筆者らは,ほかのシグナル伝達経路を阻害し割球の分化を抑制することにより,ES細胞より早い発生段階に相当する,胚体および胚体外組織の双方に寄与する幹細胞株が樹立されるのではないかと考えた.
これまでの報告から,桑実期から胚盤胞期にかけて内部細胞塊,原子内胚葉,栄養外胚葉に分化する過程にかかわるシグナル伝達経路を探し,MAPキナーゼシグナル伝達経路,Srcシグナル伝達経路,Wntシグナル伝達経路,Hippoシグナル伝達経路,および,ポリアデニル化制御タンパク質がこれらの運命決定に重要であると予想した.Srcシグナルを阻害すると桑実胚からの栄養外胚葉および原子内胚葉の形成が阻害されること,各種のポリアデニル化制御タンパク質のノックアウトにより栄養外胚葉の形成に影響がでること,Wntが初期の体軸の形成のイニシエーターであること,といった論拠をもとにさまざまな阻害剤の組合せを試し,最終的な組成にたどりついた.MAPキナーゼシグナルの阻害にはMEK1およびMEK2の阻害剤であるPD0325901のみならず,JNKシグナルの阻害剤であるJNK inhibitor VIII,p38シグナルの阻害剤であるSB203580を組み合わせ,下流の標的となるタンパク質であるERK1およびERK2の活性化を強力に阻害するようにした.XAV939は直接的にはポリアデニル化制御タンパク質のひとつであるTNKSを阻害するが,Wntシグナル阻害剤としても知られ,間接的にHippoシグナルも阻害される.この培地にはCHIR99021も添加されており,Wntシグナルの観点からはCHIR99021とXAV939の作用は矛盾するが,この培地からCHIR99021あるいはXAV939を除いてものちに述べるEPSC(expanded potential stem cell)の性質は維持されたことから,それぞれのWntシグナルのほかへの作用が重要であると考えられた.過去にも,マウスの多能性幹細胞をCHIR99021およびXAV939を添加した培地において培養した例は報告されている3,4).
マウスの8細胞期胚から単離した割球を,このEPSC培地と命名した培地において培養したところ,32の割球から8株が樹立され,EPSCと命名したすべての株はOct4陽性Cdx2陰性であった.一方,15%FBS含有培地あるいは2i/LIF培地において培養した場合には株はまったく樹立されなかった.EPSCは割球のみならず,4細胞期あるいは8細胞期の胚のまるごとからも樹立された.これらの株はマウスのES細胞と同じ多能性に関連する遺伝子を発現し,核型は正常で,異所的に移植された場合にはテラトーマを形成し,キメラ形成実験においては生殖系列への寄与も確認された.しかし,EPSCがES細胞と異なっていたのは,着床前胚に移植されたEPSCは内部細胞塊および栄養外胚葉の双方に分布することであった.これらのキメラ胚を子宮において発生させ,胚性6.5日目において解析したところ,EPSCに由来する細胞はエピブラストのみならず胚体外外胚葉にも寄与していた.より発生を進め胚性14.5日目において解析したところ,EPSCに由来する細胞は胚体のみならず羊膜および胎盤にも寄与していた.正確には,ES細胞を用いてキメラを形成させた場合,ES細胞に由来する細胞は羊膜の胚体外中胚葉には寄与するが,EPSCに由来する細胞は胚体外外胚葉への寄与も確認された.また,PD0325901を除くEPSC培地のおのおのの阻害剤はEPSCの性質の維持に必須ではなく,頻度は低下するものの,2i/LIF培地にA-419259あるいはXAV939を添加した培地でも胚体および胚体外組織への寄与が認められた.EPSCは割球から樹立されるのみならず,2i/LIF培地において維持されていたマウスのES細胞あるいはiPS細胞をEPSC培地において5継代以上にわたり培養することによっても樹立された.
RNAシークエンシングにより複数のEPSC株とES細胞株のトランスクリプトームを比較したところ,両者は異なるグループに分類された.多能性の維持にかかわる遺伝子については両者の発現プロファイルは近似していた.胚における遺伝子発現と比較すると,主成分分析にもとづくと割球における遺伝子発現とEPSCにおける遺伝子発現は異なるグループに分類された.しかし,胚の発生に関連する遺伝子に限定すると,EPSCにおける遺伝子発現と4細胞期の割球における遺伝子発現は近似していた.割球のそれぞれの段階に特異的な遺伝子の発現をEPSCとES細胞とで比較したところ,EPSCは受精胚から4細胞期に特異的な遺伝子との発現の相関が高く,ES細胞は8細胞期および16細胞期よりあとの特異的な遺伝子との相関が高くなった.また,ES細胞に含まれる全能性をもつサブポピュレーション5,6),in vivoにおいてリプログラミングしたiPS細胞7) といった既報の胚体および胚体外の双方への寄与を示す細胞株の遺伝子発現のデータをEPSCと比較したが,それらの株は異なるグループに分類された.
EPSCはES細胞と比較してDNAメチル基転移酵素であるDnmt3aおよびDnmt3lが高い発現を示した一方,DNA脱メチル化にかかわる酵素であるTet1,Tet2,Tdgの発現も相対的に高く,DNA脱メチル化の指標である5-ヒドロキシメチルシトシンの割合もはるかに高かった.これらは,4~8細胞期の割球にみられる特徴と同一であった.
ヒストンのメチル化についてEPSCとES細胞とで比較したところ,遺伝子発現が活性化した状態であるヒストンH3のLys4のトリメチル化および遺伝子発現が抑制された状態であるヒストンH3のLys27のトリメチル化の双方をもつ遺伝子座のうち,EPSCに特異的なものは胚の発生に関連する遺伝子に集中していた.ヒストンH3のLys4のトリメチル化をもつ遺伝子の発現プロファイルは8細胞期のものと類似していた.
EPSCは2i/LIF培地において数継代にわたり培養するとES細胞様の性質を獲得し,キメラ形成実験ではエピブラスト系列にしか寄与しなくなった.では,EPSCから胚盤胞を構成するほかの細胞である栄養外胚葉幹細胞あるいは胚体外内胚葉細胞は樹立されるだろうか.TX培地8) において培養したところ,EPSCからCdx2を発現する栄養外胚葉幹細胞様の細胞が得られた.この細胞はin vitroにおいて栄養膜に分化し,胚盤胞に移植してキメラを形成させたところ栄養膜に分布し胚性6.5日胚の胚体外外胚葉に寄与したことから,栄養外胚葉幹細胞と同様の性質をもつことが示された.胚体外内胚葉細胞への分化の誘導については,既報の培養法9) を適用し,Gata6を発現する細胞を胚体外内胚葉細胞様細胞として単離した.この細胞は遺伝子の発現プロファイルおよびキメラ形成実験の結果から,胚体外内胚葉細胞と同等であることが確認された.すなわち,EPSCはin vivoおよびin vitroのどちらにおいても胚体,胚体外外胚葉,胚体外内胚葉への分化能をもつことが示された.
以上の結果から,さまざまな阻害剤を組み合わせることにより,割球に相当する発生段階にある幹細胞株が樹立されたと結論づけた(図1).
今回,阻害剤の新規の組合せにより既報の多能性幹細胞とは異なる性質をもつ幹細胞株が樹立された.つぎの課題は,同様の細胞株がヒトを含むほかの哺乳動物においても樹立されるかあり,今後,検証を進めていく予定である.
略歴:2005年 東北大学大学院理学研究科 修了,同年 日本シェーリング,2007年 バイエル薬品,2008年 米国iZumiBio社,2010年 科学技術振興機構ERATO中内幹細胞制御プロジェクト 研究員を経て,2015年より東京大学医科学研究所 助教(現 特任助教).
研究テーマ:再生医療の産業化を目標とした,多能性幹細胞からの臓器の作製および機能的な細胞の作製.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 特任教授.
研究室URL:http://stemcell-u-tokyo.org/sct/memberlist/member/nakauchihiromitsu.html
© 2017 正木英樹・中内啓光 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:中内啓光
DOI: 10.7875/first.author.2017.124
Establishment of mouse expanded potential stem cells.
Jian Yang, David J. Ryan, Wei Wang, Jason Cheuk-Ho Tsang, Guocheng Lan, Hideki Masaki, Xuefei Gao, Liliana Antunes, Yong Yu, Zhexin Zhu, Juexuan Wang, Aleksandra A. Kolodziejczyk, Lia S. Campos, Cui Wang, Fengtang Yang, Zhen Zhong, Beiyuan Fu, Melanie A. Eckersley-Maslin, Michael Woods, Yosuke Tanaka, Xi Chen, Adam C. Wilkinson, James Bussell, Jacqui White, Ramiro Ramirez-Solis, Wolf Reik, Berthold Göttgens, Sarah A. Teichmann, Patrick P. L. Tam, Hiromitsu Nakauchi, Xiangang Zou, Liming Lu, Pentao Liu
Nature, 550, 393-397 (2017)
要 約
マウスにおいて,着床前胚のエピブラストに由来するES細胞は,着床前胚に移植された際には体細胞系譜および生殖系列に寄与するが,栄養外胚葉や原始内胚葉に由来する胚体外組織には寄与しない.この研究において,筆者らは,8細胞期のおのおのの割球,および,ES細胞あるいはiPS細胞から,胚体および胚体外組織への分化能をもつ幹細胞株としてEPSC(expanded potential stem cell)を樹立した.キメラ形成実験において,ひとつのEPSCが胚体および栄養外胚葉の系列の双方に寄与することが示された.また,培養下においてEPSCから栄養外胚葉幹細胞および胚体外内胚葉幹細胞が作出された.さらに,エピゲノム解析および単一の細胞におけるトランスクリプトーム解析から,EPSCが割球に特異的なDNAメチロームおよび遺伝子の発現プロファイルをもつことが確認された.マウスにおいてこのような幹細胞株が樹立されたことから,ほかの哺乳動物においても同様の幹細胞株が樹立される可能性がある.
はじめに
マウスのES細胞およびiPS細胞における未分化性の維持には,MEK阻害剤であるPD0325901およびGSK3β阻害剤であるCHIR99021を添加した2i/LIF培地を用いることにより分化を抑制する手法が広く用いられている1).2i/LIF培地を用いることにより桑実胚の割球,胚盤胞の内部細胞塊,初期のエピブラストからES細胞が樹立されるが,どの発生段階から樹立したES細胞も胎生4.5日目のエピブラストと近似した遺伝子の発現パターンを示すことが知られている2)(図1).筆者らは,ほかのシグナル伝達経路を阻害し割球の分化を抑制することにより,ES細胞より早い発生段階に相当する,胚体および胚体外組織の双方に寄与する幹細胞株が樹立されるのではないかと考えた.
1.EPSCの樹立
これまでの報告から,桑実期から胚盤胞期にかけて内部細胞塊,原子内胚葉,栄養外胚葉に分化する過程にかかわるシグナル伝達経路を探し,MAPキナーゼシグナル伝達経路,Srcシグナル伝達経路,Wntシグナル伝達経路,Hippoシグナル伝達経路,および,ポリアデニル化制御タンパク質がこれらの運命決定に重要であると予想した.Srcシグナルを阻害すると桑実胚からの栄養外胚葉および原子内胚葉の形成が阻害されること,各種のポリアデニル化制御タンパク質のノックアウトにより栄養外胚葉の形成に影響がでること,Wntが初期の体軸の形成のイニシエーターであること,といった論拠をもとにさまざまな阻害剤の組合せを試し,最終的な組成にたどりついた.MAPキナーゼシグナルの阻害にはMEK1およびMEK2の阻害剤であるPD0325901のみならず,JNKシグナルの阻害剤であるJNK inhibitor VIII,p38シグナルの阻害剤であるSB203580を組み合わせ,下流の標的となるタンパク質であるERK1およびERK2の活性化を強力に阻害するようにした.XAV939は直接的にはポリアデニル化制御タンパク質のひとつであるTNKSを阻害するが,Wntシグナル阻害剤としても知られ,間接的にHippoシグナルも阻害される.この培地にはCHIR99021も添加されており,Wntシグナルの観点からはCHIR99021とXAV939の作用は矛盾するが,この培地からCHIR99021あるいはXAV939を除いてものちに述べるEPSC(expanded potential stem cell)の性質は維持されたことから,それぞれのWntシグナルのほかへの作用が重要であると考えられた.過去にも,マウスの多能性幹細胞をCHIR99021およびXAV939を添加した培地において培養した例は報告されている3,4).
マウスの8細胞期胚から単離した割球を,このEPSC培地と命名した培地において培養したところ,32の割球から8株が樹立され,EPSCと命名したすべての株はOct4陽性Cdx2陰性であった.一方,15%FBS含有培地あるいは2i/LIF培地において培養した場合には株はまったく樹立されなかった.EPSCは割球のみならず,4細胞期あるいは8細胞期の胚のまるごとからも樹立された.これらの株はマウスのES細胞と同じ多能性に関連する遺伝子を発現し,核型は正常で,異所的に移植された場合にはテラトーマを形成し,キメラ形成実験においては生殖系列への寄与も確認された.しかし,EPSCがES細胞と異なっていたのは,着床前胚に移植されたEPSCは内部細胞塊および栄養外胚葉の双方に分布することであった.これらのキメラ胚を子宮において発生させ,胚性6.5日目において解析したところ,EPSCに由来する細胞はエピブラストのみならず胚体外外胚葉にも寄与していた.より発生を進め胚性14.5日目において解析したところ,EPSCに由来する細胞は胚体のみならず羊膜および胎盤にも寄与していた.正確には,ES細胞を用いてキメラを形成させた場合,ES細胞に由来する細胞は羊膜の胚体外中胚葉には寄与するが,EPSCに由来する細胞は胚体外外胚葉への寄与も確認された.また,PD0325901を除くEPSC培地のおのおのの阻害剤はEPSCの性質の維持に必須ではなく,頻度は低下するものの,2i/LIF培地にA-419259あるいはXAV939を添加した培地でも胚体および胚体外組織への寄与が認められた.EPSCは割球から樹立されるのみならず,2i/LIF培地において維持されていたマウスのES細胞あるいはiPS細胞をEPSC培地において5継代以上にわたり培養することによっても樹立された.
2.EPSCの性質の評価
RNAシークエンシングにより複数のEPSC株とES細胞株のトランスクリプトームを比較したところ,両者は異なるグループに分類された.多能性の維持にかかわる遺伝子については両者の発現プロファイルは近似していた.胚における遺伝子発現と比較すると,主成分分析にもとづくと割球における遺伝子発現とEPSCにおける遺伝子発現は異なるグループに分類された.しかし,胚の発生に関連する遺伝子に限定すると,EPSCにおける遺伝子発現と4細胞期の割球における遺伝子発現は近似していた.割球のそれぞれの段階に特異的な遺伝子の発現をEPSCとES細胞とで比較したところ,EPSCは受精胚から4細胞期に特異的な遺伝子との発現の相関が高く,ES細胞は8細胞期および16細胞期よりあとの特異的な遺伝子との相関が高くなった.また,ES細胞に含まれる全能性をもつサブポピュレーション5,6),in vivoにおいてリプログラミングしたiPS細胞7) といった既報の胚体および胚体外の双方への寄与を示す細胞株の遺伝子発現のデータをEPSCと比較したが,それらの株は異なるグループに分類された.
EPSCはES細胞と比較してDNAメチル基転移酵素であるDnmt3aおよびDnmt3lが高い発現を示した一方,DNA脱メチル化にかかわる酵素であるTet1,Tet2,Tdgの発現も相対的に高く,DNA脱メチル化の指標である5-ヒドロキシメチルシトシンの割合もはるかに高かった.これらは,4~8細胞期の割球にみられる特徴と同一であった.
ヒストンのメチル化についてEPSCとES細胞とで比較したところ,遺伝子発現が活性化した状態であるヒストンH3のLys4のトリメチル化および遺伝子発現が抑制された状態であるヒストンH3のLys27のトリメチル化の双方をもつ遺伝子座のうち,EPSCに特異的なものは胚の発生に関連する遺伝子に集中していた.ヒストンH3のLys4のトリメチル化をもつ遺伝子の発現プロファイルは8細胞期のものと類似していた.
EPSCは2i/LIF培地において数継代にわたり培養するとES細胞様の性質を獲得し,キメラ形成実験ではエピブラスト系列にしか寄与しなくなった.では,EPSCから胚盤胞を構成するほかの細胞である栄養外胚葉幹細胞あるいは胚体外内胚葉細胞は樹立されるだろうか.TX培地8) において培養したところ,EPSCからCdx2を発現する栄養外胚葉幹細胞様の細胞が得られた.この細胞はin vitroにおいて栄養膜に分化し,胚盤胞に移植してキメラを形成させたところ栄養膜に分布し胚性6.5日胚の胚体外外胚葉に寄与したことから,栄養外胚葉幹細胞と同様の性質をもつことが示された.胚体外内胚葉細胞への分化の誘導については,既報の培養法9) を適用し,Gata6を発現する細胞を胚体外内胚葉細胞様細胞として単離した.この細胞は遺伝子の発現プロファイルおよびキメラ形成実験の結果から,胚体外内胚葉細胞と同等であることが確認された.すなわち,EPSCはin vivoおよびin vitroのどちらにおいても胚体,胚体外外胚葉,胚体外内胚葉への分化能をもつことが示された.
以上の結果から,さまざまな阻害剤を組み合わせることにより,割球に相当する発生段階にある幹細胞株が樹立されたと結論づけた(図1).
おわりに
今回,阻害剤の新規の組合せにより既報の多能性幹細胞とは異なる性質をもつ幹細胞株が樹立された.つぎの課題は,同様の細胞株がヒトを含むほかの哺乳動物においても樹立されるかあり,今後,検証を進めていく予定である.
文 献
- Ying, Q. -L., Wray, J., Nichols, J. et al.: The ground state of embryonic stem cell self-renewal. Nature, 453, 519-523 (2008)[PubMed]
- Boroviak, T., Loos, R., Bertone, P. et al.: The ability of inner-cell-mass cells to self-renew as embryonic stem cells is acquired following epiblast specification. Nat. Cell Biol., 16, 513-525 (2014)[PubMed]
- Kim, H., Wu, J., Ye, S. et al.: Modulation of β-catenin function maintains mouse epiblast stem cell and human embryonic stem cell self-renewal. Nat. Commun., 4, 2403 (2013)[PubMed]
- Murayama, H., Masaki, H., Sato, H. et al.: Successful reprogramming of epiblast stem cells by blocking nuclear localization of β-catenin. Stem Cell Rep., 4, 103-113 (2015)[PubMed]
- Morgani, S. M., Canham, M. A., Nichols, J. et al.: Totipotent embryonic stem cells arise in ground-state culture conditions. Cell Rep., 3, 1945-1957 (2013)[PubMed]
- Macfarlan, T. S., Gifford, W. D., Driscoll, S. et al.: Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature, 487, 57-63 (2012)[PubMed]
- Abad, M., Mosteiro, L., Pantoja, C. et al.: Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature, 502, 340-345 (2013)[PubMed]
- Kubaczka, C., Senner, C., Arauzo-Bravo, M. J. et al.: Derivation and maintenance of murine trophoblast stem cells under defined conditions. Stem Cell Rep., 2, 232-242 (2014)[PubMed]
- Niakan, K. K., Schrode, N., Cho, L. T. Y. et al.: Derivation of extraembryonic endoderm stem (XEN) cells from mouse embryos and embryonic stem cells. Nat. Protocols, 8, 1028-1041 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 東北大学大学院理学研究科 修了,同年 日本シェーリング,2007年 バイエル薬品,2008年 米国iZumiBio社,2010年 科学技術振興機構ERATO中内幹細胞制御プロジェクト 研究員を経て,2015年より東京大学医科学研究所 助教(現 特任助教).
研究テーマ:再生医療の産業化を目標とした,多能性幹細胞からの臓器の作製および機能的な細胞の作製.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 特任教授.
研究室URL:http://stemcell-u-tokyo.org/sct/memberlist/member/nakauchihiromitsu.html
© 2017 正木英樹・中内啓光 Licensed under CC 表示 2.1 日本