エポキシ化ω3脂肪酸は免疫グロブリンEに依存的なマスト細胞の活性化を制御する
嶋中雄太1・河野 望1・村上 誠2・新井洋由1
(1東京大学大学院薬学系研究科 衛生化学教室,2東京大学大学院医学系研究科 疾患生命工学センター健康環境医工学部門)
email:嶋中雄太,新井洋由
DOI: 10.7875/first.author.2017.119
Omega-3 fatty acid epoxides are autocrine mediators that control the magnitude of IgE-mediated mast cell activation.
Yuta Shimanaka, Nozomu Kono, Yoshitaka Taketomi, Makoto Arita, Yoshimichi Okayama, Yuki Tanaka, Yasumasa Nishito, Tatsuki Mochizuki, Hiroyuki Kusuhara, Alexander Adibekian, Benjamin F. Cravatt, Makoto Murakami, Hiroyuki Arai
Nature Medicine, 23, 1287-1297 (2017)
マスト細胞はアレルギーにおいて中心的な役割を担う免疫細胞である.マスト細胞の機能においてはマスト細胞による脂質メディエーターの産生が必須であるが,その重要性が解析されているのはω6脂肪酸であるアラキドン酸に由来するエイコサノイドのみであった.筆者らは,網羅的なリピドミクス解析によりマスト細胞がω3脂肪酸に由来するエポキシ化ω3脂肪酸を豊富に産生することを発見し,酸化リン脂質に選択的な細胞内ホスホリパーゼA2であるPAF-AH2がエポキシ化ω3脂肪酸の産生酵素であることをつきとめた.また,PAF-AH2の欠損あるいはPAF-AH2の阻害剤の投与によりマスト細胞におけるエポキシ化ω3脂肪酸の産生は減少し,免疫グロブリンEに依存的なマスト細胞の活性化やアナフィラキシーは抑制された.さらに,エポキシ化ω3脂肪酸はSrcファミリーキナーゼの活性を抑制する足場タンパク質であるSrcin1の発現を低下させることにより免疫グロブリンEに依存的なマスト細胞の活性化を促進することが明らかにされ,このSrcin1の発現の制御には核内受容体であるPPARγが関与することが示唆された.この研究において見い出されたPAF-AH2-エポキシ化ω3脂肪酸-Srcin1経路はアレルギー性疾患に対する創薬における新規の標的として期待される.
近年,先進国においてアレルギー性疾患の患者数は急増しており大きな社会問題となっている1).その原因として,食生活の変化や排気ガスによる影響が提唱されているが,詳細は明らかではない.アレルギー性疾患の患者においては,マスト細胞の過度な活性化や血中における免疫グロブリンEの濃度の増加がみられる.したがって,マスト細胞の活性化の制御機構の詳細な解明がアレルギー性疾患の治療において急務とされている.
マスト細胞は皮膚などの結合組織や腸などの粘膜組織に常在する免疫細胞である.抗原に特異的な免疫グロブリンEがマスト細胞の表面に存在する高親和性の免疫グロブリンE受容体であるFcεRIと結合し,さらに抗原に曝露されるとFcεRIは架橋されて下流にシグナルが伝達され,顆粒小胞に蓄えられたヒスタミンなどの化学伝達物質の放出,いわゆる,脱顆粒が生じ,アナフィラキシーやアトピー性皮膚炎などのアレルギー性疾患がひき起こされる.さらに,FcεRIの活性化は細胞内ホスホリパーゼA2のひとつであるcPLA2αの活性化をひき起こし,細胞膜からω6脂肪酸であるアラキドン酸を切り出す2).切り出されたアラキドン酸はシクロキシゲナーゼやリポキシゲナーゼなどの酵素により酸化されてプロスタグランジンD2やロイコトリエンC4などの脂肪酸メディエーターとなり,気道の収縮や粘液の分泌などの活性を発揮する.一方で,近年,ω3脂肪酸であるエイコサペンタエン酸やドコサヘキサエン酸も酸化されさまざまな生理活性脂質に変換されることが報告されている3).しかしながら,これまで,マスト細胞の産生する生理活性脂質としてはアラキドン酸に由来するごくかぎられたものしか研究されておらず,ω3脂肪酸とマスト細胞の機能との関係については未解明であった.
この研究においては,マスト細胞の産生するアラキドン酸,エイコサペンタエン酸,ドコサヘキサエン酸に由来する酸化脂肪酸を網羅的に解析し,脂肪酸メディエーターを介したマスト細胞の新規の制御機構の解明をめざした.
マウスに由来する骨髄由来培養マスト細胞を免疫グロブリンEにより感作させ,抗原により刺激した際に放出される酸化脂肪酸を網羅的に測定した.その結果,これまでの報告どおり2),野生型のマウスに由来する骨髄由来培養マスト細胞は刺激に依存的してアラキドン酸やエイコサペンタエン酸に由来するプロスタグランジンやロイコトリエンを産生した一方,ドコサヘキサエン酸に由来する脂肪酸メディエーターは検出されなかった.しかしながら,野生型のマウスに由来する骨髄由来培養マスト細胞を無刺激の状態において4日間にわたり培養し培養上清に存在する酸化脂肪酸を測定したところ,エイコサペンタエン酸やドコサヘキサエン酸に由来する酸化ω3脂肪酸を豊富に産生していた.一方,アラキドン酸に由来する脂肪酸メディエーターはほとんど検出されなかった.
これらの酸化ω3脂肪酸の産生酵素の同定を試みた.マウスの骨髄由来培養マスト細胞に高発現する細胞内ホスホリパーゼA2であるcPLA2α,iPLA2γ,PAF-AH2について,それぞれのノックアウトマウスに由来する骨髄由来培養マスト細胞を解析した結果,PAF-AH2ノックアウトに由来する骨髄由来培養マスト細胞でのみ酸化ω3脂肪酸の産生が減少していた.以上から,PAF-AH2がマスト細胞における恒常的な酸化ω3脂肪酸の産生酵素であることが示唆された.
PAF-AH2ノックアウトマウスを用いマスト細胞に発現するPAF-AH2の機能を個体のレベルで解析した.PAF-AH2ノックアウトマウスにおいては免疫グロブリンEに依存的な全身性および局所性のアナフィラキシーが抑制された.また,PAF-AH2ノックアウトマウスにおけるマスト細胞の数およびその成熟については正常であったが,アナフィラキシーの際に脱顆粒を起したマスト細胞の数が減少した.さらに,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞をマスト細胞を欠損するマウスに移植したところ,免疫グロブリンEに依存的なアナフィラキシーは抑制された.以上から,マスト細胞において発現するPAF-AH2は免疫グロブリンEに依存的な脱顆粒にかかわることが個体のレベルで示された.
PAF-AH2のマスト細胞における機能を細胞のレベルで解析した.PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞の形態およびその成熟に異常はなかったが,野生型のマウスに由来する骨髄由来培養マスト細胞に比べ,免疫グロブリンEに依存的な脱顆粒が減少していた.マスト細胞は抗原に曝露されるとLynやFynなどのSrcファミリーキナーゼが活性化し高親和性の免疫グロブリンE受容体であるFcεRIがリン酸化されて活性化する.そこで,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞において,免疫グロブリンEに依存的なLynおよびFynのキナーゼ活性,および,FcεRIのリン酸化を測定したところ,すべて野生型に比べ低下していた.以上から,PAF-AH2がマスト細胞における免疫グロブリンEに依存的なFcεRIの活性化に重要であることがわかった.
PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞の培養上清において,野生型のマウスに由来する骨髄由来培養マスト細胞と比べ酸化ω3脂肪酸が大きく減少していた.これらの酸化ω3脂肪酸をPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞に添加したところ,エポキシ化ω3脂肪酸を添加したときのみ,野生型のマウスに由来する骨髄由来培養マスト細胞と同じ程度まで免疫グロブリンEに依存的な活性化が回復した.さらにPAF-AH2ノックアウトマウスにエポキシ化ω3脂肪酸を投与したところ,野生型のマウスと同じ程度にまでアナフィラキシーが回復した.以上から,エポキシ化ω3脂肪酸はPAF-AH2に依存して産生され,マスト細胞の免疫グロブリンEに依存的な活性化を制御する脂質メディエーターであることが強く示唆された.
PAF-AH2はほかの細胞内ホスホリパーゼA2とは異なり,生体膜リン脂質に存在する長鎖脂肪酸は基質にできないが,酸化リン脂質は分解できるというユニークな活性をもつ4).そこで,マスト細胞にはエポキシ化ω3脂肪酸を含有するエポキシ化リン脂質が存在し,PAF-AH2の基質になっていると予想した.実際に,質量分析計を用いた解析により,マスト細胞の細胞膜からはエポキシ化ω3脂肪酸を含有するエポキシ化リン脂質が検出された.さらに,これらのエポキシ化リン脂質にPAF-AH2を添加したところ,その酵素活性に依存してエポキシ化ω3脂肪酸が産生された.一方,エイコサペンタエン酸あるいはドコサヘキサエン酸を含有するリン脂質は分解されなかった.以上から,マスト細胞の細胞膜にはエポキシ化リン脂質が存在し,そこからPAF-AH2がエポキシ化ω3脂肪酸を直接的に切り出すことが明らかにされた.
PAF-AH2の選択的な阻害剤であるAA39-2 5) を野生型のマスト細胞に投与したところ,免疫グロブリンEに依存的なFcεRIのリン酸化および脱顆粒が抑制された.さらに,AA39-2を野生型のマウスに投与すると,免疫グロブリンEに依存的な全身性および局所性のアナフィラキシーが抑制された.定量PCR法によりPAF-AH2はヒトのマスト細胞においても高く発現していることが確認されたため,ヒトの滑膜から採取したマスト細胞にAA39-2を投与したところ,免疫グロブリンEに依存的な脱顆粒が抑制され,そこにエポキシ化ω3脂肪酸を添加すると脱顆粒は回復した.以上から,PAF-AH2によるエポキシ化ω3脂肪酸を介したマスト細胞の活性化の制御機構はヒトにおいても保存されていることが明らかにされた.
エポキシ化ω3脂肪酸の作用点として脂肪酸をリガンドとする核内受容体に着目した.既存の合成リガンドやアンタゴニストをPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞に投与したところ,PPARγのアンタゴニストであるGW9662を投与した際に脱顆粒は回復した.また,GW9662をPAF-AH2ノックアウトマウスに投与するとアナフィラキシーが回復した.PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞にエポキシ化ω3脂肪酸あるいはGW9662を投与した際の遺伝子発現の変動を解析したところ,エポキシ化ω3脂肪酸の投与により約400の遺伝子の発現が低下し,その70%以上はGW9662の投与によっても発現が低下した.以上から,エポキシ化ω3脂肪酸はPPARγのもつ転写活性能を抑制することが強く示唆された.
高親和性の免疫グロブリンE受容体であるFcεRIの活性化にはSrcファミリーキナーゼによるリン酸化が重要である6).実際に,エポキシ化ω3脂肪酸あるいはGW9662の投与によりSrcファミリーキナーゼの活性を抑制する足場タンパク質であるSrcin1の発現が低下した.さらに,Srcin1は野生型のマウスに由来する骨髄由来培養マスト細胞に比べ,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞において発現が高かった.Srcin1はSrcファミリーキナーゼおよびチロシンキナーゼであるCskの両方と結合する7).SrcファミリーキナーゼはC末端側の領域がCskによりリン酸化されると不活性化されるが,Srcin1はSrcファミリーキナーゼおよびCskと結合することによりCskによるSrcファミリーキナーゼの効率的な不活性化を促進する.しかしながら,Srcin1のマスト細胞における報告はなく,SrcファミリーキナーゼのうちLynやFynなどの活性も抑制するかどうかは不明であった.
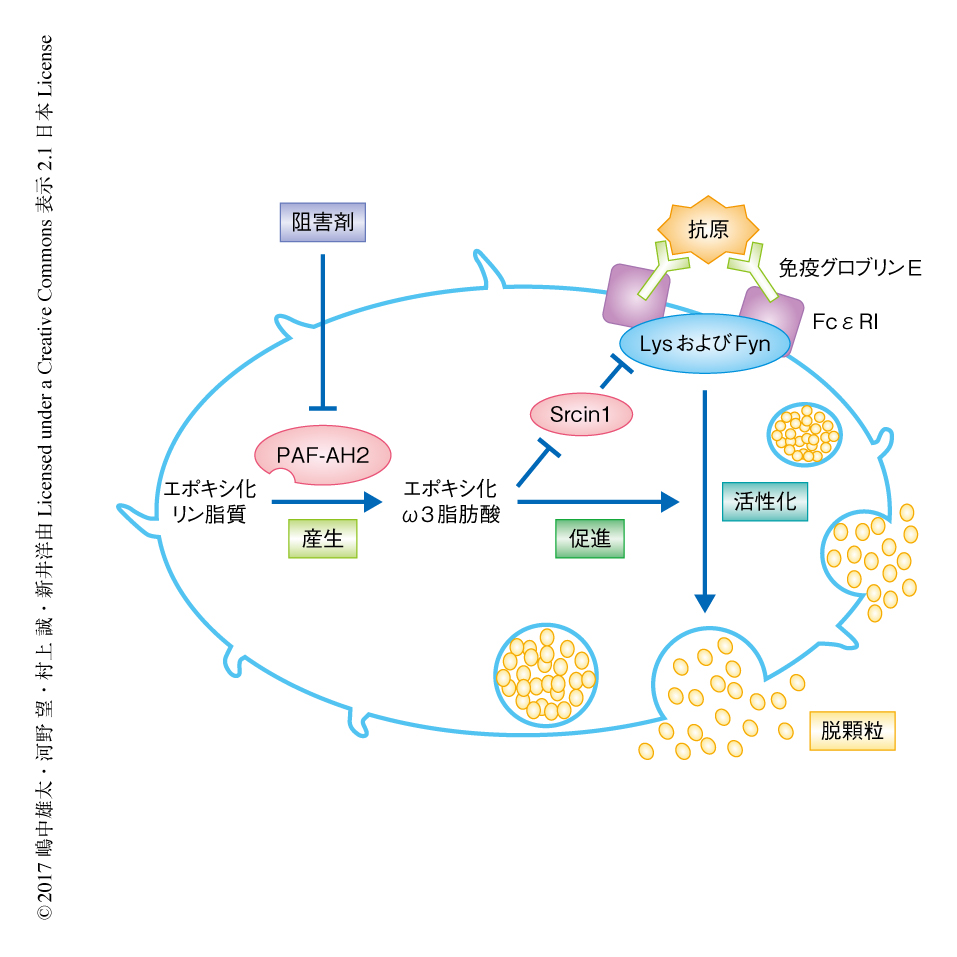
HEK293T細胞を用いた過剰発現系において,Srcin1はLynおよびFynと結合し,Cskに依存的にLynおよびFynのC末端の領域のリン酸化をひき起こした.さらに,本来はSrcin1の発現が低い野生型のマウスに由来する骨髄由来培養マスト細胞においてSrcin1を過剰に発現させたところ免疫グロブリンEに依存的なマスト細胞の活性化は抑制され,Srcin1の発現が高いPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞においてSrcin1をノックダウンしたところ免疫グロブリンEに依存的なマスト細胞の活性化は亢進した.以上から,Srcin1はLynおよびFynの活性を抑制することにより免疫グロブリンEに依存的なFcεRIの活性化を抑制し,エポキシ化ω3脂肪酸はSrcin1の発現を抑制することによりマスト細胞の活性化を促進することが明らかにされた(図1).
この研究において,マスト細胞はつねにエポキシ化ω3脂肪酸を産生しており,これらがSrcin1の発現を抑制することにより免疫グロブリンEに依存的な活性化を促進する,というまったく新しいマスト細胞の活性化の制御機構が見い出された.さらに,エポキシ化ω3脂肪酸はPAF-AH2が細胞膜に存在するエポキシ化リン脂質を分解することにより産生されることがつきとめられた.
近年,複数の研究グループから,エポキシ化ω3脂肪酸は降圧作用や腫瘍の増殖あるいは転移の抑制作用などさまざまな生理活性をもつことが報告されはじめたが8,9),この活性脂質の産生の機構や作用機序については不明であった.この研究により,マスト細胞の活性化の促進というエポキシ化ω3脂肪酸の新たな活性が明らかにされ,その産生酵素としてPAF-AH2が見い出された.そして,その作用機序として,PPARγの活性が抑制されている可能性が想定された.さらに,PAF-AH2の酵素活性が免疫グロブリンEに依存的なマスト細胞の活性化に重要であることが明らかにされた.今後,PAF-AH2の阻害を分子基盤にしたまったく新しい抗アレルギー薬の創生が期待される.
略歴:2016年 東京大学大学院薬学系研究科 修了,同年より同 助教.
研究テーマ:脂質メタボロミクスを用いた新規の生理活性脂質の探索.
抱負:生理活性脂質の産生の機構とその作用点という視点から医学および薬学に貢献したい.
河野 望(Nozomu Kono)
東京大学大学院薬学系研究科 講師.
村上 誠(Makoto Murakami)
東京大学大学院医学系研究科 教授.
研究室URL:http://lmmhs.m.u-tokyo.ac.jp/home_j.html
新井 洋由(Hiroyuki Arai)
東京大学大学院薬学系研究科 教授.
研究室URL:https://sites.google.com/site/eiseikagaku/
© 2017 嶋中雄太・河野 望・村上 誠・新井洋由 Licensed under CC 表示 2.1 日本
(1東京大学大学院薬学系研究科 衛生化学教室,2東京大学大学院医学系研究科 疾患生命工学センター健康環境医工学部門)
email:嶋中雄太,新井洋由
DOI: 10.7875/first.author.2017.119
Omega-3 fatty acid epoxides are autocrine mediators that control the magnitude of IgE-mediated mast cell activation.
Yuta Shimanaka, Nozomu Kono, Yoshitaka Taketomi, Makoto Arita, Yoshimichi Okayama, Yuki Tanaka, Yasumasa Nishito, Tatsuki Mochizuki, Hiroyuki Kusuhara, Alexander Adibekian, Benjamin F. Cravatt, Makoto Murakami, Hiroyuki Arai
Nature Medicine, 23, 1287-1297 (2017)
要 約
マスト細胞はアレルギーにおいて中心的な役割を担う免疫細胞である.マスト細胞の機能においてはマスト細胞による脂質メディエーターの産生が必須であるが,その重要性が解析されているのはω6脂肪酸であるアラキドン酸に由来するエイコサノイドのみであった.筆者らは,網羅的なリピドミクス解析によりマスト細胞がω3脂肪酸に由来するエポキシ化ω3脂肪酸を豊富に産生することを発見し,酸化リン脂質に選択的な細胞内ホスホリパーゼA2であるPAF-AH2がエポキシ化ω3脂肪酸の産生酵素であることをつきとめた.また,PAF-AH2の欠損あるいはPAF-AH2の阻害剤の投与によりマスト細胞におけるエポキシ化ω3脂肪酸の産生は減少し,免疫グロブリンEに依存的なマスト細胞の活性化やアナフィラキシーは抑制された.さらに,エポキシ化ω3脂肪酸はSrcファミリーキナーゼの活性を抑制する足場タンパク質であるSrcin1の発現を低下させることにより免疫グロブリンEに依存的なマスト細胞の活性化を促進することが明らかにされ,このSrcin1の発現の制御には核内受容体であるPPARγが関与することが示唆された.この研究において見い出されたPAF-AH2-エポキシ化ω3脂肪酸-Srcin1経路はアレルギー性疾患に対する創薬における新規の標的として期待される.
はじめに
近年,先進国においてアレルギー性疾患の患者数は急増しており大きな社会問題となっている1).その原因として,食生活の変化や排気ガスによる影響が提唱されているが,詳細は明らかではない.アレルギー性疾患の患者においては,マスト細胞の過度な活性化や血中における免疫グロブリンEの濃度の増加がみられる.したがって,マスト細胞の活性化の制御機構の詳細な解明がアレルギー性疾患の治療において急務とされている.
マスト細胞は皮膚などの結合組織や腸などの粘膜組織に常在する免疫細胞である.抗原に特異的な免疫グロブリンEがマスト細胞の表面に存在する高親和性の免疫グロブリンE受容体であるFcεRIと結合し,さらに抗原に曝露されるとFcεRIは架橋されて下流にシグナルが伝達され,顆粒小胞に蓄えられたヒスタミンなどの化学伝達物質の放出,いわゆる,脱顆粒が生じ,アナフィラキシーやアトピー性皮膚炎などのアレルギー性疾患がひき起こされる.さらに,FcεRIの活性化は細胞内ホスホリパーゼA2のひとつであるcPLA2αの活性化をひき起こし,細胞膜からω6脂肪酸であるアラキドン酸を切り出す2).切り出されたアラキドン酸はシクロキシゲナーゼやリポキシゲナーゼなどの酵素により酸化されてプロスタグランジンD2やロイコトリエンC4などの脂肪酸メディエーターとなり,気道の収縮や粘液の分泌などの活性を発揮する.一方で,近年,ω3脂肪酸であるエイコサペンタエン酸やドコサヘキサエン酸も酸化されさまざまな生理活性脂質に変換されることが報告されている3).しかしながら,これまで,マスト細胞の産生する生理活性脂質としてはアラキドン酸に由来するごくかぎられたものしか研究されておらず,ω3脂肪酸とマスト細胞の機能との関係については未解明であった.
この研究においては,マスト細胞の産生するアラキドン酸,エイコサペンタエン酸,ドコサヘキサエン酸に由来する酸化脂肪酸を網羅的に解析し,脂肪酸メディエーターを介したマスト細胞の新規の制御機構の解明をめざした.
1.PAF-AH2は無刺激の状態のマスト細胞において酸化ω3脂肪酸の産生を担う
マウスに由来する骨髄由来培養マスト細胞を免疫グロブリンEにより感作させ,抗原により刺激した際に放出される酸化脂肪酸を網羅的に測定した.その結果,これまでの報告どおり2),野生型のマウスに由来する骨髄由来培養マスト細胞は刺激に依存的してアラキドン酸やエイコサペンタエン酸に由来するプロスタグランジンやロイコトリエンを産生した一方,ドコサヘキサエン酸に由来する脂肪酸メディエーターは検出されなかった.しかしながら,野生型のマウスに由来する骨髄由来培養マスト細胞を無刺激の状態において4日間にわたり培養し培養上清に存在する酸化脂肪酸を測定したところ,エイコサペンタエン酸やドコサヘキサエン酸に由来する酸化ω3脂肪酸を豊富に産生していた.一方,アラキドン酸に由来する脂肪酸メディエーターはほとんど検出されなかった.
これらの酸化ω3脂肪酸の産生酵素の同定を試みた.マウスの骨髄由来培養マスト細胞に高発現する細胞内ホスホリパーゼA2であるcPLA2α,iPLA2γ,PAF-AH2について,それぞれのノックアウトマウスに由来する骨髄由来培養マスト細胞を解析した結果,PAF-AH2ノックアウトに由来する骨髄由来培養マスト細胞でのみ酸化ω3脂肪酸の産生が減少していた.以上から,PAF-AH2がマスト細胞における恒常的な酸化ω3脂肪酸の産生酵素であることが示唆された.
2.PAF-AH2ノックアウトマウスにおいては免疫グロブリンEに依存的なアナフィラキシーは抑制される
PAF-AH2ノックアウトマウスを用いマスト細胞に発現するPAF-AH2の機能を個体のレベルで解析した.PAF-AH2ノックアウトマウスにおいては免疫グロブリンEに依存的な全身性および局所性のアナフィラキシーが抑制された.また,PAF-AH2ノックアウトマウスにおけるマスト細胞の数およびその成熟については正常であったが,アナフィラキシーの際に脱顆粒を起したマスト細胞の数が減少した.さらに,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞をマスト細胞を欠損するマウスに移植したところ,免疫グロブリンEに依存的なアナフィラキシーは抑制された.以上から,マスト細胞において発現するPAF-AH2は免疫グロブリンEに依存的な脱顆粒にかかわることが個体のレベルで示された.
3.PAF-AH2ノックアウトマウスのマスト細胞において免疫グロブリンEに依存的なFcεRIの活性化は抑制される
PAF-AH2のマスト細胞における機能を細胞のレベルで解析した.PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞の形態およびその成熟に異常はなかったが,野生型のマウスに由来する骨髄由来培養マスト細胞に比べ,免疫グロブリンEに依存的な脱顆粒が減少していた.マスト細胞は抗原に曝露されるとLynやFynなどのSrcファミリーキナーゼが活性化し高親和性の免疫グロブリンE受容体であるFcεRIがリン酸化されて活性化する.そこで,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞において,免疫グロブリンEに依存的なLynおよびFynのキナーゼ活性,および,FcεRIのリン酸化を測定したところ,すべて野生型に比べ低下していた.以上から,PAF-AH2がマスト細胞における免疫グロブリンEに依存的なFcεRIの活性化に重要であることがわかった.
4.エポキシ化ω3脂肪酸の投与によりPAF-AH2を欠損したマスト細胞の免疫グロブリンEに依存的な活性化は回復する
PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞の培養上清において,野生型のマウスに由来する骨髄由来培養マスト細胞と比べ酸化ω3脂肪酸が大きく減少していた.これらの酸化ω3脂肪酸をPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞に添加したところ,エポキシ化ω3脂肪酸を添加したときのみ,野生型のマウスに由来する骨髄由来培養マスト細胞と同じ程度まで免疫グロブリンEに依存的な活性化が回復した.さらにPAF-AH2ノックアウトマウスにエポキシ化ω3脂肪酸を投与したところ,野生型のマウスと同じ程度にまでアナフィラキシーが回復した.以上から,エポキシ化ω3脂肪酸はPAF-AH2に依存して産生され,マスト細胞の免疫グロブリンEに依存的な活性化を制御する脂質メディエーターであることが強く示唆された.
5.PAF-AH2はマスト細胞の細胞膜からエポキシ化ω3脂肪酸を直接的に切り出す
PAF-AH2はほかの細胞内ホスホリパーゼA2とは異なり,生体膜リン脂質に存在する長鎖脂肪酸は基質にできないが,酸化リン脂質は分解できるというユニークな活性をもつ4).そこで,マスト細胞にはエポキシ化ω3脂肪酸を含有するエポキシ化リン脂質が存在し,PAF-AH2の基質になっていると予想した.実際に,質量分析計を用いた解析により,マスト細胞の細胞膜からはエポキシ化ω3脂肪酸を含有するエポキシ化リン脂質が検出された.さらに,これらのエポキシ化リン脂質にPAF-AH2を添加したところ,その酵素活性に依存してエポキシ化ω3脂肪酸が産生された.一方,エイコサペンタエン酸あるいはドコサヘキサエン酸を含有するリン脂質は分解されなかった.以上から,マスト細胞の細胞膜にはエポキシ化リン脂質が存在し,そこからPAF-AH2がエポキシ化ω3脂肪酸を直接的に切り出すことが明らかにされた.
6.PAF-AH2の阻害剤は免疫グロブリンEに依存的なマスト細胞の活性化を阻害する
PAF-AH2の選択的な阻害剤であるAA39-2 5) を野生型のマスト細胞に投与したところ,免疫グロブリンEに依存的なFcεRIのリン酸化および脱顆粒が抑制された.さらに,AA39-2を野生型のマウスに投与すると,免疫グロブリンEに依存的な全身性および局所性のアナフィラキシーが抑制された.定量PCR法によりPAF-AH2はヒトのマスト細胞においても高く発現していることが確認されたため,ヒトの滑膜から採取したマスト細胞にAA39-2を投与したところ,免疫グロブリンEに依存的な脱顆粒が抑制され,そこにエポキシ化ω3脂肪酸を添加すると脱顆粒は回復した.以上から,PAF-AH2によるエポキシ化ω3脂肪酸を介したマスト細胞の活性化の制御機構はヒトにおいても保存されていることが明らかにされた.
7.エポキシ化ω3脂肪酸はPPARγの関与する遺伝子発現の機構を介してマスト細胞の活性化を制御する
エポキシ化ω3脂肪酸の作用点として脂肪酸をリガンドとする核内受容体に着目した.既存の合成リガンドやアンタゴニストをPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞に投与したところ,PPARγのアンタゴニストであるGW9662を投与した際に脱顆粒は回復した.また,GW9662をPAF-AH2ノックアウトマウスに投与するとアナフィラキシーが回復した.PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞にエポキシ化ω3脂肪酸あるいはGW9662を投与した際の遺伝子発現の変動を解析したところ,エポキシ化ω3脂肪酸の投与により約400の遺伝子の発現が低下し,その70%以上はGW9662の投与によっても発現が低下した.以上から,エポキシ化ω3脂肪酸はPPARγのもつ転写活性能を抑制することが強く示唆された.
8.エポキシ化ω3脂肪酸はSrcin1の発現を抑制することによりマスト細胞の活性化を制御する
高親和性の免疫グロブリンE受容体であるFcεRIの活性化にはSrcファミリーキナーゼによるリン酸化が重要である6).実際に,エポキシ化ω3脂肪酸あるいはGW9662の投与によりSrcファミリーキナーゼの活性を抑制する足場タンパク質であるSrcin1の発現が低下した.さらに,Srcin1は野生型のマウスに由来する骨髄由来培養マスト細胞に比べ,PAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞において発現が高かった.Srcin1はSrcファミリーキナーゼおよびチロシンキナーゼであるCskの両方と結合する7).SrcファミリーキナーゼはC末端側の領域がCskによりリン酸化されると不活性化されるが,Srcin1はSrcファミリーキナーゼおよびCskと結合することによりCskによるSrcファミリーキナーゼの効率的な不活性化を促進する.しかしながら,Srcin1のマスト細胞における報告はなく,SrcファミリーキナーゼのうちLynやFynなどの活性も抑制するかどうかは不明であった.
HEK293T細胞を用いた過剰発現系において,Srcin1はLynおよびFynと結合し,Cskに依存的にLynおよびFynのC末端の領域のリン酸化をひき起こした.さらに,本来はSrcin1の発現が低い野生型のマウスに由来する骨髄由来培養マスト細胞においてSrcin1を過剰に発現させたところ免疫グロブリンEに依存的なマスト細胞の活性化は抑制され,Srcin1の発現が高いPAF-AH2ノックアウトマウスに由来する骨髄由来培養マスト細胞においてSrcin1をノックダウンしたところ免疫グロブリンEに依存的なマスト細胞の活性化は亢進した.以上から,Srcin1はLynおよびFynの活性を抑制することにより免疫グロブリンEに依存的なFcεRIの活性化を抑制し,エポキシ化ω3脂肪酸はSrcin1の発現を抑制することによりマスト細胞の活性化を促進することが明らかにされた(図1).
図1 エポキシ化ω3脂肪酸によるマスト細胞の活性化の制御機構
[Download]
[Download]
おわりに
この研究において,マスト細胞はつねにエポキシ化ω3脂肪酸を産生しており,これらがSrcin1の発現を抑制することにより免疫グロブリンEに依存的な活性化を促進する,というまったく新しいマスト細胞の活性化の制御機構が見い出された.さらに,エポキシ化ω3脂肪酸はPAF-AH2が細胞膜に存在するエポキシ化リン脂質を分解することにより産生されることがつきとめられた.
近年,複数の研究グループから,エポキシ化ω3脂肪酸は降圧作用や腫瘍の増殖あるいは転移の抑制作用などさまざまな生理活性をもつことが報告されはじめたが8,9),この活性脂質の産生の機構や作用機序については不明であった.この研究により,マスト細胞の活性化の促進というエポキシ化ω3脂肪酸の新たな活性が明らかにされ,その産生酵素としてPAF-AH2が見い出された.そして,その作用機序として,PPARγの活性が抑制されている可能性が想定された.さらに,PAF-AH2の酵素活性が免疫グロブリンEに依存的なマスト細胞の活性化に重要であることが明らかにされた.今後,PAF-AH2の阻害を分子基盤にしたまったく新しい抗アレルギー薬の創生が期待される.
文 献
- Devereux, G.: The increase in the prevalence of asthma and allergy: food for thought. Nat. Rev. Immunol., 6, 869-874 (2006)[PubMed]
- Fujishima, H., Sanchez Mejia, R. O., Bingham, C. O. 3rd, et al.: Cytosolic phospholipase A2 is essential for both the immediate and the delayed phases of eicosanoid generation in mouse bone marrow-derived mast cells. Proc. Natl. Acad. Sci. USA, 96, 4803-4807 (1999)[PubMed]
- Serhan, C. N.: Pro-resolving lipid mediators are leads for resolution physiology. Nature, 510, 92-101 (2014)[PubMed]
- Stafforini, D. M., Sheller, J. R., Blackwell, T. S. et al.: Release of free F2-isoprostanes from esterified phospholipids is catalyzed by intracellular and plasma platelet-activating factor acetylhydrolases. J. Biol. Chem., 281, 4616-4623 (2006)[PubMed]
- Adibekian, A., Martin, B. R., Wang, C. et al.: Click-generated triazole ureas as ultrapotent in vivo-active serine hydrolase inhibitors. Nat. Chem. Biol., 7, 469-478 (2011)[PubMed]
- Kalesnikoff, J. & Galli, S. J.: New developments in mast cell biology. Nat. Immunol., 9, 1215-1223 (2008)[PubMed]
- Di Stefano, P., Damiano, L., Cabodi, S. et al.: p140Cap protein suppresses tumour cell properties, regulating Csk and Src kinase activity. EMBO J., 26, 2843-2855 (2007)[PubMed]
- Hercule, H. C., Salanova, B., Essin, K. et al.: The vasodilator 17,18-epoxyeicosatetraenoic acid targets the pore-forming BK α channel subunit in rodents. Exp. Physiol., 92, 1067-1076 (2007)[PubMed]
- Zhang, G., Panigrahy, D., Mahakian, L. M. et al.: Epoxy metabolites of docosahexaenoic acid (DHA) inhibit angiogenesis, tumor growth, and metastasis. Proc. Natl. Acad. Sci. USA, 110, 6530-6535 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 東京大学大学院薬学系研究科 修了,同年より同 助教.
研究テーマ:脂質メタボロミクスを用いた新規の生理活性脂質の探索.
抱負:生理活性脂質の産生の機構とその作用点という視点から医学および薬学に貢献したい.
河野 望(Nozomu Kono)
東京大学大学院薬学系研究科 講師.
村上 誠(Makoto Murakami)
東京大学大学院医学系研究科 教授.
研究室URL:http://lmmhs.m.u-tokyo.ac.jp/home_j.html
新井 洋由(Hiroyuki Arai)
東京大学大学院薬学系研究科 教授.
研究室URL:https://sites.google.com/site/eiseikagaku/
© 2017 嶋中雄太・河野 望・村上 誠・新井洋由 Licensed under CC 表示 2.1 日本