核膜孔複合体の構成タンパク質Nup153と転写因子Sox2による遺伝子発現および神経前駆細胞の維持の制御
戸田智久・Fred H. Gage
(米国Salk Institute for Biological Studies,Laboratory of Genetics)
email:戸田智久
DOI: 10.7875/first.author.2017.116
Nup153 interacts with Sox2 to enable bimodal gene regulation and maintenance of neural progenitor cells.
Tomohisa Toda, Jonathan Y. Hsu, Sara B. Linker, Lauren Hu, Simon T. Schafer, Jerome Mertens, Filipe V. Jacinto, Martin W. Hetzer, Fred H. Gage
Cell Stem Cell, 21, 618-634.e7 (2017)
脳は数千種類の細胞から構成されるもっとも複雑な臓器であり,その多様な細胞種の発生,発達,維持の過程を解明することは脳を理解するうえで重要である.脳を構成する細胞は発生の過程,および,成体においては脳の特定の領域にて神経前駆細胞より産生される.これまでの研究により,神経前駆細胞の維持および特定の細胞種への分化において特定の転写因子が重要な役割をはたすことが明らかにされてきた.しかしながら,転写因子により規定された細胞の運命がいかに安定に維持されるのか,その遺伝子発現の制御の構造的な基盤については不明な点が多い.この研究においては,遺伝子発現の制御をつかさどるオルガネラである核において構造的な基盤となる核膜孔複合体に着目し,その構成タンパク質のひとつであるNup153が神経前駆細胞の維持に必須であり,神経前駆細胞のキー転写因子であるSox2と協同して遺伝子発現を制御することを見い出した.すなわち,核膜孔複合体は核において細胞種に特異的な構造的な基盤を形成し,転写因子と協同して細胞種に特異的な遺伝子発現を維持する可能性が示唆された.
脳を構成するニューロン,アストロサイト,オリゴデンドロサイトなどの細胞は神経前駆細胞より産生される.神経前駆細胞の増殖および分化の制御は脳の正常な発達のため不可欠であり,これまで,転写による制御およびエピジェネティックな制御が明らかにされてきた1).神経前駆細胞の維持にはキー転写因子とよばれる転写因子が重要であり,とくに,Sox2はほかのさまざまな転写因子およびエピジェネティックな制御にかかわるタンパク質と複合体を形成し,神経前駆細胞に特異的な転写プログラムの制御において中心的な役割をはたす2,3).細胞の分化にともないこれらのキー転写因子の発現が変化することにより転写プログラムは再編成され,特定の細胞へと分化する.筆者らは,神経前駆細胞の分化の過程において,細胞種に特異的な転写プログラムの再編成と並行して核の構造が再構成されることを見い出した.核の構造は細胞種ごとに異なり,細胞系譜に特異的な遺伝子座やヘテロクロマチンあるいはユークロマチンの核における空間的な配置が再構成されることも知られている4).神経前駆細胞からの分化の過程においても,核の構造は劇的に変化し,さらに,分化した細胞種により核の構造は異なるのである.しかしながら,どのような分子機構により,この核の構造の変化が転写プログラムの再編成と協同して細胞種に特異的な遺伝子発現を制御するのか,不明な部分が多かった.この研究においては,神経前駆細胞をモデルとし,細胞種に特異的な核の構造の分子的な基盤および転写プログラムとの協同の機構に着目した.
核の構造は核膜孔複合体や核膜ラミンなどの核内構造タンパク質により制御され,発現する核内構造タンパク質は細胞種により異なる5,6).そこで,筆者らの研究室において実施されたマウスの神経前駆細胞における遺伝子発現のスクリーニングのデータベースを用いて,神経前駆細胞に選択的に発現する核内構造タンパク質を探索した結果,核膜孔複合体の構成タンパク質のひとつであるNup153が見い出された.Nup153は約30種類のタンパク質から構成される核膜孔複合体において核質の側のバスケット様の構造を構成するタンパク質であり,ジンクフィンガードメインをもち,出芽酵母やショウジョウバエを用いた研究からゲノムDNAと直接的に結合して,転写を制御することが知られている7).このことから,Nup153が哺乳類の神経前駆細胞においては細胞系譜に特異的な遺伝子と直接的に結合し,転写の制御を介して神経前駆細胞の維持および分化を制御するのではないかと考えた.Nup153の発現量は細胞種により異なり,神経前駆細胞においてもっとも高く,ニューロンに分化すると約50%に低下し,アストロサイトに分化した際にはさらに低下した.核膜孔の数や核膜孔を形成するNup107の発現量は神経前駆細胞からニューロンあるいはアストロサイトへの分化にともない大きくは変化しなかったことから,Nup153の発現量は細胞種ごとに厳密に制御されることが示唆された.shRNAを用いてNup153をノックダウンし3日後に定量PCR法および分化マーカーを用いた細胞抗体染色法により解析したところ,神経前駆細胞が維持される培養条件においてもいちじるしく分化が誘導された.さらに,細胞周期マーカーの発現,および,DNA量をもとにした蛍光セルソーターを用いた細胞周期の測定により,Nup153の発現量の低下により増殖能も低下することが明らかにされた.すなわち,神経前駆細胞の維持にはNup153の高い発現が必須であることが示唆された.
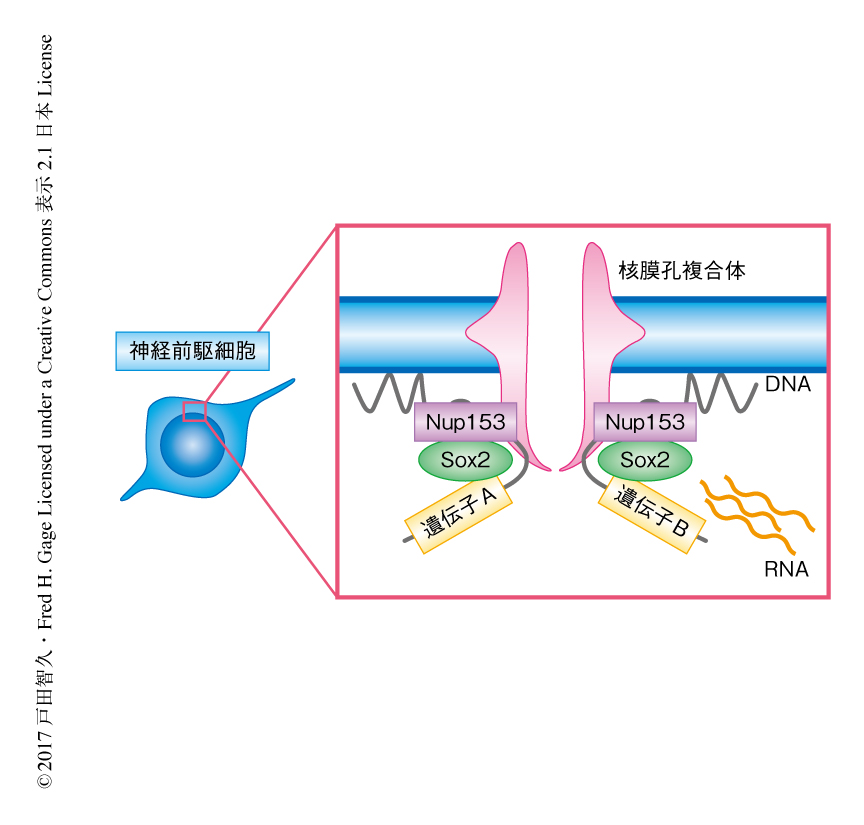
Nup153が神経前駆細胞の維持に必須であったことから,Nup153が神経前駆細胞のキー転写因子と協同して神経前駆細胞に特異的な転写プログラムを制御する可能性を考えた.構造化照明法を用いた超解像顕微鏡(structured illumination microscopy:SIM)を用いてNup153と相互作用する転写因子を探索したところ,Sox2が神経前駆細胞においてNup153と選択的に相互作用する可能性が見い出された.Nup153とSox2との相互作用は近接ライゲーションアッセイ(proximity ligation assay),2分子蛍光補完(biomolecular fluorescence complementation,BiFC)法,共免疫沈降法により確認されたことから,Nup153とSox2は神経前駆細胞において複合体を形成することが示唆された(図1).
Nup153はSox2と複合体を形成し,かつ,神経前駆細胞の維持に必須であったことから,Nup153はSox2と協同して神経前駆細胞の転写プログラムを直接的に制御する可能性が示唆された.そこで,Nup153に対するChIP-seq法により,神経前駆細胞のゲノムDNAにおいてNup153の結合する領域を同定した.遺伝子オントロジー解析により,Nup153は神経の分化および転写の制御にかかわる遺伝子と結合することが明らかにされ,Nup153により神経前駆細胞の分化および増殖が制御されるという仮説が支持された.また,Nup153と結合した遺伝子座の約8割にはSox2も結合しており,Nup153はSox2と協同して遺伝子発現を制御するという仮説が支持された.Nup153により発現が制御される遺伝子を同定するため,shRNAを用いて神経前駆細胞においてNup153をノックダウンし,RNA-seq法によりトランスクリプトームの変化を網羅的に解析した.その結果,Nup153のノックダウンにより発現の変化した3286の遺伝子のうち,825の遺伝子はSox2によっても発現の制御をうけており,これらの遺伝子はNup153およびSox2の両方により発現が制御されることが示唆された.ChIP-seq法のデータとRNA-seq法のデータを組み合わせることにより,Nup153およびSox2により直接的に発現の制御される509の遺伝子が同定された.また,Nup153のノックダウンにより,Sox2の発現量に変化はなかったにもかかわらず,Sox2のゲノムDNAへの結合はいちじるしく阻害された.すなわち,Nup153はSox2のゲノムDNAへの結合,あるいは,その維持に必須の役割をはたすことが示唆された.
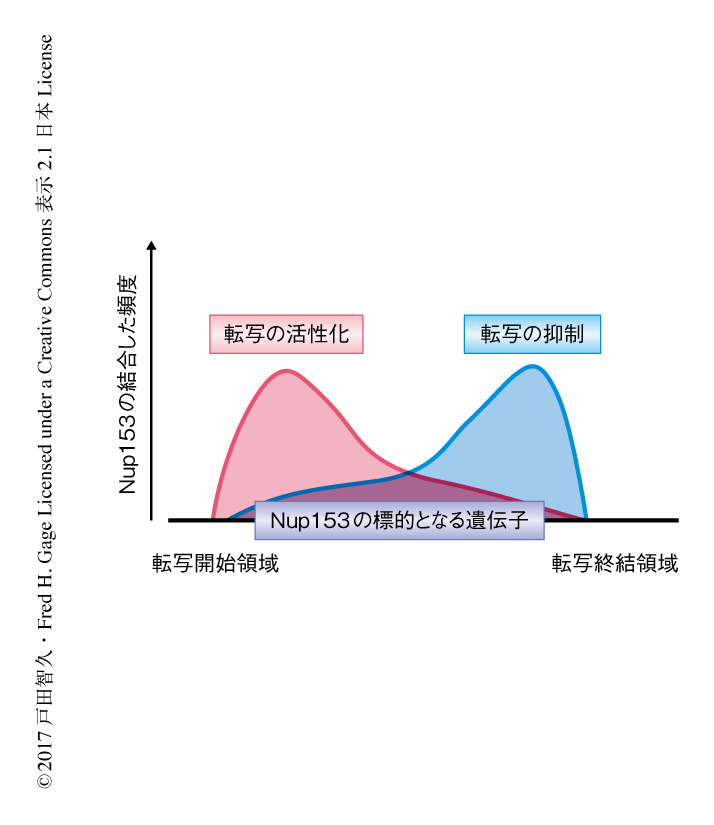
Nup153による遺伝子発現の制御をより詳細に解析するため,遺伝子コード領域を中心にNup153の結合した頻度をプロットしたところ,Nup153は転写開始領域にあるプロモーター領域の近傍に高頻度で結合しており,プロモーター領域への結合を介して遺伝子発現を制御することが示唆された.さらに,Nup153の結合は転写終結領域にも集積していた.これまでの研究において,転写因子の多くはプロモーター領域あるいはエンハンサー領域と結合して転写を制御するとされていたが,転写終結領域へのNup153の結合から核膜孔複合体の構成タンパク質に特異的な遺伝子発現の制御の機能が示唆された.RNA-seq法のデータと組み合わせることにより,Nup153がプロモーター領域と結合した際には標的となる遺伝子の発現を活性化し,一方で,Nup153が転写終結領域と結合した際には標的となる遺伝子の発現を抑制することが示唆された(図2).さらに,Nup153がプロモーター領域および転写終結領域の両方と結合した際には標的となる遺伝子の約8割において発現が抑制されていたことから,Nup153の転写終結領域への結合を介した遺伝子発現の抑制が機能的に優位であることが示唆された.
核膜孔複合体は真核生物においてきわめて大きいタンパク質複合体であり,進化的に非常に保存された構造をもつ.これまで,核輸送における役割が重点的に解析されてきたが,遺伝子発現の制御における役割についての研究ははじまったばかりである.核膜孔複合体はクロマチンと直接的あるいは間接的に結合することにくわえ,この研究において,キー転写因子と協同して遺伝子発現を制御することが示唆され,細胞種に特異的な遺伝子発現の制御において構造的な基盤としてはたらく可能性が示唆された.脳を構成する細胞の多くは,発生期に産生されたのち,ほとんど入れ替わることなく生涯にわたり細胞の個性および機能を保持しなければならないが,核膜孔複合体を含めた核内構造タンパク質は半減期が非常に長いことから8),細胞種に特異的な遺伝子発現の制御において長期にわたる維持を保証する機構としてはたらくのかもしれない.一方で,これらの核内構造タンパク質は老化および老化にともなう神経変性疾患によりいちじるしく損傷をうけることから9,10),今後,核内構造タンパク質の老化にともなう機能の低下を起因とした細胞の個性の維持,あるいは,神経機能の病態生理の解析が期待される.
略歴:2011年 東京大学大学院医学系研究科 修了,同年 東京大学医学部附属病院 特任研究員を経て,2014年より米国Salk Institute for Biological Studiesリサーチアソシエイト.
研究テーマ:核の構造の視点からみた神経の発生,発達,老化およびその進化的な変遷.
関心事:息子と自分の英語の発音の差と,言語学習能力の臨界期.
Fred H. Gage
米国Salk Institute for Biological StudiesにてAdler Professor.
研究室URL:http://logg.salk.edu/
© 2017 戸田智久・Fred H. Gage Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Laboratory of Genetics)
email:戸田智久
DOI: 10.7875/first.author.2017.116
Nup153 interacts with Sox2 to enable bimodal gene regulation and maintenance of neural progenitor cells.
Tomohisa Toda, Jonathan Y. Hsu, Sara B. Linker, Lauren Hu, Simon T. Schafer, Jerome Mertens, Filipe V. Jacinto, Martin W. Hetzer, Fred H. Gage
Cell Stem Cell, 21, 618-634.e7 (2017)
要 約
脳は数千種類の細胞から構成されるもっとも複雑な臓器であり,その多様な細胞種の発生,発達,維持の過程を解明することは脳を理解するうえで重要である.脳を構成する細胞は発生の過程,および,成体においては脳の特定の領域にて神経前駆細胞より産生される.これまでの研究により,神経前駆細胞の維持および特定の細胞種への分化において特定の転写因子が重要な役割をはたすことが明らかにされてきた.しかしながら,転写因子により規定された細胞の運命がいかに安定に維持されるのか,その遺伝子発現の制御の構造的な基盤については不明な点が多い.この研究においては,遺伝子発現の制御をつかさどるオルガネラである核において構造的な基盤となる核膜孔複合体に着目し,その構成タンパク質のひとつであるNup153が神経前駆細胞の維持に必須であり,神経前駆細胞のキー転写因子であるSox2と協同して遺伝子発現を制御することを見い出した.すなわち,核膜孔複合体は核において細胞種に特異的な構造的な基盤を形成し,転写因子と協同して細胞種に特異的な遺伝子発現を維持する可能性が示唆された.
はじめに
脳を構成するニューロン,アストロサイト,オリゴデンドロサイトなどの細胞は神経前駆細胞より産生される.神経前駆細胞の増殖および分化の制御は脳の正常な発達のため不可欠であり,これまで,転写による制御およびエピジェネティックな制御が明らかにされてきた1).神経前駆細胞の維持にはキー転写因子とよばれる転写因子が重要であり,とくに,Sox2はほかのさまざまな転写因子およびエピジェネティックな制御にかかわるタンパク質と複合体を形成し,神経前駆細胞に特異的な転写プログラムの制御において中心的な役割をはたす2,3).細胞の分化にともないこれらのキー転写因子の発現が変化することにより転写プログラムは再編成され,特定の細胞へと分化する.筆者らは,神経前駆細胞の分化の過程において,細胞種に特異的な転写プログラムの再編成と並行して核の構造が再構成されることを見い出した.核の構造は細胞種ごとに異なり,細胞系譜に特異的な遺伝子座やヘテロクロマチンあるいはユークロマチンの核における空間的な配置が再構成されることも知られている4).神経前駆細胞からの分化の過程においても,核の構造は劇的に変化し,さらに,分化した細胞種により核の構造は異なるのである.しかしながら,どのような分子機構により,この核の構造の変化が転写プログラムの再編成と協同して細胞種に特異的な遺伝子発現を制御するのか,不明な部分が多かった.この研究においては,神経前駆細胞をモデルとし,細胞種に特異的な核の構造の分子的な基盤および転写プログラムとの協同の機構に着目した.
1.核膜孔複合体の構成タンパク質Nup153は神経前駆細胞の維持に必須である
核の構造は核膜孔複合体や核膜ラミンなどの核内構造タンパク質により制御され,発現する核内構造タンパク質は細胞種により異なる5,6).そこで,筆者らの研究室において実施されたマウスの神経前駆細胞における遺伝子発現のスクリーニングのデータベースを用いて,神経前駆細胞に選択的に発現する核内構造タンパク質を探索した結果,核膜孔複合体の構成タンパク質のひとつであるNup153が見い出された.Nup153は約30種類のタンパク質から構成される核膜孔複合体において核質の側のバスケット様の構造を構成するタンパク質であり,ジンクフィンガードメインをもち,出芽酵母やショウジョウバエを用いた研究からゲノムDNAと直接的に結合して,転写を制御することが知られている7).このことから,Nup153が哺乳類の神経前駆細胞においては細胞系譜に特異的な遺伝子と直接的に結合し,転写の制御を介して神経前駆細胞の維持および分化を制御するのではないかと考えた.Nup153の発現量は細胞種により異なり,神経前駆細胞においてもっとも高く,ニューロンに分化すると約50%に低下し,アストロサイトに分化した際にはさらに低下した.核膜孔の数や核膜孔を形成するNup107の発現量は神経前駆細胞からニューロンあるいはアストロサイトへの分化にともない大きくは変化しなかったことから,Nup153の発現量は細胞種ごとに厳密に制御されることが示唆された.shRNAを用いてNup153をノックダウンし3日後に定量PCR法および分化マーカーを用いた細胞抗体染色法により解析したところ,神経前駆細胞が維持される培養条件においてもいちじるしく分化が誘導された.さらに,細胞周期マーカーの発現,および,DNA量をもとにした蛍光セルソーターを用いた細胞周期の測定により,Nup153の発現量の低下により増殖能も低下することが明らかにされた.すなわち,神経前駆細胞の維持にはNup153の高い発現が必須であることが示唆された.
2.核膜孔複合体の構成タンパク質Nup153は転写因子Sox2と相互作用する
Nup153が神経前駆細胞の維持に必須であったことから,Nup153が神経前駆細胞のキー転写因子と協同して神経前駆細胞に特異的な転写プログラムを制御する可能性を考えた.構造化照明法を用いた超解像顕微鏡(structured illumination microscopy:SIM)を用いてNup153と相互作用する転写因子を探索したところ,Sox2が神経前駆細胞においてNup153と選択的に相互作用する可能性が見い出された.Nup153とSox2との相互作用は近接ライゲーションアッセイ(proximity ligation assay),2分子蛍光補完(biomolecular fluorescence complementation,BiFC)法,共免疫沈降法により確認されたことから,Nup153とSox2は神経前駆細胞において複合体を形成することが示唆された(図1).
3.Nup153はSox2と協同して神経前駆細胞の転写プログラムを制御する
Nup153はSox2と複合体を形成し,かつ,神経前駆細胞の維持に必須であったことから,Nup153はSox2と協同して神経前駆細胞の転写プログラムを直接的に制御する可能性が示唆された.そこで,Nup153に対するChIP-seq法により,神経前駆細胞のゲノムDNAにおいてNup153の結合する領域を同定した.遺伝子オントロジー解析により,Nup153は神経の分化および転写の制御にかかわる遺伝子と結合することが明らかにされ,Nup153により神経前駆細胞の分化および増殖が制御されるという仮説が支持された.また,Nup153と結合した遺伝子座の約8割にはSox2も結合しており,Nup153はSox2と協同して遺伝子発現を制御するという仮説が支持された.Nup153により発現が制御される遺伝子を同定するため,shRNAを用いて神経前駆細胞においてNup153をノックダウンし,RNA-seq法によりトランスクリプトームの変化を網羅的に解析した.その結果,Nup153のノックダウンにより発現の変化した3286の遺伝子のうち,825の遺伝子はSox2によっても発現の制御をうけており,これらの遺伝子はNup153およびSox2の両方により発現が制御されることが示唆された.ChIP-seq法のデータとRNA-seq法のデータを組み合わせることにより,Nup153およびSox2により直接的に発現の制御される509の遺伝子が同定された.また,Nup153のノックダウンにより,Sox2の発現量に変化はなかったにもかかわらず,Sox2のゲノムDNAへの結合はいちじるしく阻害された.すなわち,Nup153はSox2のゲノムDNAへの結合,あるいは,その維持に必須の役割をはたすことが示唆された.
4.Nup153はゲノムDNAにおいて結合する領域に依存した2つのモードにより遺伝子発現を制御する
Nup153による遺伝子発現の制御をより詳細に解析するため,遺伝子コード領域を中心にNup153の結合した頻度をプロットしたところ,Nup153は転写開始領域にあるプロモーター領域の近傍に高頻度で結合しており,プロモーター領域への結合を介して遺伝子発現を制御することが示唆された.さらに,Nup153の結合は転写終結領域にも集積していた.これまでの研究において,転写因子の多くはプロモーター領域あるいはエンハンサー領域と結合して転写を制御するとされていたが,転写終結領域へのNup153の結合から核膜孔複合体の構成タンパク質に特異的な遺伝子発現の制御の機能が示唆された.RNA-seq法のデータと組み合わせることにより,Nup153がプロモーター領域と結合した際には標的となる遺伝子の発現を活性化し,一方で,Nup153が転写終結領域と結合した際には標的となる遺伝子の発現を抑制することが示唆された(図2).さらに,Nup153がプロモーター領域および転写終結領域の両方と結合した際には標的となる遺伝子の約8割において発現が抑制されていたことから,Nup153の転写終結領域への結合を介した遺伝子発現の抑制が機能的に優位であることが示唆された.
おわりに
核膜孔複合体は真核生物においてきわめて大きいタンパク質複合体であり,進化的に非常に保存された構造をもつ.これまで,核輸送における役割が重点的に解析されてきたが,遺伝子発現の制御における役割についての研究ははじまったばかりである.核膜孔複合体はクロマチンと直接的あるいは間接的に結合することにくわえ,この研究において,キー転写因子と協同して遺伝子発現を制御することが示唆され,細胞種に特異的な遺伝子発現の制御において構造的な基盤としてはたらく可能性が示唆された.脳を構成する細胞の多くは,発生期に産生されたのち,ほとんど入れ替わることなく生涯にわたり細胞の個性および機能を保持しなければならないが,核膜孔複合体を含めた核内構造タンパク質は半減期が非常に長いことから8),細胞種に特異的な遺伝子発現の制御において長期にわたる維持を保証する機構としてはたらくのかもしれない.一方で,これらの核内構造タンパク質は老化および老化にともなう神経変性疾患によりいちじるしく損傷をうけることから9,10),今後,核内構造タンパク質の老化にともなう機能の低下を起因とした細胞の個性の維持,あるいは,神経機能の病態生理の解析が期待される.
文 献
- Molyneaux, B. J., Arlotta, P., Menezes, J. R. et al.: Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci., 8, 427-437 (2007)[PubMed]
- Yao, B., Christian, K. M., He, C. et al.: Epigenetic mechanisms in neurogenesis. Nat. Rev. Neurosci., 17, 537-549 (2016)[PubMed]
- Goncalves, J. T., Schafer, S. T. & Gage, F. H.: Adult neurogenesis in the hippocampus: from stem cells to behavior. Cell, 167, 897-914 (2016)[PubMed]
- Takizawa, T. & Meshorer, E.: Chromatin and nuclear architecture in the nervous system. Trends Neurosci., 31, 343-352 (2008)[PubMed]
- Schneider, R. & Grosschedl, R.: Dynamics and interplay of nuclear architecture, genome organization, and gene expression. Genes Dev., 21, 3027-3043 (2007)[PubMed]
- Gomez-Cavazos, J. S. & Hetzer, M. W.: Outfits for different occasions: tissue-specific roles of nuclear envelope proteins. Curr. Opin. Cell Biol., 24, 775-783 (2012)[PubMed]
- Liang, Y. & Hetzer, M. W.: Functional interactions between nucleoporins and chromatin. Curr. Opin. Cell Biol., 23, 65-70 (2011)[PubMed]
- Toyama, B. H., Savas, J. N., Park, S. K. et al.: Identification of long-lived proteins reveals exceptional stability of essential cellular structures. Cell, 154, 971-982 (2013)[PubMed]
- Frost, B., Gotz, J. & Feany, M. B.: Connecting the dots between tau dysfunction and neurodegeneration. Trends Cell Biol., 25, 46-53 (2015)[PubMed]
- D'Angelo, M. A., Raices, M., Panowski, S. H. et al.: Age-dependent deterioration of nuclear pore complexes causes a loss of nuclear integrity in postmitotic cells. Cell, 136, 284-295 (2009)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 東京大学大学院医学系研究科 修了,同年 東京大学医学部附属病院 特任研究員を経て,2014年より米国Salk Institute for Biological Studiesリサーチアソシエイト.
研究テーマ:核の構造の視点からみた神経の発生,発達,老化およびその進化的な変遷.
関心事:息子と自分の英語の発音の差と,言語学習能力の臨界期.
Fred H. Gage
米国Salk Institute for Biological StudiesにてAdler Professor.
研究室URL:http://logg.salk.edu/
© 2017 戸田智久・Fred H. Gage Licensed under CC 表示 2.1 日本