コンデンシンはDNAのうえを歩進する分子モーターである
寺川 剛
(米国Columbia大学Department of Biochemistry and Molecular Biophysics)
email:寺川 剛
DOI: 10.7875/first.author.2017.106
The condensin complex is a mechanochemical motor that translocates along DNA.
Tsuyoshi Terakawa, Shveta Bisht, Jorine M. Eeftens, Cees Dekker, Christian H. Haering, Eric C. Greene
Science, 358, 672-676 (2017)
コンデンシンは染色体の構造形成において重要な役割をはたすタンパク質であるが,その分子機構についてはわかっていなかった.この研究において,筆者らは,蛍光顕微鏡を用いた1分子観察により,出芽酵母のコンデンシンはATPの加水分解のエネルギーを用いてDNAのうえを歩進する分子モーターであることを明らかにした.また,コンデンシンはDNAから解離するまでに1万bpの距離を1秒間に60 bpずつ進むことも明らかにされた.生化学的な実験との比較により,コンデンシンは1個のATPの加水分解につき30 bpもの距離を進むことも示唆された.このことから,コンデンシンはほかのDNAの分子モーターとはまったく異なる分子機構によりDNAのうえを歩進することが示された.
細胞が複製されたDNAをどのようにして2つの娘細胞に正確に分配するのかは,生命科学における大きな謎のひとつである.百年以上もまえから,DNAはスパゲッティの麺のように複雑にからみあって核に収納されると考えられてきた.そして,細胞が分裂するときにはそれらのDNAは小さくまとめられ染色体とよばれる構造に変化する.この構造変化にはコンデンシンとよばれるタンパク質がかかわることが知られている1).しかし,どのような機構によりDNAに構造変化がひき起こされるのかはわかっていない.この点については,これまで,2つのおもなモデルが提唱されてきた.ひとつは,複雑にからみあうDNAにおいてランダムに形成されたループにコンデンシンが結合し,そのループを安定化することによりDNAを小さくまとめていくというモデルである.そして,もうひとつは,環状のタンパク質であるコンデンシンが化学エネルギーを使い環のなかにDNA鎖を引き込んでループを形成するというモデルである.この研究においては,コンデンシンはATPの加水分解のエネルギーを力学的なエネルギーに変換しDNAのうえを一方向に歩進する分子モーターであること,さらに,歩進しているDNA鎖とはべつのDNA鎖とも同時に結合することが明らかにされた.
出芽酵母のコンデンシンはSmc2,Smc4,Ycs4,Ycg1,Brn1という5つのサブユニットから構成されるヘテロ五量体タンパク質である2).Smc2およびSmc4を含むことから,コンデンシンはSMCファミリータンパク質に分類される.これまでの多くの研究において,Smc2およびSmc4の2つのサブユニットから構成される不完全なコンデンシンが使用されてきたが,コンデンシンをヘテロ五量体タンパク質として単離および精製することに成功した.
精製されたコンデンシンの活性を確認するため,ATPの加水分解の速度を生化学的に測定した.その結果,1つのコンデンシンは1秒間に約0.6個のATPを加水分解することがわかった.そして,DNAの存在下ではより多くのATPを加水分解し,1つのコンデンシンは1分間に約2個のATPを加水分解した.この結果は,ほかのSMCファミリータンパク質における実験の結果と一致した.この加水分解の速度は,ほかの分子モーターに比べいちじるしく低かった.たとえば,代表的な分子モーターのひとつであるキネシンは1秒間に数十個のATPを加水分解する3).実際に,これまで,この低い加水分解の速度はコンデンシンが分子モーターではないこと支持するという見解もあった4).
精製したコンデンシンがDNAの構造変化をひき起こす能力を生化学的に測定した.その結果,コンデンシンはATPの加水分解の存在下においてのみ,DNAの構造変化をひき起こすことがわかった.この結果から,ATPの加水分解のエネルギーがDNAの構造変化の誘起に必須であることが示唆されたが,このエネルギーが何に使われるかはわからなかった.
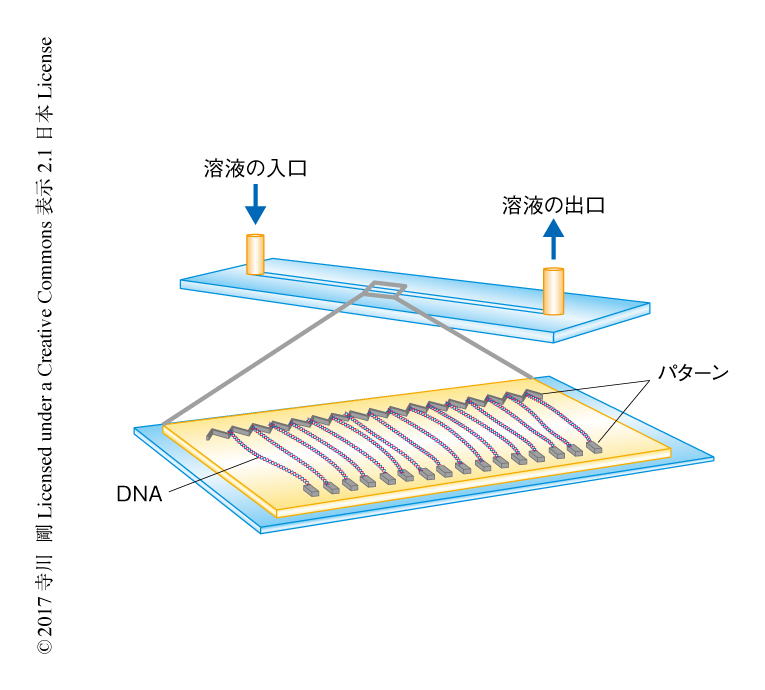
DNAカーテン法とよばれる蛍光顕微鏡による1分子観察法により5),ATPの存在下におけるコンデンシンのDNAのうえでの動態を分子レベルで観察した.この手法においては,ガラススライドのうえにナノテクノロジーを用いてパターンを描画し,そのパターンにDNAを張りつける(図1).パターンのうえにならべたDNAがカーテンのようにみえることがこの手法の名前の由来である.この手法は,従来の蛍光顕微鏡による1分子観察法と比較して,DNAのうえでいちどに観察される分子の数が多いという特徴がある.この実験においては,DNAの両端をパターンに結合させてDNAを伸長しているので,コンデンシンはATPの存在下においてもDNAの構造変化を誘起しない.これにより,コンデンシンのDNAのうえでの動態が観察される.
コンデンシンを量子ドットにより蛍光標識して,レーザー光で蛍光を励起し蛍光顕微鏡によりそのシグナルを観察した.コンデンシンをDNAのうえにロードすると,コンデンシンがDNAと結合するのが観察された.使用したλファージのゲノムDNAには,アデニンとチミンが多く存在する領域と,グアニンとシトシンが多く存在する領域とがある.コンデンシンはアデニンとチミンが多く存在する領域により多く結合した.この結果は,ほかのSMCファミリータンパク質における実験の結果と一致した.観察をつづけると,5分ほどのラグタイムののちコンデンシンが一方向に歩進した.ラグタイムの存在から,結合から歩進の開始までにコンデンシンがその構造を変化させる必要のあることが示唆された.コンデンシンが歩進を開始すると,約1万bpを歩進して解離するまでのあいだ,1秒間に60 bpの速さで歩進することもわかった.同様の実験において,ATPを加水分解しないコンデンシンの変異体は歩進しなかったことから,この歩進はATPの加水分解のエネルギーに依存することもわかった.ここで,コンデンシンがDNAの存在下において1秒間に2個のATPを加水分解することを考えると,1個のATPの加水分解につき30 bpを歩進する計算になる.これは,これまでに研究されてきたDNAの分子モーターが1個のATPの加水分解につき約1 bpの距離を歩進するのと比べ6),非常に大きな値であった.これらの結果から,コンデンシンはこれまでに類をみない大きな歩進距離をもつ分子モーターであることが示唆された.
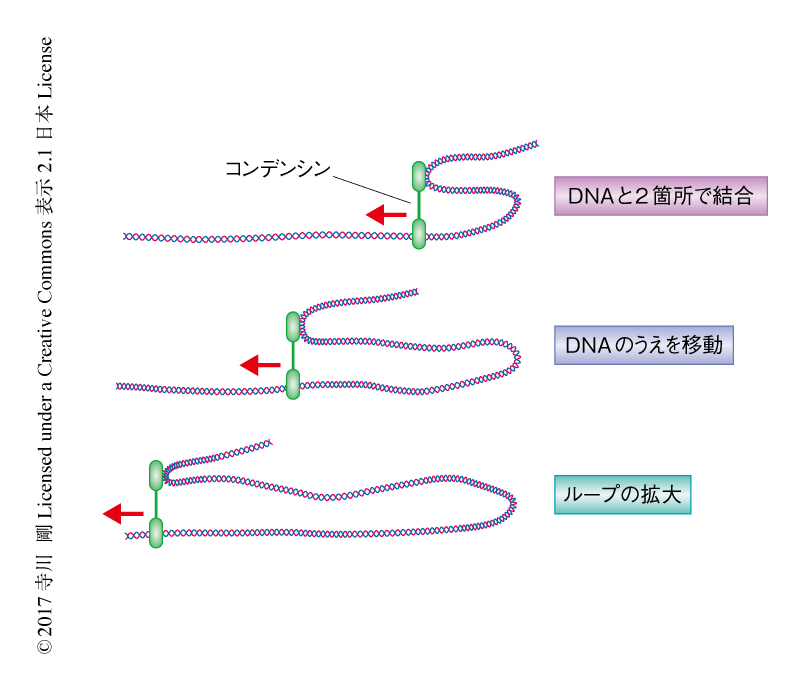
この実験においては,DNAの両端をパターンに結合させて伸長させているため,DNAの構造は観察できなかった.そこで,コンデンシンの分子モーター活性とDNAの構造変化との関係について調べるため新しい実験をデザインした.蛍光標識したDNAとコンデンシンとを結合させて,両端をパターンに結合させて伸長させたDNAにロードし,パターンに結合させていないDNAのシグナルを観察した.もし,コンデンシンがあるDNA鎖と結合しながら別のDNA鎖のうえを歩進することによりDNAの構造を変化させるならば,パターンに結合させていないDNAがパターンに結合させたDNAのうえを歩進するのが観察されるはずである.実験の結果,パターンに結合させていないDNAの歩進が観察され,コンデンシンがATPの加水分解のエネルギーを利用してDNAの構造を変化させる能力のあることが示唆された(図2).また,この実験においても,コンデンシンが歩進を開始すると約1万bpを歩進して解離するまで1秒間に60 bpの速さで歩進をつづけたことから,パターンに結合させていないDNAの結合はコンデンシンの歩進の機構を大幅に変えることはないと考えられた.
出芽酵母のコンデンシンがDNAのうえを歩進する分子モーターであるという発見は,染色体の構造形成の機構の理解に重要な示唆をあたえる.この研究において,コンデンシンの分子モーター活性は染色体の構造形成に密接にかかわることが示唆された.つまり,コンデンシンやそのほかのSMCファミリータンパク質がDNAを環状タンパク質の環に化学エネルギーを使い引き込む機構により,染色体の構造形成がひき起こされることが示唆された.今後は,ほかのSMCファミリータンパク質が分子モーターであるかどうか,また,どのような制御因子が分子モーター活性の有無を決めているかなどをさらに探求する必要がある.Cornelia de Lange症候群などの遺伝性疾患は,SMCファミリータンパク質が機能しないことによりひき起こされる7).また,コンデンシンのかかわる染色体の構造形成のエラーは細胞のがん化につながる8).コンデンシンによる染色体の構造形成の機構の解明は,それら深刻な疾患の分子機序の理解に重要である.
略歴:2014年 京都大学大学院理学研究科博士課程 修了,同年 同 博士研究員を経て,2015年より米国Columbia大学 博士研究員.
研究テーマ:蛍光顕微鏡による1分子の観察および分子動力学シミュレーションによるDNA結合タンパク質の機能の解明.
抱負:一歩ずつ前に進む.
© 2017 寺川 剛 Licensed under CC 表示 2.1 日本
(米国Columbia大学Department of Biochemistry and Molecular Biophysics)
email:寺川 剛
DOI: 10.7875/first.author.2017.106
The condensin complex is a mechanochemical motor that translocates along DNA.
Tsuyoshi Terakawa, Shveta Bisht, Jorine M. Eeftens, Cees Dekker, Christian H. Haering, Eric C. Greene
Science, 358, 672-676 (2017)
要 約
コンデンシンは染色体の構造形成において重要な役割をはたすタンパク質であるが,その分子機構についてはわかっていなかった.この研究において,筆者らは,蛍光顕微鏡を用いた1分子観察により,出芽酵母のコンデンシンはATPの加水分解のエネルギーを用いてDNAのうえを歩進する分子モーターであることを明らかにした.また,コンデンシンはDNAから解離するまでに1万bpの距離を1秒間に60 bpずつ進むことも明らかにされた.生化学的な実験との比較により,コンデンシンは1個のATPの加水分解につき30 bpもの距離を進むことも示唆された.このことから,コンデンシンはほかのDNAの分子モーターとはまったく異なる分子機構によりDNAのうえを歩進することが示された.
はじめに
細胞が複製されたDNAをどのようにして2つの娘細胞に正確に分配するのかは,生命科学における大きな謎のひとつである.百年以上もまえから,DNAはスパゲッティの麺のように複雑にからみあって核に収納されると考えられてきた.そして,細胞が分裂するときにはそれらのDNAは小さくまとめられ染色体とよばれる構造に変化する.この構造変化にはコンデンシンとよばれるタンパク質がかかわることが知られている1).しかし,どのような機構によりDNAに構造変化がひき起こされるのかはわかっていない.この点については,これまで,2つのおもなモデルが提唱されてきた.ひとつは,複雑にからみあうDNAにおいてランダムに形成されたループにコンデンシンが結合し,そのループを安定化することによりDNAを小さくまとめていくというモデルである.そして,もうひとつは,環状のタンパク質であるコンデンシンが化学エネルギーを使い環のなかにDNA鎖を引き込んでループを形成するというモデルである.この研究においては,コンデンシンはATPの加水分解のエネルギーを力学的なエネルギーに変換しDNAのうえを一方向に歩進する分子モーターであること,さらに,歩進しているDNA鎖とはべつのDNA鎖とも同時に結合することが明らかにされた.
1.コンデンシンの単離および精製
出芽酵母のコンデンシンはSmc2,Smc4,Ycs4,Ycg1,Brn1という5つのサブユニットから構成されるヘテロ五量体タンパク質である2).Smc2およびSmc4を含むことから,コンデンシンはSMCファミリータンパク質に分類される.これまでの多くの研究において,Smc2およびSmc4の2つのサブユニットから構成される不完全なコンデンシンが使用されてきたが,コンデンシンをヘテロ五量体タンパク質として単離および精製することに成功した.
精製されたコンデンシンの活性を確認するため,ATPの加水分解の速度を生化学的に測定した.その結果,1つのコンデンシンは1秒間に約0.6個のATPを加水分解することがわかった.そして,DNAの存在下ではより多くのATPを加水分解し,1つのコンデンシンは1分間に約2個のATPを加水分解した.この結果は,ほかのSMCファミリータンパク質における実験の結果と一致した.この加水分解の速度は,ほかの分子モーターに比べいちじるしく低かった.たとえば,代表的な分子モーターのひとつであるキネシンは1秒間に数十個のATPを加水分解する3).実際に,これまで,この低い加水分解の速度はコンデンシンが分子モーターではないこと支持するという見解もあった4).
精製したコンデンシンがDNAの構造変化をひき起こす能力を生化学的に測定した.その結果,コンデンシンはATPの加水分解の存在下においてのみ,DNAの構造変化をひき起こすことがわかった.この結果から,ATPの加水分解のエネルギーがDNAの構造変化の誘起に必須であることが示唆されたが,このエネルギーが何に使われるかはわからなかった.
2.コンデンシンのDNAのうえでの動態
DNAカーテン法とよばれる蛍光顕微鏡による1分子観察法により5),ATPの存在下におけるコンデンシンのDNAのうえでの動態を分子レベルで観察した.この手法においては,ガラススライドのうえにナノテクノロジーを用いてパターンを描画し,そのパターンにDNAを張りつける(図1).パターンのうえにならべたDNAがカーテンのようにみえることがこの手法の名前の由来である.この手法は,従来の蛍光顕微鏡による1分子観察法と比較して,DNAのうえでいちどに観察される分子の数が多いという特徴がある.この実験においては,DNAの両端をパターンに結合させてDNAを伸長しているので,コンデンシンはATPの存在下においてもDNAの構造変化を誘起しない.これにより,コンデンシンのDNAのうえでの動態が観察される.
コンデンシンを量子ドットにより蛍光標識して,レーザー光で蛍光を励起し蛍光顕微鏡によりそのシグナルを観察した.コンデンシンをDNAのうえにロードすると,コンデンシンがDNAと結合するのが観察された.使用したλファージのゲノムDNAには,アデニンとチミンが多く存在する領域と,グアニンとシトシンが多く存在する領域とがある.コンデンシンはアデニンとチミンが多く存在する領域により多く結合した.この結果は,ほかのSMCファミリータンパク質における実験の結果と一致した.観察をつづけると,5分ほどのラグタイムののちコンデンシンが一方向に歩進した.ラグタイムの存在から,結合から歩進の開始までにコンデンシンがその構造を変化させる必要のあることが示唆された.コンデンシンが歩進を開始すると,約1万bpを歩進して解離するまでのあいだ,1秒間に60 bpの速さで歩進することもわかった.同様の実験において,ATPを加水分解しないコンデンシンの変異体は歩進しなかったことから,この歩進はATPの加水分解のエネルギーに依存することもわかった.ここで,コンデンシンがDNAの存在下において1秒間に2個のATPを加水分解することを考えると,1個のATPの加水分解につき30 bpを歩進する計算になる.これは,これまでに研究されてきたDNAの分子モーターが1個のATPの加水分解につき約1 bpの距離を歩進するのと比べ6),非常に大きな値であった.これらの結果から,コンデンシンはこれまでに類をみない大きな歩進距離をもつ分子モーターであることが示唆された.
3.コンデンシンによるDNAの構造変化の機構
この実験においては,DNAの両端をパターンに結合させて伸長させているため,DNAの構造は観察できなかった.そこで,コンデンシンの分子モーター活性とDNAの構造変化との関係について調べるため新しい実験をデザインした.蛍光標識したDNAとコンデンシンとを結合させて,両端をパターンに結合させて伸長させたDNAにロードし,パターンに結合させていないDNAのシグナルを観察した.もし,コンデンシンがあるDNA鎖と結合しながら別のDNA鎖のうえを歩進することによりDNAの構造を変化させるならば,パターンに結合させていないDNAがパターンに結合させたDNAのうえを歩進するのが観察されるはずである.実験の結果,パターンに結合させていないDNAの歩進が観察され,コンデンシンがATPの加水分解のエネルギーを利用してDNAの構造を変化させる能力のあることが示唆された(図2).また,この実験においても,コンデンシンが歩進を開始すると約1万bpを歩進して解離するまで1秒間に60 bpの速さで歩進をつづけたことから,パターンに結合させていないDNAの結合はコンデンシンの歩進の機構を大幅に変えることはないと考えられた.
おわりに
出芽酵母のコンデンシンがDNAのうえを歩進する分子モーターであるという発見は,染色体の構造形成の機構の理解に重要な示唆をあたえる.この研究において,コンデンシンの分子モーター活性は染色体の構造形成に密接にかかわることが示唆された.つまり,コンデンシンやそのほかのSMCファミリータンパク質がDNAを環状タンパク質の環に化学エネルギーを使い引き込む機構により,染色体の構造形成がひき起こされることが示唆された.今後は,ほかのSMCファミリータンパク質が分子モーターであるかどうか,また,どのような制御因子が分子モーター活性の有無を決めているかなどをさらに探求する必要がある.Cornelia de Lange症候群などの遺伝性疾患は,SMCファミリータンパク質が機能しないことによりひき起こされる7).また,コンデンシンのかかわる染色体の構造形成のエラーは細胞のがん化につながる8).コンデンシンによる染色体の構造形成の機構の解明は,それら深刻な疾患の分子機序の理解に重要である.
文 献
- Hirano, T.: Condensin-based chromosome organization from bacteria to vertebrates. Cell, 164, 847-857 (2016)[PubMed]
- Uhlmann, F.: SMC complexes: from DNA to chromosomes. Nat. Rev. Mol. Cell Biol., 17, 399-412 (2016)[PubMed]
- Gilbert, S. P., Webb, M. R., Brune, M. et al.: Pathway of processive ATP hydrolysis by kinesin. Nature, 273, 671-676 (1995)[PubMed]
- Dolgin, E.: DNA's secret weapon against knots and tangles. Nature, 544, 284-286 (2017)[PubMed]
- Greene, E. C., Wind, S., Fazio, T. et al.: DNA curtains for high-throughput single-molecule optical imaging. Methods Enzymol., 472, 293-315 (2010)[PubMed]
- Myong, S. & Ha, T.: Stepwise translocation of nucleic acid motors. Curr. Opin. Struct. Biol., 20, 121-127 (2010)[PubMed]
- Liu, J. & Krantz, I. D.: Cornelia de Lange syndrome, cohesion, and beyond. Clin. Genet., 76, 303-314 (2009)[PubMed]
- Woodward, J., Taylor, G. C., Soares, D. C. et al.: Condensin II mutation causes T-cell lymphoma through tissue-specific genome instability. Genes Dev., 30, 2173-2186 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 京都大学大学院理学研究科博士課程 修了,同年 同 博士研究員を経て,2015年より米国Columbia大学 博士研究員.
研究テーマ:蛍光顕微鏡による1分子の観察および分子動力学シミュレーションによるDNA結合タンパク質の機能の解明.
抱負:一歩ずつ前に進む.
© 2017 寺川 剛 Licensed under CC 表示 2.1 日本