コンデンシンはクロマチンの空間配置を再構築することにより分裂期における染色体の凝縮を担う
角井 康貢
(英国Francis Crick Institute,Chromosome Segregation Laboratory)
email:角井康貢
DOI: 10.7875/first.author.2017.096
Condensin-mediated remodeling of the mitotic chromatin landscape in fission yeast.
Yasutaka Kakui, Adam Rabinowitz, David J. Barry, Frank Uhlmann
Nature Genetics, 49, 1553-1557 (2017)
核にクロマチンとして詰め込まれているDNAは細胞周期に応じてその3次元構造を大きく変化させる.分裂期における染色体の凝縮は核に分散していたクロマチンが染色体へと形態を変化させる過程であり,遺伝情報を次世代へと正確に受け継ぐために必須である.コンデンシンは染色体の凝縮において中心的な役割をはたしており,その分子機構の解明は重要な課題である.筆者らは,クロマチンの空間的な相互作用を可視化することのできるHi-C法を用いて,間期および分裂期において染色体の内部におけるクロマチンの空間配置を決定した.その結果,間期の核において形成されていた小さなドメイン構造が分裂期においては融合しより大きなドメイン構造を形成することを見い出した.また,コンデンシンは染色体の腕部内における相互作用を遠距離の相互作用に置き換え,同時に,クロマチンの振動を抑制することにより染色体の凝縮を担うことが明らかにされた.
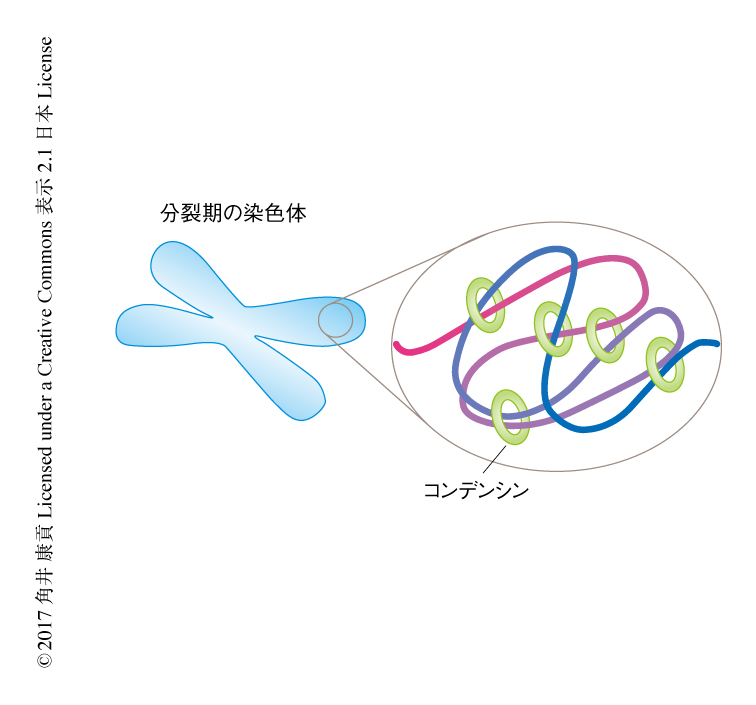
遺伝情報の担体であるDNAはきわめて長い直鎖状の分子であり,その全長は細胞の長さよりもはるかに長い.そのため,DNAはヒストンとの複合体として構成されるクロマチンを基本として,不規則に折りたたまれ核に詰め込まれている.クロマチンは細胞周期あるいは分化に応じその形態を大きく変化させ,分裂期においてはもっとも劇的に形態を変化させる.つまり,間期において核に詰め込まれていたクロマチンは,分裂期になると凝縮して染色体を形成する.この染色体の凝縮の過程は,μm単位の大きさの細胞においてその1000倍以上の長さをもつDNAを娘細胞へと正確に分配するために必須であり,コンデンシンはその中心的な役割を担う.コンデンシンは染色体の構造の制御にかかわるSMC複合体のひとつであり,細菌から高等生物まで広く保存されている1).コンデンシンはその巨大なリング状の構造によりDNAをたばね,染色体の高次構造の形成にかかわると考えられている2)(図1).しかしながら,コンデンシンがどのように染色体の凝縮を制御するかについては未解明の部分が多い.
Hi-C法は3C(chromosome conformation capture)法を応用した手法で,クロマチンの空間的な相互作用を可視化する強力な解析法であり3,4),空間的に近接したクロマチンの領域をゲノムワイドに決定することができる.Hi-C法を用いたこれまでの研究により,間期の核におけるクロマチンのドメイン構造の形成や,ヒトの分裂期の染色体における均一なクロマチン構造が報告されている3,5-7).しかし,これらの報告においては空間解像度が低く,クロマチンの3次元構造の決定にはさらなる解析がもとめられる.Hi-C法における解像度は,次世代シークエンサーによるリードの数,および,対象とする生物のゲノムの大きさや複雑さに大きく依存する.そこで,筆者らは,染色体が3本と少なくゲノムの大きさも比較的小さい分裂酵母を対象とし,Hi-C法によりクロマチンの相互作用をゲノムワイドかつ超高解像度で決定した.これにより,染色体の凝縮にともなうクロマチンの空間配置の変化を明らかにするとともに,コンデンシンのはたらきの解明をめざした.
細胞周期におけるクロマチンの空間配置の変化について調べるため,間期および分裂期におけるクロマチンの相互作用をHi-C法により解析した.栄養増殖期の分裂酵母は9割以上の細胞がG2期にあるため,これを間期とした.他方,細胞を分裂期に同調させるためにはAPC/Cの活性化タンパク質であるSlp1/Cdc20の変異体を用いた.Hi-C法により,間期の核において,局所的な狭い範囲における相互作用がもっとも高頻度に検出され,さらに,セントロメアどうし,染色体の末端のテロメアどうしの強い相互作用もみられた.これは,分裂酵母の間期の核においてクロマチンがRabl配向を形成することと一致した6,8).また,クロマチンが核に一様に分散していることを反映して,染色体のあいだ,および,染色体の腕部のあいだの相互作用もみられた.これに対して,分裂期においては染色体および染色体の腕部のあいだの相互作用が減少し,染色体の腕部内における相互作用が増加した.蛍光顕微鏡による染色体の観察においては分裂期において個々の染色体が独立することが報告されており9),Hi-C法により染色体の形態の大規模な変化がとらえられた.
Hi-C法によりコンデンシンによる分裂期における染色体の凝縮を解析するため,オーキシンデグロン法によるタンパク質の分解と転写の抑制とを組み合わせることにより,コンデンシンのサブユニットのひとつであるCut14/SMC2を分裂期に特異的に細胞から取り除いた.この系においてHi-C法によりクロマチンの相互作用について調べたところ,染色体のあいだの相互作用の減少,および,染色体の腕部内における相互作用の増加がみられず,間期にきわめて近いパターンを示した.やはりコンデンシンのサブユニットのひとつであるCnd3/CAP-Gを分裂期に特異的に細胞から取り除いた際にも同様に,クロマチンの相互作用のパターンは間期におけるパターンに類似した.さらに,コンデンシンの有無により生じるクロマチンの相互作用の違いは,間期と分裂期との違いにきわめて類似していた.これらの結果から,分裂酵母においてコンデンシンは分裂期における染色体の凝縮をつかさどる主要なタンパク質であることが明らかにされた.
Hi-C法により得られたクロマチンの相互作用の変化は,データの標準化などの影響をうけるため必ずしも定量的とはいえない.そこで,Hi-C法のための試料と同時に調製した3C法のためのライブラリーを鋳型としてリアルタイムPCR法を実施する3C-qPCR法により,クロマチンの相互作用の定量化を試みた.染色体のあいだの相互作用のうちもっとも検出の容易なセントロメアのあいだの相互作用をこの方法により定量化したところ,分裂期における相互作用は間期の約半分に減少しており,これはHi-C法と一致した.一方,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において,セントロメアのあいだの相互作用はHi-C法あるいは3C-qPCR法のいずれにおいても間期から変化しなかった.別の角度からこの結果を検証するため,セントロメアの局在を蛍光顕微鏡により観察した.分裂期においてセントロメアはスピンドル微小管のうえに散らばって局在したのに対し,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において,セントロメアはスピンドル微小管の両極に近い部位に局在した.これらの結果はHi-C法および3C-qPCR法により得られた結果と一致し,Hi-C法により決定された相互作用の減少は定量的な変化であるといえた.
染色体の凝縮の分子機構にせまるため,クロマチンの染色体の腕部内における相互作用の変化に注目した.間期のクロマチンにおいては90 kb以内の範囲の局所的な相互作用が高い頻度でみられる.これに対し,分裂期の染色体においてクロマチンはその相互作用の範囲を大きく広げ,90~900 kbの範囲の遠距離の相互作用が増加する.Hi-C法により,間期から分裂期にかけての遠距離の相互作用の増加にともなう,局所的な相互作用および1 Mbをこえる超遠距離の相互作用の減少がみられた.分裂期における超遠距離の相互作用の減少は,Hi-C法によりヒトの分裂期の染色体においてもみられている5).これらの結果から,染色体の凝縮によりクロマチンの動きが制限されることが示唆された.染色体の凝縮にともなうクロマチンの局所的な相互作用の減少を定量的に検証するため3C-qPCR法を用いたところ,Hi-C法による結果が支持された.Cut14/SMC2を分裂期に特異的に細胞から取り除いた系においては,Hi-C法あるいは3C-qPCR法のいずれにおいてもこれらの定量的な変化はみられなかったことから,コンデンシンに依存したクロマチンの局所的な相互作用の減少は定量的な変化であることが明らかにされた.
さらに,染色体の腕部の位置による凝縮の度合いの違いについても検討した.その結果,腕部の中央部は末端と比較してやや凝縮しているものの,染色体の全域においてほぼ均一な凝縮度を示すことがわかった.
これまでのHi-C法による解析により,ヒトの分裂期の染色体においては間期に形成されたドメイン構造が解消されることが報告されていた5).そこで,分裂酵母の分裂期の染色体においてドメイン構造を解析した.分裂酵母においては分裂期の染色体においてもドメイン構造は維持されていたが,間期よりもドメイン構造の数は減少し,大きさは拡大していた.また,分裂期におけるドメイン構造のあいだの境界は,間期におけるドメイン構造の境界の一部と同じ位置であったことから,間期の小さなドメイン構造が融合し,分裂期において大きなドメイン構造となることが明らかにされた.また,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系においてドメイン構造を解析したところ,間期のドメイン構造と同じ程度の数および大きさを示した.よって,分裂期におけるドメイン構造の融合はコンデンシンに依存的であることがわかった.
ドメイン構造の大きさの拡大はコンデンシンに依存していたことから,ChIP-seq法によりコンデンシンの結合部位を同定した.その結果,コンデンシンの結合部位どうしは非結合部位どうしよりも高い頻度で相互作用していたが,コンデンシンの結合強度には分裂期の染色体における遠距離の相互作用の増加との関連はみられなかった.このことから,コンデンシンは結合部位どうしをたばねるだけでなく,非結合部位も間接的に凝縮させることが示唆された.また,コンデンシンの結合部位はドメイン構造の境界と共局在しており,コンデンシンがドメイン構造の形成および融合にかかわることが支持された.
染色体の凝縮におけるクロマチンの局所的な相互作用の減少についてさらにくわしく解析するため,クロマチンの動きについて調べた.染色体に挿入したLacO配列と結合するLacI-GFPの挙動を共焦点顕微鏡により観察し平均2乗変位をもとめたところ,間期においてクロマチンは大きく振動していたが,分裂期のクロマチンはほとんど振動していなかった.また,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において平均2乗変位は間期よりも大きかったことから,染色体の凝縮にともないコンデンシンがクロマチンの振動を抑制していることがわかった.
以上の結果から,分裂期において染色体を凝縮させるため,コンデンシンは間期におけるクロマチンの局所的な相互作用を遠距離の相互作用に置き換えると同時に,クロマチンの振動を抑制しドメイン構造を融合させることが明らかにされた(図2).
塩基配列決定技術と3C法の発展によりクロマチンの空間配置が決定できるようになり,SMC複合体によるクロマチンのドメイン構造の形成が大きく注目されている.ドメイン構造の形成の分子機構として,DNAをSMC複合体のリングの内側へと押し出してループを形成するモデルと,SMC複合体どうしの相互作用によりDNAのループを形成するモデルの2つが提唱されている10,11).これまでのところ,押し出してループを形成するモデルが優位ではあるが,まだまだ議論の余地は残されている.Hi-C法により得られるデータはコンピューターモデリングと相性がいいため,超高解像度のデータを用いてこれら2つのモデルを詳細に検討することにより,その分子機構の解析が進むと予想される.また,クロマチンの振動がコンデンシンにより抑制されていたことから,クロマチンのポリマーとしての性質に注目することも染色体の凝縮の分子機構の解明において鍵をにぎるのではないだろうか.はじめて染色体の凝縮が詳細に記述されてから130年以上がたったが,その分子機構はまだまだ謎につつまれている.今後,さらなる解析をつうじてこのミクロな世界の壮大な謎の全容を解明したい.
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より英国Francis Crick Institute博士研究員.
研究テーマ:染色体の3次元構造および分裂期における凝縮.
抱負:生命現象のおもしろさをシンプルにわかりやすく伝えられるようにしたい.
© 2017 角井 康貢 Licensed under CC 表示 2.1 日本
(英国Francis Crick Institute,Chromosome Segregation Laboratory)
email:角井康貢
DOI: 10.7875/first.author.2017.096
Condensin-mediated remodeling of the mitotic chromatin landscape in fission yeast.
Yasutaka Kakui, Adam Rabinowitz, David J. Barry, Frank Uhlmann
Nature Genetics, 49, 1553-1557 (2017)
要 約
核にクロマチンとして詰め込まれているDNAは細胞周期に応じてその3次元構造を大きく変化させる.分裂期における染色体の凝縮は核に分散していたクロマチンが染色体へと形態を変化させる過程であり,遺伝情報を次世代へと正確に受け継ぐために必須である.コンデンシンは染色体の凝縮において中心的な役割をはたしており,その分子機構の解明は重要な課題である.筆者らは,クロマチンの空間的な相互作用を可視化することのできるHi-C法を用いて,間期および分裂期において染色体の内部におけるクロマチンの空間配置を決定した.その結果,間期の核において形成されていた小さなドメイン構造が分裂期においては融合しより大きなドメイン構造を形成することを見い出した.また,コンデンシンは染色体の腕部内における相互作用を遠距離の相互作用に置き換え,同時に,クロマチンの振動を抑制することにより染色体の凝縮を担うことが明らかにされた.
はじめに
遺伝情報の担体であるDNAはきわめて長い直鎖状の分子であり,その全長は細胞の長さよりもはるかに長い.そのため,DNAはヒストンとの複合体として構成されるクロマチンを基本として,不規則に折りたたまれ核に詰め込まれている.クロマチンは細胞周期あるいは分化に応じその形態を大きく変化させ,分裂期においてはもっとも劇的に形態を変化させる.つまり,間期において核に詰め込まれていたクロマチンは,分裂期になると凝縮して染色体を形成する.この染色体の凝縮の過程は,μm単位の大きさの細胞においてその1000倍以上の長さをもつDNAを娘細胞へと正確に分配するために必須であり,コンデンシンはその中心的な役割を担う.コンデンシンは染色体の構造の制御にかかわるSMC複合体のひとつであり,細菌から高等生物まで広く保存されている1).コンデンシンはその巨大なリング状の構造によりDNAをたばね,染色体の高次構造の形成にかかわると考えられている2)(図1).しかしながら,コンデンシンがどのように染色体の凝縮を制御するかについては未解明の部分が多い.
Hi-C法は3C(chromosome conformation capture)法を応用した手法で,クロマチンの空間的な相互作用を可視化する強力な解析法であり3,4),空間的に近接したクロマチンの領域をゲノムワイドに決定することができる.Hi-C法を用いたこれまでの研究により,間期の核におけるクロマチンのドメイン構造の形成や,ヒトの分裂期の染色体における均一なクロマチン構造が報告されている3,5-7).しかし,これらの報告においては空間解像度が低く,クロマチンの3次元構造の決定にはさらなる解析がもとめられる.Hi-C法における解像度は,次世代シークエンサーによるリードの数,および,対象とする生物のゲノムの大きさや複雑さに大きく依存する.そこで,筆者らは,染色体が3本と少なくゲノムの大きさも比較的小さい分裂酵母を対象とし,Hi-C法によりクロマチンの相互作用をゲノムワイドかつ超高解像度で決定した.これにより,染色体の凝縮にともなうクロマチンの空間配置の変化を明らかにするとともに,コンデンシンのはたらきの解明をめざした.
1.Hi-C法による分裂酵母における染色体の3次元構造の決定
細胞周期におけるクロマチンの空間配置の変化について調べるため,間期および分裂期におけるクロマチンの相互作用をHi-C法により解析した.栄養増殖期の分裂酵母は9割以上の細胞がG2期にあるため,これを間期とした.他方,細胞を分裂期に同調させるためにはAPC/Cの活性化タンパク質であるSlp1/Cdc20の変異体を用いた.Hi-C法により,間期の核において,局所的な狭い範囲における相互作用がもっとも高頻度に検出され,さらに,セントロメアどうし,染色体の末端のテロメアどうしの強い相互作用もみられた.これは,分裂酵母の間期の核においてクロマチンがRabl配向を形成することと一致した6,8).また,クロマチンが核に一様に分散していることを反映して,染色体のあいだ,および,染色体の腕部のあいだの相互作用もみられた.これに対して,分裂期においては染色体および染色体の腕部のあいだの相互作用が減少し,染色体の腕部内における相互作用が増加した.蛍光顕微鏡による染色体の観察においては分裂期において個々の染色体が独立することが報告されており9),Hi-C法により染色体の形態の大規模な変化がとらえられた.
2.コンデンシンはクロマチンの相互作用を大きく変化させる
Hi-C法によりコンデンシンによる分裂期における染色体の凝縮を解析するため,オーキシンデグロン法によるタンパク質の分解と転写の抑制とを組み合わせることにより,コンデンシンのサブユニットのひとつであるCut14/SMC2を分裂期に特異的に細胞から取り除いた.この系においてHi-C法によりクロマチンの相互作用について調べたところ,染色体のあいだの相互作用の減少,および,染色体の腕部内における相互作用の増加がみられず,間期にきわめて近いパターンを示した.やはりコンデンシンのサブユニットのひとつであるCnd3/CAP-Gを分裂期に特異的に細胞から取り除いた際にも同様に,クロマチンの相互作用のパターンは間期におけるパターンに類似した.さらに,コンデンシンの有無により生じるクロマチンの相互作用の違いは,間期と分裂期との違いにきわめて類似していた.これらの結果から,分裂酵母においてコンデンシンは分裂期における染色体の凝縮をつかさどる主要なタンパク質であることが明らかにされた.
3.Hi-C法により決定された相互作用は定量的である
Hi-C法により得られたクロマチンの相互作用の変化は,データの標準化などの影響をうけるため必ずしも定量的とはいえない.そこで,Hi-C法のための試料と同時に調製した3C法のためのライブラリーを鋳型としてリアルタイムPCR法を実施する3C-qPCR法により,クロマチンの相互作用の定量化を試みた.染色体のあいだの相互作用のうちもっとも検出の容易なセントロメアのあいだの相互作用をこの方法により定量化したところ,分裂期における相互作用は間期の約半分に減少しており,これはHi-C法と一致した.一方,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において,セントロメアのあいだの相互作用はHi-C法あるいは3C-qPCR法のいずれにおいても間期から変化しなかった.別の角度からこの結果を検証するため,セントロメアの局在を蛍光顕微鏡により観察した.分裂期においてセントロメアはスピンドル微小管のうえに散らばって局在したのに対し,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において,セントロメアはスピンドル微小管の両極に近い部位に局在した.これらの結果はHi-C法および3C-qPCR法により得られた結果と一致し,Hi-C法により決定された相互作用の減少は定量的な変化であるといえた.
4.コンデンシンは分裂期においてクロマチンの染色体の腕部内における相互作用を再構築する
染色体の凝縮の分子機構にせまるため,クロマチンの染色体の腕部内における相互作用の変化に注目した.間期のクロマチンにおいては90 kb以内の範囲の局所的な相互作用が高い頻度でみられる.これに対し,分裂期の染色体においてクロマチンはその相互作用の範囲を大きく広げ,90~900 kbの範囲の遠距離の相互作用が増加する.Hi-C法により,間期から分裂期にかけての遠距離の相互作用の増加にともなう,局所的な相互作用および1 Mbをこえる超遠距離の相互作用の減少がみられた.分裂期における超遠距離の相互作用の減少は,Hi-C法によりヒトの分裂期の染色体においてもみられている5).これらの結果から,染色体の凝縮によりクロマチンの動きが制限されることが示唆された.染色体の凝縮にともなうクロマチンの局所的な相互作用の減少を定量的に検証するため3C-qPCR法を用いたところ,Hi-C法による結果が支持された.Cut14/SMC2を分裂期に特異的に細胞から取り除いた系においては,Hi-C法あるいは3C-qPCR法のいずれにおいてもこれらの定量的な変化はみられなかったことから,コンデンシンに依存したクロマチンの局所的な相互作用の減少は定量的な変化であることが明らかにされた.
さらに,染色体の腕部の位置による凝縮の度合いの違いについても検討した.その結果,腕部の中央部は末端と比較してやや凝縮しているものの,染色体の全域においてほぼ均一な凝縮度を示すことがわかった.
5.分裂期の染色体においてコンデンシンに依存的にドメイン構造が融合する
これまでのHi-C法による解析により,ヒトの分裂期の染色体においては間期に形成されたドメイン構造が解消されることが報告されていた5).そこで,分裂酵母の分裂期の染色体においてドメイン構造を解析した.分裂酵母においては分裂期の染色体においてもドメイン構造は維持されていたが,間期よりもドメイン構造の数は減少し,大きさは拡大していた.また,分裂期におけるドメイン構造のあいだの境界は,間期におけるドメイン構造の境界の一部と同じ位置であったことから,間期の小さなドメイン構造が融合し,分裂期において大きなドメイン構造となることが明らかにされた.また,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系においてドメイン構造を解析したところ,間期のドメイン構造と同じ程度の数および大きさを示した.よって,分裂期におけるドメイン構造の融合はコンデンシンに依存的であることがわかった.
ドメイン構造の大きさの拡大はコンデンシンに依存していたことから,ChIP-seq法によりコンデンシンの結合部位を同定した.その結果,コンデンシンの結合部位どうしは非結合部位どうしよりも高い頻度で相互作用していたが,コンデンシンの結合強度には分裂期の染色体における遠距離の相互作用の増加との関連はみられなかった.このことから,コンデンシンは結合部位どうしをたばねるだけでなく,非結合部位も間接的に凝縮させることが示唆された.また,コンデンシンの結合部位はドメイン構造の境界と共局在しており,コンデンシンがドメイン構造の形成および融合にかかわることが支持された.
6.コンデンシンはクロマチンの振動を抑制する
染色体の凝縮におけるクロマチンの局所的な相互作用の減少についてさらにくわしく解析するため,クロマチンの動きについて調べた.染色体に挿入したLacO配列と結合するLacI-GFPの挙動を共焦点顕微鏡により観察し平均2乗変位をもとめたところ,間期においてクロマチンは大きく振動していたが,分裂期のクロマチンはほとんど振動していなかった.また,Cut14/SMC2を分裂期に特異的に細胞から取り除いた系において平均2乗変位は間期よりも大きかったことから,染色体の凝縮にともないコンデンシンがクロマチンの振動を抑制していることがわかった.
以上の結果から,分裂期において染色体を凝縮させるため,コンデンシンは間期におけるクロマチンの局所的な相互作用を遠距離の相互作用に置き換えると同時に,クロマチンの振動を抑制しドメイン構造を融合させることが明らかにされた(図2).
おわりに
塩基配列決定技術と3C法の発展によりクロマチンの空間配置が決定できるようになり,SMC複合体によるクロマチンのドメイン構造の形成が大きく注目されている.ドメイン構造の形成の分子機構として,DNAをSMC複合体のリングの内側へと押し出してループを形成するモデルと,SMC複合体どうしの相互作用によりDNAのループを形成するモデルの2つが提唱されている10,11).これまでのところ,押し出してループを形成するモデルが優位ではあるが,まだまだ議論の余地は残されている.Hi-C法により得られるデータはコンピューターモデリングと相性がいいため,超高解像度のデータを用いてこれら2つのモデルを詳細に検討することにより,その分子機構の解析が進むと予想される.また,クロマチンの振動がコンデンシンにより抑制されていたことから,クロマチンのポリマーとしての性質に注目することも染色体の凝縮の分子機構の解明において鍵をにぎるのではないだろうか.はじめて染色体の凝縮が詳細に記述されてから130年以上がたったが,その分子機構はまだまだ謎につつまれている.今後,さらなる解析をつうじてこのミクロな世界の壮大な謎の全容を解明したい.
文 献
- Hirano, T.: Condensin-based chromosome organization from bacteria to vertebrates. Cell, 164, 847-857 (2016)[PubMed]
- Uhlmann, F.: SMC complexes: from DNA to chromosomes. Nat. Rev. Mol. Cell Biol., 17, 399-412 (2016)[PubMed]
- Lieberman-Aiden, E., van Berkum, N. L., Williams, L. et al.: Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science, 326, 289-293 (2009)[PubMed]
- Dekker, J., Marti-Renom, M. A. & Mirny, L. A.: Exploring the three-dimensional organization of genomes: interpreting chromatin interaction data. Nat. Rev. Genet., 14, 390-403 (2013)[PubMed]
- Naumova, N., Imakaev, M., Fudenberg, G. et al.: Organization of the mitotic chromosome. Science, 342, 948-953 (2013)[PubMed]
- Mizuguchi, T., Fudenberg, G., Mehta, S. et al.: Cohesin-dependent globules and heterochromatin shape 3D genome architecture in S. pombe. Nature, 516, 432-435 (2014)[PubMed]
- Dixon, J. R., Selvaraj, S., Yue, F. et al.: Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature, 485, 376-380 (2012)[PubMed]
- Funabiki, H., Hagan, I., Uzawa, S. et al.: Cell cycle-dependent specific positioning and clustering of centromeres and telomeres in fission yeast. J. Cell Biol., 121, 961-976 (1993)[PubMed]
- Hiraoka, Y., Toda, T. & Yanagida, M.: The NDA3 gene of fission yeast encodes β-tubulin: a cold-sensitive nda3 mutation reversibly blocks spindle formation and chromosome movement in mitosis. Cell, 39, 349-358 (1984)[PubMed]
- Cheng, T. M., Heeger, S., Chaleil, R. A. et al.: A simple biophysical model emulates budding yeast chromosome condensation. Elife, 4, e05565 (2015)[PubMed]
- Fudenberg, G., Imakaev, M., Lu, C. et al.: Formation of chromosomal domains by loop extrusion. Cell Rep., 15, 2038-2049 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より英国Francis Crick Institute博士研究員.
研究テーマ:染色体の3次元構造および分裂期における凝縮.
抱負:生命現象のおもしろさをシンプルにわかりやすく伝えられるようにしたい.
© 2017 角井 康貢 Licensed under CC 表示 2.1 日本