霊長類モデルを用いたパーキンソン病に対するヒトのiPS細胞に由来するドーパミン神経前駆細胞の移植
菊地哲広・髙橋 淳
(京都大学iPS細胞研究所 臨床応用研究部門)
email:菊地哲広,髙橋 淳
DOI: 10.7875/first.author.2017.095
Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model.
Tetsuhiro Kikuchi, Asuka Morizane, Daisuke Doi, Hiroaki Magotani, Hirotaka Onoe, Takuya Hayashi, Hiroshi Mizuma, Sayuki Takara, Ryosuke Takahashi, Haruhisa Inoue, Satoshi Morita, Michio Yamamoto, Keisuke Okita, Masato Nakagawa, Malin Parmar, Jun Takahashi
Nature, 548, 592-596 (2017)
パーキンソン病においてはおもに中脳のドーパミンニューロンが障害されさまざまな運動症状が生じる.iPS細胞はパーキンソン病に対する細胞移植治療の細胞源として期待されるが,iPS細胞に由来するドーパミン神経前駆細胞を霊長類のパーキンソン病モデルに移植し長期間にわたり観察した研究はいまだない.今回,筆者らは,カニクイザルに薬剤を投与してパーキンソン病モデルを作製し,その脳にヒトのiPS細胞に由来するドーパミン神経前駆細胞を移植して,移植された細胞が脳に生着し機能することを確認した.行動の解析においては,サルパーキンソン病スコアによる評価およびビデオ解析による自動運動の評価により,スコアの改善および運動時間の増加が認められた.組織学的な解析においては,成熟したドーパミンニューロンが宿主の線条体に密な神経線維を伸ばすのが確認された.これらの結果は,健常人に由来するiPS細胞あるいはパーキンソン病の患者に由来するiPS細胞にかかわらず同様であった.観察の期間において,MRI法およびPET法により移植片の生着,増大,機能,また,宿主における免疫反応をモニターすることができ,少なくとも2年間にわたり腫瘍の形成は認められなかった.これらの結果から,ヒトのiPS細胞に由来するドーパミン神経前駆細胞はパーキンソン病の患者の治療に対し臨床応用が可能であることが示唆された.
パーキンソン病においてはおもに中脳のドーパミンニューロンが障害されさまざまな運動症状が生じる.その比較的単純な病態から,細胞移植治療の標的として研究が進められてきたが,その細胞源として注目されるのがES細胞やiPS細胞である.現在までに,ES細胞やiPS細胞から分化させた中脳のドーパミンニューロンを移植することにより,ラット1) や非ヒト霊長類のパーキンソン病モデル2) において行動の改善が報告されている.近年では,臨床応用の可能なドーパミンニューロンの分化を誘導する手法も報告されているが1,3-5),霊長類を用いて長期にわたり観察した研究はいまだない.今回,筆者らは,ヒトのiPS細胞から分化させたドーパミン神経前駆細胞の移植の有効性および安全性について調べるため,パーキンソン病モデルのカニクイザルの脳に移植し最長で2年間にわたり観察した.また,パーキンソン病の患者の90%以上は家族歴のない孤発性で,遺伝性の要因と環境要因とが影響して発症するといわれているが,パーキンソン病の患者に由来するiPS細胞についても潜在的にドーパミンニューロンへの分化やニューロンの機能が障害されている可能性がある.そこで,パーキンソン病の患者に由来するiPS細胞から分化させたドーパミンニューロンが,健常人に由来するドーパミンニューロンと同様に機能するかどうか移植の効果を比較した.
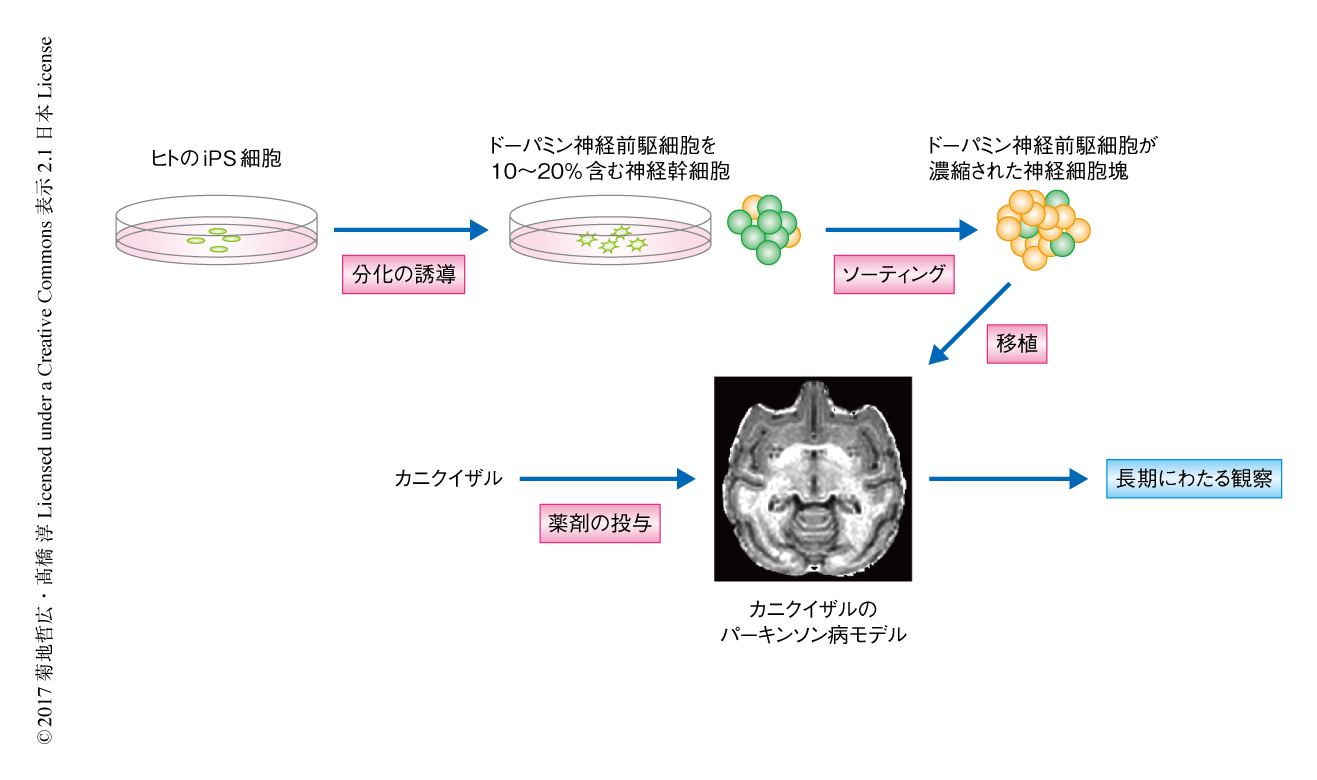
健常人4名より4株,パーキンソン病の患者3名より4株,計8株のiPS細胞を作製した.それらのiPS細胞よりドーパミンニューロンを分化させ,分化12日目に底板のマーカーであるCORINによりソーティングした.中脳のドーパミンニューロンは底板より発生するといわれており,この方法によりドーパミン神経前駆細胞を選別することが可能である.ソーティングした細胞は細胞塊の状態で浮遊培養し,分化28日目に評価したところ,およそ90%の細胞がTUJ-1およびFOXA2に共陽性の中脳のドーパミン神経前駆細胞であった(図1).ドーパミンニューロンへの分化の傾向において,健常人に由来するiPS細胞とパーキンソン病の患者に由来するiPS細胞とのあいだに有意な差は認められなかった.また,OCT4陽性の未分化なiPS細胞は認められなかった.
霊長類のパーキンソン病モデルとしては,中脳のドーパミンニューロンを選択的に障害する神経毒MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)を用いてパーキンソン病モデルのカニクイザルを作製した.このモデルサルは,振戦,固縮,寡動,姿勢反射障害など,ヒトのパーキンソン病の患者に似た運動症状を呈し,齧歯類と比べ行動の詳細な解析が可能である.作製したドーパミン神経前駆細胞をそれぞれ1匹のパーキンソン病のモデルサルの脳に1株ずつ,定位脳手術により両側の被殻に計4,800,000細胞を移植した(図1).免疫抑制のため,タクロリムスを移植の前日より安楽死まで筋肉注射した.
サルの神経症状を評価するためには,サルパーキンソン病スコアおよびビデオ解析による自動運動の解析の2種類の手法を用いた.サルパーキンソン病スコアは,表情,周囲をみわたす動作,自発運動,刺激に対する反応,振戦,姿勢の不安定性,歩行の7項目をそれぞれ0~3の4段階で評価し,合計0~21の22段階で神経症状をスコア化したもので,スコアが高いほど重症になる.移植後12カ月までの評価において,健常人に由来する細胞を移植したサルおよびパーキンソン病の患者に由来する細胞を移植したサルにおいてはスコアの有意な改善が認められたが,移植していないサルにおいてスコアの改善は認められなかった.また,健常人に由来する細胞とパーキンソン病の患者に由来する細胞とのあいだに有意な差は認められなかった.ビデオ解析においては,90分間にわたり撮影し移動の時間を計測した.その結果,細胞を移植したサルにおいては時間の経過とともに移動の時間が有意に増加したが,移植していないサルにおいて増加は認められなかった.
移植した細胞の安全性を確認するため,観察の経過においてMRI(magnetic resonance imaging,核磁気共鳴画像)法およびPET(positron emission tomography,陽電子放出断層撮影)法によりモニターした.移植片はMRIのT2強調画像において高信号域として描出されたが,それらは移植片の周囲の浮腫,移植片の内部への宿主の細胞の移動,移植片からの神経突起の伸展を含む可能性も考えられた.MRIの画像から機械的に移植片の体積を計測し時間の経過をみたところ,移植後6~9カ月までは増大の傾向にあったが,そののちはプラトーに達した.この移植片の体積の95%信頼区間を推定したところ,信頼上限のピークは最大のものでも5 mm四方より小さかった.組織学的な解析において,ヒトの細胞のマーカーであるSTEM121による染色により算出した移植片の体積は約40 mm3であり,移植片による正常な脳の圧迫が問題になる可能性は低いことが示された.また,ヘマトキシリン-エオジン染色により,移植片のロゼッタの形成,分裂像,核異型などの悪性の所見は認められなかった.また,Ki-67に陽性の分裂細胞も認められなかった.放射性同位体により標識したフルオロチミジンを投与しPET法を用いて増殖している細胞を検出したところ,いずれのサルにおいても認められず,組織学的な解析と合致する結果であった.
ドーパミンニューロンのマーカーであるチロシン水酸化酵素による染色により,すべての移植片においてチロシン水酸化酵素に陽性の細胞が生着していることが確認された.8頭中4頭においては神経突起の著明な伸展が認められた.いずれの移植片においても,チロシン水酸化酵素に陽性の細胞は大型で多くの神経突起をもち,中脳黒質のドーパミンニューロンに類似していた.生着したチロシン水酸化酵素に陽性の細胞の数は平均して1頭あたり130,000細胞であり,健常人に由来する細胞を移植したサルとパーキンソン病の患者に由来する細胞を移植したサルとのあいだに有意な差は認められなかった.これらのチロシン水酸化酵素に陽性の細胞は中脳のドーパミンニューロンのマーカーであるDATやA9型ドーパミンニューロンのマーカーであるGIRK2に陽性であり,目的とする中脳黒質のドーパミンニューロンに近い性質をもつことが示唆された.セロトニンニューロンのマーカーであるセロトニンや,そのほかのニューロンのマーカーであるGABA,VGRUT1,CHATによる染色により,陽性の細胞は認められないか,あってもごくわずか(1%以下)であった.パーキンソン病の患者の脳に特異的な病理所見であるLewy小体などの異常な所見は,いずれの移植片においても認められなかった.
移植された細胞がドーパミンニューロンとして機能しているかどうか確認するため,放射性同位体により標識したドーパを投与しPET法により測定する方法によりドーパミンの合成能について調べた.その結果,移植部位におけるドーパミンの合成能は,モデルサルにおいては正常なサルのおよそ10%に低下したが,移植ののち約48%にまで回復した.PETによるドーパの計測値と生着したチロシン水酸化酵素に陽性の細胞の数とのあいだには正の相関が認められ,ドーパミンニューロンの生着はPET法によりモニターできることが示唆された.また,移植する細胞の数の有効域を評価するため,生着したチロシン水酸化酵素に陽性の細胞の数とスコアの改善率および自動運動の増加量との相関について調べたが,チロシン水酸化酵素に陽性の細胞がもっとも少ない16,000細胞でも移植の効果としてはすでに飽和しており,チロシン水酸化酵素に陽性の細胞の増加にともない移植の効果がさらに増強されることはなかった.また,チロシン水酸化酵素に陽性の神経線維による線条体の被覆率とスコアの改善率および自動運動の増加量との相関についても検討したが,やはり,最低の被覆率である9.3%でも移植の効果としてはすでに飽和していた.
これまでの報告において,4300~13,000細胞のチロシン水酸化酵素に陽性の細胞があればパーキンソン病モデルのサルに行動の改善が認められるとされており2,6,7),今回の結果と矛盾するものではなかった.また,パーキンソン病に対する細胞移植治療として,胎児の組織から採取した中脳の組織を移植する胎児中脳組織移植が欧米を中心に行われているが,それらの臨床例において,症状が改善した患者の剖検脳に43,000~240,000細胞のチロシン水酸化酵素に陽性の細胞が認められたとの報告がある8-11).カニクイザルとヒトとの線条体の体積比が1:6.55であること考慮すると,サルにおける16,000細胞はヒトにおいて約100,000細胞に匹敵すると考えられ,今回の結果も妥当であると考えられた.また,サルのパーキンソン病モデルへのヒトの胎児中脳組織移植の実験において,サルパーキンソン病スコアについて40~60%の改善が報告されており12),今回の研究におけるスコアの改善率が約40~55%であることを考えると,ヒトのiPS細胞に由来するドーパミン神経前駆細胞の移植は胎児中脳組織移植とほぼ同等の効果があるといえた.
臨床試験においては,免疫抑制剤による副作用を最小限に抑えるため免疫反応をモニターして投与量を調節する必要があり,これらのPET法による検査が有用である.宿主の脳における免疫反応を2種類のリガンドを用いたPET法によりモニターしたところ,上昇は認められなかった.組織学的な解析においては,MHCクラスII分子の免疫染色にて一部のサルで多くの陽性細胞が認められたが,それらのサルにおいてもリンパ球や免疫グロブリンの沈着はほとんど認められず,タクロリムスの投与により免疫反応は効果的に抑えられていたことが示唆された.
生着したチロシン水酸化酵素に陽性の細胞の数はサルのあいだでばらつきがあり,移植した細胞の未知の性質が生着に影響したことが考えられた.その性質について調べるため,移植に用いた細胞における遺伝子の発現をマイクロアレイ法により網羅的に測定した.遺伝子発現プロファイルを解析したところ,未分化なiPS細胞,胎児の中脳細胞,成人の中脳黒質細胞を含む主成分分析において,移植した細胞は胎児の中脳細胞の近傍に位置し,未分化なiPS細胞および成人の中脳黒質細胞とは離れていた.
今回の研究においては,移植に用いた細胞株はおのおののドナーよりランダムに選択したが,臨床においては,最良の株を選択することにより生着した細胞のばらつきを抑制できる可能性がある.そのため,優良な移植細胞のマーカー遺伝子があれば有用である.この点について調べるため,移植した細胞を,生着したチロシン水酸化酵素に陽性の細胞の数,チロシン水酸化酵素に陽性の神経線維の伸展,PET法により測定したドーパミンの合成能,にもとづき優良な細胞と不良な細胞とに分け,遺伝子の発現をマイクロアレイ法により網羅的に測定し比較した.その結果,優良な移植細胞に多く発現する遺伝子の候補として11個の遺伝子が選出された.最近,ヒトのES細胞に由来するドーパミン神経前駆細胞をパーキンソン病モデルのラットに移植し良好な結果と相関するマーカー遺伝子を調べた研究が報告されたが13),選出された11個の遺伝子にはそのひとつであるDlk1遺伝子が含まれていた.Dlk1は上皮成長因子スーパーファミリーに属し,マウスの脳において胎生11.5日より中脳腹側において発現し,中脳のドーパミンニューロンの発生において重要な役割をはたす可能性が示唆されている.Dlk1遺伝子が優良な移植細胞のマーカーとして使えるのかどうか,さらなる研究が必要である.
この研究においては,パーキンソン病に対する細胞移植の非臨床試験のプロトコールを霊長類モデルに対して適用し,長期にわたり経過を観察することによりヒトのiPS細胞に由来するドーパミン神経前駆細胞の移植の安全性および有効性について確認した.また,健常人あるいはパーキンソン病の患者に由来するいずれのドーパミン神経前駆細胞を移植した場合も,脳において高い安全性をもって機能することが確認された.
基礎研究の成果をどのような過程をへて臨床につなげ,さらに治療法として確立させるかは,医学の研究において大きな課題である.この研究は,この課題に対する筆者らなりの回答である.げっ歯類を用いた実験の結果は必ずしも臨床の成績に反映されない.筆者らは,霊長類モデルを用いて実際の臨床と同様に細胞移植治療を実施し,組織学的な解析も含めその有効性および安全性を検証した.これらの成果にもとづき,つぎは実際のパーキンソン病の患者に対する治験を予定している.
略歴:2012年 京都大学大学院医学研究科後期博士課程 修了,同年より京都大学iPS細胞研究所 特定研究員.
研究テーマ:iPS細胞を用いた細胞移植治療.
髙橋 淳(Jun Takahashi)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/jtakahashi/
© 2017 菊地哲広・髙橋 淳 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 臨床応用研究部門)
email:菊地哲広,髙橋 淳
DOI: 10.7875/first.author.2017.095
Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model.
Tetsuhiro Kikuchi, Asuka Morizane, Daisuke Doi, Hiroaki Magotani, Hirotaka Onoe, Takuya Hayashi, Hiroshi Mizuma, Sayuki Takara, Ryosuke Takahashi, Haruhisa Inoue, Satoshi Morita, Michio Yamamoto, Keisuke Okita, Masato Nakagawa, Malin Parmar, Jun Takahashi
Nature, 548, 592-596 (2017)
要 約
パーキンソン病においてはおもに中脳のドーパミンニューロンが障害されさまざまな運動症状が生じる.iPS細胞はパーキンソン病に対する細胞移植治療の細胞源として期待されるが,iPS細胞に由来するドーパミン神経前駆細胞を霊長類のパーキンソン病モデルに移植し長期間にわたり観察した研究はいまだない.今回,筆者らは,カニクイザルに薬剤を投与してパーキンソン病モデルを作製し,その脳にヒトのiPS細胞に由来するドーパミン神経前駆細胞を移植して,移植された細胞が脳に生着し機能することを確認した.行動の解析においては,サルパーキンソン病スコアによる評価およびビデオ解析による自動運動の評価により,スコアの改善および運動時間の増加が認められた.組織学的な解析においては,成熟したドーパミンニューロンが宿主の線条体に密な神経線維を伸ばすのが確認された.これらの結果は,健常人に由来するiPS細胞あるいはパーキンソン病の患者に由来するiPS細胞にかかわらず同様であった.観察の期間において,MRI法およびPET法により移植片の生着,増大,機能,また,宿主における免疫反応をモニターすることができ,少なくとも2年間にわたり腫瘍の形成は認められなかった.これらの結果から,ヒトのiPS細胞に由来するドーパミン神経前駆細胞はパーキンソン病の患者の治療に対し臨床応用が可能であることが示唆された.
はじめに
パーキンソン病においてはおもに中脳のドーパミンニューロンが障害されさまざまな運動症状が生じる.その比較的単純な病態から,細胞移植治療の標的として研究が進められてきたが,その細胞源として注目されるのがES細胞やiPS細胞である.現在までに,ES細胞やiPS細胞から分化させた中脳のドーパミンニューロンを移植することにより,ラット1) や非ヒト霊長類のパーキンソン病モデル2) において行動の改善が報告されている.近年では,臨床応用の可能なドーパミンニューロンの分化を誘導する手法も報告されているが1,3-5),霊長類を用いて長期にわたり観察した研究はいまだない.今回,筆者らは,ヒトのiPS細胞から分化させたドーパミン神経前駆細胞の移植の有効性および安全性について調べるため,パーキンソン病モデルのカニクイザルの脳に移植し最長で2年間にわたり観察した.また,パーキンソン病の患者の90%以上は家族歴のない孤発性で,遺伝性の要因と環境要因とが影響して発症するといわれているが,パーキンソン病の患者に由来するiPS細胞についても潜在的にドーパミンニューロンへの分化やニューロンの機能が障害されている可能性がある.そこで,パーキンソン病の患者に由来するiPS細胞から分化させたドーパミンニューロンが,健常人に由来するドーパミンニューロンと同様に機能するかどうか移植の効果を比較した.
1.健常人およびパーキンソン病の患者に由来するiPS細胞からのドーパミン神経前駆細胞の分化
健常人4名より4株,パーキンソン病の患者3名より4株,計8株のiPS細胞を作製した.それらのiPS細胞よりドーパミンニューロンを分化させ,分化12日目に底板のマーカーであるCORINによりソーティングした.中脳のドーパミンニューロンは底板より発生するといわれており,この方法によりドーパミン神経前駆細胞を選別することが可能である.ソーティングした細胞は細胞塊の状態で浮遊培養し,分化28日目に評価したところ,およそ90%の細胞がTUJ-1およびFOXA2に共陽性の中脳のドーパミン神経前駆細胞であった(図1).ドーパミンニューロンへの分化の傾向において,健常人に由来するiPS細胞とパーキンソン病の患者に由来するiPS細胞とのあいだに有意な差は認められなかった.また,OCT4陽性の未分化なiPS細胞は認められなかった.
2.ドーパミン神経前駆細胞の移植によりパーキンソン病モデルのサルの行動は改善する
霊長類のパーキンソン病モデルとしては,中脳のドーパミンニューロンを選択的に障害する神経毒MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)を用いてパーキンソン病モデルのカニクイザルを作製した.このモデルサルは,振戦,固縮,寡動,姿勢反射障害など,ヒトのパーキンソン病の患者に似た運動症状を呈し,齧歯類と比べ行動の詳細な解析が可能である.作製したドーパミン神経前駆細胞をそれぞれ1匹のパーキンソン病のモデルサルの脳に1株ずつ,定位脳手術により両側の被殻に計4,800,000細胞を移植した(図1).免疫抑制のため,タクロリムスを移植の前日より安楽死まで筋肉注射した.
サルの神経症状を評価するためには,サルパーキンソン病スコアおよびビデオ解析による自動運動の解析の2種類の手法を用いた.サルパーキンソン病スコアは,表情,周囲をみわたす動作,自発運動,刺激に対する反応,振戦,姿勢の不安定性,歩行の7項目をそれぞれ0~3の4段階で評価し,合計0~21の22段階で神経症状をスコア化したもので,スコアが高いほど重症になる.移植後12カ月までの評価において,健常人に由来する細胞を移植したサルおよびパーキンソン病の患者に由来する細胞を移植したサルにおいてはスコアの有意な改善が認められたが,移植していないサルにおいてスコアの改善は認められなかった.また,健常人に由来する細胞とパーキンソン病の患者に由来する細胞とのあいだに有意な差は認められなかった.ビデオ解析においては,90分間にわたり撮影し移動の時間を計測した.その結果,細胞を移植したサルにおいては時間の経過とともに移動の時間が有意に増加したが,移植していないサルにおいて増加は認められなかった.
3.MRI法およびPET法による生体における移植片のモニター
移植した細胞の安全性を確認するため,観察の経過においてMRI(magnetic resonance imaging,核磁気共鳴画像)法およびPET(positron emission tomography,陽電子放出断層撮影)法によりモニターした.移植片はMRIのT2強調画像において高信号域として描出されたが,それらは移植片の周囲の浮腫,移植片の内部への宿主の細胞の移動,移植片からの神経突起の伸展を含む可能性も考えられた.MRIの画像から機械的に移植片の体積を計測し時間の経過をみたところ,移植後6~9カ月までは増大の傾向にあったが,そののちはプラトーに達した.この移植片の体積の95%信頼区間を推定したところ,信頼上限のピークは最大のものでも5 mm四方より小さかった.組織学的な解析において,ヒトの細胞のマーカーであるSTEM121による染色により算出した移植片の体積は約40 mm3であり,移植片による正常な脳の圧迫が問題になる可能性は低いことが示された.また,ヘマトキシリン-エオジン染色により,移植片のロゼッタの形成,分裂像,核異型などの悪性の所見は認められなかった.また,Ki-67に陽性の分裂細胞も認められなかった.放射性同位体により標識したフルオロチミジンを投与しPET法を用いて増殖している細胞を検出したところ,いずれのサルにおいても認められず,組織学的な解析と合致する結果であった.
4.組織学的な解析によるドーパミンニューロンの生着の確認
ドーパミンニューロンのマーカーであるチロシン水酸化酵素による染色により,すべての移植片においてチロシン水酸化酵素に陽性の細胞が生着していることが確認された.8頭中4頭においては神経突起の著明な伸展が認められた.いずれの移植片においても,チロシン水酸化酵素に陽性の細胞は大型で多くの神経突起をもち,中脳黒質のドーパミンニューロンに類似していた.生着したチロシン水酸化酵素に陽性の細胞の数は平均して1頭あたり130,000細胞であり,健常人に由来する細胞を移植したサルとパーキンソン病の患者に由来する細胞を移植したサルとのあいだに有意な差は認められなかった.これらのチロシン水酸化酵素に陽性の細胞は中脳のドーパミンニューロンのマーカーであるDATやA9型ドーパミンニューロンのマーカーであるGIRK2に陽性であり,目的とする中脳黒質のドーパミンニューロンに近い性質をもつことが示唆された.セロトニンニューロンのマーカーであるセロトニンや,そのほかのニューロンのマーカーであるGABA,VGRUT1,CHATによる染色により,陽性の細胞は認められないか,あってもごくわずか(1%以下)であった.パーキンソン病の患者の脳に特異的な病理所見であるLewy小体などの異常な所見は,いずれの移植片においても認められなかった.
5.PET法による移植された細胞の機能のモニター
移植された細胞がドーパミンニューロンとして機能しているかどうか確認するため,放射性同位体により標識したドーパを投与しPET法により測定する方法によりドーパミンの合成能について調べた.その結果,移植部位におけるドーパミンの合成能は,モデルサルにおいては正常なサルのおよそ10%に低下したが,移植ののち約48%にまで回復した.PETによるドーパの計測値と生着したチロシン水酸化酵素に陽性の細胞の数とのあいだには正の相関が認められ,ドーパミンニューロンの生着はPET法によりモニターできることが示唆された.また,移植する細胞の数の有効域を評価するため,生着したチロシン水酸化酵素に陽性の細胞の数とスコアの改善率および自動運動の増加量との相関について調べたが,チロシン水酸化酵素に陽性の細胞がもっとも少ない16,000細胞でも移植の効果としてはすでに飽和しており,チロシン水酸化酵素に陽性の細胞の増加にともない移植の効果がさらに増強されることはなかった.また,チロシン水酸化酵素に陽性の神経線維による線条体の被覆率とスコアの改善率および自動運動の増加量との相関についても検討したが,やはり,最低の被覆率である9.3%でも移植の効果としてはすでに飽和していた.
これまでの報告において,4300~13,000細胞のチロシン水酸化酵素に陽性の細胞があればパーキンソン病モデルのサルに行動の改善が認められるとされており2,6,7),今回の結果と矛盾するものではなかった.また,パーキンソン病に対する細胞移植治療として,胎児の組織から採取した中脳の組織を移植する胎児中脳組織移植が欧米を中心に行われているが,それらの臨床例において,症状が改善した患者の剖検脳に43,000~240,000細胞のチロシン水酸化酵素に陽性の細胞が認められたとの報告がある8-11).カニクイザルとヒトとの線条体の体積比が1:6.55であること考慮すると,サルにおける16,000細胞はヒトにおいて約100,000細胞に匹敵すると考えられ,今回の結果も妥当であると考えられた.また,サルのパーキンソン病モデルへのヒトの胎児中脳組織移植の実験において,サルパーキンソン病スコアについて40~60%の改善が報告されており12),今回の研究におけるスコアの改善率が約40~55%であることを考えると,ヒトのiPS細胞に由来するドーパミン神経前駆細胞の移植は胎児中脳組織移植とほぼ同等の効果があるといえた.
6.宿主の免疫反応のPET法によるモニター
臨床試験においては,免疫抑制剤による副作用を最小限に抑えるため免疫反応をモニターして投与量を調節する必要があり,これらのPET法による検査が有用である.宿主の脳における免疫反応を2種類のリガンドを用いたPET法によりモニターしたところ,上昇は認められなかった.組織学的な解析においては,MHCクラスII分子の免疫染色にて一部のサルで多くの陽性細胞が認められたが,それらのサルにおいてもリンパ球や免疫グロブリンの沈着はほとんど認められず,タクロリムスの投与により免疫反応は効果的に抑えられていたことが示唆された.
7.マイクロアレイ法による優良な移植細胞のマーカーとなる遺伝子の探索
生着したチロシン水酸化酵素に陽性の細胞の数はサルのあいだでばらつきがあり,移植した細胞の未知の性質が生着に影響したことが考えられた.その性質について調べるため,移植に用いた細胞における遺伝子の発現をマイクロアレイ法により網羅的に測定した.遺伝子発現プロファイルを解析したところ,未分化なiPS細胞,胎児の中脳細胞,成人の中脳黒質細胞を含む主成分分析において,移植した細胞は胎児の中脳細胞の近傍に位置し,未分化なiPS細胞および成人の中脳黒質細胞とは離れていた.
今回の研究においては,移植に用いた細胞株はおのおののドナーよりランダムに選択したが,臨床においては,最良の株を選択することにより生着した細胞のばらつきを抑制できる可能性がある.そのため,優良な移植細胞のマーカー遺伝子があれば有用である.この点について調べるため,移植した細胞を,生着したチロシン水酸化酵素に陽性の細胞の数,チロシン水酸化酵素に陽性の神経線維の伸展,PET法により測定したドーパミンの合成能,にもとづき優良な細胞と不良な細胞とに分け,遺伝子の発現をマイクロアレイ法により網羅的に測定し比較した.その結果,優良な移植細胞に多く発現する遺伝子の候補として11個の遺伝子が選出された.最近,ヒトのES細胞に由来するドーパミン神経前駆細胞をパーキンソン病モデルのラットに移植し良好な結果と相関するマーカー遺伝子を調べた研究が報告されたが13),選出された11個の遺伝子にはそのひとつであるDlk1遺伝子が含まれていた.Dlk1は上皮成長因子スーパーファミリーに属し,マウスの脳において胎生11.5日より中脳腹側において発現し,中脳のドーパミンニューロンの発生において重要な役割をはたす可能性が示唆されている.Dlk1遺伝子が優良な移植細胞のマーカーとして使えるのかどうか,さらなる研究が必要である.
おわりに
この研究においては,パーキンソン病に対する細胞移植の非臨床試験のプロトコールを霊長類モデルに対して適用し,長期にわたり経過を観察することによりヒトのiPS細胞に由来するドーパミン神経前駆細胞の移植の安全性および有効性について確認した.また,健常人あるいはパーキンソン病の患者に由来するいずれのドーパミン神経前駆細胞を移植した場合も,脳において高い安全性をもって機能することが確認された.
基礎研究の成果をどのような過程をへて臨床につなげ,さらに治療法として確立させるかは,医学の研究において大きな課題である.この研究は,この課題に対する筆者らなりの回答である.げっ歯類を用いた実験の結果は必ずしも臨床の成績に反映されない.筆者らは,霊長類モデルを用いて実際の臨床と同様に細胞移植治療を実施し,組織学的な解析も含めその有効性および安全性を検証した.これらの成果にもとづき,つぎは実際のパーキンソン病の患者に対する治験を予定している.
文 献
- Kriks, S., Shim, J. W., Piao, J. et al.: Dopamine neurons derived from human ES cells efficiently engraft in animal models of Parkinson's disease. Nature, 480, 547-551 (2011)[PubMed]
- Doi, D., Morizane, A., Kikuchi, T. et al.: Prolonged maturation culture favors a reduction in the tumorigenicity and the dopaminergic function of human ESC-derived neural cells in a primate model of Parkinson's disease. Stem Cells, 30, 935-945 (2012)[PubMed]
- Doi, D., Samata, B., Katsukawa, M. et al.: Isolation of human induced pluripotent stem cell-derived dopaminergic progenitors by cell sorting for successful transplantation. Stem Cell Reports, 2, 337-350 (2014)[PubMed]
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P. et al.: Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat. Biotechnol., 27, 275-280 (2009)[PubMed]
- Kirkeby, A., Grealish, S., Wolf, D. A. et al.: Generation of regionally specified neural progenitors and functional neurons from human embryonic stem cells under defined conditions. Cell Rep., 1, 703-714 (2012)[PubMed]
- Takagi, Y., Takahashi, J., Saiki, H. et al.: Dopaminergic neurons generated from monkey embryonic stem cells function in a Parkinson primate model. J. Clin. Invest., 115, 102-109 (2005)[PubMed]
- Hallett, P. J., Deleidi, M., Astradsson, A. et al.: Successful function of autologous iPSC-derived dopamine neurons following transplantation in a non-human primate model of Parkinson's disease. Cell Stem Cell, 16, 269-274 (2015)[PubMed]
- Freed, C.R., Greene, P. E., Breeze, R. E. et al.: Transplantation of embryonic dopamine neurons for severe Parkinson's disease. N. Engl. J. Med., 344, 710-719 (2001)[PubMed]
- Olanow, C. W., Goetz, C. G., Kordower, J. H. et al.: A double-blind controlled trial of bilateral fetal nigral transplantation in Parkinson's disease. Ann. Neurol., 54, 403-414 (2003)[PubMed]
- Kurowska, Z., Englund, E., Widner, H. et al.: Signs of degeneration in 12-22-year old grafts of mesencephalic dopamine neurons in patients with Parkinson's disease. J. Parkinsons Dis., 1, 83-92 (2011)[PubMed]
- Li, W., Englund, E., Widner, H. et al.: Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proc. Natl. Acad. Sci. USA, 113, 6544-6549 (2016)[PubMed]
- Redmond, D. E. Jr., Vinuela, A., Kordower, J. H. et al.: Influence of cell preparation and target location on the behavioral recovery after striatal transplantation of fetal dopaminergic neurons in a primate model of Parkinson's disease. Neurobiol. Dis. 29, 103-116 (2008)[PubMed]
- Kirkeby, A., Nolbrant, S., Tiklova, K. et al.: Predictive markers guide differentiation to improve graft outcome in clinical translation of hESC-based therapy for Parkinson's disease. Cell Stem Cell, 20, 135-148 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 京都大学大学院医学研究科後期博士課程 修了,同年より京都大学iPS細胞研究所 特定研究員.
研究テーマ:iPS細胞を用いた細胞移植治療.
髙橋 淳(Jun Takahashi)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/jtakahashi/
© 2017 菊地哲広・髙橋 淳 Licensed under CC 表示 2.1 日本