Foxp3の変異体の解析から明らかにされた制御性T細胞における転写因子BATFの重要な役割
堀 昌平・早津徳人・宮尾貴久
(理化学研究所統合生命医科学研究センター 免疫恒常性研究チーム)
email:堀 昌平
DOI: 10.7875/first.author.2017.094
Analyses of a mutant Foxp3 allele reveal BATF as a critical transcription factor in the differentiation and accumulation of tissue regulatory T cells.
Norihito Hayatsu, Takahisa Miyao, Masashi Tachibana, Ryuichi Murakami, Akihiko Kimura, Takako Kato, Eiryo Kawakami, Takaho A. Endo, Ruka Setoguchi, Hiroshi Watarai, Takeshi Nishikawa, Takuwa Yasuda, Hisahiro Yoshida, Shohei Hori
Immunity, 47, 268-283.e9 (2017)
制御性T細胞は免疫寛容の確立および維持に必須の役割を担う.Foxp3遺伝子はヒトの自己免疫疾患であるIPEX症候群の原因遺伝子として同定され,Foxp3は転写因子として制御性T細胞の分化および機能を制御するが,その分子機構は不明である.この研究において,筆者らは,IPEX症候群において同定されたFoxp3遺伝子の変異に着目し,変異を導入した遺伝子改変マウスを作製して制御性T細胞における遺伝子の発現および機能におよぼす影響について解析した.Foxp3のIle363がValに置換した変異およびArg397がTrpに置換した変異は機能欠失型の変異であり,制御性T細胞における遺伝子の発現および機能を全体的に障害することによりさまざまな臓器において炎症を惹起した.一方,Foxp3のAla384がThrに置換した変異はDNAとの結合の特異性を拡大する機能獲得型の変異であり,特定の標的遺伝子との結合が乱れることにより特定の非リンパ組織において制御性T細胞の機能を障害し炎症を惹起した.この組織における制御性T細胞の機能の障害はAla384がThrに置換したFoxp3変異体による転写因子BATFの発現の抑制に起因した.以上の結果から,制御性T細胞におけるBATFの重要な役割について明らかにされると同時に,Foxp3とDNAとの相互作用を乱すような遺伝子多型が自己免疫疾患に対する感受性を賦与する可能性が示唆された.
免疫系には免疫応答を抑制する機能をもつ制御性T細胞とよばれるT細胞のサブセットが存在し,自己免疫,炎症,アレルギーといったさまざまな病的な免疫応答を制御することにより免疫寛容において必須の役割を担う.一方,制御性T細胞はがん細胞に対する免疫応答も抑制し,がんの成長に寄与すると考えられている1).Scurfy変異マウスおよびヒトの自己免疫疾患であるIPEX症候群の患者に発症する致死的な自己免疫疾患の原因遺伝子として同定されたFoxp3遺伝子は制御性T細胞に選択的に発現し,Foxp3は制御性T細胞の分化および機能を制御するマスター転写因子として機能する2-4).Foxp3は制御性T細胞の分子ネットワークにおけるハブであり,数千におよぶゲノムの領域および300をこえる転写制御因子と相互作用することにより制御性T細胞における遺伝子の発現を制御する5,6).しかしながら,Foxp3の標的遺伝子は多数あるため,どの遺伝子が制御性T細胞のどのような性質を制御するのか十分には理解されていない.
そこで,筆者らは,IPEX症候群においてみつかったFoxp3遺伝子の変異のなかに特定の標的遺伝子の発現に影響し制御性T細胞の機能を障害する変異があるのではないかと考え,DNA結合ドメインであるフォークヘッドドメインに存在しDNAとの相互作用に影響すると考えられる3種類のミスセンス変異に着目して,これらの変異が制御性T細胞における遺伝子の発現および機能におよぼす影響について解析した.
Foxp3のフォークヘッドドメインに存在する3種類のミスセンス変異,Ile363のValへの置換(I363V変異),Ala384のThrへの置換(A384T変異),Arg397のTrpへの置換(R397W変異)が,制御性T細胞の分化あるいは機能におよぼす影響について個体のレベルで明らかにするため,Foxp3遺伝子座に変異を導入したノックインマウスを作製した.同時に,3’側非翻訳領域にレポーター遺伝子を導入し,野生型のFoxp3あるいはFoxp3の変異体を発現する制御性T細胞を同定できるようにした.胸腺および末梢のリンパ組織においてI363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞の割合は野生型Foxp3を発現する制御性T細胞と比較して低下した.一方,A384T変異Foxp3を発現する制御性T細胞は胸腺においては減少せず,末梢のリンパ組織においては軽度に減少した.したがって,Foxp3のI363V変異およびR397W変異は制御性T細胞の胸腺における分化および末梢における恒常性を障害するのに対し,A384T変異は末梢における恒常性のみを選択的に障害すると考えられた.
Foxp3の3種類のミスセンス変異が制御性T細胞における遺伝子の発現におよぼす影響についてマイクロアレイ解析により調べたところ,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞の遺伝子発現プロファイルは野生型Foxp3を発現する制御性T細胞とは大きく異なり,Foxp3陰性CD4陽性T細胞により近い遺伝子の発現パターンを示した.一方,A384T変異Foxp3を発現する制御性T細胞は野生型Foxp3を発現する制御性T細胞ともっとも近い遺伝子発現プロファイルを示したが,一部の遺伝子は野生型Foxp3を発現する制御性T細胞とは異なる遺伝子の発現パターンを示した.マイクロアレイ解析の結果と一致して,制御性T細胞の代表的なマーカーであるCD25あるいはCTLA4の発現は,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においては低下したのに対し,A384T変異Foxp3を発現する制御性T細胞においては低下しなかった.一方,制御性T細胞において発現の抑制されるインターロイキン2あるいはインターロイキン17といったサイトカインは,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においては発現が脱抑制されたのに対し,A384T変異Foxp3を発現する制御性T細胞においては発現が脱抑制されなかった.制御性T細胞はin vitroにおいてFoxp3陰性CD4陽性T細胞の増殖を抑制することが知られているが,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においてはこの抑制の活性が障害されたが,A384T変異Foxp3を発現する制御性T細胞において抑制の活性は障害されなかった.
以上の結果から,Foxp3のI363V変異およびR397W変異は機能を全体的に障害する機能欠失型の変異であることがわかった.一方,A384T変異は一部のFoxp3に依存的な遺伝子の発現を選択的に障害するユニークな変異であった.
Foxp3の3種類のミスセンス変異が免疫寛容を破綻させるかどうか検討した.I363V変異Foxp3あるいはR397W変異Foxp3を発現するマウスにおいては,皮膚,肺,肝臓などさまざまな組織に炎症性の細胞の浸潤がみられ,インターフェロンγを産生するTh1細胞およびインターロイキン4を産生するTh2細胞の集積がみられた.一方,A384T変異Foxp3を発現するマウスにおいても皮膚,肺,大腸などの組織に炎症性の細胞の浸潤がみられたが,肝臓には炎症はみられなかった.また,Th2細胞およびインターロイキン17を産生するTh17細胞が選択的に集積した.以上の結果から,Foxp3のA384T変異はI363V変異あるいはR397W変異とは異なり,組織に選択的かつTh2応答およびTh17応答にかたよった自己免疫疾患を惹起することが明らかにされた.
Foxp3のA384T変異は自己免疫疾患を惹起することから,特定の標的遺伝子の発現を乱すことにより制御性T細胞の生体におけるなんらかの機能を障害しているはずである.では,この変異は制御性T細胞のどのような機能的な側面を障害するのだろうか? 野生型Foxp3を発現する制御性T細胞とA384T変異Foxp3を発現する制御性T細胞とが共存した環境において,A384T変異Foxp3を発現する制御性T細胞の割合が非リンパ組織においていちじるしく低下した.T細胞は一般的に,リンパ組織を巡回するナイーブ型と,非リンパ組織に局在するエフェクター・メモリー型とに大別され,ナイーブ型T細胞が抗原の刺激をうけて活性化され,エフェクター・メモリー型T細胞に分化し免疫応答の場である非リンパ組織へと移行することが知られている.A384T変異Foxp3を発現する制御性T細胞の非リンパ組織における選択的な減少はエフェクター・メモリー型のサブセットの欠損によるものであり,ナイーブ型のサブセットは変異により影響をうけていなかった.自己免疫疾患を発症したA384T変異Foxp3を発現するマウスにおいては,皮膚,肺,大腸といった炎症を起こす組織においてのみエフェクター・メモリー型の制御性T細胞の割合が低下しており,逆に,炎症を起こすエフェクター・メモリー型のヘルパーT細胞の割合が増加していた.一方,炎症の起こらない肝臓においてはこのような制御性T細胞とヘルパーT細胞とのアンバランスはみられなかった.以上の結果から,Foxp3のA384T変異はナイーブ型の制御性T細胞がエフェクター・メモリー型の制御性T細胞へと分化して非リンパ組織に集積する機能を障害し,そのため,組織において制御性T細胞が欠損し非リンパ組織における免疫制御が破綻すると考えられた.
なぜA384T変異Foxp3を発現するマウスは組織に選択的かつTh2応答およびTh17応答にかたよった自己免疫疾患を発症するのだろうか? 近年,エフェクター・メモリー型の制御性T細胞はヘルパーT細胞と同様に不均一な集団であり,Tbet,GATA3,RORγtといったヘルパーT細胞のサブセットの分化を制御するマスター転写因子や,ヘルパーT細胞のサブセットの機能において重要なサイトカイン受容体やケモカイン受容体の発現により,多様なサブセットに分けられることが明らかにされてきた.そして,それらヘルパーT細胞に関連するタンパク質を利用して対応するヘルパーT細胞のサブセットと同じ環境に集積し,その機能を抑制すると考えられている7).A384T変異Foxp3を発現する制御性T細胞においては,Th2細胞に選択的に発現するGATA3,ST2,CCR4といったタンパク質の発現が低下する一方,Th1細胞に選択的に発現するTbet,CXCR3といったタンパク質の発現は低下していなかった.Th17細胞に選択的に発現するRORγt,CCR4,CCR6についてはCCR4の発現だけが低下していた.このことから,A384T変異Foxp3を発現する制御性T細胞においては,GATA3,ST2,CCR4の発現が低下するためTh2細胞およびTh17細胞がはたらく環境に集積することができず,Th2細胞およびTh17細胞の制御が選択的に破綻すると考えられた.
また,肝臓においてはGATA3,ST2,CCR4を発現する制御性T細胞,Th2細胞,Th17細胞はほかの組織よりマイナーなサブセットであり,逆に,Tbet,CXCR3を発現する制御性T細胞およびTh1細胞が主要なサブセットであった.したがって,肝臓においてはGATA3,ST2,CCR4の発現の低下によるTh2細胞あるいはTh17細胞の制御の破綻の影響がほかの組織よりも小さく,そのため炎症がほとんど起こらないと考えられた.
Foxp3のA384T変異により,どの標的遺伝子の発現が障害され制御性T細胞において異常がひき起こされるのであろうか? マイクロアレイ解析およびFoxp3のChIP-seq解析により,野生型Foxp3を発現する制御性T細胞と比較してA384T変異Foxp3を発現する制御性T細胞において発現が変化し,かつ,Foxp3との結合が変化する標的遺伝子を探索した.その結果,A384T変異Foxp3を発現する制御性T細胞において発現が低下しFoxp3との結合が強まる遺伝子として,AP-1転写因子ファミリーに属する転写因子BATFをコードするBatf遺伝子が同定された.BATFはTh2細胞やTh17細胞などのエフェクター・メモリー型のT細胞の分化および機能に必須の転写因子であることから8),これらのヘルパーT細胞を抑制するエフェクター・メモリー型の制御性T細胞のサブセットの分化および機能においてもBATFが重要であるとの仮説をたてた.
この仮説を検証するため,BATFノックアウトマウスにおいて制御性T細胞の性状を解析した.マイクロアレイ解析により遺伝子の発現について調べた結果,BATFを欠損した制御性T細胞はA384T変異Foxp3を発現する制御性T細胞と類似した遺伝子発現プロファイルを示した.また,同様にエフェクター・メモリー型のサブセットを欠損しており,とくにGATA3,ST2,CCR4を発現するサブセットが選択的に減少していた.さらに,A384T変異Foxp3を発現するマウスから単離した脾臓およびリンパ節細胞をリンパ球を欠損したマウスに移入することにより大腸炎を発症させる系を用いて,生体における免疫抑制機能について評価した.その結果,野生型Foxp3を発現する制御性T細胞は大腸炎の発症を阻止したのに対し,A384T変異Foxp3を発現する制御性T細胞,および,BATFを欠損した制御性T細胞は発症を阻止しなかった.以上の結果から,BATFを欠損した制御性T細胞は表現型および機能の両面においてA384T変異Foxp3を発現する制御性T細胞に類似することが明らかにされた.
仮説を検証する2つ目のアプローチとして,レトロウイルスベクターを用いてA384T変異Foxp3を発現する制御性T細胞にBATFを強制発現させた.その結果,A384T変異Foxp3を発現する制御性T細胞は大腸炎の抑制能を回復し,大腸におけるエフェクター・メモリー型の制御性T細胞,とくにGATA3,CCR4を発現するサブセットの割合が上昇した.
以上の結果から,A384T変異Foxp3を発現する制御性T細胞の機能の異常の一因は,転写因子BATFの発現の低下にあることが明らかにされた.
なぜFoxp3のA384T変異によりBatf遺伝子遺伝子を含む特定の標的遺伝子の発現が障害されるのであろうか? Foxp3のChIP-seq解析のデータを用いて,野生型Foxp3あるいはA384T変異Foxp3を発現する制御性T細胞においてFoxp3が選択的に結合するゲノム領域にどのような転写因子との結合モチーフが存在するか調べた.その結果,野生型Foxp3を発現する制御性T細胞に選択的なFoxp3との結合領域には有意な結合モチーフは検出されなかったが,A384T変異Foxp3を発現する制御性T細胞に選択的なFoxp3との結合領域にフォークヘッド転写因子結合配列と類似した配列が有意に多く存在した.このことから,Foxp3においてDNA結合ドメインであるフォークヘッドドメインに存在するA384T変異はDNAとの結合の特異性を変化させる可能性が示唆された.そこで,種々のフォークヘッド転写因子結合配列に対するFoxp3変異体の結合活性についてゲルシフトアッセイにより解析した.その結果,いくつかのフォークヘッド転写因子結合配列に対しては野生型Foxp3およびA384T変異Foxp3は同じ程度の結合活性を呈したが,そのほかのフォークヘッド転写因子結合配列に対してはA384T変異Foxp3のみが結合した.このことから,Foxp3のA384T変異はフォークヘッド転写因子結合配列に対し結合の特異性を拡大する機能獲得型の変異であることがわかった.一方,I363V変異およびR397W変異はDNAとの結合活性をそれぞれ減弱および消失させる機能欠失型の変異であった.
Foxp3のChIP-seq解析により,野生型Foxp3およびA384T変異Foxp3はBatf遺伝子遺伝子のプロモーター領域に結合し,A384T変異Foxp3は野生型Foxp3よりも多く結合することがわかった.Batf遺伝子遺伝子のプロモーター領域には5個のフォークヘッド転写因子結合配列が存在し,そのうち4つはA384T変異Foxp3が野生型Foxp3よりも強く結合する配列であった.このことから,A384T変異Foxp3はこれらフォークヘッド転写因子結合配列の存在によりBatf遺伝子遺伝子のプロモーター領域に野生型Foxp3よりも強く結合すると考えられた.レポーターアッセイによりA384T変異Foxp3あるいは野生型Foxp3がBatf遺伝子遺伝子のプロモーター活性におよぼす影響について検討した結果,A384T変異Foxp3は野生型Foxp3と比較して,Batf遺伝子遺伝子のプロモーター活性をフォークヘッド転写因子結合配列に依存的に強く抑制することがわかった.
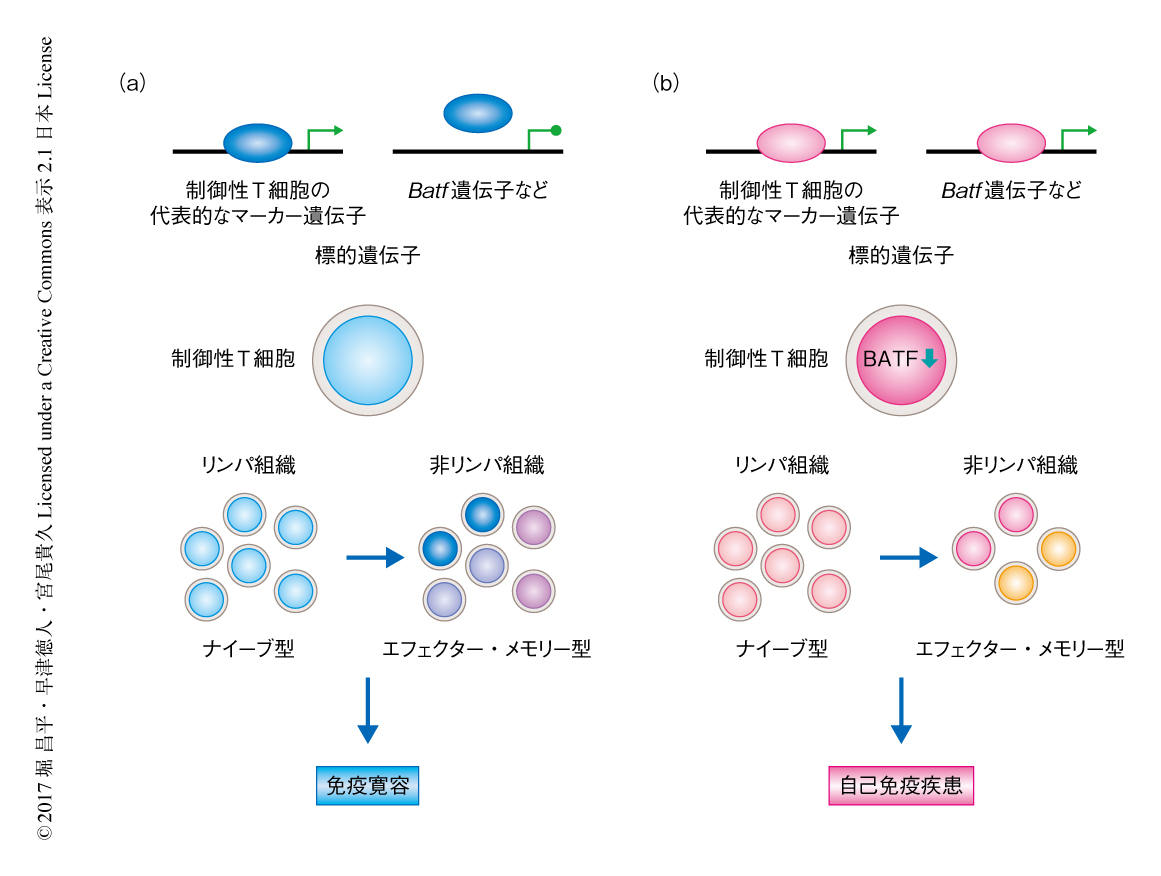
この研究により,転写因子Foxp3のA384T変異がDNAとの結合の特異性を拡大することによりBatf遺伝子遺伝子など特定の標的遺伝子の発現を乱し,その結果,エフェクター・メモリー型の制御性T細胞の分化および組織への集積を障害して自己免疫疾患を惹起することが明らかにされた(図1).このことから,Foxp3による遺伝子の発現の制御におけるDNAとの結合の特異性の重要性が明らかにされるとともに,Foxp3とDNAとの相互作用を変化させるような遺伝子多型がさまざまな自己免疫疾患に対する感受性を賦与する可能性が示唆された.最近,関節リウマチやI型糖尿病などの疾患に感受性を示すSNPが制御性T細胞において選択的に活性化されているエンハンサー領域に多くみつかることが報告された9).疾患感受性SNPがFoxp3の結合に影響をおよぼし,Foxp3を介した制御性T細胞における遺伝子の発現および機能を変化させる可能性が考えられ,さらなる研究が待たれる.
さらに,この研究において,転写因子BATFがエフェクター・メモリー型の制御性T細胞の分化および非リンパ組織への集積を制御する重要な役割を担うことが明らかにされた.つぎの重要な課題は,BATFがどのような標的遺伝子の発現を制御することにより制御性T細胞の分化および機能を制御するのかを明らかにすることである.また,今回の研究から,制御性T細胞においてBATFの発現あるいは機能を強化することにより組織における過剰な免疫応答を抑制でき,逆に,BATFの発現あるいは機能を阻害することにより組織における免疫応答を強化できる可能性が示唆された.さまざまな自己免疫疾患,炎症性疾患,アレルギー疾患,さらには,がんの治療につながることが期待される.
略歴:理化学研究所統合生命医科学研究センター チームリーダーを経て,東京大学大学院薬学系研究科 教授.
早津 徳人(Norihito Hayatsu)
理化学研究所ライフサイエンス技術基盤研究センター 研究員.
宮尾 貴久(Takahisa Miyao)
理化学研究所統合生命医科学研究センター テクニカルスタッフ.
© 2017 堀 昌平・早津徳人・宮尾貴久 Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター 免疫恒常性研究チーム)
email:堀 昌平
DOI: 10.7875/first.author.2017.094
Analyses of a mutant Foxp3 allele reveal BATF as a critical transcription factor in the differentiation and accumulation of tissue regulatory T cells.
Norihito Hayatsu, Takahisa Miyao, Masashi Tachibana, Ryuichi Murakami, Akihiko Kimura, Takako Kato, Eiryo Kawakami, Takaho A. Endo, Ruka Setoguchi, Hiroshi Watarai, Takeshi Nishikawa, Takuwa Yasuda, Hisahiro Yoshida, Shohei Hori
Immunity, 47, 268-283.e9 (2017)
要 約
制御性T細胞は免疫寛容の確立および維持に必須の役割を担う.Foxp3遺伝子はヒトの自己免疫疾患であるIPEX症候群の原因遺伝子として同定され,Foxp3は転写因子として制御性T細胞の分化および機能を制御するが,その分子機構は不明である.この研究において,筆者らは,IPEX症候群において同定されたFoxp3遺伝子の変異に着目し,変異を導入した遺伝子改変マウスを作製して制御性T細胞における遺伝子の発現および機能におよぼす影響について解析した.Foxp3のIle363がValに置換した変異およびArg397がTrpに置換した変異は機能欠失型の変異であり,制御性T細胞における遺伝子の発現および機能を全体的に障害することによりさまざまな臓器において炎症を惹起した.一方,Foxp3のAla384がThrに置換した変異はDNAとの結合の特異性を拡大する機能獲得型の変異であり,特定の標的遺伝子との結合が乱れることにより特定の非リンパ組織において制御性T細胞の機能を障害し炎症を惹起した.この組織における制御性T細胞の機能の障害はAla384がThrに置換したFoxp3変異体による転写因子BATFの発現の抑制に起因した.以上の結果から,制御性T細胞におけるBATFの重要な役割について明らかにされると同時に,Foxp3とDNAとの相互作用を乱すような遺伝子多型が自己免疫疾患に対する感受性を賦与する可能性が示唆された.
はじめに
免疫系には免疫応答を抑制する機能をもつ制御性T細胞とよばれるT細胞のサブセットが存在し,自己免疫,炎症,アレルギーといったさまざまな病的な免疫応答を制御することにより免疫寛容において必須の役割を担う.一方,制御性T細胞はがん細胞に対する免疫応答も抑制し,がんの成長に寄与すると考えられている1).Scurfy変異マウスおよびヒトの自己免疫疾患であるIPEX症候群の患者に発症する致死的な自己免疫疾患の原因遺伝子として同定されたFoxp3遺伝子は制御性T細胞に選択的に発現し,Foxp3は制御性T細胞の分化および機能を制御するマスター転写因子として機能する2-4).Foxp3は制御性T細胞の分子ネットワークにおけるハブであり,数千におよぶゲノムの領域および300をこえる転写制御因子と相互作用することにより制御性T細胞における遺伝子の発現を制御する5,6).しかしながら,Foxp3の標的遺伝子は多数あるため,どの遺伝子が制御性T細胞のどのような性質を制御するのか十分には理解されていない.
そこで,筆者らは,IPEX症候群においてみつかったFoxp3遺伝子の変異のなかに特定の標的遺伝子の発現に影響し制御性T細胞の機能を障害する変異があるのではないかと考え,DNA結合ドメインであるフォークヘッドドメインに存在しDNAとの相互作用に影響すると考えられる3種類のミスセンス変異に着目して,これらの変異が制御性T細胞における遺伝子の発現および機能におよぼす影響について解析した.
1.Ala384がThrに置換したFoxp3変異体は特定の遺伝子の発現に影響する
Foxp3のフォークヘッドドメインに存在する3種類のミスセンス変異,Ile363のValへの置換(I363V変異),Ala384のThrへの置換(A384T変異),Arg397のTrpへの置換(R397W変異)が,制御性T細胞の分化あるいは機能におよぼす影響について個体のレベルで明らかにするため,Foxp3遺伝子座に変異を導入したノックインマウスを作製した.同時に,3’側非翻訳領域にレポーター遺伝子を導入し,野生型のFoxp3あるいはFoxp3の変異体を発現する制御性T細胞を同定できるようにした.胸腺および末梢のリンパ組織においてI363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞の割合は野生型Foxp3を発現する制御性T細胞と比較して低下した.一方,A384T変異Foxp3を発現する制御性T細胞は胸腺においては減少せず,末梢のリンパ組織においては軽度に減少した.したがって,Foxp3のI363V変異およびR397W変異は制御性T細胞の胸腺における分化および末梢における恒常性を障害するのに対し,A384T変異は末梢における恒常性のみを選択的に障害すると考えられた.
Foxp3の3種類のミスセンス変異が制御性T細胞における遺伝子の発現におよぼす影響についてマイクロアレイ解析により調べたところ,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞の遺伝子発現プロファイルは野生型Foxp3を発現する制御性T細胞とは大きく異なり,Foxp3陰性CD4陽性T細胞により近い遺伝子の発現パターンを示した.一方,A384T変異Foxp3を発現する制御性T細胞は野生型Foxp3を発現する制御性T細胞ともっとも近い遺伝子発現プロファイルを示したが,一部の遺伝子は野生型Foxp3を発現する制御性T細胞とは異なる遺伝子の発現パターンを示した.マイクロアレイ解析の結果と一致して,制御性T細胞の代表的なマーカーであるCD25あるいはCTLA4の発現は,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においては低下したのに対し,A384T変異Foxp3を発現する制御性T細胞においては低下しなかった.一方,制御性T細胞において発現の抑制されるインターロイキン2あるいはインターロイキン17といったサイトカインは,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においては発現が脱抑制されたのに対し,A384T変異Foxp3を発現する制御性T細胞においては発現が脱抑制されなかった.制御性T細胞はin vitroにおいてFoxp3陰性CD4陽性T細胞の増殖を抑制することが知られているが,I363V変異Foxp3あるいはR397W変異Foxp3を発現する制御性T細胞においてはこの抑制の活性が障害されたが,A384T変異Foxp3を発現する制御性T細胞において抑制の活性は障害されなかった.
以上の結果から,Foxp3のI363V変異およびR397W変異は機能を全体的に障害する機能欠失型の変異であることがわかった.一方,A384T変異は一部のFoxp3に依存的な遺伝子の発現を選択的に障害するユニークな変異であった.
2.A384T変異Foxp3を発現するマウスは組織に選択的な自己免疫疾患を発症する
Foxp3の3種類のミスセンス変異が免疫寛容を破綻させるかどうか検討した.I363V変異Foxp3あるいはR397W変異Foxp3を発現するマウスにおいては,皮膚,肺,肝臓などさまざまな組織に炎症性の細胞の浸潤がみられ,インターフェロンγを産生するTh1細胞およびインターロイキン4を産生するTh2細胞の集積がみられた.一方,A384T変異Foxp3を発現するマウスにおいても皮膚,肺,大腸などの組織に炎症性の細胞の浸潤がみられたが,肝臓には炎症はみられなかった.また,Th2細胞およびインターロイキン17を産生するTh17細胞が選択的に集積した.以上の結果から,Foxp3のA384T変異はI363V変異あるいはR397W変異とは異なり,組織に選択的かつTh2応答およびTh17応答にかたよった自己免疫疾患を惹起することが明らかにされた.
3.A384T変異Foxp3を発現する制御性T細胞においてエフェクター・メモリー型のサブセットが選択的に欠損する
Foxp3のA384T変異は自己免疫疾患を惹起することから,特定の標的遺伝子の発現を乱すことにより制御性T細胞の生体におけるなんらかの機能を障害しているはずである.では,この変異は制御性T細胞のどのような機能的な側面を障害するのだろうか? 野生型Foxp3を発現する制御性T細胞とA384T変異Foxp3を発現する制御性T細胞とが共存した環境において,A384T変異Foxp3を発現する制御性T細胞の割合が非リンパ組織においていちじるしく低下した.T細胞は一般的に,リンパ組織を巡回するナイーブ型と,非リンパ組織に局在するエフェクター・メモリー型とに大別され,ナイーブ型T細胞が抗原の刺激をうけて活性化され,エフェクター・メモリー型T細胞に分化し免疫応答の場である非リンパ組織へと移行することが知られている.A384T変異Foxp3を発現する制御性T細胞の非リンパ組織における選択的な減少はエフェクター・メモリー型のサブセットの欠損によるものであり,ナイーブ型のサブセットは変異により影響をうけていなかった.自己免疫疾患を発症したA384T変異Foxp3を発現するマウスにおいては,皮膚,肺,大腸といった炎症を起こす組織においてのみエフェクター・メモリー型の制御性T細胞の割合が低下しており,逆に,炎症を起こすエフェクター・メモリー型のヘルパーT細胞の割合が増加していた.一方,炎症の起こらない肝臓においてはこのような制御性T細胞とヘルパーT細胞とのアンバランスはみられなかった.以上の結果から,Foxp3のA384T変異はナイーブ型の制御性T細胞がエフェクター・メモリー型の制御性T細胞へと分化して非リンパ組織に集積する機能を障害し,そのため,組織において制御性T細胞が欠損し非リンパ組織における免疫制御が破綻すると考えられた.
4.A384T変異Foxp3を発現する制御性T細胞におけるTh2細胞およびTh17細胞に選択的に発現するタンパク質の発現の低下
なぜA384T変異Foxp3を発現するマウスは組織に選択的かつTh2応答およびTh17応答にかたよった自己免疫疾患を発症するのだろうか? 近年,エフェクター・メモリー型の制御性T細胞はヘルパーT細胞と同様に不均一な集団であり,Tbet,GATA3,RORγtといったヘルパーT細胞のサブセットの分化を制御するマスター転写因子や,ヘルパーT細胞のサブセットの機能において重要なサイトカイン受容体やケモカイン受容体の発現により,多様なサブセットに分けられることが明らかにされてきた.そして,それらヘルパーT細胞に関連するタンパク質を利用して対応するヘルパーT細胞のサブセットと同じ環境に集積し,その機能を抑制すると考えられている7).A384T変異Foxp3を発現する制御性T細胞においては,Th2細胞に選択的に発現するGATA3,ST2,CCR4といったタンパク質の発現が低下する一方,Th1細胞に選択的に発現するTbet,CXCR3といったタンパク質の発現は低下していなかった.Th17細胞に選択的に発現するRORγt,CCR4,CCR6についてはCCR4の発現だけが低下していた.このことから,A384T変異Foxp3を発現する制御性T細胞においては,GATA3,ST2,CCR4の発現が低下するためTh2細胞およびTh17細胞がはたらく環境に集積することができず,Th2細胞およびTh17細胞の制御が選択的に破綻すると考えられた.
また,肝臓においてはGATA3,ST2,CCR4を発現する制御性T細胞,Th2細胞,Th17細胞はほかの組織よりマイナーなサブセットであり,逆に,Tbet,CXCR3を発現する制御性T細胞およびTh1細胞が主要なサブセットであった.したがって,肝臓においてはGATA3,ST2,CCR4の発現の低下によるTh2細胞あるいはTh17細胞の制御の破綻の影響がほかの組織よりも小さく,そのため炎症がほとんど起こらないと考えられた.
5.転写因子BATFの発現の低下によりA384T変異Foxp3を発現する制御性T細胞において機能が障害される
Foxp3のA384T変異により,どの標的遺伝子の発現が障害され制御性T細胞において異常がひき起こされるのであろうか? マイクロアレイ解析およびFoxp3のChIP-seq解析により,野生型Foxp3を発現する制御性T細胞と比較してA384T変異Foxp3を発現する制御性T細胞において発現が変化し,かつ,Foxp3との結合が変化する標的遺伝子を探索した.その結果,A384T変異Foxp3を発現する制御性T細胞において発現が低下しFoxp3との結合が強まる遺伝子として,AP-1転写因子ファミリーに属する転写因子BATFをコードするBatf遺伝子が同定された.BATFはTh2細胞やTh17細胞などのエフェクター・メモリー型のT細胞の分化および機能に必須の転写因子であることから8),これらのヘルパーT細胞を抑制するエフェクター・メモリー型の制御性T細胞のサブセットの分化および機能においてもBATFが重要であるとの仮説をたてた.
この仮説を検証するため,BATFノックアウトマウスにおいて制御性T細胞の性状を解析した.マイクロアレイ解析により遺伝子の発現について調べた結果,BATFを欠損した制御性T細胞はA384T変異Foxp3を発現する制御性T細胞と類似した遺伝子発現プロファイルを示した.また,同様にエフェクター・メモリー型のサブセットを欠損しており,とくにGATA3,ST2,CCR4を発現するサブセットが選択的に減少していた.さらに,A384T変異Foxp3を発現するマウスから単離した脾臓およびリンパ節細胞をリンパ球を欠損したマウスに移入することにより大腸炎を発症させる系を用いて,生体における免疫抑制機能について評価した.その結果,野生型Foxp3を発現する制御性T細胞は大腸炎の発症を阻止したのに対し,A384T変異Foxp3を発現する制御性T細胞,および,BATFを欠損した制御性T細胞は発症を阻止しなかった.以上の結果から,BATFを欠損した制御性T細胞は表現型および機能の両面においてA384T変異Foxp3を発現する制御性T細胞に類似することが明らかにされた.
仮説を検証する2つ目のアプローチとして,レトロウイルスベクターを用いてA384T変異Foxp3を発現する制御性T細胞にBATFを強制発現させた.その結果,A384T変異Foxp3を発現する制御性T細胞は大腸炎の抑制能を回復し,大腸におけるエフェクター・メモリー型の制御性T細胞,とくにGATA3,CCR4を発現するサブセットの割合が上昇した.
以上の結果から,A384T変異Foxp3を発現する制御性T細胞の機能の異常の一因は,転写因子BATFの発現の低下にあることが明らかにされた.
6.Foxp3のA384T変異はDNAとの結合の特異性を拡大させBATFの発現を抑制する
なぜFoxp3のA384T変異によりBatf遺伝子遺伝子を含む特定の標的遺伝子の発現が障害されるのであろうか? Foxp3のChIP-seq解析のデータを用いて,野生型Foxp3あるいはA384T変異Foxp3を発現する制御性T細胞においてFoxp3が選択的に結合するゲノム領域にどのような転写因子との結合モチーフが存在するか調べた.その結果,野生型Foxp3を発現する制御性T細胞に選択的なFoxp3との結合領域には有意な結合モチーフは検出されなかったが,A384T変異Foxp3を発現する制御性T細胞に選択的なFoxp3との結合領域にフォークヘッド転写因子結合配列と類似した配列が有意に多く存在した.このことから,Foxp3においてDNA結合ドメインであるフォークヘッドドメインに存在するA384T変異はDNAとの結合の特異性を変化させる可能性が示唆された.そこで,種々のフォークヘッド転写因子結合配列に対するFoxp3変異体の結合活性についてゲルシフトアッセイにより解析した.その結果,いくつかのフォークヘッド転写因子結合配列に対しては野生型Foxp3およびA384T変異Foxp3は同じ程度の結合活性を呈したが,そのほかのフォークヘッド転写因子結合配列に対してはA384T変異Foxp3のみが結合した.このことから,Foxp3のA384T変異はフォークヘッド転写因子結合配列に対し結合の特異性を拡大する機能獲得型の変異であることがわかった.一方,I363V変異およびR397W変異はDNAとの結合活性をそれぞれ減弱および消失させる機能欠失型の変異であった.
Foxp3のChIP-seq解析により,野生型Foxp3およびA384T変異Foxp3はBatf遺伝子遺伝子のプロモーター領域に結合し,A384T変異Foxp3は野生型Foxp3よりも多く結合することがわかった.Batf遺伝子遺伝子のプロモーター領域には5個のフォークヘッド転写因子結合配列が存在し,そのうち4つはA384T変異Foxp3が野生型Foxp3よりも強く結合する配列であった.このことから,A384T変異Foxp3はこれらフォークヘッド転写因子結合配列の存在によりBatf遺伝子遺伝子のプロモーター領域に野生型Foxp3よりも強く結合すると考えられた.レポーターアッセイによりA384T変異Foxp3あるいは野生型Foxp3がBatf遺伝子遺伝子のプロモーター活性におよぼす影響について検討した結果,A384T変異Foxp3は野生型Foxp3と比較して,Batf遺伝子遺伝子のプロモーター活性をフォークヘッド転写因子結合配列に依存的に強く抑制することがわかった.
おわりに
この研究により,転写因子Foxp3のA384T変異がDNAとの結合の特異性を拡大することによりBatf遺伝子遺伝子など特定の標的遺伝子の発現を乱し,その結果,エフェクター・メモリー型の制御性T細胞の分化および組織への集積を障害して自己免疫疾患を惹起することが明らかにされた(図1).このことから,Foxp3による遺伝子の発現の制御におけるDNAとの結合の特異性の重要性が明らかにされるとともに,Foxp3とDNAとの相互作用を変化させるような遺伝子多型がさまざまな自己免疫疾患に対する感受性を賦与する可能性が示唆された.最近,関節リウマチやI型糖尿病などの疾患に感受性を示すSNPが制御性T細胞において選択的に活性化されているエンハンサー領域に多くみつかることが報告された9).疾患感受性SNPがFoxp3の結合に影響をおよぼし,Foxp3を介した制御性T細胞における遺伝子の発現および機能を変化させる可能性が考えられ,さらなる研究が待たれる.
さらに,この研究において,転写因子BATFがエフェクター・メモリー型の制御性T細胞の分化および非リンパ組織への集積を制御する重要な役割を担うことが明らかにされた.つぎの重要な課題は,BATFがどのような標的遺伝子の発現を制御することにより制御性T細胞の分化および機能を制御するのかを明らかにすることである.また,今回の研究から,制御性T細胞においてBATFの発現あるいは機能を強化することにより組織における過剰な免疫応答を抑制でき,逆に,BATFの発現あるいは機能を阻害することにより組織における免疫応答を強化できる可能性が示唆された.さまざまな自己免疫疾患,炎症性疾患,アレルギー疾患,さらには,がんの治療につながることが期待される.
文 献
- Sakaguchi, S.: Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses. Annu. Rev. Immunol., 22, 531-562 (2004)[PubMed]
- Fontenot, J. D., Gavin, M. A. & Rudensky, A. Y.: Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol., 4, 330-336 (2003)[PubMed]
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Khattri, R., Cox, T., Yasayko, S. A. et al.: An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat. Immunol., 4, 337-342 (2003)[PubMed]
- Rudra, D., deRoos, P., Chaudhry, A. et al.: Transcription factor Foxp3 and its protein partners form a complex regulatory network. Nat. Immunol., 13, 1010-1019 (2012)[PubMed]
- Samstein, R. M., Arvey, A., Josefowicz, S. Z. et al.: Foxp3 exploits a pre-existent enhancer landscape for regulatory T cell lineage specification. Cell, 151, 153-166 (2012)[PubMed]
- Cretney, E., Kallies, A. & Nutt, S. L.: Differentiation and function of Foxp3+ effector regulatory T cells. Trends Immunol., 34, 74-80 (2013)[PubMed]
- Murphy, T. L., Tussiwand, R. & Murphy, K. M.: Specificity through cooperation: BATF-IRF interactions control immune-regulatory networks. Nat. Rev. Immunol., 13, 499-509 (2013)[PubMed]
- Arvey, A., van der Veeken, J., Plitas, G. et al.: Genetic and epigenetic variation in the lineage specification of regulatory T cells. Elife, 4, e07571 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:理化学研究所統合生命医科学研究センター チームリーダーを経て,東京大学大学院薬学系研究科 教授.
早津 徳人(Norihito Hayatsu)
理化学研究所ライフサイエンス技術基盤研究センター 研究員.
宮尾 貴久(Takahisa Miyao)
理化学研究所統合生命医科学研究センター テクニカルスタッフ.
© 2017 堀 昌平・早津徳人・宮尾貴久 Licensed under CC 表示 2.1 日本