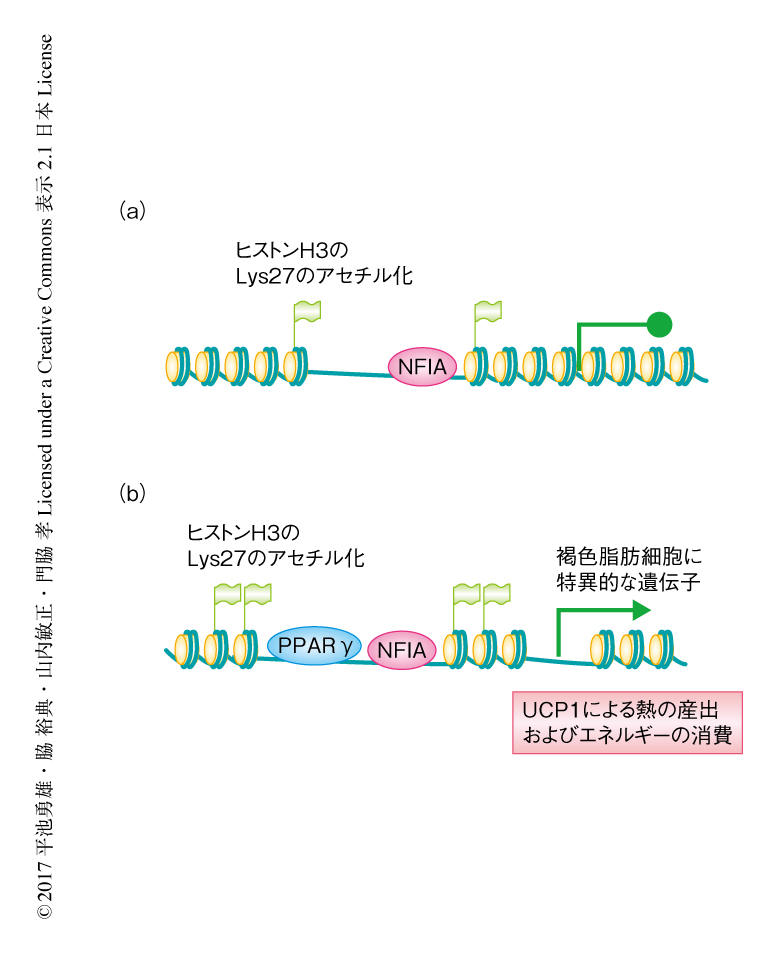
転写因子NFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーにおいてPPARγと共局在することにより遺伝子発現プログラムを制御する
平池勇雄・脇 裕典・山内敏正・門脇 孝
(東京大学大学院医学系研究科 代謝・栄養病態学)
email:山内敏正,門脇 孝
DOI: 10.7875/first.author.2017.090
NFIA co-localizes with PPARγ and transcriptionally controls the brown fat gene program.
Yuta Hiraike, Hironori Waki, Jing Yu, Masahiro Nakamura, Kana Miyake, Gaku Nagano, Ryo Nakaki, Ken Suzuki, Hirofumi Kobayashi, Shogo Yamamoto, Wei Sun, Tomohisa Aoyama, Yusuke Hirota, Haruya Ohno, Kenji Oki, Masayasu Yoneda, Andrew P. White, Yu-Hua Tseng, Aaron M. Cypess, Therese J. Larsen, Naja Z. Jespersen, Camilla Scheele, Shuichi Tsutsumi, Hiroyuki Aburatani, Toshimasa Yamauchi, Takashi Kadowaki
Nature Cell Biology, 19, 1081-1092 (2017)
褐色脂肪組織はミトコンドリアにおけるUCP1の作用を介して熱を産生しエネルギーを消費しており,肥満症の治療の標的としても期待される.筆者らは,褐色脂肪組織に特異的な開いた構造をとるクロマチンの領域の解析から,褐色脂肪組織の分化を制御する主要な転写因子としてNFIAを同定した.褐色脂肪細胞においてNFIAは,脂肪細胞の分化におけるマスター転写因子であるPPARγと褐色脂肪細胞に特異的な遺伝子のエンハンサーにおいて高頻度に共局在していた.さらに,NFIAのエンハンサーへの結合はPPARγを含む主要な転写因子の結合に先行し,かつ,NFIAの結合はPPARγの結合を促進した.また,NFIAが結合した時点においてその領域は,開いたクロマチン構造やヒストンH3のLys27のアセチル化といった活性型のエンハンサーの特徴を呈していた.筋芽細胞はNFIAの導入により褐色脂肪細胞へと分化した.NFIAノックアウトマウスの褐色脂肪組織において,褐色脂肪細胞の遺伝子発現プログラムの全体が障害されていた一方,骨格筋細胞の遺伝子発現プログラムは活性化されていた.また,ヒトの褐色脂肪組織においてもNFIAは高く発現しており,かつ,その発現はUcp1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現と正に相関していた.以上から,NFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーを活性化し,PPARγのエンハンサーへの結合を促進することにより褐色脂肪細胞の遺伝子発現プログラムを制御すると考えられた.
肥満症およびそれに起因するメタボリックシンドロームや肥満2型糖尿病は心血管疾患,腎疾患,悪性腫瘍のリスクを高めることから,その克服は健康長寿をめざすうえで大きな課題である.現在,肥満症の治療は食事療法や運動療法といった生活習慣の改善が主体であり,エネルギーの摂取や吸収を抑制する薬剤はいくつか開発されているものの,副作用などの懸念から十分には活用されていない.また,高度の肥満症の症例に対する減量手術の有効性は確立されつつあるものの,すべての症例に適応できる治療法とはいいがたい.
近年,エネルギーの貯蔵を担う白色脂肪組織のほかに,ミトコンドリアにおけるUCP1による熱の産生を介しエネルギーを消費する褐色脂肪組織がヒトの成人にも存在することがわかってきた1-5).すでに,肥満度の指標であるBMIと褐色脂肪組織の活性とが負に相関すること,また,加齢にともない褐色脂肪組織の活性が低下することが報告されている2,6).そのため,褐色脂肪組織を増やすないしはたらきを高めることが肥満症の新しい治療法につながると期待されている.また,発生学的な観点において,褐色脂肪組織は白色脂肪組織よりむしろ骨格筋組織に近い可能性が報告されている一方7),白色脂肪組織も寒冷刺激や交感刺激に応じて褐色脂肪組織に近い機能をもちうることが示されており8),褐色脂肪組織の分化の全体像には未解決の部分が多く残されている.
一般に,エンハンサーやプロモーターといったゲノムにおける制御領域は転写因子のアクセスのしやすい開いたクロマチン構造をとることが知られており,そのような開いた構造をとるクロマチンの領域を同定する手法のひとつとしてFAIRE-seq(formaldehyde-assisted isolation of regulatory elements coupled with high-throughput sequencing)法が報告されている9).この手法をマウスの褐色脂肪組織,皮下の白色脂肪組織,内臓の白色脂肪組織に対し用いることにより,これらの組織において開いた構造をとるクロマチンの領域を網羅的に同定した.褐色脂肪組織に特異的な開いた構造をとるクロマチンの領域には,転写因子NFIの結合配列であるNF-1モチーフが強く濃縮していた.NFIファミリーにはA,B,C,Xの4種類のアイソフォームが存在するが,そのうちNFIAは褐色脂肪組織において高く発現しており,白色脂肪組織や骨格筋組織における発現は低かった.以上から,NFIAは褐色脂肪組織の分化を制御する新規の転写因子である可能性が考えられた.
C2C12筋芽細胞にレトロウイルスベクターを用いてNFIAを導入したところ,Oil-Red-O染色にて脂肪滴の蓄積が認められた.また,RT-qPCR法を用いて遺伝子の発現を解析したところ,Myod1遺伝子やMyog遺伝子といった骨格筋細胞に特異的な遺伝子の発現は抑制されていた一方,脂肪細胞の分化におけるマスター転写因子であるPPARγをコードするPparg遺伝子や,PPARγの標的であるFabp4遺伝子は強く発現しており,また,Ucp1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現も亢進していた.フラックスアナライザーを用いた酸素の消費量の測定により脱共役呼吸の増大が認められ,このことはUcp1の活性化と合致すると考えられた.
褐色脂肪細胞においてshRNAを用いNFIAの発現をノックダウンしたところ,約60~70%の抑制効率においてOil-Red-O染色およびPparg遺伝子やFabp4遺伝子の発現により評価した場合,脂肪細胞の分化の程度には対照と比較して差は認められなかった.しかしながら,Ucp1遺伝子やPpargc1a遺伝子といった褐色脂肪細胞に特異的な遺伝子の発現は有意に抑制され,UCP1の発現も抑制されていた.以上より,NFIAは褐色脂肪細胞の分化を正に制御すると考えらえた.
NFIAによる褐色脂肪細胞の分化の機構をゲノムワイドに解析するため,抗NFI抗体および抗PPARγ抗体を用いたChIP-seq法により解析した.その結果,Ucp1遺伝子を含む代表的な褐色脂肪細胞に特異的な遺伝子の近傍にNFIの結合領域が認められた.また,網羅的な解析の結果,褐色脂肪細胞に特異的な遺伝子の転写開始点においては,白色脂肪細胞に特異的な遺伝子の転写開始点と比較して,1)より近傍にNFIの結合領域が存在し,2)転写開始点の+/-50 kbにおけるNFIの結合領域の数が多く,3)転写開始点の+/-50 kbにおけるNFIの結合強度の総和も大きかった.よって,NFIの結合は褐色脂肪細胞に特異的な遺伝子の近傍に濃縮していると考えられた.
NFIの結合領域は脂肪細胞の分化におけるマスター転写因子であるPPARγの結合領域と高頻度に共局在していた.分化ののちの褐色脂肪細胞においてNFIとPPARγが共局在する領域のうち,分化のまえの時点から共局在の認められた領域は約2割にとどまり,半数以上の領域において分化のまえの時点ではNFIのみが結合していた.また,この時点においてC/EBPα,C/EBPβ,EBF2など褐色脂肪細胞の分化における既知の主要な転写因子はいずれも結合していなかった.にもかかわらず,これらの領域は分化のまえの時点において,開いたクロマチン構造やヒストンH3のLys27のアセチル化といった活性型のエンハンサーの特徴を呈していた.
NFIAとPPARγがエンハンサーにおいて共局在することの機能的な意義について検討するため,C2C12筋芽細胞にPPARγを導入した細胞とPPARγとNFIAをともに導入した細胞とを比較した.その結果,脂肪細胞の分化の程度やPPARγの発現には差は認められず,また,PPARγおよびNFIAを導入した細胞においてNFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーと結合していた.このとき,PPARγおよびNFIAを導入した細胞においては,PPARγを単独で導入した細胞と比較して,NFIAと共局在することによりPPARγのエンハンサーへの結合が促進されていた.これらのエンハンサーにおいて,開いたクロマチン構造のシグナルおよび標的となる褐色脂肪細胞に特異的な遺伝子の発現も上昇しており,NFIAはPPARγのエンハンサーへの結合を促進し,ひいては,標的となる遺伝子の転写を促進すると考えられた.
NFIAノックアウトマウスは脳梁の欠損や脳梁の欠損など中枢神経系における表現型のため生後数日で死亡してしまう10).そこで,新生仔の褐色脂肪組織を解析したが,形態や大きさに明らかな差は認められず,PPARγの発現にも差はなかった.しかしながら,PPARγのエンハンサーへの結合をChIP-qPCR法により解析したところ,NFIAノックアウトマウスにおいてUcp1遺伝子のエンハンサーへのPPARγの結合が失われていた.このとき,Ucp1 RNAの発現およびUCP1の発現も明らかに低下していた.RNA-seq法による網羅的な遺伝子の発現の解析および遺伝子オントロジーの解析から,NFIAノックアウトマウスにおいて発現の低下した遺伝子は褐色脂肪細胞に特異的な遺伝子や脂質代謝に関連する遺伝子と考えられた一方,NFIAノックアウトマウスにおいて発現の上昇した遺伝子は骨格筋に関連する遺伝子と考えられた.よって,in vivoにおいても,NFIAは褐色脂肪細胞の遺伝子発現プログラムに必須と考えられた.
ヒトの褐色脂肪組織におけるNFIA遺伝子の発現について検討した.褐色細胞腫の患者において腎臓の周囲の褐色脂肪組織が活性化されることが報告されている11).褐色細胞腫の患者から採取した腎臓の周囲の褐色脂肪組織においては,非機能性腺腫の患者に由来する組織と比べNFIA遺伝子の発現が有意に高かった.また,褐色細胞腫の患者と非機能性腺腫の患者のいずれにおいても,NFIA遺伝子の発現はUCP1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現と正に相関した.
この研究において,筆者らは,NFIAが褐色脂肪細胞の分化を制御する主要な転写因子であり,PPARγを含むほかの転写因子に先行してエンハンサーと結合しこれを活性化し,PPARγとの結合を促進することにより褐色脂肪細胞の遺伝子発現プログラムを制御することを見い出した(図1).現在の肥満症の薬物治療法および外科治療法はすべてエネルギー摂取の抑制という考え方にもとづく.NFIAの制御を介して褐色脂肪組織を増やすないしはたらきを高めることにより,エネルギー摂取の抑制ではなく,エネルギー消費の促進にもとづく肥満症,メタボリックシンドローム,肥満2型糖尿病の新しい治療法につながる可能性が期待される.
略歴:2017年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
脇 裕典(Hironori Waki)
東京大学大学院医学系研究科 特任准教授.
山内 敏正(Toshimasa Yamauchi)
東京大学大学院医学系研究科 准教授.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
© 2017 平池勇雄・脇 裕典・山内敏正・門脇 孝 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 代謝・栄養病態学)
email:山内敏正,門脇 孝
DOI: 10.7875/first.author.2017.090
NFIA co-localizes with PPARγ and transcriptionally controls the brown fat gene program.
Yuta Hiraike, Hironori Waki, Jing Yu, Masahiro Nakamura, Kana Miyake, Gaku Nagano, Ryo Nakaki, Ken Suzuki, Hirofumi Kobayashi, Shogo Yamamoto, Wei Sun, Tomohisa Aoyama, Yusuke Hirota, Haruya Ohno, Kenji Oki, Masayasu Yoneda, Andrew P. White, Yu-Hua Tseng, Aaron M. Cypess, Therese J. Larsen, Naja Z. Jespersen, Camilla Scheele, Shuichi Tsutsumi, Hiroyuki Aburatani, Toshimasa Yamauchi, Takashi Kadowaki
Nature Cell Biology, 19, 1081-1092 (2017)
要 約
褐色脂肪組織はミトコンドリアにおけるUCP1の作用を介して熱を産生しエネルギーを消費しており,肥満症の治療の標的としても期待される.筆者らは,褐色脂肪組織に特異的な開いた構造をとるクロマチンの領域の解析から,褐色脂肪組織の分化を制御する主要な転写因子としてNFIAを同定した.褐色脂肪細胞においてNFIAは,脂肪細胞の分化におけるマスター転写因子であるPPARγと褐色脂肪細胞に特異的な遺伝子のエンハンサーにおいて高頻度に共局在していた.さらに,NFIAのエンハンサーへの結合はPPARγを含む主要な転写因子の結合に先行し,かつ,NFIAの結合はPPARγの結合を促進した.また,NFIAが結合した時点においてその領域は,開いたクロマチン構造やヒストンH3のLys27のアセチル化といった活性型のエンハンサーの特徴を呈していた.筋芽細胞はNFIAの導入により褐色脂肪細胞へと分化した.NFIAノックアウトマウスの褐色脂肪組織において,褐色脂肪細胞の遺伝子発現プログラムの全体が障害されていた一方,骨格筋細胞の遺伝子発現プログラムは活性化されていた.また,ヒトの褐色脂肪組織においてもNFIAは高く発現しており,かつ,その発現はUcp1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現と正に相関していた.以上から,NFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーを活性化し,PPARγのエンハンサーへの結合を促進することにより褐色脂肪細胞の遺伝子発現プログラムを制御すると考えられた.
はじめに
肥満症およびそれに起因するメタボリックシンドロームや肥満2型糖尿病は心血管疾患,腎疾患,悪性腫瘍のリスクを高めることから,その克服は健康長寿をめざすうえで大きな課題である.現在,肥満症の治療は食事療法や運動療法といった生活習慣の改善が主体であり,エネルギーの摂取や吸収を抑制する薬剤はいくつか開発されているものの,副作用などの懸念から十分には活用されていない.また,高度の肥満症の症例に対する減量手術の有効性は確立されつつあるものの,すべての症例に適応できる治療法とはいいがたい.
近年,エネルギーの貯蔵を担う白色脂肪組織のほかに,ミトコンドリアにおけるUCP1による熱の産生を介しエネルギーを消費する褐色脂肪組織がヒトの成人にも存在することがわかってきた1-5).すでに,肥満度の指標であるBMIと褐色脂肪組織の活性とが負に相関すること,また,加齢にともない褐色脂肪組織の活性が低下することが報告されている2,6).そのため,褐色脂肪組織を増やすないしはたらきを高めることが肥満症の新しい治療法につながると期待されている.また,発生学的な観点において,褐色脂肪組織は白色脂肪組織よりむしろ骨格筋組織に近い可能性が報告されている一方7),白色脂肪組織も寒冷刺激や交感刺激に応じて褐色脂肪組織に近い機能をもちうることが示されており8),褐色脂肪組織の分化の全体像には未解決の部分が多く残されている.
1.開いた構造をとるクロマチンの領域のゲノムワイドな解析による褐色脂肪組織の分化を制御する主要な転写因子NFIAの同定
一般に,エンハンサーやプロモーターといったゲノムにおける制御領域は転写因子のアクセスのしやすい開いたクロマチン構造をとることが知られており,そのような開いた構造をとるクロマチンの領域を同定する手法のひとつとしてFAIRE-seq(formaldehyde-assisted isolation of regulatory elements coupled with high-throughput sequencing)法が報告されている9).この手法をマウスの褐色脂肪組織,皮下の白色脂肪組織,内臓の白色脂肪組織に対し用いることにより,これらの組織において開いた構造をとるクロマチンの領域を網羅的に同定した.褐色脂肪組織に特異的な開いた構造をとるクロマチンの領域には,転写因子NFIの結合配列であるNF-1モチーフが強く濃縮していた.NFIファミリーにはA,B,C,Xの4種類のアイソフォームが存在するが,そのうちNFIAは褐色脂肪組織において高く発現しており,白色脂肪組織や骨格筋組織における発現は低かった.以上から,NFIAは褐色脂肪組織の分化を制御する新規の転写因子である可能性が考えられた.
2.NFIAは褐色脂肪細胞の分化を正に制御する
C2C12筋芽細胞にレトロウイルスベクターを用いてNFIAを導入したところ,Oil-Red-O染色にて脂肪滴の蓄積が認められた.また,RT-qPCR法を用いて遺伝子の発現を解析したところ,Myod1遺伝子やMyog遺伝子といった骨格筋細胞に特異的な遺伝子の発現は抑制されていた一方,脂肪細胞の分化におけるマスター転写因子であるPPARγをコードするPparg遺伝子や,PPARγの標的であるFabp4遺伝子は強く発現しており,また,Ucp1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現も亢進していた.フラックスアナライザーを用いた酸素の消費量の測定により脱共役呼吸の増大が認められ,このことはUcp1の活性化と合致すると考えられた.
褐色脂肪細胞においてshRNAを用いNFIAの発現をノックダウンしたところ,約60~70%の抑制効率においてOil-Red-O染色およびPparg遺伝子やFabp4遺伝子の発現により評価した場合,脂肪細胞の分化の程度には対照と比較して差は認められなかった.しかしながら,Ucp1遺伝子やPpargc1a遺伝子といった褐色脂肪細胞に特異的な遺伝子の発現は有意に抑制され,UCP1の発現も抑制されていた.以上より,NFIAは褐色脂肪細胞の分化を正に制御すると考えらえた.
3.NFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーにおいてPPARγと共局在しそのエンハンサーへの結合を促進する
NFIAによる褐色脂肪細胞の分化の機構をゲノムワイドに解析するため,抗NFI抗体および抗PPARγ抗体を用いたChIP-seq法により解析した.その結果,Ucp1遺伝子を含む代表的な褐色脂肪細胞に特異的な遺伝子の近傍にNFIの結合領域が認められた.また,網羅的な解析の結果,褐色脂肪細胞に特異的な遺伝子の転写開始点においては,白色脂肪細胞に特異的な遺伝子の転写開始点と比較して,1)より近傍にNFIの結合領域が存在し,2)転写開始点の+/-50 kbにおけるNFIの結合領域の数が多く,3)転写開始点の+/-50 kbにおけるNFIの結合強度の総和も大きかった.よって,NFIの結合は褐色脂肪細胞に特異的な遺伝子の近傍に濃縮していると考えられた.
NFIの結合領域は脂肪細胞の分化におけるマスター転写因子であるPPARγの結合領域と高頻度に共局在していた.分化ののちの褐色脂肪細胞においてNFIとPPARγが共局在する領域のうち,分化のまえの時点から共局在の認められた領域は約2割にとどまり,半数以上の領域において分化のまえの時点ではNFIのみが結合していた.また,この時点においてC/EBPα,C/EBPβ,EBF2など褐色脂肪細胞の分化における既知の主要な転写因子はいずれも結合していなかった.にもかかわらず,これらの領域は分化のまえの時点において,開いたクロマチン構造やヒストンH3のLys27のアセチル化といった活性型のエンハンサーの特徴を呈していた.
NFIAとPPARγがエンハンサーにおいて共局在することの機能的な意義について検討するため,C2C12筋芽細胞にPPARγを導入した細胞とPPARγとNFIAをともに導入した細胞とを比較した.その結果,脂肪細胞の分化の程度やPPARγの発現には差は認められず,また,PPARγおよびNFIAを導入した細胞においてNFIAは褐色脂肪細胞に特異的な遺伝子のエンハンサーと結合していた.このとき,PPARγおよびNFIAを導入した細胞においては,PPARγを単独で導入した細胞と比較して,NFIAと共局在することによりPPARγのエンハンサーへの結合が促進されていた.これらのエンハンサーにおいて,開いたクロマチン構造のシグナルおよび標的となる褐色脂肪細胞に特異的な遺伝子の発現も上昇しており,NFIAはPPARγのエンハンサーへの結合を促進し,ひいては,標的となる遺伝子の転写を促進すると考えられた.
4.マウスの褐色脂肪組織においてNFIAの欠損により褐色脂肪細胞の遺伝子発現プログラムは障害され骨格筋細胞の遺伝子発現プログラムは活性化される
NFIAノックアウトマウスは脳梁の欠損や脳梁の欠損など中枢神経系における表現型のため生後数日で死亡してしまう10).そこで,新生仔の褐色脂肪組織を解析したが,形態や大きさに明らかな差は認められず,PPARγの発現にも差はなかった.しかしながら,PPARγのエンハンサーへの結合をChIP-qPCR法により解析したところ,NFIAノックアウトマウスにおいてUcp1遺伝子のエンハンサーへのPPARγの結合が失われていた.このとき,Ucp1 RNAの発現およびUCP1の発現も明らかに低下していた.RNA-seq法による網羅的な遺伝子の発現の解析および遺伝子オントロジーの解析から,NFIAノックアウトマウスにおいて発現の低下した遺伝子は褐色脂肪細胞に特異的な遺伝子や脂質代謝に関連する遺伝子と考えられた一方,NFIAノックアウトマウスにおいて発現の上昇した遺伝子は骨格筋に関連する遺伝子と考えられた.よって,in vivoにおいても,NFIAは褐色脂肪細胞の遺伝子発現プログラムに必須と考えられた.
5.ヒトの褐色脂肪組織においてNFIA遺伝子は高く発現し褐色脂肪細胞に特異的な遺伝子の発現と正に相関する
ヒトの褐色脂肪組織におけるNFIA遺伝子の発現について検討した.褐色細胞腫の患者において腎臓の周囲の褐色脂肪組織が活性化されることが報告されている11).褐色細胞腫の患者から採取した腎臓の周囲の褐色脂肪組織においては,非機能性腺腫の患者に由来する組織と比べNFIA遺伝子の発現が有意に高かった.また,褐色細胞腫の患者と非機能性腺腫の患者のいずれにおいても,NFIA遺伝子の発現はUCP1遺伝子を含む褐色脂肪細胞に特異的な遺伝子の発現と正に相関した.
おわりに
この研究において,筆者らは,NFIAが褐色脂肪細胞の分化を制御する主要な転写因子であり,PPARγを含むほかの転写因子に先行してエンハンサーと結合しこれを活性化し,PPARγとの結合を促進することにより褐色脂肪細胞の遺伝子発現プログラムを制御することを見い出した(図1).現在の肥満症の薬物治療法および外科治療法はすべてエネルギー摂取の抑制という考え方にもとづく.NFIAの制御を介して褐色脂肪組織を増やすないしはたらきを高めることにより,エネルギー摂取の抑制ではなく,エネルギー消費の促進にもとづく肥満症,メタボリックシンドローム,肥満2型糖尿病の新しい治療法につながる可能性が期待される.
文 献
- Nedergaard, J., Bengtsson, T. & Cannon, B.: Unexpected evidence for active brown adipose tissue in adult humans. Am. J. Physiol. Endocrinol. Metab., 293, E444-E452 (2007)[PubMed]
- van Marken Lichtenbelt, W. D., Vanhommerig, J. W., Smulders, N. M. et al.: Cold-activated brown adipose tissue in healthy men. N. Engl. J. Med., 360, 1500-1508 (2009)[PubMed]
- Cypess, A. M., Lehman, S., Williams, G. et al.: Identification and importance of brown adipose tissue in adult humans. N. Engl. J. Med., 360, 1509-1517 (2009)[PubMed]
- Virtanen, K. A., Lidell, M. E., Orava, J. et al.: Functional brown adipose tissue in healthy adults. N. Engl. J. Med., 360, 1518-1525 (2009)[PubMed]
- Saito, M., Okamatsu-Ogura, Y., Matsushita, M. et al.: High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes, 58, 1526-1531 (2009)[PubMed]
- Yoneshiro, T., Aita, S., Matsushita, M. et al.: Age-related decrease in cold-activated brown adipose tissue and accumulation of body fat in healthy humans. Obesity, 19, 1755-1760 (2011)[PubMed]
- Seale, P., Bjork, B., Yang, W. et al.: PRDM16 controls a brown fat/skeletal muscle switch. Nature, 454, 961-967 (2008)[PubMed]
- Wu, J., Bostrom, P., Sparks, L. M. et al.: Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell, 150, 366-376 (2012)[PubMed]
- Giresi, P. G., Kim, J., McDaniell, R. M. et al.: FAIRE (formaldehyde-assisted isolation of regulatory elements) isolates active regulatory elements from human chromatin. Genome Res., 17, 877-885 (2007)[PubMed]
- das Neves, L., Duchala, C. S., Tolentino-Silva, F. et al.: Disruption of the murine nuclear factor I-A gene (Nfia) results in perinatal lethality, hydrocephalus, and agenesis of the corpus callosum. Proc. Natl. Acad. Sci. USA, 96, 11946-11951 (1999)[PubMed]
- Nagano, G., Ohno, H., Oki, K. et al.: Activation of classical brown adipocytes in the adult human perirenal depot is highly correlated with PRDM16-EHMT1 complex expression. PLoS One, 10, 1-13 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
脇 裕典(Hironori Waki)
東京大学大学院医学系研究科 特任准教授.
山内 敏正(Toshimasa Yamauchi)
東京大学大学院医学系研究科 准教授.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
© 2017 平池勇雄・脇 裕典・山内敏正・門脇 孝 Licensed under CC 表示 2.1 日本