分泌型および細胞内型のオステオポンチンによるミエロイド系細胞とリンパ球系細胞とのバランスの制御
金山剛士・篠原眞理
(米国Duke大学School of Medicine,Department of Immunology)
email:金山剛士,篠原眞理
DOI: 10.7875/first.author.2017.070
Skewing of the population balance of lymphoid and myeloid cells by secreted and intracellular osteopontin.
Masashi Kanayama, Shengjie Xu, Keiko Danzaki, Jason R. Gibson, Makoto Inoue, Simon G. Gregory, Mari L. Shinohara
Nature Immunology, 18, 973-984 (2017)
造血系は免疫細胞の産生および供給をつかさどっており,おのおのの細胞集団のバランスは緊密に制御される.オステオポンチンは多様な機能をもつ糖タンパク質であり,さまざまな生理機能や病態の進展に関与する.この研究において,筆者らは,炎症や真菌への感染においてオステオポンチンが好中球などのミエロイド系細胞の産生を抑制することを見い出し,その機序として,細胞内型のオステオポンチンがミエロイド系前駆細胞のアポトーシスを促進するという負の制御機構を発見した.その一方で,分泌型のオステオポンチンはT細胞やB細胞などのリンパ球系細胞に作用し,アポトーシスを抑制することによりその細胞集団の大きさを正に制御した.実際に,細胞内型オステオポンチンによるミエロイド系細胞の抑制は真菌の感染に対する抵抗性を減弱させ,分泌型オステオポンチンによるT細胞の増加はT細胞に依存的な大腸炎を悪化させた.このように,オステオポンチンの2つのアイソフォームが協調的に作用して,ミエロイド系細胞とリンパ球系細胞とのバランスを制御することが明らかにされた.
造血系は免疫細胞を産生することにより免疫応答を制御する.とりわけ,全身性の感染が惹起されると病原体を駆逐し危機を回避するため好中球や単球などの自然免疫細胞が大量に産生される.この緊急措置的な造血応答は“emergency myelopoiesis”とよばれ,正常な状態における造血とは明確に区別される1,2).emergency myelopoiesisは感染のほか,炎症や放射線の曝露などによっても誘導される.免疫細胞の過剰な産生や免疫バランスの崩壊を抑制するため,emergency myelopoiesisのような病的な状況における造血応答は精密に制御されると考えられるが,emergency myelopoiesisを制御する詳細な機構はいまだ明らかにされていない.
オステオポンチンはさまざまな細胞や組織において発現が認められ,炎症,感染,がんといった病態において発現の亢進する糖タンパク質である3-6).オステオポンチンには分泌型および細胞内型の2つのアイソフォームが存在し,これらは選択的な翻訳により同一のmRNAを鋳型として合成される5-7).分泌型のオステオポンチンは細胞外マトリックスタンパク質あるいは炎症性サイトカインとして機能し,細胞内型のオステオポンチンは細胞内におけるシグナル伝達に関与する足場タンパク質やアダプタータンパク質として機能する8-12).これまで,さまざまな病態においてオステオポンチンの機能が報告されてきたが,その大部分は分泌型オステオポンチンに注目したものであった.本研究において,筆者らは,骨髄に由来する細胞において細胞内型オステオポンチンを発現し分泌型オステオポンチンを発現しないマウスを新たに作製し,おのおののアイソフォームの機能を個別に解析することによりオステオポンチンの造血系における機能の解明を試みた.
正常な状態においてオステオポンチンがおのおのの造血系細胞の細胞集団の大きさにどのような影響をおよぼすのか検討するため,成熟したマウスの骨髄および胎仔のマウスの肝臓におけるおのおのの造血系細胞の細胞集団の大きさを,野生型のマウスとオステオポンチンノックアウトマウスとで比較した.その結果,野生型マウスおよびオステオポンチンノックアウトマウスにおいて,成熟した細胞および前駆細胞の細胞集団の大きさに変化はなかった.このことから,オステオポンチンは正常な状態においては造血系細胞のバランスの維持には寄与しないことが示された.しかしながら,野生型マウスに由来する骨髄細胞とオステオポンチンノックアウトマウスに由来する骨髄細胞を1対1で混ぜ合わせたのち,放射線を照射した野生型マウスに移植して骨髄キメラマウスを作製したところ,オステオポンチンを欠損したドナー細胞は野生型のドナー細胞と比較して,好中球,単球,マクロファージ,樹状細胞といったミエロイド系細胞において増加し,T細胞やB細胞などのリンパ球系細胞において減少した.同様の傾向は,骨髄だけでなく,脾臓,肝臓,肺,リンパ節,循環血においても確認された.
造血系にオステオポンチンが影響をおよぼすのではないかと推察し,同様に骨髄キメラマウスを作製して,多能性造血前駆細胞,共通ミエロイド前駆細胞,顆粒球マクロファージ前駆細胞,リンパ系共通前駆細胞においてオステオポンチンを欠損したドナー細胞と野生型のドナー細胞との割合を比較したところ,多能性造血前駆細胞,および,ミエロイド系前駆細胞である共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞においてはオステオポンチンを欠損したドナー細胞が多かった.しかしながら,リンパ系共通前駆細胞においては2つのドナー細胞の割合に大きな差はなかった.このように,オステオポンチンは骨髄移植ののちのミエロイド系細胞の産生を抑制することがわかった.
野生型マウスおよびオステオポンチンノックアウトマウスの骨髄から多能性造血前駆細胞や造血幹細胞を含むLSK細胞を選択的に単離し,1対1で混ぜ合わせたのち,放射線を照射した野生型マウスへと移植してLSK細胞キメラマウスを作製したところ,骨髄キメラマウスと同様に,オステオポンチンによりミエロイド系細胞の割合が低下した.この結果から,造血前駆細胞それ自体の産生するオステオポンチンがミエロイド系細胞を減少させ,ミエロイド系細胞の産生を負に制御することが示唆された.以上のように,骨髄移植ののちの免疫細胞の回復において,オステオポンチンがミエロイド系細胞とリンパ球系細胞のバランスを制御することが明らかにされた.
骨髄移植モデルにおいてオステオポンチンの欠損によりミエロイド系細胞の産生が抑制されたことから,炎症や感染におけるemergency myelopoiesisにもオステオポンチンが関与するのではないかと考えた.マウスの腹腔にチオグリコレートを投与して炎症を惹起した場合,投与後12時間で骨髄の好中球は炎症の局所への遊走により急激に減少するが,投与後24時間から48時間にかけて好中球の数は回復する.回復の開始する投与後24時間の段階ではミエロイド系前駆細胞が活発に増殖しており,emergency myelopoiesisが誘導されたことが確認された.この投与後24時間の時点においてemergency myelopoiesisに対するオステオポンチンの影響について検討したところ,オステオポンチンの欠損により好中球の数の回復は加速し,ミエロイド系前駆細胞である顆粒球マクロファージ前駆細胞の数も増加した.このことから,オステオポンチンはemergency myelopoiesisを抑制することが示された.
真菌の感染に対する生体防御において好中球などの自然免疫細胞が必須の機能を担うことから13,14),オステオポンチンが真菌の感染に対する感受性に影響をおよぼすかどうか検討した.その結果,チオグリコレートによる炎症モデルと同様に,全身性のカンジダの感染においてオステオポンチンによる好中球や顆粒球マクロファージ前駆細胞の減少が確認された.また,オステオポンチンの欠損は急性のカンジダの感染に対する致命率を低下させ,脾臓や腎臓におけるカンジダの増加を抑制し,組織の傷害も抑制した.以上のように,オステオポンチンは炎症や感染により誘導されるemergency myelopoiesisを負に制御することが示唆された.
オステオポンチンの細胞内型と分泌型のどちらのアイソフォームがミエロイド系細胞の産生を抑制するのか検討するため,細胞内型オステオポンチンのみを発現するマウスを作製した.オステオポンチンをコードするSpp1遺伝子からN末端側のコード領域に相当する45塩基を除いたΔ45Spp1遺伝子からは,シグナル配列のみを欠損する成熟したオステオポンチンが産生され,これは分泌されないことがわかっている7).このΔ45Spp1遺伝子を用いることにより,造血系細胞のみで細胞内型オステオポンチンが発現し,すべての細胞において分泌型オステオポンチンは発現しないマウスを作製した.このマウスを用いて骨髄移植やカンジダの感染における細胞内型オステオポンチンの機能を解析したところ,細胞内型オステオポンチンの発現によりオステオポンチンノックアウトマウスにおいてみられたミエロイド系細胞の過剰な産生が解除されたことから,オステオポンチンによるミエロイド系細胞の増加の抑制は細胞内型オステオポンチンにより仲介されることがわかった.
細胞内型オステオポンチンがemergency myelopoiesisにおいてミエロイド系細胞の産生を抑制する機構について調べるため,オステオポンチンが造血前駆細胞の分化能におよぼす影響について検討した.チオグリコレートの投与によりemergency myelopoiesisを誘導した野生型マウスあるいはオステオポンチンノックアウトマウスの骨髄から多能性造血前駆細胞を1細胞ソーティングにより単離し,サイトカインや増殖因子の存在下においてストローマ細胞と共培養することにより分化能について調べた.その結果,オステオポンチンを欠損した細胞は野生型の細胞と比較して顆粒球あるいはマクロファージとB細胞の両方へ分化する両能性が低下し,顆粒球あるいはマクロファージのみへ分化する単能性が上昇した.このように,オステオポンチンは顆粒球あるいはマクロファージへの分化を抑制することがわかった.
骨髄移植やチオグリコレートの投与によるemergency myelopoiesisの誘導ののち,カンジダの感染によるアポトーシスを同様に比較したところ,オステオポンチンの欠損により多能性造血前駆細胞,共通ミエロイド前駆細胞,顆粒球マクロファージ前駆細胞のアポトーシスが増加した.一方で,オステオポンチンはemergency myelopoiesisを誘導したのちのリンパ系共通前駆細胞,分化した好中球や単球,正常な状態における共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞において,アポトーシスに影響をおよぼさなかったことから,オステオポンチンによるアポトーシスの促進の効果は特定の細胞種や状況においてのみ発揮されると推察された.また,オステオポンチンは共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞の増殖には影響をおよぼさなかった.
オステオポンチンが造血前駆細胞のアポトーシスを促進する機序について検討するため,チオグリコレートによるemergency myelopoiesisの誘導ののち,多能性造血前駆細胞を単離し1細胞シークエンスによりクラスター解析したところ,オステオポンチンを欠損した細胞が優勢なクラスターでは抗アポトーシスタンパク質であるSurvivinをコードするBirc5遺伝子の発現が顕著に亢進した.そこで,カンジダの感染によるemergency myelopoiesisの誘導ののちの造血前駆細胞におけるBirc5遺伝子の発現を野生型の細胞とオステオポンチンを欠損した細胞とで比較したところ,オステオポンチンの欠損により顆粒球マクロファージ前駆細胞におけるBirc5遺伝子の発現およびSurvivinの発現が亢進した.一方,リンパ系共通前駆細胞や分化した好中球あるいは単球においてBirc5遺伝子の発現にオステオポンチンは影響をおよぼさず,アポトーシスについてみられた傾向と一致した.以上の結果から,オステオポンチンによるSurvivinの発現の抑制がミエロイド系前駆細胞におけるアポトーシスの促進を誘導する可能性が強く示唆された.このオステオポンチンによるアポトーシスの誘導,Birc5遺伝子の発現の亢進,ミエロイド系細胞の分化の抑制は細胞内型オステオポンチンのノックインマウスにおいてひき起されたことから,細胞内型オステオポンチンに仲介される現象であることも確認された.
野生型マウスにおいてemergency myelopoiesisが誘導されたときにオステオポンチンの発現がどのように制御されるか検討した.その結果,チオグリコレートの投与後24時間(emergency myelopoiesisの早期)にSpp1遺伝子の発現が顆粒球マクロファージ前駆細胞において一時的に低下した.オステオポンチンはemergency myelopoiesisを負に制御するため,Spp1遺伝子の発現の低下によるemergency myelopoiesisの抑制を解除する機構が存在するのではないかと推察し,顆粒球マクロファージ前駆細胞においてどのような要因によりSpp1遺伝子の発現が抑制されるのか検討した.emergency myelopoiesisや炎症に関与する複数のサイトカインや増殖因子により顆粒球マクロファージ前駆細胞を刺激したがSpp1遺伝子の発現は低下しなかった.一方,顆粒球マクロファージ前駆細胞やマクロファージの培養においては細胞の密度がSpp1遺伝子の発現と密接にかかわり,細胞の密度が低いとSpp1遺伝子の発現は低下することがわかった.これは,炎症に関連するほかのタンパク質においてはみられないオステオポンチンに特異的な現象であった.さらに解析を進めたところ,顆粒球マクロファージ前駆細胞はemergency myelopoiesisを誘導したのちEカドヘリンの発現を亢進させ,Eカドヘリンに依存的なMst1あるいはMst2を経由するHippo経路の活性化がSpp1遺伝子の発現を誘導することがわかった.すなわち,顆粒球マクロファージ前駆細胞はemergency myelopoiesisにともなう骨髄における細胞の密度の変化をEカドヘリン-Hippo経路を介して感知し,オステオポンチンの発現を変化させることによりミエロイド系細胞の産生を制御することが示唆された.
以上に述べた条件において,オステオポンチンの欠損はリンパ系共通前駆細胞の数やアポトーシスに影響をおよぼさなかった.そこで,オステオポンチンが分化したリンパ球に作用する可能性について検討したところ,骨髄移植モデルにおいて,T細胞やB細胞のアポトーシスがオステオポンチンにより抑制されることが見い出された.分化したリンパ球のみに焦点をあてて解析するため,T細胞およびB細胞の存在しないRag1ノックアウトマウスに野生型マウスあるいはオステオポンチンノックアウトマウスから回収したナイーブなT細胞をそれぞれ移入し,その増加におよぼすオステオポンチンの影響について検討した.その結果,ドナーT細胞におけるオステオポンチンの欠損は,レシピエントマウスがRag1ノックアウトマウスあるいはSpp1とRag1のダブルノックアウトマウスのいずれであっても,T細胞のアポトーシスを亢進し細胞の数を減少させた.さらに,このオステオポンチンによるT細胞の増加はT細胞に依存的な大腸炎の重篤度をいちじるしく高めた.また,B細胞をRag1ノックアウトマウスに移入することにより,オステオポンチンがB細胞の生存にも促進的な効果を発揮することが確認された.以上のように,T細胞やB細胞のようなリンパ球系細胞においてオステオポンチンはアポトーシス抑制能を示し,ミエロイド系前駆細胞において確認されたアポトーシス促進能とは正反対の機能を担うことがわかった.
この機能の違いから,ミエロイド系前駆細胞とは異なり,リンパ球系細胞においては分泌型のオステオポンチンがはたらくことが推察された.実際に,細胞内型オステオポンチンのみを発現させてもT細胞やB細胞のアポトーシスや細胞の数に影響をおよぼさず,T細胞に依存的な大腸炎も悪化させなかった.また,細胞内型オステオポンチンのみ,あるいは,細胞内型オステオポンチンおよび分泌型オステオポンチンを発現する骨髄細胞を移植した骨髄キメラマウスの比較において,細胞内型オステオポンチンさえ存在すれば分泌型オステオポンチンがなくてもミエロイド系細胞の数に変化はなかったが,リンパ球系細胞の数は減少した.さらに,オステオポンチンをT細胞の培養上清に添加することによりT細胞のアポトーシスが抑制された.以上の結果から,リンパ球系細胞においては細胞内型オステオポンチンではなく分泌型オステオポンチンが機能し,アポトーシスを抑制することが明らかにされた.
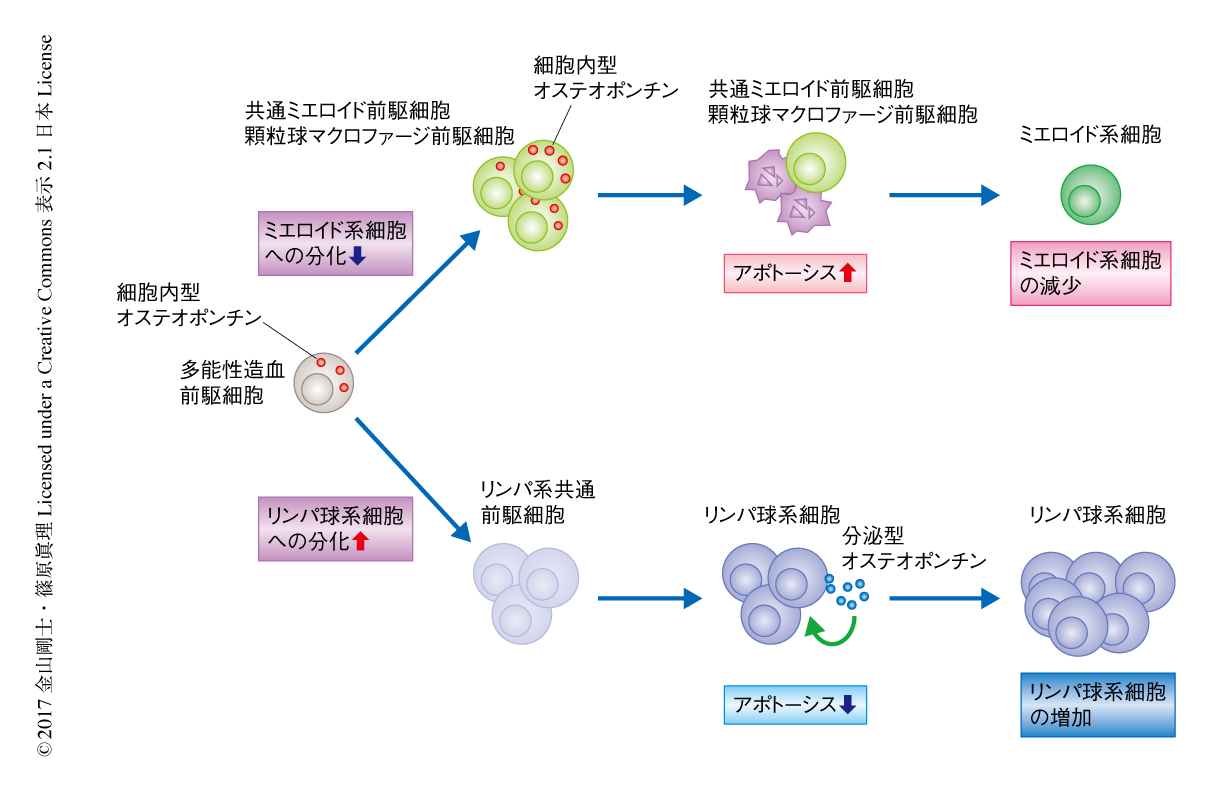
自然免疫を担う好中球や単球は比較的短命で,炎症や感染において使い捨てにされる運命にあり,骨髄における造血応答がその数に強く影響する.一方,T細胞やB細胞は骨髄で生み出されたのち2次リンパ組織へと移行し,抗原や炎症性因子の刺激に依存して末梢においてその数を増減させる.このように,細胞集団の大きさを制御する力点はおのおのの細胞集団において異なる.この研究において,同一のmRNAから合成されるオステオポンチンの2つの異なるアイソフォーム,細胞内型オステオポンチンと分泌型オステオポンチンとがそれぞれミエロイド系前駆細胞とリンパ球系細胞のアポトーシスにおいて正反対の機能を担うことにより,細胞集団の大きさを制御することが示された(図1).以上の結果から,オステオポンチンが炎症や感染などの危機的な環境において力点の異なる細胞集団の量的なバランスを統括的に制御する機能を担うことが示された.今後,細胞内型オステオポンチンと分泌型オステオポンチンとのあいだの発現のバランスがどのように制御されるのか調べるとともに,この2つのアイソフォームの機能をより詳細に解析することにより,オステオポンチンを介した生理機能の制御機構を解明したい.
略歴:2011年 北海道大学大学院医学研究科博士課程 修了,同年 米国Duke大学School of Medicineポスドクを経て,2017年より東京医科歯科大学難治疾患研究所 助教.
研究テーマ:マクロファージの機能および分化の機構.
関心事:研究助成金の申請.
篠原 眞理(Mari L. Shinohara)
米国Duke大学School of MedicineにてAssociate Professor.
研究室URL:https://immunology.duke.edu/people/mari-l-shinohara
? 2017 金山剛士・篠原眞理 Licensed under CC 表示 2.1 日本
(米国Duke大学School of Medicine,Department of Immunology)
email:金山剛士,篠原眞理
DOI: 10.7875/first.author.2017.070
Skewing of the population balance of lymphoid and myeloid cells by secreted and intracellular osteopontin.
Masashi Kanayama, Shengjie Xu, Keiko Danzaki, Jason R. Gibson, Makoto Inoue, Simon G. Gregory, Mari L. Shinohara
Nature Immunology, 18, 973-984 (2017)
この論文に出現する遺伝子・タンパク質のUniprot ID
オステオポンチン(P10923), osteopontin(P10923), 細胞外マトリックスタンパク質, 炎症性サイトカイン, 足場タンパク質, アダプタータンパク質, Spp1(20750), サイトカイン, Survivin(O70201), Birc5(O70201), Eカドヘリン(P09803), Mst1(Q9JI11), Mst2(Q9JI10), Hippo経路, Rag1(P15919)
要 約
造血系は免疫細胞の産生および供給をつかさどっており,おのおのの細胞集団のバランスは緊密に制御される.オステオポンチンは多様な機能をもつ糖タンパク質であり,さまざまな生理機能や病態の進展に関与する.この研究において,筆者らは,炎症や真菌への感染においてオステオポンチンが好中球などのミエロイド系細胞の産生を抑制することを見い出し,その機序として,細胞内型のオステオポンチンがミエロイド系前駆細胞のアポトーシスを促進するという負の制御機構を発見した.その一方で,分泌型のオステオポンチンはT細胞やB細胞などのリンパ球系細胞に作用し,アポトーシスを抑制することによりその細胞集団の大きさを正に制御した.実際に,細胞内型オステオポンチンによるミエロイド系細胞の抑制は真菌の感染に対する抵抗性を減弱させ,分泌型オステオポンチンによるT細胞の増加はT細胞に依存的な大腸炎を悪化させた.このように,オステオポンチンの2つのアイソフォームが協調的に作用して,ミエロイド系細胞とリンパ球系細胞とのバランスを制御することが明らかにされた.
はじめに
造血系は免疫細胞を産生することにより免疫応答を制御する.とりわけ,全身性の感染が惹起されると病原体を駆逐し危機を回避するため好中球や単球などの自然免疫細胞が大量に産生される.この緊急措置的な造血応答は“emergency myelopoiesis”とよばれ,正常な状態における造血とは明確に区別される1,2).emergency myelopoiesisは感染のほか,炎症や放射線の曝露などによっても誘導される.免疫細胞の過剰な産生や免疫バランスの崩壊を抑制するため,emergency myelopoiesisのような病的な状況における造血応答は精密に制御されると考えられるが,emergency myelopoiesisを制御する詳細な機構はいまだ明らかにされていない.
オステオポンチンはさまざまな細胞や組織において発現が認められ,炎症,感染,がんといった病態において発現の亢進する糖タンパク質である3-6).オステオポンチンには分泌型および細胞内型の2つのアイソフォームが存在し,これらは選択的な翻訳により同一のmRNAを鋳型として合成される5-7).分泌型のオステオポンチンは細胞外マトリックスタンパク質あるいは炎症性サイトカインとして機能し,細胞内型のオステオポンチンは細胞内におけるシグナル伝達に関与する足場タンパク質やアダプタータンパク質として機能する8-12).これまで,さまざまな病態においてオステオポンチンの機能が報告されてきたが,その大部分は分泌型オステオポンチンに注目したものであった.本研究において,筆者らは,骨髄に由来する細胞において細胞内型オステオポンチンを発現し分泌型オステオポンチンを発現しないマウスを新たに作製し,おのおののアイソフォームの機能を個別に解析することによりオステオポンチンの造血系における機能の解明を試みた.
1.オステオポンチンはミエロイド系細胞とリンパ球系細胞とのバランスの保持に機能する
正常な状態においてオステオポンチンがおのおのの造血系細胞の細胞集団の大きさにどのような影響をおよぼすのか検討するため,成熟したマウスの骨髄および胎仔のマウスの肝臓におけるおのおのの造血系細胞の細胞集団の大きさを,野生型のマウスとオステオポンチンノックアウトマウスとで比較した.その結果,野生型マウスおよびオステオポンチンノックアウトマウスにおいて,成熟した細胞および前駆細胞の細胞集団の大きさに変化はなかった.このことから,オステオポンチンは正常な状態においては造血系細胞のバランスの維持には寄与しないことが示された.しかしながら,野生型マウスに由来する骨髄細胞とオステオポンチンノックアウトマウスに由来する骨髄細胞を1対1で混ぜ合わせたのち,放射線を照射した野生型マウスに移植して骨髄キメラマウスを作製したところ,オステオポンチンを欠損したドナー細胞は野生型のドナー細胞と比較して,好中球,単球,マクロファージ,樹状細胞といったミエロイド系細胞において増加し,T細胞やB細胞などのリンパ球系細胞において減少した.同様の傾向は,骨髄だけでなく,脾臓,肝臓,肺,リンパ節,循環血においても確認された.
造血系にオステオポンチンが影響をおよぼすのではないかと推察し,同様に骨髄キメラマウスを作製して,多能性造血前駆細胞,共通ミエロイド前駆細胞,顆粒球マクロファージ前駆細胞,リンパ系共通前駆細胞においてオステオポンチンを欠損したドナー細胞と野生型のドナー細胞との割合を比較したところ,多能性造血前駆細胞,および,ミエロイド系前駆細胞である共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞においてはオステオポンチンを欠損したドナー細胞が多かった.しかしながら,リンパ系共通前駆細胞においては2つのドナー細胞の割合に大きな差はなかった.このように,オステオポンチンは骨髄移植ののちのミエロイド系細胞の産生を抑制することがわかった.
野生型マウスおよびオステオポンチンノックアウトマウスの骨髄から多能性造血前駆細胞や造血幹細胞を含むLSK細胞を選択的に単離し,1対1で混ぜ合わせたのち,放射線を照射した野生型マウスへと移植してLSK細胞キメラマウスを作製したところ,骨髄キメラマウスと同様に,オステオポンチンによりミエロイド系細胞の割合が低下した.この結果から,造血前駆細胞それ自体の産生するオステオポンチンがミエロイド系細胞を減少させ,ミエロイド系細胞の産生を負に制御することが示唆された.以上のように,骨髄移植ののちの免疫細胞の回復において,オステオポンチンがミエロイド系細胞とリンパ球系細胞のバランスを制御することが明らかにされた.
2.細胞内型オステオポンチンは真菌の感染におけるミエロイド系細胞の増加を抑制する
骨髄移植モデルにおいてオステオポンチンの欠損によりミエロイド系細胞の産生が抑制されたことから,炎症や感染におけるemergency myelopoiesisにもオステオポンチンが関与するのではないかと考えた.マウスの腹腔にチオグリコレートを投与して炎症を惹起した場合,投与後12時間で骨髄の好中球は炎症の局所への遊走により急激に減少するが,投与後24時間から48時間にかけて好中球の数は回復する.回復の開始する投与後24時間の段階ではミエロイド系前駆細胞が活発に増殖しており,emergency myelopoiesisが誘導されたことが確認された.この投与後24時間の時点においてemergency myelopoiesisに対するオステオポンチンの影響について検討したところ,オステオポンチンの欠損により好中球の数の回復は加速し,ミエロイド系前駆細胞である顆粒球マクロファージ前駆細胞の数も増加した.このことから,オステオポンチンはemergency myelopoiesisを抑制することが示された.
真菌の感染に対する生体防御において好中球などの自然免疫細胞が必須の機能を担うことから13,14),オステオポンチンが真菌の感染に対する感受性に影響をおよぼすかどうか検討した.その結果,チオグリコレートによる炎症モデルと同様に,全身性のカンジダの感染においてオステオポンチンによる好中球や顆粒球マクロファージ前駆細胞の減少が確認された.また,オステオポンチンの欠損は急性のカンジダの感染に対する致命率を低下させ,脾臓や腎臓におけるカンジダの増加を抑制し,組織の傷害も抑制した.以上のように,オステオポンチンは炎症や感染により誘導されるemergency myelopoiesisを負に制御することが示唆された.
オステオポンチンの細胞内型と分泌型のどちらのアイソフォームがミエロイド系細胞の産生を抑制するのか検討するため,細胞内型オステオポンチンのみを発現するマウスを作製した.オステオポンチンをコードするSpp1遺伝子からN末端側のコード領域に相当する45塩基を除いたΔ45Spp1遺伝子からは,シグナル配列のみを欠損する成熟したオステオポンチンが産生され,これは分泌されないことがわかっている7).このΔ45Spp1遺伝子を用いることにより,造血系細胞のみで細胞内型オステオポンチンが発現し,すべての細胞において分泌型オステオポンチンは発現しないマウスを作製した.このマウスを用いて骨髄移植やカンジダの感染における細胞内型オステオポンチンの機能を解析したところ,細胞内型オステオポンチンの発現によりオステオポンチンノックアウトマウスにおいてみられたミエロイド系細胞の過剰な産生が解除されたことから,オステオポンチンによるミエロイド系細胞の増加の抑制は細胞内型オステオポンチンにより仲介されることがわかった.
3.細胞内型オステオポンチンによるミエロイド系前駆細胞の産生の抑制機構およびオステオポンチンの発現の制御機構
細胞内型オステオポンチンがemergency myelopoiesisにおいてミエロイド系細胞の産生を抑制する機構について調べるため,オステオポンチンが造血前駆細胞の分化能におよぼす影響について検討した.チオグリコレートの投与によりemergency myelopoiesisを誘導した野生型マウスあるいはオステオポンチンノックアウトマウスの骨髄から多能性造血前駆細胞を1細胞ソーティングにより単離し,サイトカインや増殖因子の存在下においてストローマ細胞と共培養することにより分化能について調べた.その結果,オステオポンチンを欠損した細胞は野生型の細胞と比較して顆粒球あるいはマクロファージとB細胞の両方へ分化する両能性が低下し,顆粒球あるいはマクロファージのみへ分化する単能性が上昇した.このように,オステオポンチンは顆粒球あるいはマクロファージへの分化を抑制することがわかった.
骨髄移植やチオグリコレートの投与によるemergency myelopoiesisの誘導ののち,カンジダの感染によるアポトーシスを同様に比較したところ,オステオポンチンの欠損により多能性造血前駆細胞,共通ミエロイド前駆細胞,顆粒球マクロファージ前駆細胞のアポトーシスが増加した.一方で,オステオポンチンはemergency myelopoiesisを誘導したのちのリンパ系共通前駆細胞,分化した好中球や単球,正常な状態における共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞において,アポトーシスに影響をおよぼさなかったことから,オステオポンチンによるアポトーシスの促進の効果は特定の細胞種や状況においてのみ発揮されると推察された.また,オステオポンチンは共通ミエロイド前駆細胞や顆粒球マクロファージ前駆細胞の増殖には影響をおよぼさなかった.
オステオポンチンが造血前駆細胞のアポトーシスを促進する機序について検討するため,チオグリコレートによるemergency myelopoiesisの誘導ののち,多能性造血前駆細胞を単離し1細胞シークエンスによりクラスター解析したところ,オステオポンチンを欠損した細胞が優勢なクラスターでは抗アポトーシスタンパク質であるSurvivinをコードするBirc5遺伝子の発現が顕著に亢進した.そこで,カンジダの感染によるemergency myelopoiesisの誘導ののちの造血前駆細胞におけるBirc5遺伝子の発現を野生型の細胞とオステオポンチンを欠損した細胞とで比較したところ,オステオポンチンの欠損により顆粒球マクロファージ前駆細胞におけるBirc5遺伝子の発現およびSurvivinの発現が亢進した.一方,リンパ系共通前駆細胞や分化した好中球あるいは単球においてBirc5遺伝子の発現にオステオポンチンは影響をおよぼさず,アポトーシスについてみられた傾向と一致した.以上の結果から,オステオポンチンによるSurvivinの発現の抑制がミエロイド系前駆細胞におけるアポトーシスの促進を誘導する可能性が強く示唆された.このオステオポンチンによるアポトーシスの誘導,Birc5遺伝子の発現の亢進,ミエロイド系細胞の分化の抑制は細胞内型オステオポンチンのノックインマウスにおいてひき起されたことから,細胞内型オステオポンチンに仲介される現象であることも確認された.
野生型マウスにおいてemergency myelopoiesisが誘導されたときにオステオポンチンの発現がどのように制御されるか検討した.その結果,チオグリコレートの投与後24時間(emergency myelopoiesisの早期)にSpp1遺伝子の発現が顆粒球マクロファージ前駆細胞において一時的に低下した.オステオポンチンはemergency myelopoiesisを負に制御するため,Spp1遺伝子の発現の低下によるemergency myelopoiesisの抑制を解除する機構が存在するのではないかと推察し,顆粒球マクロファージ前駆細胞においてどのような要因によりSpp1遺伝子の発現が抑制されるのか検討した.emergency myelopoiesisや炎症に関与する複数のサイトカインや増殖因子により顆粒球マクロファージ前駆細胞を刺激したがSpp1遺伝子の発現は低下しなかった.一方,顆粒球マクロファージ前駆細胞やマクロファージの培養においては細胞の密度がSpp1遺伝子の発現と密接にかかわり,細胞の密度が低いとSpp1遺伝子の発現は低下することがわかった.これは,炎症に関連するほかのタンパク質においてはみられないオステオポンチンに特異的な現象であった.さらに解析を進めたところ,顆粒球マクロファージ前駆細胞はemergency myelopoiesisを誘導したのちEカドヘリンの発現を亢進させ,Eカドヘリンに依存的なMst1あるいはMst2を経由するHippo経路の活性化がSpp1遺伝子の発現を誘導することがわかった.すなわち,顆粒球マクロファージ前駆細胞はemergency myelopoiesisにともなう骨髄における細胞の密度の変化をEカドヘリン-Hippo経路を介して感知し,オステオポンチンの発現を変化させることによりミエロイド系細胞の産生を制御することが示唆された.
4.分泌型オステオポンチンはリンパ球系細胞の増加を促進する
以上に述べた条件において,オステオポンチンの欠損はリンパ系共通前駆細胞の数やアポトーシスに影響をおよぼさなかった.そこで,オステオポンチンが分化したリンパ球に作用する可能性について検討したところ,骨髄移植モデルにおいて,T細胞やB細胞のアポトーシスがオステオポンチンにより抑制されることが見い出された.分化したリンパ球のみに焦点をあてて解析するため,T細胞およびB細胞の存在しないRag1ノックアウトマウスに野生型マウスあるいはオステオポンチンノックアウトマウスから回収したナイーブなT細胞をそれぞれ移入し,その増加におよぼすオステオポンチンの影響について検討した.その結果,ドナーT細胞におけるオステオポンチンの欠損は,レシピエントマウスがRag1ノックアウトマウスあるいはSpp1とRag1のダブルノックアウトマウスのいずれであっても,T細胞のアポトーシスを亢進し細胞の数を減少させた.さらに,このオステオポンチンによるT細胞の増加はT細胞に依存的な大腸炎の重篤度をいちじるしく高めた.また,B細胞をRag1ノックアウトマウスに移入することにより,オステオポンチンがB細胞の生存にも促進的な効果を発揮することが確認された.以上のように,T細胞やB細胞のようなリンパ球系細胞においてオステオポンチンはアポトーシス抑制能を示し,ミエロイド系前駆細胞において確認されたアポトーシス促進能とは正反対の機能を担うことがわかった.
この機能の違いから,ミエロイド系前駆細胞とは異なり,リンパ球系細胞においては分泌型のオステオポンチンがはたらくことが推察された.実際に,細胞内型オステオポンチンのみを発現させてもT細胞やB細胞のアポトーシスや細胞の数に影響をおよぼさず,T細胞に依存的な大腸炎も悪化させなかった.また,細胞内型オステオポンチンのみ,あるいは,細胞内型オステオポンチンおよび分泌型オステオポンチンを発現する骨髄細胞を移植した骨髄キメラマウスの比較において,細胞内型オステオポンチンさえ存在すれば分泌型オステオポンチンがなくてもミエロイド系細胞の数に変化はなかったが,リンパ球系細胞の数は減少した.さらに,オステオポンチンをT細胞の培養上清に添加することによりT細胞のアポトーシスが抑制された.以上の結果から,リンパ球系細胞においては細胞内型オステオポンチンではなく分泌型オステオポンチンが機能し,アポトーシスを抑制することが明らかにされた.
おわりに
自然免疫を担う好中球や単球は比較的短命で,炎症や感染において使い捨てにされる運命にあり,骨髄における造血応答がその数に強く影響する.一方,T細胞やB細胞は骨髄で生み出されたのち2次リンパ組織へと移行し,抗原や炎症性因子の刺激に依存して末梢においてその数を増減させる.このように,細胞集団の大きさを制御する力点はおのおのの細胞集団において異なる.この研究において,同一のmRNAから合成されるオステオポンチンの2つの異なるアイソフォーム,細胞内型オステオポンチンと分泌型オステオポンチンとがそれぞれミエロイド系前駆細胞とリンパ球系細胞のアポトーシスにおいて正反対の機能を担うことにより,細胞集団の大きさを制御することが示された(図1).以上の結果から,オステオポンチンが炎症や感染などの危機的な環境において力点の異なる細胞集団の量的なバランスを統括的に制御する機能を担うことが示された.今後,細胞内型オステオポンチンと分泌型オステオポンチンとのあいだの発現のバランスがどのように制御されるのか調べるとともに,この2つのアイソフォームの機能をより詳細に解析することにより,オステオポンチンを介した生理機能の制御機構を解明したい.
文 献
- Manz, M. G. & Boettcher, S.: Emergency granulopoiesis. Nat. Rev. Immunol., 14, 302-314 (2014)[PubMed]
- Takizawa, H., Boettcher, S. & Manz, M. G.: Demand-adapted regulation of early hematopoiesis in infection and inflammation. Blood, 119, 2991-3002 (2012)[PubMed]
- Rittling, S. R. & Singh, R.: Osteopontin in immune-mediated diseases. J. Dent. Res., 94, 1638-1645 (2015)[PubMed]
- Uede, T.: Osteopontin, intrinsic tissue regulator of intractable inflammatory diseases. Pathol. Int., 61, 265-280 (2011)[PubMed]
- Cantor, H. & Shinohara, M. L.: Regulation of T-helper-cell lineage development by osteopontin: the inside story. Nat. Rev. Immunol., 9, 137-141 (2009)[PubMed]
- Inoue, M. & Shinohara, M. L.: Intracellular osteopontin (iOPN) and immunity. Immunol. Res., 49, 160-172 (2011)[PubMed]
- Shinohara, M. L., Kim, H. J., Kim, J. H. et al.: Alternative translation of osteopontin generates intracellular and secreted isoforms that mediate distinct biological activities in dendritic cells. Proc. Natl. Acad. Sci. USA, 105, 7235-7239 (2008)[PubMed]
- Shinohara, M. L., Lu, L., Bu, J. et al.: Osteopontin expression is essential for interferon-α production by plasmacytoid dendritic cells. Nat. Immunol., 7, 498-506 (2006)[PubMed]
- Shinohara, M. L., Kim, J. H., Garcia, V. A. et al.: Engagement of the type I interferon receptor on dendritic cells inhibits T helper 17 cell development: role of intracellular osteopontin. Immunity, 29, 68-78 (2008)[PubMed]
- Inoue, M., Moriwaki, Y., Arikawa, T. et al.: Cutting edge: critical role of intracellular osteopontin in antifungal innate immune responses. J. Immunol., 186, 19-23 (2011)[PubMed]
- Inoue, M., Arikawa, T., Chen, Y. H. et al.: T cells down-regulate macrophage TNF production by IRAK1-mediated IL-10 expression and control innate hyperinflammation. Proc. Natl. Acad. Sci. USA, 111, 5295-5300 (2014)[PubMed]
- Leavenworth, J. W., Verbinnen, B., Yin, J. et al.: p85α-osteopontin axis couples the receptor ICOS to sustained Bcl-6 expression by follicular helper and regulatory T cells. Nat. Immunol., 16, 96-106 (2015)[PubMed]
- Kanayama, M., Inoue, M., Danzaki, K. et al.: Autophagy enhances NFκB activity in specific tissue macrophages by sequestering A20 to boost antifungal immunity. Nat. Commun., 6, 5779 (2015)[PubMed]
- Walsh, T. J. & Gamaletsou, M. N.: Treatment of fungal disease in the setting of neutropenia. Hematology Am. Soc. Hematol. Educ. Program, 2013, 423-427 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 北海道大学大学院医学研究科博士課程 修了,同年 米国Duke大学School of Medicineポスドクを経て,2017年より東京医科歯科大学難治疾患研究所 助教.
研究テーマ:マクロファージの機能および分化の機構.
関心事:研究助成金の申請.
篠原 眞理(Mari L. Shinohara)
米国Duke大学School of MedicineにてAssociate Professor.
研究室URL:https://immunology.duke.edu/people/mari-l-shinohara
? 2017 金山剛士・篠原眞理 Licensed under CC 表示 2.1 日本