反応性アストロサイトと1型コラーゲンとの相互作用はインテグリン-Nカドヘリン経路を介して脊髄損傷ののちのアストロサイト瘢痕の形成をひき起こす
原 正光・岡田誠司
(九州大学大学院医学研究院 整形外科学分野)
email:岡田誠司
DOI: 10.7875/first.author.2017.067
Interaction of reactive astrocytes with type I collagen induces astrocytic scar formation through the integrin-N-cadherin pathway after spinal cord injury.
Masamitsu Hara, Kazu Kobayakawa, Yasuyuki Ohkawa, Hiromi Kumamaru, Kazuya Yokota, Takeyuki Saito, Ken Kijima, Shingo Yoshizaki, Katsumi Harimaya, Yasuharu Nakashima, Seiji Okada
Nature Medicine, 23, 818-828 (2017)
中枢神経の損傷は脊髄に豊富に存在する正常なアストロサイトを反応性アストロサイトへと変化させ,反応性アストロサイトは最終的に軸索の再生や機能の回復を阻害する瘢痕形成アストロサイトになる.反応性アストログリオーシスとして知られるこの連続的な表現型の変化は一方向性であり不可逆的であると長く考えられてきた.しかし,この研究において,筆者らは,反応性アストロサイトは正常な脊髄に移植されると正常なアストロサイトにもどるが,損傷した脊髄に移植されるとアストロサイト瘢痕を形成することを見い出し,反応性アストログリオーシスの環境に依存的な可塑性を示した.また,1型コラーゲンは瘢痕の形成期において脊髄に高く発現し,インテグリン-Nカドヘリン経路を介してアストロサイト瘢痕の形成をひき起こした.さらに,反応性アストロサイトと1型コラーゲンとの相互作用を阻害するとアストロサイト瘢痕の形成が抑制され,軸索の再生および機能の回復は促進された.今回の研究により,中枢神経の損傷における治療の新たな標的が示唆された.
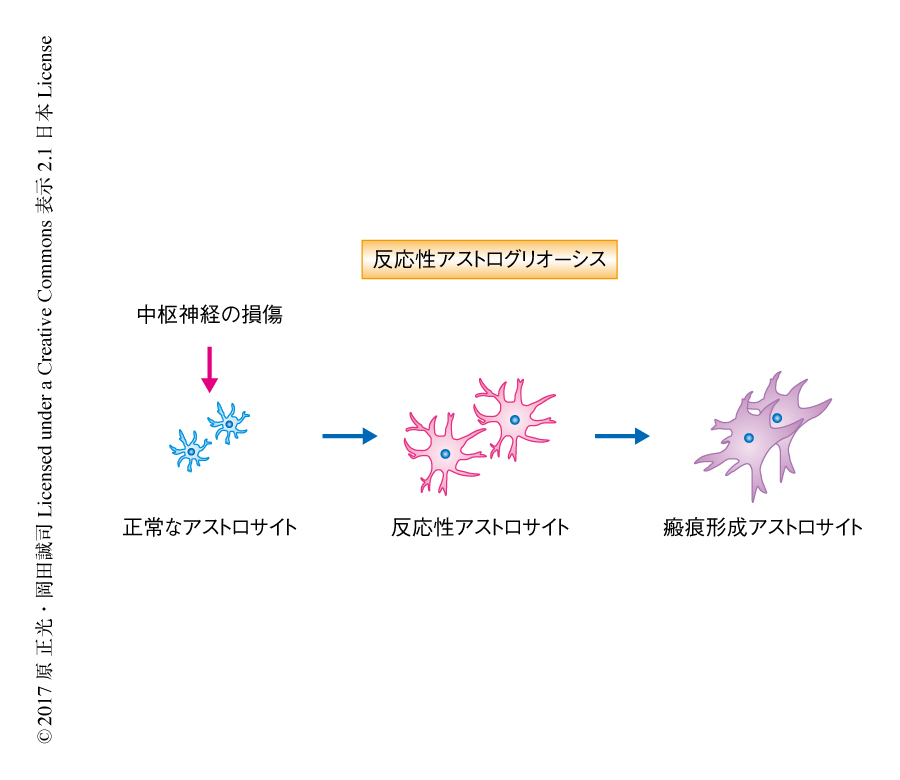
脊髄損傷は永続的な四肢の麻痺や感覚の障害を中心としてさまざまな合併症をひき起こす.脊髄が損傷したのち,中枢神経にもっとも豊富に存在する細胞であるアストロサイトは反応性アストログリオーシスとして知られる表現型の変化を起こすことにより脊髄損傷の病態において重要な役割をはたす.反応性アストログリオーシスの過程において,正常なアストロサイトは経時的に,反応性アストロサイト,そののち,瘢痕形成アストロサイトへと変化する(図1).脊髄損傷の亜急性期において,反応性アストロサイトは損傷の中心部へと遊走して炎症を起こした細胞を隔離し組織の修復および機能の回復をもたらす1).しかし,反応性アストロサイトは中枢神経の損傷ののちの軸索の再生のおもな阻害因子であるアストロサイト瘢痕を形成する瘢痕形成アストロサイトへと徐々に変化し,脊髄損傷の慢性期における機能の回復を阻害してしまう2).アストロサイト瘢痕は不可逆的であり,げっ歯類やヒトの脊髄損傷において永続的に軸索の再生を阻害するとされる3).したがって,アストロサイト瘢痕の形成の機構を解明しそれを制御することは脊髄損傷の新しい治療の戦略の発展に役だつと考えられた.
アストロサイト瘢痕は半世紀以上ものあいだ研究されており4),その形成は細胞間および細胞内の複雑なシグナル伝達系により制御されると提案されてきた2).しかし,多くの研究においてアストロサイトの変化が検証されたにもかかわらず,アストロサイト瘢痕の形成の機構については明らかにされていない.その解明をさまたげる要因のひとつは,正常なアストロサイト,反応性アストロサイト,瘢痕形成アストロサイトの明確な定義がないことである.これまで,これらは組織学的な解析により区別されてきたが,この方法は客観的でも定量的でもない.そこで,筆者らは,マーカー遺伝子の発現にもとづき正常アストロサイト,反応性アストロサイト,瘢痕形成アストロサイトを明確に定義し,脊髄損傷ののちのアストロサイト瘢痕の形成の制御機構について検討した.
ヒトの脊髄損傷に近いモデルである脊髄圧挫損傷モデルマウスを用いて,免疫染色法およびレーザーマイクロダイセクション法を組み合わせ,正常な脊髄から正常なアストロサイト,損傷ののち7日目の脊髄から反応性アストロサイト,損傷ののち14日目の脊髄から瘢痕形成アストロサイトを採取した.反応性アストロサイトあるいは瘢痕形成アストロサイトに特徴的な遺伝子として報告のある遺伝子の発現を測定し,それぞれのアストロサイトにおいて有意かつ選択的に発現の上昇した遺伝子をマーカー遺伝子と定義した.
反応性アストロサイトにおいてNes遺伝子およびβカテニンをコードするCtnnb1遺伝子の発現の有意な上昇が確認された.くわえて,βカテニンに関連する遺伝子が機能的な観点から反応性アストロサイトのマーカー遺伝子として適切であることが見い出された.脊髄損傷において反応性アストロサイトの遊走は組織の修復および機能の回復に重要であり1),最近になり,βカテニンが核へと移行したのち,βカテニン-LEF-TCF複合体がウロキナーゼ型プラスミノゲン活性化因子受容体をコードする遺伝子のエンハンサーと結合し,マトリックスメタロプロテアーゼの活性化および細胞の遊走をひき起こす機構が報告されている5).実際に,ウロキナーゼ型プラスミノゲン活性化因子受容体をコードするPlaur遺伝子,マトリックスメタロプロテアーゼをコードするMmp2遺伝子およびMmp13遺伝子の発現が反応性アストロサイトにおいて選択的に上昇していた.さらに,βカテニンの負のフィードバック制御遺伝子であるAxin2遺伝子の発現も反応性アストロサイトにおいて有意に上昇していた.以上の結果から,Nes遺伝子,Ctnnb1遺伝子,Plaur遺伝子,Mmp2遺伝子,Mmp13遺伝子,Axin2遺伝子が反応性アストロサイトのマーカー遺伝子と定義され,βカテニン-マトリックスメタロプロテアーゼシグナル伝達系を介して反応性アストロサイトが遊走する機構の可能性が示唆された.
瘢痕形成アストロサイトについても同様に解析し,NカドヘリンをコードするCdh2遺伝子およびSox9遺伝子が瘢痕形成アストロサイトのマーカー遺伝子と定義された.また,コンドロイチン硫酸プロテオグリカンは軸索の再生においてもっとも豊富な細胞外の阻害因子であり,その発現は脊髄損傷ののちのアストロサイト瘢痕の領域においてみられる2).瘢痕形成アストロサイトにおいて,Xylt1遺伝子,Chst11遺伝子,Csgalnact1遺伝子,Acan遺伝子,Pcan遺伝子というコンドロイチン硫酸プロテオグリカンに関連する遺伝子の有意な発現の上昇が検出された.くわえて,反発性の軸索ガイダンスタンパク質をコードするSlit2遺伝子も瘢痕形成アストロサイトのマーカー遺伝子の条件をみたした.反応性アストログリオーシスは遺伝子の発現および形態が段階的かつ連続して変化するため,形態学的な定義とマーカー遺伝子のプロファイルとを組み合わせることはアストロサイトの表現型を特定するのに有用であると考えられた.
哺乳類の細胞における表現型の変化はおおよそ細胞自律性あるいは細胞非自律性であるが6),反応性アストログリオーシスの機構はわかっていない.この機構を明らかにするため,マウスの初代培養アストロサイトから得たアストロサイトをマウスの正常な脊髄あるいは脊髄圧挫損傷モデルマウスの損傷の直後の脊髄に移植した.移植された正常なアストロサイトは,正常な脊髄においては形態学的な変化を起こさなかったが,損傷した脊髄においては宿主のアストロサイトとともに変化し,最終的にアストロサイト瘢痕を形成した.さらに,このような形態学的な変化と一致して,正常な脊髄に移植されたアストロサイトにおいてマーカー遺伝子の発現は変化しなかったが,損傷した脊髄に移植すると,移植ののち7日目に反応性アストロサイトのマーカー遺伝子の発現が,移植ののち14日目に瘢痕形成アストロサイトのマーカー遺伝子が有意に上昇した.以上の結果から,脊髄損傷ののちにアストロサイトは環境に依存して表現型を変化させることが明らかにされた.
反応性アストログリオーシスが環境に依存性の反応であるなら,反応性アストロサイトを正常な脊髄へ移植すると正常なアストロサイトにもどるとの仮説をたてた.反応性アストロサイトを選択的に分離するため,マーカー遺伝子と定義されたNes遺伝子の発現がGFPの蛍光によりモニターされるトランスジェニックマウスを作製した1).このマウスの脊髄圧挫損傷モデルにおいて損傷ののち7日目の脊髄を採取して分散し,蛍光セルソーターによりGFP陽性を示す反応性アストロサイトを選択的に分離し,正常な脊髄あるいは損傷した脊髄に移植した.組織学的にも遺伝子学的にも,移植された反応性アストロサイトは損傷した脊髄に移植したときには瘢痕形成アストロサイトへと変化したが,正常な脊髄に移植したときには正常なアストロサイトにもどった.以上の結果から,反応性アストログリオーシスは特定の状況においては可逆的であることがわかった.
脊髄損傷の病態において反応性アストロサイトは有益であるが瘢痕形成アストロサイトは有害であるため,環境的な制御を介して反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害することは脊髄損傷における治療の新しい戦略になると考えた.そして,反応性アストロサイトの運命は正常な脊髄と損傷した脊髄とのあいだの環境の違いにより決定されると推測した.
正常な脊髄および損傷した脊髄においてゲノムの全体にわたり遺伝子の発現を解析したところ,損傷ののち14日目に細胞外マトリックスに関連する遺伝子の発現が劇的に上昇した.なかでも,1型コラーゲンをコードするCol1a1遺伝子およびCol1a2遺伝子がもっとも高く発現していた.さらに,免疫組織学的な解析により,アストロサイト瘢痕は1型コラーゲンと共局在する瘢痕形成アストロサイトにより形成されていたが,1型コラーゲンが存在しない領域のアストロサイトはアストロサイト瘢痕を形成していなかった.以上の結果から,1型コラーゲンは反応性アストロサイトから瘢痕形成アストロサイトへの変化およびアストロサイト瘢痕の形成に直接に関与することが示唆された.
反応性アストロサイトから瘢痕形成アストロサイトへの変化における1型コラーゲンの影響について明らかにするために,1型コラーゲンをコートしたあるいはコートしていないディッシュにおいて反応性アストロサイトを培養した.その結果,1型コラーゲンをコートしていないディッシュの反応性アストロサイトは突起の退縮およびGFAPの発現の低下という正常なアストロサイトに似た表現型を示したのに対し,1型コラーゲンをコートしたディッシュの反応性アストロサイトはとなりあうアストロサイトと接着しGFAPの発現が上昇するという瘢痕形成アストロサイトに似た表現型を示した.くわえて,1型コラーゲンをコートしたディッシュの反応性アストロサイトにのみ瘢痕形成アストロサイトの特徴であるNカドヘリンの発現の有意な上昇が認められた.アストロサイトはNカドヘリンを介して接着すること7),アストロサイト瘢痕においてNカドヘリンの発現が上昇すること8) を考えると,これらの結果から,1型コラーゲンが反応性アストロサイトにおいてNカドヘリンによる細胞間の接着を増強させ,反応性アストロサイトから瘢痕形成アストロサイトへの変化をひき起こすことが示唆された.
さらに,細胞と1型コラーゲンとの相互作用において重要な役割をはたすコラーゲン結合インテグリンに対する抗体を,1型コラーゲンをコートしたディッシュにて培養した反応性アストロサイトに投与した.その結果,反応性アストロサイトは分散したままで,NカドヘリンおよびGFAPの発現は変化しなかった.さらに,抗Nカドヘリン中和抗体は同様な状況において反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害した.以上の結果から,1型コラーゲンがインテグリン-Nカドヘリン経路を介して反応性アストロサイトから瘢痕形成アストロサイトへの変化をひき起こすことが明らかにされた.
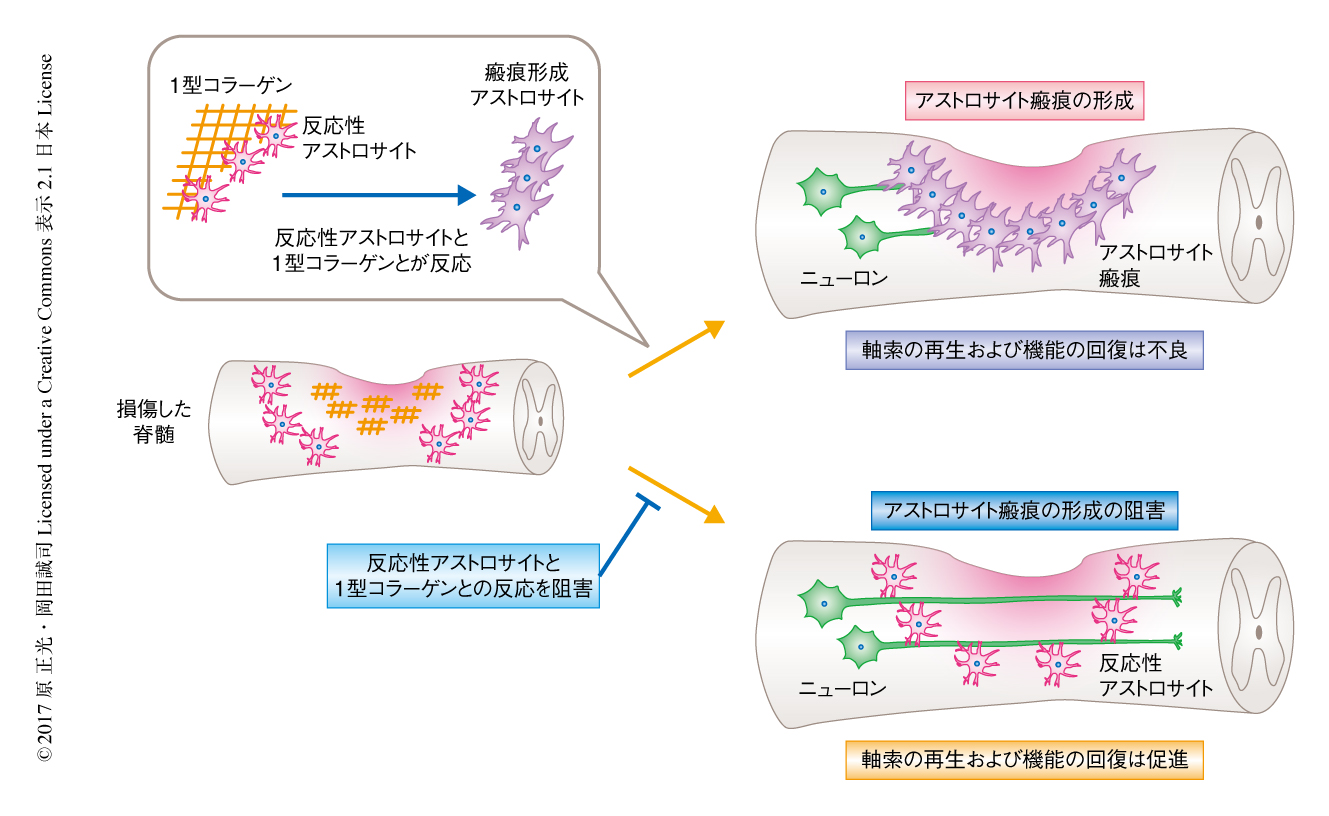
治療的な観点からは,反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害することにより,実際に,脊髄損傷ののちのアストロサイト瘢痕の形成が抑制され機能の回復が促進されるかは重要である.そこで,in vivoにおいて,インテグリンを介した反応性アストロサイトと1型コラーゲンとの相互作用の阻害による脊髄損傷ののちのアストロサイト瘢痕の形成および機能の回復について検証した.コラーゲン結合インテグリンに対する抗体の投与により,アストロサイトにおけるNカドヘリンおよびGFAPの発現は有意に低下し,結果として,細胞間の接着が低下しアストロサイト瘢痕の形成が抑制された.また,同様に,抗Nカドヘリン中和抗体の投与によりアストロサイト瘢痕の形成が抑制された.くわえて,コラーゲン結合インテグリンに対する抗体の投与により,再生した軸索のマーカーであるGAP43に陽性の軸索の数が有意に増加した.セロトニン陽性の軸索およびチロシン水酸化酵素陽性の軸索の数も有意に増加しており,これらの軸索のほとんどはGAP43を発現していた.このことから,アストロサイト瘢痕の形成を抑制することにより,損傷した脊髄の中心部を通過する再生した軸索の数が有意に増加することが示された.さらに,コラーゲン結合インテグリンに対する抗体の投与により運動機能の有意に良好な回復が示された.以上の結果から,インテグリンを介した反応性アストロサイトと1型コラーゲンとの相互作用の阻害は,脊髄損傷ののちのNカドヘリンの発現の低下を介してアストロサイト瘢痕の形成を抑制し,軸索の再生および機能の回復を促進することが示唆された(図2).
脊髄損傷の病態において反応性アストログリオーシスは一方向性かつ不可逆的な反応であり3),反応性アストログリオーシスの最終的な形態であるアストロサイト瘢痕は軸索の再生や機能の回復の不良のおもな原因であると長く考えられてきた2).しかし,筆者らは,反応性アストログリオーシスの環境に依存的な可塑性を示し,環境への介入によりアストロサイトの変化を制御するという治療の可能性を提示した.とくに,1型コラーゲンはインテグリン-Nカドヘリン経路を介したアストロサイト瘢痕の形成に重要であり,反応性アストロサイトと1型コラーゲンとの相互作用を阻害することにより脊髄損傷ののちのアストロサイト瘢痕の形成が抑制され機能の改善が促進されることが見い出された.アストロサイト瘢痕の形成は中枢神経におけるさまざまな疾患においてもみられることから,脊髄損傷だけでなく,ほかの疾患の新たな治療法の開発にもつながることが期待される.
略歴:九州大学大学院医学系学府 在学中.
研究テーマ:脊髄損傷の病態.
関心事:脊髄損傷の患者に対する新規の治療法の開発.
岡田 誠司(Seiji Okada)
九州大学大学院医学研究院 准教授.
© 2017 原 正光・岡田誠司 Licensed under CC 表示 2.1 日本
(九州大学大学院医学研究院 整形外科学分野)
email:岡田誠司
DOI: 10.7875/first.author.2017.067
Interaction of reactive astrocytes with type I collagen induces astrocytic scar formation through the integrin-N-cadherin pathway after spinal cord injury.
Masamitsu Hara, Kazu Kobayakawa, Yasuyuki Ohkawa, Hiromi Kumamaru, Kazuya Yokota, Takeyuki Saito, Ken Kijima, Shingo Yoshizaki, Katsumi Harimaya, Yasuharu Nakashima, Seiji Okada
Nature Medicine, 23, 818-828 (2017)
要 約
中枢神経の損傷は脊髄に豊富に存在する正常なアストロサイトを反応性アストロサイトへと変化させ,反応性アストロサイトは最終的に軸索の再生や機能の回復を阻害する瘢痕形成アストロサイトになる.反応性アストログリオーシスとして知られるこの連続的な表現型の変化は一方向性であり不可逆的であると長く考えられてきた.しかし,この研究において,筆者らは,反応性アストロサイトは正常な脊髄に移植されると正常なアストロサイトにもどるが,損傷した脊髄に移植されるとアストロサイト瘢痕を形成することを見い出し,反応性アストログリオーシスの環境に依存的な可塑性を示した.また,1型コラーゲンは瘢痕の形成期において脊髄に高く発現し,インテグリン-Nカドヘリン経路を介してアストロサイト瘢痕の形成をひき起こした.さらに,反応性アストロサイトと1型コラーゲンとの相互作用を阻害するとアストロサイト瘢痕の形成が抑制され,軸索の再生および機能の回復は促進された.今回の研究により,中枢神経の損傷における治療の新たな標的が示唆された.
はじめに
脊髄損傷は永続的な四肢の麻痺や感覚の障害を中心としてさまざまな合併症をひき起こす.脊髄が損傷したのち,中枢神経にもっとも豊富に存在する細胞であるアストロサイトは反応性アストログリオーシスとして知られる表現型の変化を起こすことにより脊髄損傷の病態において重要な役割をはたす.反応性アストログリオーシスの過程において,正常なアストロサイトは経時的に,反応性アストロサイト,そののち,瘢痕形成アストロサイトへと変化する(図1).脊髄損傷の亜急性期において,反応性アストロサイトは損傷の中心部へと遊走して炎症を起こした細胞を隔離し組織の修復および機能の回復をもたらす1).しかし,反応性アストロサイトは中枢神経の損傷ののちの軸索の再生のおもな阻害因子であるアストロサイト瘢痕を形成する瘢痕形成アストロサイトへと徐々に変化し,脊髄損傷の慢性期における機能の回復を阻害してしまう2).アストロサイト瘢痕は不可逆的であり,げっ歯類やヒトの脊髄損傷において永続的に軸索の再生を阻害するとされる3).したがって,アストロサイト瘢痕の形成の機構を解明しそれを制御することは脊髄損傷の新しい治療の戦略の発展に役だつと考えられた.
アストロサイト瘢痕は半世紀以上ものあいだ研究されており4),その形成は細胞間および細胞内の複雑なシグナル伝達系により制御されると提案されてきた2).しかし,多くの研究においてアストロサイトの変化が検証されたにもかかわらず,アストロサイト瘢痕の形成の機構については明らかにされていない.その解明をさまたげる要因のひとつは,正常なアストロサイト,反応性アストロサイト,瘢痕形成アストロサイトの明確な定義がないことである.これまで,これらは組織学的な解析により区別されてきたが,この方法は客観的でも定量的でもない.そこで,筆者らは,マーカー遺伝子の発現にもとづき正常アストロサイト,反応性アストロサイト,瘢痕形成アストロサイトを明確に定義し,脊髄損傷ののちのアストロサイト瘢痕の形成の制御機構について検討した.
1.反応性アストロサイトおよび瘢痕形成アストロサイトのマーカー遺伝子の定義
ヒトの脊髄損傷に近いモデルである脊髄圧挫損傷モデルマウスを用いて,免疫染色法およびレーザーマイクロダイセクション法を組み合わせ,正常な脊髄から正常なアストロサイト,損傷ののち7日目の脊髄から反応性アストロサイト,損傷ののち14日目の脊髄から瘢痕形成アストロサイトを採取した.反応性アストロサイトあるいは瘢痕形成アストロサイトに特徴的な遺伝子として報告のある遺伝子の発現を測定し,それぞれのアストロサイトにおいて有意かつ選択的に発現の上昇した遺伝子をマーカー遺伝子と定義した.
反応性アストロサイトにおいてNes遺伝子およびβカテニンをコードするCtnnb1遺伝子の発現の有意な上昇が確認された.くわえて,βカテニンに関連する遺伝子が機能的な観点から反応性アストロサイトのマーカー遺伝子として適切であることが見い出された.脊髄損傷において反応性アストロサイトの遊走は組織の修復および機能の回復に重要であり1),最近になり,βカテニンが核へと移行したのち,βカテニン-LEF-TCF複合体がウロキナーゼ型プラスミノゲン活性化因子受容体をコードする遺伝子のエンハンサーと結合し,マトリックスメタロプロテアーゼの活性化および細胞の遊走をひき起こす機構が報告されている5).実際に,ウロキナーゼ型プラスミノゲン活性化因子受容体をコードするPlaur遺伝子,マトリックスメタロプロテアーゼをコードするMmp2遺伝子およびMmp13遺伝子の発現が反応性アストロサイトにおいて選択的に上昇していた.さらに,βカテニンの負のフィードバック制御遺伝子であるAxin2遺伝子の発現も反応性アストロサイトにおいて有意に上昇していた.以上の結果から,Nes遺伝子,Ctnnb1遺伝子,Plaur遺伝子,Mmp2遺伝子,Mmp13遺伝子,Axin2遺伝子が反応性アストロサイトのマーカー遺伝子と定義され,βカテニン-マトリックスメタロプロテアーゼシグナル伝達系を介して反応性アストロサイトが遊走する機構の可能性が示唆された.
瘢痕形成アストロサイトについても同様に解析し,NカドヘリンをコードするCdh2遺伝子およびSox9遺伝子が瘢痕形成アストロサイトのマーカー遺伝子と定義された.また,コンドロイチン硫酸プロテオグリカンは軸索の再生においてもっとも豊富な細胞外の阻害因子であり,その発現は脊髄損傷ののちのアストロサイト瘢痕の領域においてみられる2).瘢痕形成アストロサイトにおいて,Xylt1遺伝子,Chst11遺伝子,Csgalnact1遺伝子,Acan遺伝子,Pcan遺伝子というコンドロイチン硫酸プロテオグリカンに関連する遺伝子の有意な発現の上昇が検出された.くわえて,反発性の軸索ガイダンスタンパク質をコードするSlit2遺伝子も瘢痕形成アストロサイトのマーカー遺伝子の条件をみたした.反応性アストログリオーシスは遺伝子の発現および形態が段階的かつ連続して変化するため,形態学的な定義とマーカー遺伝子のプロファイルとを組み合わせることはアストロサイトの表現型を特定するのに有用であると考えられた.
2.反応性アストログリオーシスは周囲の環境に依存した反応である
哺乳類の細胞における表現型の変化はおおよそ細胞自律性あるいは細胞非自律性であるが6),反応性アストログリオーシスの機構はわかっていない.この機構を明らかにするため,マウスの初代培養アストロサイトから得たアストロサイトをマウスの正常な脊髄あるいは脊髄圧挫損傷モデルマウスの損傷の直後の脊髄に移植した.移植された正常なアストロサイトは,正常な脊髄においては形態学的な変化を起こさなかったが,損傷した脊髄においては宿主のアストロサイトとともに変化し,最終的にアストロサイト瘢痕を形成した.さらに,このような形態学的な変化と一致して,正常な脊髄に移植されたアストロサイトにおいてマーカー遺伝子の発現は変化しなかったが,損傷した脊髄に移植すると,移植ののち7日目に反応性アストロサイトのマーカー遺伝子の発現が,移植ののち14日目に瘢痕形成アストロサイトのマーカー遺伝子が有意に上昇した.以上の結果から,脊髄損傷ののちにアストロサイトは環境に依存して表現型を変化させることが明らかにされた.
3.反応性アストログリオーシスは可塑性をもつ
反応性アストログリオーシスが環境に依存性の反応であるなら,反応性アストロサイトを正常な脊髄へ移植すると正常なアストロサイトにもどるとの仮説をたてた.反応性アストロサイトを選択的に分離するため,マーカー遺伝子と定義されたNes遺伝子の発現がGFPの蛍光によりモニターされるトランスジェニックマウスを作製した1).このマウスの脊髄圧挫損傷モデルにおいて損傷ののち7日目の脊髄を採取して分散し,蛍光セルソーターによりGFP陽性を示す反応性アストロサイトを選択的に分離し,正常な脊髄あるいは損傷した脊髄に移植した.組織学的にも遺伝子学的にも,移植された反応性アストロサイトは損傷した脊髄に移植したときには瘢痕形成アストロサイトへと変化したが,正常な脊髄に移植したときには正常なアストロサイトにもどった.以上の結果から,反応性アストログリオーシスは特定の状況においては可逆的であることがわかった.
4.損傷した脊髄において1型コラーゲンがインテグリン-Nカドヘリン経路を介してアストロサイト瘢痕の形成をひき起こす
脊髄損傷の病態において反応性アストロサイトは有益であるが瘢痕形成アストロサイトは有害であるため,環境的な制御を介して反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害することは脊髄損傷における治療の新しい戦略になると考えた.そして,反応性アストロサイトの運命は正常な脊髄と損傷した脊髄とのあいだの環境の違いにより決定されると推測した.
正常な脊髄および損傷した脊髄においてゲノムの全体にわたり遺伝子の発現を解析したところ,損傷ののち14日目に細胞外マトリックスに関連する遺伝子の発現が劇的に上昇した.なかでも,1型コラーゲンをコードするCol1a1遺伝子およびCol1a2遺伝子がもっとも高く発現していた.さらに,免疫組織学的な解析により,アストロサイト瘢痕は1型コラーゲンと共局在する瘢痕形成アストロサイトにより形成されていたが,1型コラーゲンが存在しない領域のアストロサイトはアストロサイト瘢痕を形成していなかった.以上の結果から,1型コラーゲンは反応性アストロサイトから瘢痕形成アストロサイトへの変化およびアストロサイト瘢痕の形成に直接に関与することが示唆された.
反応性アストロサイトから瘢痕形成アストロサイトへの変化における1型コラーゲンの影響について明らかにするために,1型コラーゲンをコートしたあるいはコートしていないディッシュにおいて反応性アストロサイトを培養した.その結果,1型コラーゲンをコートしていないディッシュの反応性アストロサイトは突起の退縮およびGFAPの発現の低下という正常なアストロサイトに似た表現型を示したのに対し,1型コラーゲンをコートしたディッシュの反応性アストロサイトはとなりあうアストロサイトと接着しGFAPの発現が上昇するという瘢痕形成アストロサイトに似た表現型を示した.くわえて,1型コラーゲンをコートしたディッシュの反応性アストロサイトにのみ瘢痕形成アストロサイトの特徴であるNカドヘリンの発現の有意な上昇が認められた.アストロサイトはNカドヘリンを介して接着すること7),アストロサイト瘢痕においてNカドヘリンの発現が上昇すること8) を考えると,これらの結果から,1型コラーゲンが反応性アストロサイトにおいてNカドヘリンによる細胞間の接着を増強させ,反応性アストロサイトから瘢痕形成アストロサイトへの変化をひき起こすことが示唆された.
さらに,細胞と1型コラーゲンとの相互作用において重要な役割をはたすコラーゲン結合インテグリンに対する抗体を,1型コラーゲンをコートしたディッシュにて培養した反応性アストロサイトに投与した.その結果,反応性アストロサイトは分散したままで,NカドヘリンおよびGFAPの発現は変化しなかった.さらに,抗Nカドヘリン中和抗体は同様な状況において反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害した.以上の結果から,1型コラーゲンがインテグリン-Nカドヘリン経路を介して反応性アストロサイトから瘢痕形成アストロサイトへの変化をひき起こすことが明らかにされた.
5.反応性アストロサイトと1型コラーゲンとの相互作用を阻害することによりアストロサイト瘢痕の形成が抑制され機能の回復が促進される
治療的な観点からは,反応性アストロサイトから瘢痕形成アストロサイトへの変化を阻害することにより,実際に,脊髄損傷ののちのアストロサイト瘢痕の形成が抑制され機能の回復が促進されるかは重要である.そこで,in vivoにおいて,インテグリンを介した反応性アストロサイトと1型コラーゲンとの相互作用の阻害による脊髄損傷ののちのアストロサイト瘢痕の形成および機能の回復について検証した.コラーゲン結合インテグリンに対する抗体の投与により,アストロサイトにおけるNカドヘリンおよびGFAPの発現は有意に低下し,結果として,細胞間の接着が低下しアストロサイト瘢痕の形成が抑制された.また,同様に,抗Nカドヘリン中和抗体の投与によりアストロサイト瘢痕の形成が抑制された.くわえて,コラーゲン結合インテグリンに対する抗体の投与により,再生した軸索のマーカーであるGAP43に陽性の軸索の数が有意に増加した.セロトニン陽性の軸索およびチロシン水酸化酵素陽性の軸索の数も有意に増加しており,これらの軸索のほとんどはGAP43を発現していた.このことから,アストロサイト瘢痕の形成を抑制することにより,損傷した脊髄の中心部を通過する再生した軸索の数が有意に増加することが示された.さらに,コラーゲン結合インテグリンに対する抗体の投与により運動機能の有意に良好な回復が示された.以上の結果から,インテグリンを介した反応性アストロサイトと1型コラーゲンとの相互作用の阻害は,脊髄損傷ののちのNカドヘリンの発現の低下を介してアストロサイト瘢痕の形成を抑制し,軸索の再生および機能の回復を促進することが示唆された(図2).
おわりに
脊髄損傷の病態において反応性アストログリオーシスは一方向性かつ不可逆的な反応であり3),反応性アストログリオーシスの最終的な形態であるアストロサイト瘢痕は軸索の再生や機能の回復の不良のおもな原因であると長く考えられてきた2).しかし,筆者らは,反応性アストログリオーシスの環境に依存的な可塑性を示し,環境への介入によりアストロサイトの変化を制御するという治療の可能性を提示した.とくに,1型コラーゲンはインテグリン-Nカドヘリン経路を介したアストロサイト瘢痕の形成に重要であり,反応性アストロサイトと1型コラーゲンとの相互作用を阻害することにより脊髄損傷ののちのアストロサイト瘢痕の形成が抑制され機能の改善が促進されることが見い出された.アストロサイト瘢痕の形成は中枢神経におけるさまざまな疾患においてもみられることから,脊髄損傷だけでなく,ほかの疾患の新たな治療法の開発にもつながることが期待される.
文 献
- Okada, S., Masaya, N., Hiroyuki, K. et al.: Conditional ablation of Stat3 or Socs3 discloses a dual role for reactive astrocytes after spinal cord injury. Nat. Med., 12, 829-834 (2006)[PubMed]
- Silver, J. & Miller, J. H.: Regeneration beyond the glial scar. Nat. Rev. Neurosci., 5, 146-156 (2004)[PubMed]
- Karimi-Abdolrezaee, S. & Billakanti, R.: Reactive astrogliosis after spinal cord injury-beneficial and detrimental effects. Mol. Neurobiol., 46, 251-264 (2012)[PubMed]
- Windle, W. F., Clemente, C. D. & Chambers, W. W.: Inhibition of formation of a glial barrier as a means of permitting a peripheral nerve to grow into the brain. J. Comp. Neurol., 96, 359-369 (1952)[PubMed]
- Mann, B., Gelos, M., Siedow, A. et al.: Target genes of β-catenin-T cell-factor/lymphoid-enhancer-factor signaling in human colorectal carcinomas. Proc. Natl. Acad. Sci. USA, 96, 1603-1608 (1999)[PubMed]
- Ilieva, H., Polymenidou, M. & Cleveland, D. W.: Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J. Cell Biol., 187, 761-772 (2009)[PubMed]
- Tran, M. D., Wanner, I. B. & Neary, J. T.: Purinergic receptor signaling regulates N-cadherin expression in primary astrocyte cultures. J. Neurochem., 105, 272-286 (2008)[PubMed]
- Vazquez-Chona, F. & Geisert, E. E. Jr.: N-cadherin at the glial scar in the rat. Brain Res., 838, 45-50 (1999)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:九州大学大学院医学系学府 在学中.
研究テーマ:脊髄損傷の病態.
関心事:脊髄損傷の患者に対する新規の治療法の開発.
岡田 誠司(Seiji Okada)
九州大学大学院医学研究院 准教授.
© 2017 原 正光・岡田誠司 Licensed under CC 表示 2.1 日本