ブロモドメインタンパク質BRD4によるオートファジーおよびリソソームの機能の抑制
坂巻純一・Kevin M. Ryan
(英国Cancer Research UK Beatson Institute)
email:坂巻純一
DOI: 10.7875/first.author.2017.060
Bromodomain protein BRD4 is a transcriptional repressor of autophagy and lysosomal function.
Jun-ichi Sakamaki, Simon Wilkinson, Marcel Hahn, Nilgun Tasdemir, Jim O’Prey, William Clark, Ann Hedley, Colin Nixon, Jaclyn S. Long, Maria New, Tim Van Acker, Sharon A. Tooze, Scott W. Lowe, Ivan Dikic, Kevin M. Ryan
Molecular Cell, 66, 517-532.e9 (2017)
オートファジーは細胞に生じた膜構造が細胞質の成分やオルガネラをとりかこみ,リソソームへと輸送して分解する機構である.細胞における恒常性の維持にはたらき,その異常は神経変性疾患やがんなどにつながる可能性が示唆されている.これまで,オートファジーに関与する多くの遺伝子が同定され,基礎的な分子機構は確立されつつあるが,その制御機構に関しては不明な点が多い.筆者らは,RNAiスクリーニングによりBETファミリーに属するブロモドメインタンパク質BRD4が転写のレベルでオートファジーおよびリソソームの機能を抑制することを見い出した.BRD4のノックダウンはオートファジーおよびリソソームの機能を活性化し,凝集したタンパク質の分解を促進した.栄養飢餓においてはAMPキナーゼ-SIRT1シグナル伝達系がBRD4による転写の抑制を解除し,オートファジーに関連する遺伝子の発現を誘導した.この研究により,オートファジーおよびリソソームの機能の新たな制御機構が明らかにされた.
オートファジーは細胞に生じた膜構造が細胞質の成分やオルガネラを隔離し分解する機構である1).細胞において隔離膜とよばれる膜構造が形成され,細胞質の成分がとりかこまれる.隔離膜はさらに成長し,その末端が融合することによりオートファゴソームとよばれる球体状の二重膜の構造が形成される.オートファゴソームはさまざまな分解酵素を含むリソソームと融合し,内部の物質は分解され再利用される2).オートファジーの異常は神経変性疾患,炎症性疾患,感染症,がんなど,さまざまな疾患につながる可能性が示唆されている3).これまで,オートファジーに関与する多くの遺伝子が同定され,基礎的な分子機構は確立されつつある4).その一方,オートファジーの不全あるいは過剰な活性化は細胞や生体に有害な影響をおよぼすため3),その厳密な制御が必須であるが,オートファジーの詳細な制御機構に関しては不明な点が多い.
オートファジーによる細胞質の成分の分解にはリソソームが必須の役割をはたす.リソソームはさまざまな分解酵素をもつ酸性のオルガネラであり,オートファジーだけでなく,エンドサイトーシス経路,マクロピノサイトーシス,シャペロン介在性オートファジーなどにより輸送されてきた物質の分解も担う5).リソソームの機能不全は神経変性疾患やリソソーム病につながる.オートファジーの過程においてリソソームの機能も同時に制御されうるはずだが,その制御機構に関しては多くが不明である.
ショウジョウバエS2R+細胞を用いてのオートファゴソームのマーカーであるGFP-LC3の局在を指標としたRNAiスクリーニングにより,オートファゴソームの形成に影響をおよぼす遺伝子の同定を試みた6).その結果,Fs(1)hのノックダウンがオートファゴソームの形成を示すGFP-LC3のドット状の構造7,8) を増加させることを見い出した.Fs(1)hはBETファミリーに属するタンパク質であり,哺乳類においては全身において発現するBRD2,BRD3,BRD4,精巣に特異的に発現するBRDTがそのオーソログに相当する9).ヒトの培養細胞においてBRD2,BRD3,BRD4をそれぞれノックダウンしたところ,BRD4のノックダウンがオートファジーのマーカーであるLC3II 8) を増加させた一方,BRD2およびBRD3はオートファジーに影響しなかった.BRD4はブロモドメインを介してアセチル化したヒストンと結合し,P-TEFbやメディエーター複合体との相互作用を介して転写を活性化させることが報告されている9).BRD4がオートファジーにおよぼす影響について詳細に調べたところ,BRD4のノックダウンはオートファジーを活性化させ,オートファゴソームの形成およびオートファゴソームのリソソームとの融合を促進した.さらに,BRD4をノックダウンしたマウス,あるいは,BETファミリータンパク質の阻害剤を投与したマウスにおいてもオートファゴソームの形成は増加し,Fs(1)hおよびBRD4は生物種のあいだで保存されたオートファジーの抑制タンパク質であることが示された.
BRD4は転写を制御するタンパク質であることから転写のレベルでオートファジーを抑制するのではないかと考え,BRD4をノックダウンした細胞においてRNAシークエンシングを実施したところ,オートファジーに関与するさまざまな遺伝子の発現が上昇していた.BRD4のノックダウンにより,オートファジーに関連する遺伝子にくわえ,グリカンの分解,タンパク質およびペプチドの分解,リソソームの生合成など,リソソームに関連する遺伝子の発現も上昇した.この遺伝子発現の変化と一致し,BRD4のノックダウンによりリソソームのマーカーであるLAMP1あるいはLysoTrackerに陽性の領域が増加し,カテプシンBやヘキソサミニダーゼなどのリソソーム酵素の活性も上昇した.これらの結果より,BRD4のノックダウンはオートファジーおよびリソソームに関連する遺伝子の発現を上昇させることにより,オートファジーの開始から終了までの過程を活性化させることが示唆された.BRD4をノックダウンした細胞にみられたオートファジーおよびリソソームの活性化は,オートファジーおよびリソソームに関連する遺伝子の発現のマスターレギュレーターである転写因子TFEBの活性化によりみられるものと似ていたことから10),TFEB,および,そのファミリータンパク質であるTFE3,MITFの関与について調べたところ,これらのタンパク質を同時にノックダウンした細胞においてもBRD4のノックダウンはオートファジーを活性化したことから,BRD4によるオートファジーおよびリソソームの機能の抑制はTFEB,TFE3,MITFには依存しないことが示された.
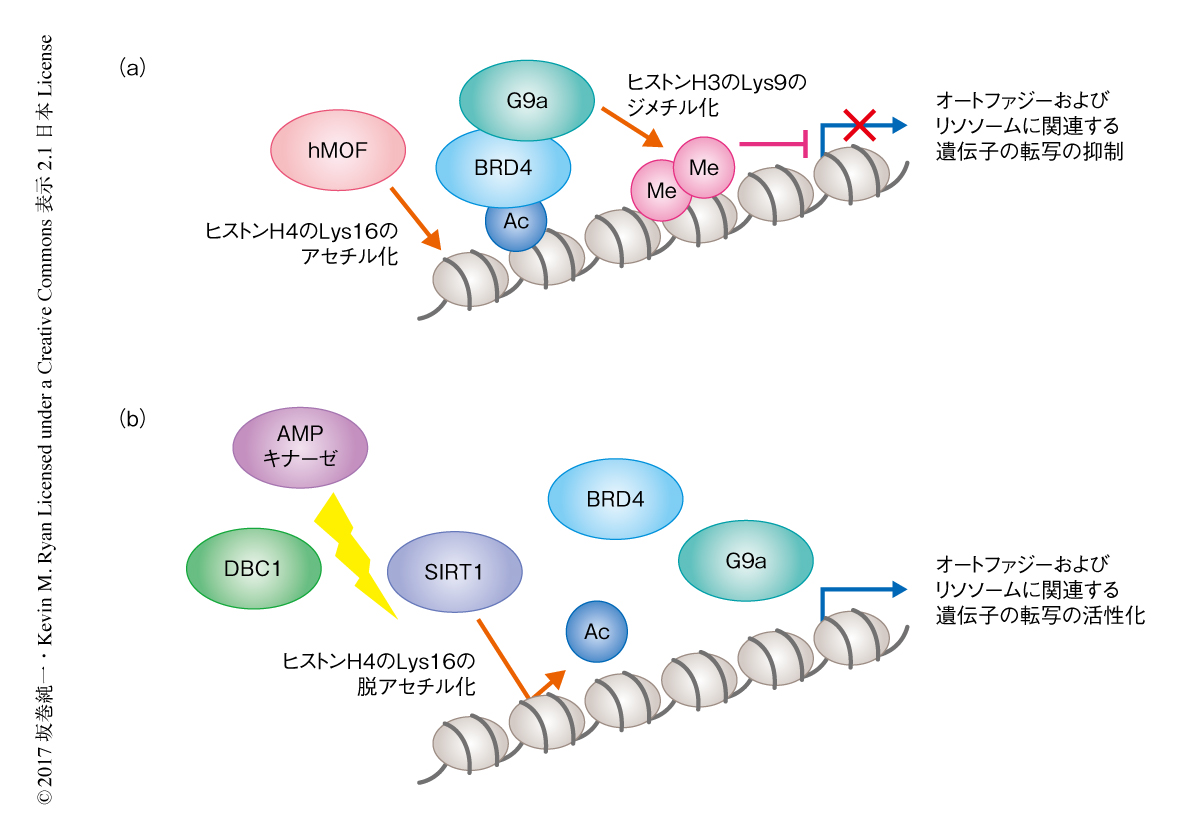
富栄養状態においては,BRD4はヒストンアセチル化酵素hMOFによるヒストンH4のLys16のアセチル化を介してオートファジーおよびリソソームに関連する遺伝子のプロモーターと結合し,そこでヒストンメチル化酵素G9aと相互作用してヒストンH3のLys9のジメチル化を誘導することにより発現を抑制していた.一方で,栄養飢餓においてはAMPキナーゼが活性化し,ヒストン脱アセチル化酵素SIRT1とその抑制タンパク質DBC1との結合を解離させることによりSIRT1を活性化し,ヒストンH4のLys16の脱アセチル化およびBRD4のクロマチンからの解離がひき起こされて,その結果,オートファジーおよびリソソームに関連する遺伝子の転写は活性化された(図1).
非選択的なオートファジーはバルクオートファジーとよばれ,おもに栄養飢餓により活性化し細胞にエネルギーを供給する11).一方で,傷害をうけたミトコンドリア,凝集したタンパク質,細菌やウイルスなどの病原菌などはオートファジーにより選択的に分解される12).これは,選択的オートファジーとよばれており,その機能不全は神経変性疾患や感染症などにつながる可能性が示唆されている.栄養飢餓,グルコースの飢餓,アミノ酸の飢餓,mTORの阻害剤であるラパマイシンの添加,低酸素,トレハロースの添加,発がん性のRas変異体の導入,TFEBの過剰な発現といったオートファジーを誘導するさまざまな条件において,BRD4のノックダウンはオートファジーをさらに活性化した.また,BRD4のノックダウンはハンチントン病の原因と考えられているHTT変異体の分解を促進した一方,傷害をうけたミトコンドリアやサルモネラ菌の分解は促進しなかった.
細胞の増殖あるいは生存に対するBRD4のノックダウンの影響について調べたところ,ほかの研究グループの報告と一致して,富栄養状態においてBRD4のノックダウンはc-Mycおよび細胞増殖に関与する遺伝子の発現を抑制し,細胞周期の遅延および細胞増殖の抑制をひき起こした.この細胞増殖の抑制はオートファジーの活性化とは独立して起こり,ほかに報告されているように,c-Mycの発現の抑制がおもな原因であると考えられた.一方で,栄養飢餓においてBRD4のノックダウンは細胞死を抑制した.この細胞死の抑制はオートファジーに依存的であった.以上より,BRD4のノックダウンは特定の選択的オートファジーを活性化させ,また,栄養飢餓においてはオートファジーに依存して細胞の保護にはたらくことが示された.
NUT遺伝子とBRD4遺伝子の染色体転座により生じるBRD4-NUT融合タンパク質はNUT midline carcinoma(NMC)とよばれる悪性度の高い低分化型の扁平上皮がんをひき起こす13).BRD4と同様に,BRD4-NUT融合タンパク質のノックダウンもオートファジーを活性化させた.NUT midline carcinomaにおいて染色体転座を起こしていない正常の遺伝子座より発現する野生型のBRD4のノックダウンはオートファジーにほぼ影響をおよぼさなかったことから,BRD4-NUT融合タンパク質はドミナントな抑制タンパク質としてはたらくことが示唆された.さらに,BRD4-NUTタンパク質のノックダウンはオートファジーおよびリソソームに関連する遺伝子の発現を誘導し,リソソームのマーカーであるLysoTrackerに陽性の領域を増加させたことから,NUT midline carcinomaにおいてBRD4-NUT融合タンパク質がオートファジーおよびリソソームの機能を制御することが示された.
筆者らは,この研究において,オートファゴソームの形成からリソソームとの融合までのオートファジーの一連の過程,および,リソソームの機能がBRD4により転写のレベルで抑制されることを明らかにした.これまで,オートファジーは細胞質において起こることから,その制御機構に関してはシグナル伝達系など細胞質における制御に注目がむいていた.しかし近年になり,オートファジーに関連する遺伝子の転写のレベルでの発現制御が定常な状態におけるオートファジーの抑制,あるいは,長期的な飢餓状態におけるオートファジーの維持に重要であることが明らかにされつつある14,15).転写因子TFEBがオートファジーおよびリソソームに関連する遺伝子の発現をつかさどるマスターレギュレーターとして認識されているが10),BRD4の抑制によるオートファジーの活性化はTFEBをノックダウンした細胞においても起こったことから,BRD4はTFEBに非依存的にオートファジーおよびリソソームに関連する遺伝子の発現を抑制する重要なタンパク質であることが示された.
略歴:2011年 筑波大学大学院生命環境科学研究科 修了,同年 カナダChildren's Hospital of Eastern Ontario Research Institute博士研究員を経て,2014年より英国Cancer Research UK Beatson Institute博士研究員.
研究テーマ:オートファジーの制御機構.
Kevin M. Ryan
英国Cancer Research UK Beatson InstituteにてProfessor.
© 2017 坂巻純一・Kevin M. Ryan Licensed under CC 表示 2.1 日本
(英国Cancer Research UK Beatson Institute)
email:坂巻純一
DOI: 10.7875/first.author.2017.060
Bromodomain protein BRD4 is a transcriptional repressor of autophagy and lysosomal function.
Jun-ichi Sakamaki, Simon Wilkinson, Marcel Hahn, Nilgun Tasdemir, Jim O’Prey, William Clark, Ann Hedley, Colin Nixon, Jaclyn S. Long, Maria New, Tim Van Acker, Sharon A. Tooze, Scott W. Lowe, Ivan Dikic, Kevin M. Ryan
Molecular Cell, 66, 517-532.e9 (2017)
要 約
オートファジーは細胞に生じた膜構造が細胞質の成分やオルガネラをとりかこみ,リソソームへと輸送して分解する機構である.細胞における恒常性の維持にはたらき,その異常は神経変性疾患やがんなどにつながる可能性が示唆されている.これまで,オートファジーに関与する多くの遺伝子が同定され,基礎的な分子機構は確立されつつあるが,その制御機構に関しては不明な点が多い.筆者らは,RNAiスクリーニングによりBETファミリーに属するブロモドメインタンパク質BRD4が転写のレベルでオートファジーおよびリソソームの機能を抑制することを見い出した.BRD4のノックダウンはオートファジーおよびリソソームの機能を活性化し,凝集したタンパク質の分解を促進した.栄養飢餓においてはAMPキナーゼ-SIRT1シグナル伝達系がBRD4による転写の抑制を解除し,オートファジーに関連する遺伝子の発現を誘導した.この研究により,オートファジーおよびリソソームの機能の新たな制御機構が明らかにされた.
はじめに
オートファジーは細胞に生じた膜構造が細胞質の成分やオルガネラを隔離し分解する機構である1).細胞において隔離膜とよばれる膜構造が形成され,細胞質の成分がとりかこまれる.隔離膜はさらに成長し,その末端が融合することによりオートファゴソームとよばれる球体状の二重膜の構造が形成される.オートファゴソームはさまざまな分解酵素を含むリソソームと融合し,内部の物質は分解され再利用される2).オートファジーの異常は神経変性疾患,炎症性疾患,感染症,がんなど,さまざまな疾患につながる可能性が示唆されている3).これまで,オートファジーに関与する多くの遺伝子が同定され,基礎的な分子機構は確立されつつある4).その一方,オートファジーの不全あるいは過剰な活性化は細胞や生体に有害な影響をおよぼすため3),その厳密な制御が必須であるが,オートファジーの詳細な制御機構に関しては不明な点が多い.
オートファジーによる細胞質の成分の分解にはリソソームが必須の役割をはたす.リソソームはさまざまな分解酵素をもつ酸性のオルガネラであり,オートファジーだけでなく,エンドサイトーシス経路,マクロピノサイトーシス,シャペロン介在性オートファジーなどにより輸送されてきた物質の分解も担う5).リソソームの機能不全は神経変性疾患やリソソーム病につながる.オートファジーの過程においてリソソームの機能も同時に制御されうるはずだが,その制御機構に関しては多くが不明である.
1.BRD4は転写のレベルでオートファジーおよびリソソームの機能を抑制する
ショウジョウバエS2R+細胞を用いてのオートファゴソームのマーカーであるGFP-LC3の局在を指標としたRNAiスクリーニングにより,オートファゴソームの形成に影響をおよぼす遺伝子の同定を試みた6).その結果,Fs(1)hのノックダウンがオートファゴソームの形成を示すGFP-LC3のドット状の構造7,8) を増加させることを見い出した.Fs(1)hはBETファミリーに属するタンパク質であり,哺乳類においては全身において発現するBRD2,BRD3,BRD4,精巣に特異的に発現するBRDTがそのオーソログに相当する9).ヒトの培養細胞においてBRD2,BRD3,BRD4をそれぞれノックダウンしたところ,BRD4のノックダウンがオートファジーのマーカーであるLC3II 8) を増加させた一方,BRD2およびBRD3はオートファジーに影響しなかった.BRD4はブロモドメインを介してアセチル化したヒストンと結合し,P-TEFbやメディエーター複合体との相互作用を介して転写を活性化させることが報告されている9).BRD4がオートファジーにおよぼす影響について詳細に調べたところ,BRD4のノックダウンはオートファジーを活性化させ,オートファゴソームの形成およびオートファゴソームのリソソームとの融合を促進した.さらに,BRD4をノックダウンしたマウス,あるいは,BETファミリータンパク質の阻害剤を投与したマウスにおいてもオートファゴソームの形成は増加し,Fs(1)hおよびBRD4は生物種のあいだで保存されたオートファジーの抑制タンパク質であることが示された.
BRD4は転写を制御するタンパク質であることから転写のレベルでオートファジーを抑制するのではないかと考え,BRD4をノックダウンした細胞においてRNAシークエンシングを実施したところ,オートファジーに関与するさまざまな遺伝子の発現が上昇していた.BRD4のノックダウンにより,オートファジーに関連する遺伝子にくわえ,グリカンの分解,タンパク質およびペプチドの分解,リソソームの生合成など,リソソームに関連する遺伝子の発現も上昇した.この遺伝子発現の変化と一致し,BRD4のノックダウンによりリソソームのマーカーであるLAMP1あるいはLysoTrackerに陽性の領域が増加し,カテプシンBやヘキソサミニダーゼなどのリソソーム酵素の活性も上昇した.これらの結果より,BRD4のノックダウンはオートファジーおよびリソソームに関連する遺伝子の発現を上昇させることにより,オートファジーの開始から終了までの過程を活性化させることが示唆された.BRD4をノックダウンした細胞にみられたオートファジーおよびリソソームの活性化は,オートファジーおよびリソソームに関連する遺伝子の発現のマスターレギュレーターである転写因子TFEBの活性化によりみられるものと似ていたことから10),TFEB,および,そのファミリータンパク質であるTFE3,MITFの関与について調べたところ,これらのタンパク質を同時にノックダウンした細胞においてもBRD4のノックダウンはオートファジーを活性化したことから,BRD4によるオートファジーおよびリソソームの機能の抑制はTFEB,TFE3,MITFには依存しないことが示された.
2.BRD4によるオートファジーおよびリソソームに関連する遺伝子の発現抑制の機構
富栄養状態においては,BRD4はヒストンアセチル化酵素hMOFによるヒストンH4のLys16のアセチル化を介してオートファジーおよびリソソームに関連する遺伝子のプロモーターと結合し,そこでヒストンメチル化酵素G9aと相互作用してヒストンH3のLys9のジメチル化を誘導することにより発現を抑制していた.一方で,栄養飢餓においてはAMPキナーゼが活性化し,ヒストン脱アセチル化酵素SIRT1とその抑制タンパク質DBC1との結合を解離させることによりSIRT1を活性化し,ヒストンH4のLys16の脱アセチル化およびBRD4のクロマチンからの解離がひき起こされて,その結果,オートファジーおよびリソソームに関連する遺伝子の転写は活性化された(図1).
3.BRD4のノックダウンが選択的オートファジーにおよぼす影響
非選択的なオートファジーはバルクオートファジーとよばれ,おもに栄養飢餓により活性化し細胞にエネルギーを供給する11).一方で,傷害をうけたミトコンドリア,凝集したタンパク質,細菌やウイルスなどの病原菌などはオートファジーにより選択的に分解される12).これは,選択的オートファジーとよばれており,その機能不全は神経変性疾患や感染症などにつながる可能性が示唆されている.栄養飢餓,グルコースの飢餓,アミノ酸の飢餓,mTORの阻害剤であるラパマイシンの添加,低酸素,トレハロースの添加,発がん性のRas変異体の導入,TFEBの過剰な発現といったオートファジーを誘導するさまざまな条件において,BRD4のノックダウンはオートファジーをさらに活性化した.また,BRD4のノックダウンはハンチントン病の原因と考えられているHTT変異体の分解を促進した一方,傷害をうけたミトコンドリアやサルモネラ菌の分解は促進しなかった.
細胞の増殖あるいは生存に対するBRD4のノックダウンの影響について調べたところ,ほかの研究グループの報告と一致して,富栄養状態においてBRD4のノックダウンはc-Mycおよび細胞増殖に関与する遺伝子の発現を抑制し,細胞周期の遅延および細胞増殖の抑制をひき起こした.この細胞増殖の抑制はオートファジーの活性化とは独立して起こり,ほかに報告されているように,c-Mycの発現の抑制がおもな原因であると考えられた.一方で,栄養飢餓においてBRD4のノックダウンは細胞死を抑制した.この細胞死の抑制はオートファジーに依存的であった.以上より,BRD4のノックダウンは特定の選択的オートファジーを活性化させ,また,栄養飢餓においてはオートファジーに依存して細胞の保護にはたらくことが示された.
4.BRD4-NUT融合タンパク質はNUT midline carcinomaにおけるオートファジーの抑制タンパク質である
NUT遺伝子とBRD4遺伝子の染色体転座により生じるBRD4-NUT融合タンパク質はNUT midline carcinoma(NMC)とよばれる悪性度の高い低分化型の扁平上皮がんをひき起こす13).BRD4と同様に,BRD4-NUT融合タンパク質のノックダウンもオートファジーを活性化させた.NUT midline carcinomaにおいて染色体転座を起こしていない正常の遺伝子座より発現する野生型のBRD4のノックダウンはオートファジーにほぼ影響をおよぼさなかったことから,BRD4-NUT融合タンパク質はドミナントな抑制タンパク質としてはたらくことが示唆された.さらに,BRD4-NUTタンパク質のノックダウンはオートファジーおよびリソソームに関連する遺伝子の発現を誘導し,リソソームのマーカーであるLysoTrackerに陽性の領域を増加させたことから,NUT midline carcinomaにおいてBRD4-NUT融合タンパク質がオートファジーおよびリソソームの機能を制御することが示された.
おわりに
筆者らは,この研究において,オートファゴソームの形成からリソソームとの融合までのオートファジーの一連の過程,および,リソソームの機能がBRD4により転写のレベルで抑制されることを明らかにした.これまで,オートファジーは細胞質において起こることから,その制御機構に関してはシグナル伝達系など細胞質における制御に注目がむいていた.しかし近年になり,オートファジーに関連する遺伝子の転写のレベルでの発現制御が定常な状態におけるオートファジーの抑制,あるいは,長期的な飢餓状態におけるオートファジーの維持に重要であることが明らかにされつつある14,15).転写因子TFEBがオートファジーおよびリソソームに関連する遺伝子の発現をつかさどるマスターレギュレーターとして認識されているが10),BRD4の抑制によるオートファジーの活性化はTFEBをノックダウンした細胞においても起こったことから,BRD4はTFEBに非依存的にオートファジーおよびリソソームに関連する遺伝子の発現を抑制する重要なタンパク質であることが示された.
文 献
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Ktistakis, N. T. & Tooze, S. A.: Digesting the expanding mechanisms of autophagy. Trends Cell Biol., 26, 624-635 (2016)[PubMed]
- Mizushima, N., Levine, B., Cuervo, A. M. et al.: Autophagy fights disease through cellular self-digestion. Nature, 451, 1069-1075 (2008)[PubMed]
- Mizushima, N., Yoshimori, T. & Ohsumi, Y.: The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107-132 (2011)[PubMed]
- Shen, H. M. & Mizushima, N.: At the end of the autophagic road: an emerging understanding of lysosomal functions in autophagy. Trends Biochem. Sci., 39, 61-71 (2014)[PubMed]
- Wilkinson, S., Croft, D. R., O'Prey, J. et al.: The cyclin-dependent kinase PITSLRE/CDK11 is required for successful autophagy. Autophagy, 7, 1295-1301 (2011)[PubMed]
- Mizushima, N., Yoshimori, T. & Levine, B.: Methods in mammalian autophagy research. Cell, 140, 313-326 (2010)[PubMed]
- Klionsky, D. J., Abdelmohsen, K., Abe, A. et al.: Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy, 12, 1-222 (2016)[PubMed]
- Shi, J. & Vakoc, C. R.: The mechanisms behind the therapeutic activity of BET bromodomain inhibition. Mol. Cell, 54, 728-736 (2014)[PubMed]
- Settembre, C., Di Malta, C., Polito, V. A. et al.: TFEB links autophagy to lysosomal biogenesis. Science, 332, 1429-1433 (2011)[PubMed]
- Rabinowitz, J. D. & White, E.: Autophagy and metabolism. Science, 330, 1344-1348 (2010)[PubMed]
- Khaminets, A., Behl, C. & Dikic, I.: Ubiquitin-dependent and independent signals in selective autophagy. Trends Cell Biol., 26, 6-16 (2016)[PubMed]
- French, C. A.: NUT midline carcinoma. Cancer Genet. Cytogenet., 203, 16-20 (2010)[PubMed]
- Fullgrabe, J., Klionsky, D. J. & Joseph, B.: The return of the nucleus: transcriptional and epigenetic control of autophagy. Nat. Rev. Mol. Cell Biol., 15, 65-74 (2014)[PubMed]
- Fullgrabe, J., Ghislat, G., Cho, D. H. et al.: Transcriptional regulation of mammalian autophagy at a glance. J. Cell Sci., 129, 3059-3066 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 筑波大学大学院生命環境科学研究科 修了,同年 カナダChildren's Hospital of Eastern Ontario Research Institute博士研究員を経て,2014年より英国Cancer Research UK Beatson Institute博士研究員.
研究テーマ:オートファジーの制御機構.
Kevin M. Ryan
英国Cancer Research UK Beatson InstituteにてProfessor.
© 2017 坂巻純一・Kevin M. Ryan Licensed under CC 表示 2.1 日本