Fanconi貧血の新規の原因タンパク質RFWD3による相同組換えの制御
稲野将二郎1・佐藤浩一2・胡桃坂仁志2・高田 穣1
(1京都大学放射線生物研究センター 晩発効果研究部門,2早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室)
email:稲野将二郎
DOI: 10.7875/first.author.2017.052
RFWD3-mediated ubiquitination promotes timely removal of both RPA and RAD51 from DNA damage sites to facilitate homologous recombination.
Shojiro Inano, Koichi Sato, Yoko Katsuki, Wataru Kobayashi, Hiroki Tanaka, Kazuhiro Nakajima, Shinichiro Nakada, Hiroyuki Miyoshi, Kerstin Knies, Akifumi Takaori-Kondo, Detlev Schindler, Masamichi Ishiai, Hitoshi Kurumizaka, Minoru Takata
Molecular Cell, 66, 622-634.e8 (2017)
Fanconi貧血はDNA鎖間架橋の修復の障害による症患で,その原因遺伝子の解析はDNA鎖間架橋の修復経路の解明に大きく寄与してきた.RFWD3はFanconi貧血の患者におけるエキソーム解析により同定された新規のユビキチンリガーゼである.DNA鎖間架橋の修復経路においては複数のDNA修復機構が協調して機能するが,RFWD3はそのうち相同組換えにはたらき,相同組換えの主要な制御タンパク質であるRPAおよびRAD51をユビキチン化することによりDNAの損傷部位からの解離および分解を促進した.RFWD3を欠損した細胞においては,RPAおよびRAD51が損傷をもつクロマチンに残存していた一方,RAD54やMCM8といった相同組換えの後期においてはたらくタンパク質はリクルートされず,相同組換えにおいて機能するタンパク質の入れ替わりが阻害されているものと考えられた.
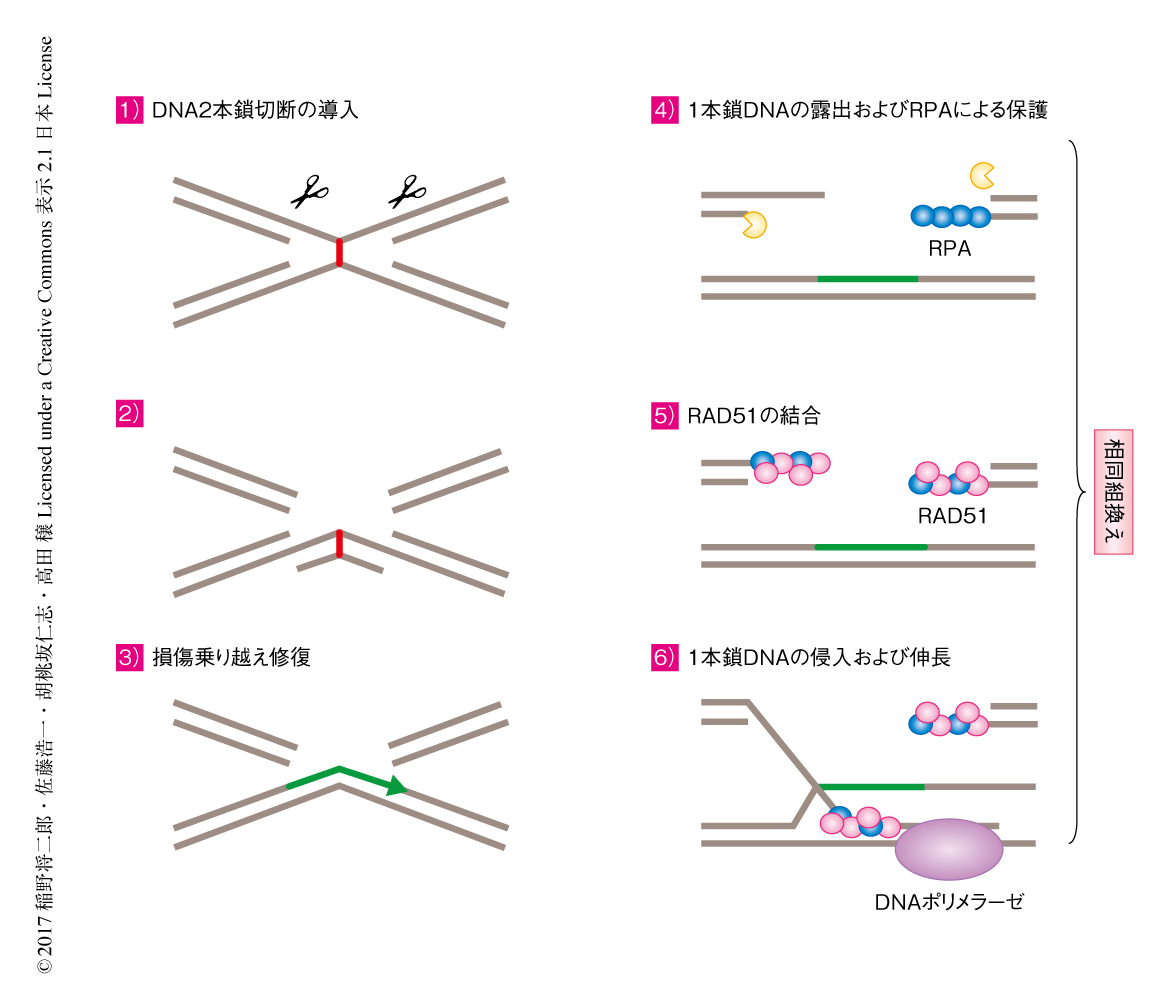
DNA鎖間架橋の修復経路においては複数のDNA修復機構が協調して機能することによりDNA鎖間架橋の除去および正確な複製が実現される.これを単純化すると,DNA鎖間架橋の両側へのDNA 2本鎖切断の導入,DNA損傷乗り換え,相同組換え,となる(図1).相同組換えにおいては,DNA 2本鎖切断の平滑末端が1本鎖となり,そこにRPAがリクルートされる.そこにBRCA2に依存してRAD51が結合し,鋳型となる相同なDNA配列へと侵入し相補鎖を形成する.侵入した1本鎖DNAの末端はDNAポリメラーゼにより伸長し,ふたたび相補鎖が解離することにより修復は完了する.しかしながら,相同組換えの詳細な分子機構については未解明な点が多い.
RFWD3はFanconi貧血の患者のエキソーム解析により同定された新規のユビキチンリガーゼである.すでに,RPAと結合すること,および,チェックポイントの活性化に必要であることが報告されていたが1,2),本質的な分子機能は未解明であった.RFWD3の機能を解明するため,ヒトのハプロイド細胞株HAP1細胞においてRFWD3を欠損した細胞を作製した.RFWD3欠損細胞はDNA鎖間架橋の誘導剤に対しきわめて強い感受性を示し,DNA鎖間架橋の修復経路が障害されていることが示唆された.また,RFWD3欠損細胞にレンチウイルスを用いて野生型のRFWD3あるいはユビキチンリガーゼ活性をもたないRFWD3変異体を発現させたところ,野生型のRFWD3を発現させた場合のみDNA鎖間架橋に対する耐性が回復し,DNA鎖間架橋の修復にはRFWD3のユビキチンリガーゼ活性が必要であることが確認された.
RFWD3のDNA鎖間架橋の修復経路における作用点を明確にするため,RFWD3欠損細胞においてその上流のイベントであるFANCD2のモノユビキチン化について調べたが影響はみられなかった.一方で,DNAの損傷のち16~24時間において,相同組換えにはたらく主要なタンパク質であるRPAおよびRAD51のクロマチンへの集積が増強していた.これらのことから,RFWD3の鎖間架橋の修復経路における作用点は相同組換えにあると推察された.
ユビキチンリガーゼRFWDの基質はRPAおよびRAD51であると仮説をたてた.in vivoにおいて,DNAの損傷のちRFWD3に依存したRPAおよびRAD51のユビキチン化が確認された.さらに,精製したタンパク質を用いたin vitroの系においても同様の結果が得られた.ユビキチン化されたRPAおよびRAD51はプロテアソームの阻害薬を処理することにより細胞に蓄積したことから,RPAおよびRAD51はユビキチン化ののちプロテアソームにおいて分解されることが示唆された.
RPAおよびRAD51はともに相同組換えにおいてきわめて重要なタンパク質であるため,RFWD3の活性は厳密に制御される必要がある.RFWD3はATR/ATMによりSer46およびSer63がリン酸化されると報告されているが3),この2箇所のリン酸化部位の変異体を作製したところ,野生型のRFWD3と比べ,RPA2のユビキチン化能は低く,RFWD3欠損細胞に発現させた際にはDNA鎖間架橋に対し低い耐性しか賦与しなかった.したがって,RFWDのSer46およびSer63のリン酸化が重要な引き金となりユビキチン化が起こると考えられた.ただし,RFWD3にはほかにも多くのリン酸化のコンセンサス配列が存在することから,Ser46およびSer63のリン酸化はあくまで必要条件であり,そのほかの部位のリン酸化が関与する可能性もある.
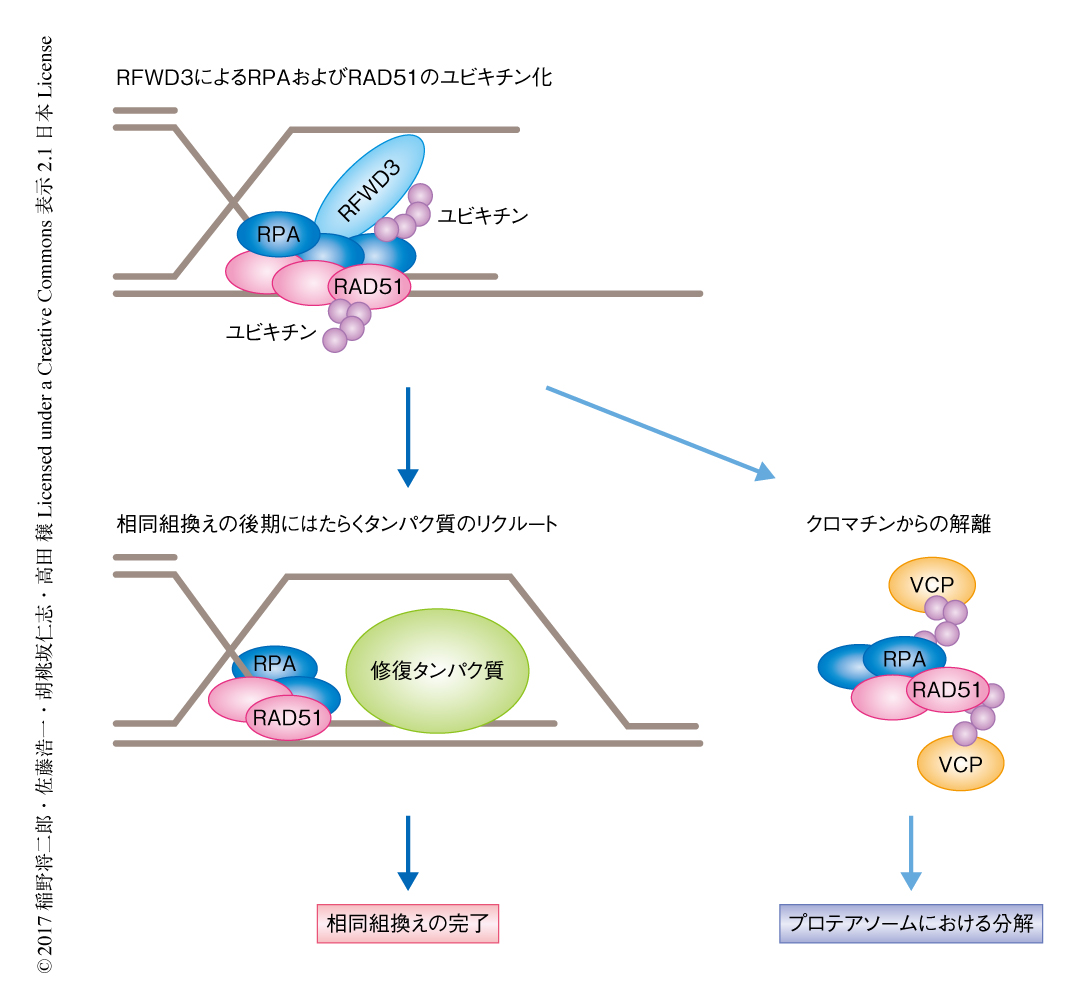
RPAおよびRAD51のユビキチン化がクロマチンからの除去にどう関与するかについて検証したところ,in vitroにおいて,ユビキチン化されたRPAおよびRAD51はユビキチン化されていないものと比べ1本鎖DNAへの結合能の低いことが見い出された.また,ユビキチン化タンパク質の輸送を介し細胞におけるさまざまな過程に関与するVCP/p97に注目したところ4),RPAおよびRAD51はDNAの損傷に依存してVCPと結合し,また,VCPのノックダウンによりRPAのターンオーバーは低下しクロマチンに集積したユビキチン化RPAが増加することわかった.これらの結果より,ユビキチン化されたRPAおよびRAD51は構造的にクロマチンから解離しやすくなり,少なくとも部分的には,VCPに依存してプロテアソームにおいて分解されることが示唆された(図2).
一般にユビキチン化は基質タンパク質のLysにユビキチンが付加される反応である.そこで,RPA2およびRAD51においてユビキチン化の標的となる部位を既知のプロテオクミクスのデータなどから推定し,複数の変異体において試験したうえ,最終的には,5箇所のLysをArgに置換したRPA2およびRAD51の変異体を作製したところ,ユビキチン化は有意に低下した.レンチウイルスを用いてこれらの変異体をドキシサイクリンに依存的に発現させ,さらに内在する野生型のタンパク質をノックダウンして入れ替えた細胞においては,野生型を発現させた場合と比べ相同組換えの活性が低下し,クロマチンへの集積がみられた.これらの結果より,RPAおよびRAD51のユビキチン化はクロマチンからの除去を介して相同組換えに寄与することが支持された.
相同組換えにおいてクロマチンに集積したRPAおよびRAD51は後続のタンパク質のクロマチンへのアクセスを阻害することから除去される必要があるという仮説をたてた.相同組換えの後期の過程の制御については未解明な部分が多いが,主要なタンパク質としてRAD54およびMCM8に注目した.RAD54はSWI2/SNF2ファミリーに属する2本鎖DNAに依存性のATPaseであり相同組換えにおいて多彩な機能が報告されている5).MCM8はAAA+スーパーファミリーに属し相同組換えにおいてRAD51の下流にて機能すると考えられている6,7).解析の結果,対照となる細胞においてはRAD54およびMCM8はDNA鎖間架橋に依存してリクルートされDNAの損傷部位に集積したのに対し,RFWD3欠損細胞においてはその蓄積は顕著に低下していた.さらに,5箇所のLysの置換によりユビキチン化をさまたげたRAD51の変異体を発現させた細胞において,野生型の細胞と比べクロマチンへのMCM8のリクルートが低下しており,この仮説が支持された.
この研究は,ドイツにおけるFanconi貧血の新規の原因遺伝子の同定から共同研究としてスタートした.RFWD3がRPAをユビキチン化することにより相同組換えに寄与する点については,2015年にほかの研究グループにより報告されたが8),この論文においては機序についての言及がなく,また,RPAの分解も起こらないとしている.おそらく,異なるDNAの損傷を用い早期における観察にしぼられていたため,筆者らとは異なる結論にいたったのではないかと推察される.
相同組換えをはじめとするDNAの損傷の修復への注目は飛躍的に高まってきたが,いまだに不明な部分が多い.この研究からの直接的な臨床応用への距離はまだまだ遠いが,非常に複雑なDNAの損傷の修復経路において,そのパズルの1ピースを埋めることができたと感じている.それがFanconi貧血に苦しむ患者の治療につながること,および,将来のより洗練されたがんの治療法の開発にわずかながらでも貢献することを切に願う.
略歴:2017年 京都大学大学院医学研究科 修了,関西電力病院血液内科 医師.
研究テーマ:DNAの修復.血液悪性腫瘍.
抱負:4年間にわたりDNAの修復について基礎研究をしてきましたが,今後は,基礎と臨床の両面の視点から血液腫瘍の治療を俯瞰し,その発展に微力をつくしたい.
佐藤 浩一(Koichi Sato)
オランダHubrecht Institute研究員.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学大学院先進理工学研究科 教授.
高田 穣(Minoru Takata)
京都大学放射線生物研究センター 教授.
研究室URL:http://house.rbc.kyoto-u.ac.jp/late-effect
© 2017 稲野将二郎・佐藤浩一・胡桃坂仁志・高田 穣 Licensed under CC 表示 2.1 日本
(1京都大学放射線生物研究センター 晩発効果研究部門,2早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室)
email:稲野将二郎
DOI: 10.7875/first.author.2017.052
RFWD3-mediated ubiquitination promotes timely removal of both RPA and RAD51 from DNA damage sites to facilitate homologous recombination.
Shojiro Inano, Koichi Sato, Yoko Katsuki, Wataru Kobayashi, Hiroki Tanaka, Kazuhiro Nakajima, Shinichiro Nakada, Hiroyuki Miyoshi, Kerstin Knies, Akifumi Takaori-Kondo, Detlev Schindler, Masamichi Ishiai, Hitoshi Kurumizaka, Minoru Takata
Molecular Cell, 66, 622-634.e8 (2017)
要 約
Fanconi貧血はDNA鎖間架橋の修復の障害による症患で,その原因遺伝子の解析はDNA鎖間架橋の修復経路の解明に大きく寄与してきた.RFWD3はFanconi貧血の患者におけるエキソーム解析により同定された新規のユビキチンリガーゼである.DNA鎖間架橋の修復経路においては複数のDNA修復機構が協調して機能するが,RFWD3はそのうち相同組換えにはたらき,相同組換えの主要な制御タンパク質であるRPAおよびRAD51をユビキチン化することによりDNAの損傷部位からの解離および分解を促進した.RFWD3を欠損した細胞においては,RPAおよびRAD51が損傷をもつクロマチンに残存していた一方,RAD54やMCM8といった相同組換えの後期においてはたらくタンパク質はリクルートされず,相同組換えにおいて機能するタンパク質の入れ替わりが阻害されているものと考えられた.
はじめに
DNA鎖間架橋の修復経路においては複数のDNA修復機構が協調して機能することによりDNA鎖間架橋の除去および正確な複製が実現される.これを単純化すると,DNA鎖間架橋の両側へのDNA 2本鎖切断の導入,DNA損傷乗り換え,相同組換え,となる(図1).相同組換えにおいては,DNA 2本鎖切断の平滑末端が1本鎖となり,そこにRPAがリクルートされる.そこにBRCA2に依存してRAD51が結合し,鋳型となる相同なDNA配列へと侵入し相補鎖を形成する.侵入した1本鎖DNAの末端はDNAポリメラーゼにより伸長し,ふたたび相補鎖が解離することにより修復は完了する.しかしながら,相同組換えの詳細な分子機構については未解明な点が多い.
1.RFWD3は鎖間架橋の修復経路において相同組換えにはたらく
RFWD3はFanconi貧血の患者のエキソーム解析により同定された新規のユビキチンリガーゼである.すでに,RPAと結合すること,および,チェックポイントの活性化に必要であることが報告されていたが1,2),本質的な分子機能は未解明であった.RFWD3の機能を解明するため,ヒトのハプロイド細胞株HAP1細胞においてRFWD3を欠損した細胞を作製した.RFWD3欠損細胞はDNA鎖間架橋の誘導剤に対しきわめて強い感受性を示し,DNA鎖間架橋の修復経路が障害されていることが示唆された.また,RFWD3欠損細胞にレンチウイルスを用いて野生型のRFWD3あるいはユビキチンリガーゼ活性をもたないRFWD3変異体を発現させたところ,野生型のRFWD3を発現させた場合のみDNA鎖間架橋に対する耐性が回復し,DNA鎖間架橋の修復にはRFWD3のユビキチンリガーゼ活性が必要であることが確認された.
RFWD3のDNA鎖間架橋の修復経路における作用点を明確にするため,RFWD3欠損細胞においてその上流のイベントであるFANCD2のモノユビキチン化について調べたが影響はみられなかった.一方で,DNAの損傷のち16~24時間において,相同組換えにはたらく主要なタンパク質であるRPAおよびRAD51のクロマチンへの集積が増強していた.これらのことから,RFWD3の鎖間架橋の修復経路における作用点は相同組換えにあると推察された.
2.RFWD3はRPAおよびRAD51をDNAの損傷に依存してユビキチン化する
ユビキチンリガーゼRFWDの基質はRPAおよびRAD51であると仮説をたてた.in vivoにおいて,DNAの損傷のちRFWD3に依存したRPAおよびRAD51のユビキチン化が確認された.さらに,精製したタンパク質を用いたin vitroの系においても同様の結果が得られた.ユビキチン化されたRPAおよびRAD51はプロテアソームの阻害薬を処理することにより細胞に蓄積したことから,RPAおよびRAD51はユビキチン化ののちプロテアソームにおいて分解されることが示唆された.
RPAおよびRAD51はともに相同組換えにおいてきわめて重要なタンパク質であるため,RFWD3の活性は厳密に制御される必要がある.RFWD3はATR/ATMによりSer46およびSer63がリン酸化されると報告されているが3),この2箇所のリン酸化部位の変異体を作製したところ,野生型のRFWD3と比べ,RPA2のユビキチン化能は低く,RFWD3欠損細胞に発現させた際にはDNA鎖間架橋に対し低い耐性しか賦与しなかった.したがって,RFWDのSer46およびSer63のリン酸化が重要な引き金となりユビキチン化が起こると考えられた.ただし,RFWD3にはほかにも多くのリン酸化のコンセンサス配列が存在することから,Ser46およびSer63のリン酸化はあくまで必要条件であり,そのほかの部位のリン酸化が関与する可能性もある.
3.ユビキチン化されたRPAおよびRAD51はクロマチンから除去される
RPAおよびRAD51のユビキチン化がクロマチンからの除去にどう関与するかについて検証したところ,in vitroにおいて,ユビキチン化されたRPAおよびRAD51はユビキチン化されていないものと比べ1本鎖DNAへの結合能の低いことが見い出された.また,ユビキチン化タンパク質の輸送を介し細胞におけるさまざまな過程に関与するVCP/p97に注目したところ4),RPAおよびRAD51はDNAの損傷に依存してVCPと結合し,また,VCPのノックダウンによりRPAのターンオーバーは低下しクロマチンに集積したユビキチン化RPAが増加することわかった.これらの結果より,ユビキチン化されたRPAおよびRAD51は構造的にクロマチンから解離しやすくなり,少なくとも部分的には,VCPに依存してプロテアソームにおいて分解されることが示唆された(図2).
一般にユビキチン化は基質タンパク質のLysにユビキチンが付加される反応である.そこで,RPA2およびRAD51においてユビキチン化の標的となる部位を既知のプロテオクミクスのデータなどから推定し,複数の変異体において試験したうえ,最終的には,5箇所のLysをArgに置換したRPA2およびRAD51の変異体を作製したところ,ユビキチン化は有意に低下した.レンチウイルスを用いてこれらの変異体をドキシサイクリンに依存的に発現させ,さらに内在する野生型のタンパク質をノックダウンして入れ替えた細胞においては,野生型を発現させた場合と比べ相同組換えの活性が低下し,クロマチンへの集積がみられた.これらの結果より,RPAおよびRAD51のユビキチン化はクロマチンからの除去を介して相同組換えに寄与することが支持された.
4.RPAおよびRAD51のクロマチンからの除去は後続するタンパク質のアクセスに必要である
相同組換えにおいてクロマチンに集積したRPAおよびRAD51は後続のタンパク質のクロマチンへのアクセスを阻害することから除去される必要があるという仮説をたてた.相同組換えの後期の過程の制御については未解明な部分が多いが,主要なタンパク質としてRAD54およびMCM8に注目した.RAD54はSWI2/SNF2ファミリーに属する2本鎖DNAに依存性のATPaseであり相同組換えにおいて多彩な機能が報告されている5).MCM8はAAA+スーパーファミリーに属し相同組換えにおいてRAD51の下流にて機能すると考えられている6,7).解析の結果,対照となる細胞においてはRAD54およびMCM8はDNA鎖間架橋に依存してリクルートされDNAの損傷部位に集積したのに対し,RFWD3欠損細胞においてはその蓄積は顕著に低下していた.さらに,5箇所のLysの置換によりユビキチン化をさまたげたRAD51の変異体を発現させた細胞において,野生型の細胞と比べクロマチンへのMCM8のリクルートが低下しており,この仮説が支持された.
おわりに
この研究は,ドイツにおけるFanconi貧血の新規の原因遺伝子の同定から共同研究としてスタートした.RFWD3がRPAをユビキチン化することにより相同組換えに寄与する点については,2015年にほかの研究グループにより報告されたが8),この論文においては機序についての言及がなく,また,RPAの分解も起こらないとしている.おそらく,異なるDNAの損傷を用い早期における観察にしぼられていたため,筆者らとは異なる結論にいたったのではないかと推察される.
相同組換えをはじめとするDNAの損傷の修復への注目は飛躍的に高まってきたが,いまだに不明な部分が多い.この研究からの直接的な臨床応用への距離はまだまだ遠いが,非常に複雑なDNAの損傷の修復経路において,そのパズルの1ピースを埋めることができたと感じている.それがFanconi貧血に苦しむ患者の治療につながること,および,将来のより洗練されたがんの治療法の開発にわずかながらでも貢献することを切に願う.
文 献
- Gong, Z. & Chen, J.: E3 ligase RFWD3 participates in replication checkpoint control. J. Biol. Chem., 286, 22308-22313 (2011)[PubMed]
- Liu, S., Chu, J., Yucer, N. et al.: RING finger and WD repeat domain 3 (RFWD3) associates with replication protein A (RPA) and facilitates RPA-mediated DNA damage response. J. Biol. Chem., 286, 22314-22322 (2011)[PubMed]
- Fu, X., Yucer, N., Liu, S. et al.: RFWD3-Mdm2 ubiquitin ligase complex positively regulates p53 stability in response to DNA damage. Proc. Natl. Acad. Sci. USA, 107, 4579-4584 (2010)[PubMed]
- Meyer, H., Bug, M. & Bremer, S.: Emerging functions of the VCP/p97 AAA-ATPase in the ubiquitin system. Nat. Cell Biol., 14, 117-123 (2012)[PubMed]
- Solinger, J. A., Kiianitsa, K. & Heyer, W. D.: Rad54, a Swi2/Snf2-like recombinational repair protein, disassembles Rad51:dsDNA filaments. Mol. Cell, 10, 1175-1188 (2002)[PubMed]
- Natsume, T., Nishimura, K., Minocherhomji, S. et al.: Acute inactivation of the replicative helicase in human cells triggers MCM8-9-dependent DNA synthesis. Genes Dev., 31, 816-829 (2017)[PubMed]
- Nishimura, K., Ishiai, M., Horikawa, K. et al.: Mcm8 and Mcm9 form a complex that functions in homologous recombination repair induced by DNA interstrand crosslinks. Mol. Cell, 47, 511-522 (2012)[PubMed] [新着論文レビュー]
- Elia, A. E. H., Wang, D. C., Willis, N. A. et al.: RFWD3-dependent ubiquitination of RPA regulates repair at stalled replication forks. Mol. Cell, 60, 280-293 (2015)[PubMed]
著者プロフィール
略歴:2017年 京都大学大学院医学研究科 修了,関西電力病院血液内科 医師.
研究テーマ:DNAの修復.血液悪性腫瘍.
抱負:4年間にわたりDNAの修復について基礎研究をしてきましたが,今後は,基礎と臨床の両面の視点から血液腫瘍の治療を俯瞰し,その発展に微力をつくしたい.
佐藤 浩一(Koichi Sato)
オランダHubrecht Institute研究員.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学大学院先進理工学研究科 教授.
高田 穣(Minoru Takata)
京都大学放射線生物研究センター 教授.
研究室URL:http://house.rbc.kyoto-u.ac.jp/late-effect
© 2017 稲野将二郎・佐藤浩一・胡桃坂仁志・高田 穣 Licensed under CC 表示 2.1 日本